La fibrilación auricular es la arritmia más frecuente en la práctica clínica. Su prevalencia está aumentando considerablemente debido al envejecimiento de la población de los países desarrollados. La fibrilación auricular es la causa principal del ictus cardioembólico, y el tratamiento anticoagulante oral es una terapia eficaz para disminuir su riesgo de manera considerable. También es creciente el número de pacientes portadores de dispositivos cardiacos electrónicos implantables que, por su capacidad para detectar alteraciones del ritmo y almacenar electrogramas, son una herramienta de alto rendimiento en la detección de episodios de alta frecuencia auricular, que corresponden normalmente a episodios de fibrilación auricular (en menor medida, flutter auricular y taquicardia auricular) en gran número de pacientes. Diversos estudios han demostrado que los episodios de fibrilación auricular subclínica se asocian con un aumento del riesgo de eventos tromboembólicos, aunque no se ha podido demostrar una relación temporal entre ambas circunstancias. Sin embargo, la evaluación de la eficacia del tratamiento con anticoagulantes orales en pacientes con fibrilación auricular subclínica solo se ha evaluado en un ensayo clínico cuyos resultados han sido negativos. Por ello, a falta de más información, la decisión clínica de indicar un tratamiento con anticoagulantes orales para pacientes con fibrilación auricular subclínica es compleja y hasta la fecha no se apoya en evidencia firme.
Palabras clave
anticoagulante oral
desfibrilador automático implantable
dispositivos cardiacos electrónicos implantables
episodios tromboembólicos
fibrilación auricular
terapia de resincronización cardiaca
La fibrilación auricular (FA) es la arritmia clínica más frecuente, con una prevalencia estimada de 8,8 millones de personas afectadas en Europa en el año 2010, y se ha estimado un incremento hasta 17,9 millones en 2060 debido al envejecimiento de la población1,2. La FA está reconocida como la causa principal de la mayoría de los ictus cardioembólicos, un subtipo de ictus que normalmente se asocia con mayor gravedad y pérdida funcional3. En pacientes con FA, el tratamiento con anticoagulantes orales (ACO) es más efectivo para disminuir el riesgo de ictus que el tratamiento antiagregante (el 39 frente al 22%)4. Asimismo, la tasa de recurrencia de ictus en pacientes con FA en tratamiento antiagregante, que es el tratamiento convencional del ictus, es de un 15% y con ACO se ha comunicado una reducción de la tasa anual de recurrencia de ictus de un 40%5. Por ello, el tratamiento con ACO está indicado tanto en prevención primaria para pacientes con FA sin ictus previo y riesgo tromboembólico significativo6 (CHA2DS2-VASc [insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años [doble], diabetes mellitus, evento tromboembólico [ET] — ictus o tromboembolia sistémica arterial— [doble], enfermedad vascular, edad ≥ 65 años y sexo [mujeres] ≥ 1) como en prevención secundaria (pacientes con antecedentes de ictus secundario a FA). Tradicionalmente se ha considerado que el riesgo de ictus es similar para todos los pacientes con FA independientemente de la carga arrítmica. No obstante, ahora hay datos de relación positiva entre la carga arrítmica y el riesgo de ictus, y se estima un riesgo anual de ictus de, respectivamente, el 2,1, el 3,0 y el 4,2% para pacientes con FA paroxística, persistente o permanente en ausencia de tratamiento antitrombótico7.
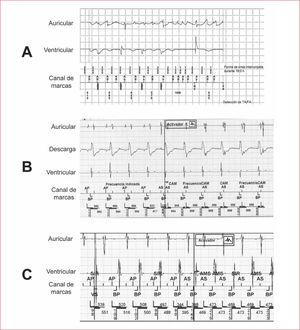
Con el creciente aumento del uso de dispositivos cardiacos electrónicos implantables (DCEI) (marcapasos, desfibrilador automático implantable [DAI] y monitores cardiacos insertables) (figura 1) que proporcionan monitorización del ritmo cardiaco durante años, con detección de episodios de alta frecuencia auricular, que corresponden normalmente a FA (y en menor medida a flutter auricular y taquicardia auricular), se plantea la duda razonable de si tratar precozmente con ACO a los pacientes con FA subclínica o no8. No obstante, es necesaria la inspección manual de los episodios registrados para descartar falsos positivos debido a la detección de campo lejano ventricular, episodios repetidos de sincronía ventriculoauricular no reentrantes9, sobredetección del canal auricular, interferencias miopotenciales, etc. (figura 2). El presente artículo pretende revisar brevemente la evidencia sobre asociación de FA subclínica y riesgo de ET y su manejo terapéutico.
El monitor cardiaco insertable Reveal LINQ de Medtronic (A) ofrece monitorización del ritmo cardiaco, incluida la detección de fibrilación auricular, durante aproximadamente 3 años; presenta una reducción muy significativa de tamaño y una mejora del algoritmo de detección de fibrilación auricular19 con respecto a su predecesor, el Reveal XT (B).
Registros intracavitarios de eventos clasificados por el dispositivo como taquiarritmia auricular de manera correcta (A: fibrilación auricular) e incorrecta (B: detección de campo lejano ventricular en el canal auricular; C: episodio de sincronía ventriculoauricular no reentrante).
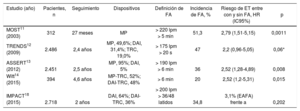
Varios estudios han demostrado una incidencia relativamente alta de FA subclínica detectada por los DCEI (10-79%), principalmente debido a su alta sensibilidad (monitorización continua durante varios años) y una población de riesgo, ya que los pacientes portadores de DCEI normalmente presentan disfunción sinusal, bloqueo auriculoventricular o insuficiencia cardiaca, todos asociados con mayor riesgo de FA10–14. Además, los mismos estudios han demostrado un aumento significativo del riesgo de ET en pacientes con FA subclínica, aunque la carga arrítmica necesaria para demostrar tal asociación de manera estadísticamente significativa varía ampliamente entre los estudios (tabla).
Estudios que han valorado la asociación entre episodios de fibrilación auricular subclínica y el riesgo de eventos tromboembólicos.
| Estudio (año) | Pacientes, n | Seguimiento | Dispositivos | Definición de FA | Incidencia de FA, % | Riesgo de ET entre con y sin FA, HR (IC95%) | p |
|---|---|---|---|---|---|---|---|
| MOST11 (2003) | 312 | 27 meses | MP | > 220 lpm > 5 min | 51,3 | 2,79 (1,51-5,15) | 0,0011 |
| TRENDS12 (2009) | 2.486 | 2,4 años | MP, 49,6%; DAI, 31,4%; TRC, 19,0% | > 175 lpm > 20 s | 47 | 2,2 (0,96-5,05) | 0,06* |
| ASSERT13 (2012) | 2.451 | 2,5 años | MP, 95%; DAI, 5% | > 190 lpm > 6 min | 36 | 2,52 (1,28-4,89) | 0,008 |
| Witt14 (2015) | 394 | 4,6 años | MP-TRC, 52%; DAI-TRC, 48% | > 6 min | 20 | 2,52 (1,2-5,31) | 0,015 |
| IMPACT18 (2015) | 2.718 | 2 años | DAI, 64%; DAI-TRC, 36% | > 200 lpm > 36/48 latidos | 34,8 | 3,1% (EAFA) frente a | 0,202 |
DAI: desfibrilador automático implantable; EAFA: episodios de alta frecuencia auricular; ET: episodio tromboembólico; FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MP: marcapasos; TRC: terapia de resincronización cardiaca.
Los primeros indicios de asociación entre FA subclínica y ET se remontan a 2003, a partir de un subestudio11 del ensayo clínico aleatorizado MOST15, que comparó la estimulación cardiaca en modo DDDR y en modo VVIR en pacientes con disfunción sinusal. De los 312 pacientes incluidos en dicho subestudio, el 51,3% sufrió al menos un episodio de FA subclínica (entendiendo por tal frecuencias auriculares > 220 lpm de duración > 5 min), durante un seguimiento de 27 meses. La presencia de FA subclínica fue un predictor independiente del objetivo primario compuesto por muerte o ictus no mortal (hazard ratio [HR] = 2,79; intervalo de confianza del 95% [IC95%], 1,51-5,15; p = 0,0011)”. No obstante, debido a las limitaciones de memoria de los marcapasos, no se pudo valorar la asociación entre carga de FA subclínica y riesgo de ictus, y el objetivo primario compuesto se alcanzó por la mortalidad, ya que solo hubo 10 casos de ictus durante el seguimiento (8 en el grupo con FA subclínica).
Posteriormente, el estudio TRENDS12 evaluó de manera prospectiva la asociación entre carga de FA subclínica y riesgo de ictus en 2.486 pacientes (media de edad, 71 años) portadores de marcapasos (49,6%), DAI (31,4%) o dispositivos con terapia de resincronización cardiaca (TRC) (19,0%) con al menos un factor de riesgo (insuficiencia cardiaca, hipertensión arterial, edad ≥ 65 años, diabetes mellitus y ET previo). Un 20% de los pacientes tenían antecedentes de FA y un 21% recibía tratamiento con ACO al inicio del estudio. Se definió FA subclínica como frecuencia auricular > 175 lpm de duración > 20 s y se clasificó a los pacientes en 3 grupos: sin FA subclínica; pacientes con FA subclínica < 5,5 h, y FA subclínica ≥ 5,5 h durante una ventana de 30 días. Tras un seguimiento de 1,4 años, casi la mitad de los pacientes (47%) habían sufrido un episodio de FA subclínica y el riesgo anual de ET fue aproximadamente el doble (2,4%) en el grupo de FA subclínica ≥ 5,5 h que en los grupos de FA subclínica < 5,5 h (1,1%) o sin FA subclínica (1,1%), aunque no se alcanzó la significación estadística (p = 0,06), en parte debido a la baja tasa de ET (40 pacientes) del estudio.
El estudio ASSERT13 evaluó de manera prospectiva la asociación de FA subclínica y riesgo de ET en 2.451 pacientes (media de edad, 77 años) diagnosticados de hipertensión arterial y portadores de marcapasos (95%) o DAI (5%). Se excluyó a los pacientes con antecedentes de FA o en tratamiento con ACO. Se monitorizó a los pacientes para detectar FA subclínica (definida como la detección de una frecuencia auricular > 190 lpm de duración > 6 min) durante los primeros 3 meses, con un seguimiento medio posterior de 2,5 años. A los 3 meses, el 10,1% de los pacientes había presentado FA subclínica; tras el seguimiento completo, el 34,7% había sufrido FA subclínica al menos una vez, y de ellos, el 15,7% presentó FA clínica, detectada de manera convencional. El 4,2% de los pacientes que habían sufrido FA subclínica durante los primeros 3 meses cursaron con ET durante el seguimiento, frente al 1,7% de los pacientes sin FA subclínica (HR ajustada = 2,5; IC95%, 1,28-4,89; p = 0,01). Los resultados también indican asociación entre carga de FA subclínica y riesgo de ET, y fue necesaria una carga de FA > 17,72 h para aumentar de manera significativa el riesgo de ET, aunque el estudio no tenía potencia estadística suficiente para valorar esta asociación.
Los pacientes portadores de dispositivos con TRC constituyen un grupo con cardiopatía típicamente avanzada y alto riesgo de FA que normalmente conlleva un empeoramiento de los síntomas de la insuficiencia cardiaca y del pronóstico vital. Un registro nacional danés de 394 pacientes con marcapasos-TRC (52%) y DAI-TRC (48%), sin antecedentes de FA, fracción de eyección del ventrículo izquierdo del 24 ± 6%, con un 17% de ellos en tratamiento con ACO, la mayoría en clase funcional III de la New York Heart Association, valoró la asociación entre FA subclínica (duración > 6 min) y ET. Se detectó FA subclínica en el 20% de los pacientes durante los primeros 6 meses y, tras un seguimiento medio posterior de 4,6 años, el riesgo anual de ET fue del 3,1% en el grupo con FA subclínica y el 1,4% en el grupo sin FA subclínica (HR ajustada = 2,52; IC95%, 1,2-5,31; p = 0,015)14.
Relación temporal entre fibrilación auricular subclínica y episodios tromboembólicosLos DCEI han permitido también valorar la relación temporal entre FA y ET. En el subanálisis de los 40 pacientes del estudio TRENDS16 que sufrieron ET, previamente se había detectado FA subclínica en la mitad y, de estos, 9 pacientes (45%) no habían presentado FA subclínica en los últimos 30 días antes del ET. Además, 14 (70%) estaban en ritmo sinusal en el momento del ET, y el tiempo desde el último episodio de FA subclínica en estos pacientes fue de 168 ± 199 días. Asimismo, en el subanálisis de los 51 pacientes con ET del estudio ASSERT17, 18 (35%) presentaron FA subclínica antes del ET y solo 4 (8%) la habían tenido en los 30 días previos. A pesar de las limitaciones de estos 2 subanálisis (reducido número de eventos y ausencia de clasificación del origen cardioembólico del ictus), los datos no muestran relación temporal entre FA subclínica y ET. Los ET en pacientes sin FA subclínica se pueden explicar, entre otros motivos, por el hecho de ser una población de alto riesgo, ya que en ambos estudios presentaban varios factores de riesgo de ictus isquémico (no cardioembólico). También se ha especulado con la idea de que la FA no es una causa directa del ET, sino un marcador de enfermedad vascular, inflamación y disfunción endotelial, que por sí mismos incrementan el riesgo de ET8.
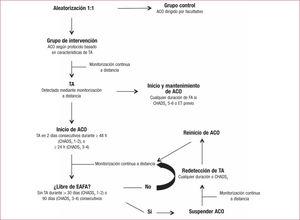
Anticoagulantes orales en pacientes con fibrilación auricular subclínicaA pesar de que varios estudios han establecido asociación entre FA subclínica y aumento del riesgo de ET11–14, hasta la fecha solo hay un ensayo clínico que ha evaluado la eficacia del tratamiento con ACO en estos pacientes: el reciente IMPACT18, un ensayo prospectivo, multi-céntrico y aleatorizado. Entre 2008 y 2013, se incluyó a 2.718 pacientes con miocardiopatía isquémica (57%) y no isquémica (31%), fracción de eyección del ventrículo izquierdo del 29 ± 11%, media de edad de 64 años, la mayoría con CHADS2 1-2 (53%) y el 42% con CHADS2 3-4. Los pacientes eran portadores de DAI (64%) y DAI-TRC (36%). El objetivo primario del estudio fue un compuesto de ictus, embolia sistémica y sangrado mayor. Se aleatorizó a los pacientes 1:1 al grupo de intervención según un esquema de anticoagulación de FA subclínica (definida como más de 36 latidos en ritmo auricular > 200 lpm de 48 consecutivos), basado en la duración del episodio y la puntuación CHADS2, o al grupo de control (ACO indicados por el facultativo en caso de FA clínica) (figura 3). Tras un seguimiento medio de 2 años, se había producido el 75% (n = 124) de los eventos primarios esperados, sin que se hallaran diferencias significativas en el objetivo primario entre los 2 grupos del estudio (HR = 1,06; IC95%, 0,75-1,51; p = 0,732), motivo por el que el comité de monitorización de datos decidió terminar precozmente el estudio. No obstante, al analizar los eventos por separado, hubo una tendencia no significativa a menor riesgo de ictus (HR = 0,55; IC95%, 0,23-1,34; p = 0,188) y mayor riesgo de sangrado mayor (HR = 1,39; IC95%, 0,89-2,17; p = 0,145) en el grupo de intervención. El 34,8% de los pacientes presentaron FA subclínica durante el seguimiento y no se observó relación temporal con la ocurrencia de ET. Entre las limitaciones del estudio, se debe mencionar el número relativamente bajo de ET (69 pacientes), un objetivo primario compuesto de ET y sangrado mayor (con efecto neutralizante) y un incremento pequeño del uso de ACO en el grupo de intervención debido a un uso relativamente alto de ACO en el grupo control (60%). Además, la estrategia de ACO era relativamente compleja (figura 3), basada en la presunción de que hay relación temporal entre FA subclínica y ET, algo que hasta la fecha no se ha demostrado. Finalmente, es posible que la ACO no reduzca los ET en pacientes con FA subclínica en la misma magnitud que en los pacientes diagnosticados de FA clínica.
Protocolo de anticoagulación oral de los 2 grupos de pacientes del estudio IMPACT18. El grupo de intervención recibió anticoagulación oral según la carga arrítmica y la puntuación CHADS2 de los episodios de TA transmitidos por la monitorización a distancia. ACO: anticoagulación oral; EAFA: episodios de alta frecuencia auricular; TA: taquiarritmia auricular.
Aunque no está claro el manejo terapéutico de los ACO para pacientes con FA subclínica, el clínico frecuentemente se enfrenta a este dilema terapéutico, ya que varios estudios sí han comunicado un riesgo de ET elevado en estos pacientes. Por ello es preciso evaluar de manera individual el beneficio neto del tratamiento con ACO, analizando el equilibrio entre el potencial riesgo de ET (duración del episodio de FA subclínica y puntuación CHA2DS2-VASc) y el de sangrado por los ACO. Con los datos publicados hasta la fecha, parece razonable indicar ACO a pacientes de alto riesgo (CHA2DS2-VASc > 2) con FA subclínica de larga duración (> 24 h) y bajo riesgo de sangrado, no indicar ACO a pacientes de bajo riesgo (CHA2DS2-VASc 0) y considerar los ACO para pacientes con riesgo de ET intermedio (CHA2DS2-VASc 1-2) y duración intermedia de FA subclínica, teniendo en consideración el riesgo de sangrado. Futuros estudios como el ATRESiA (NCT 01938248), ensayo clínico prospectivo y aleatorizado diseñado para valorar el tratamiento con un nuevo ACO (apixabán) comparado con el ácido acetilsalicílico en pacientes con FA subclínica, actualmente en fase de selección de pacientes, aportará más información acerca del manejo de este perfil de pacientes, que actualmente está por definir de manera precisa.
ConclusionesLos DCEI son una herramienta de alto rendimiento en la detección de FA subclínica. Múltiples estudios han comunicado una incidencia de FA subclínica en pacientes portadores de DCEI relativamente alta que se asocia con un aumento del riesgo de ET, aunque no se ha podido demostrar una relación temporal entre ambos. No obstante, solo el estudio IMPACT ha evaluado la eficacia del tratamiento con ACO en pacientes con FA subclínica, pero no ha logrado demostrar beneficio para estos pacientes. Hasta que se disponga de nueva evidencia, resulta imprescindible realizar una evaluación individual del beneficio neto del tratamiento con ACO basado en los riesgos de ET (duración del episodio de FA subclínica y CHA2DS2-VASc) y sangrado por la terapia con ACO.
Conflicto de interesesNinguno.




 ACO: anticoagulación oral; EAFA: episodios de alta frecuencia auricular; TA: taquiarritmia auricular.' title='Protocolo de anticoagulación oral de los 2 grupos de pacientes del estudio IMPACT18. El grupo de intervención recibió anticoagulación oral según la carga arrítmica y la puntuación CHADS2 de los episodios de TA transmitidos por la monitorización a distancia.
ACO: anticoagulación oral; EAFA: episodios de alta frecuencia auricular; TA: taquiarritmia auricular.' title='Protocolo de anticoagulación oral de los 2 grupos de pacientes del estudio IMPACT18. El grupo de intervención recibió anticoagulación oral según la carga arrítmica y la puntuación CHADS2 de los episodios de TA transmitidos por la monitorización a distancia.