El dabigatrán etexilato es un anticoagulante oral eficaz en la prevención de embolias en pacientes con fibrilación auricular no valvular. Es un profármaco que se transforma rápidamente en dabigatrán, un inhibidor potente, directo y reversible de la trombina. Tras su administración alcanza el pico plasmático a las 2h y tiene una vida media de 14h. Su actividad anticoagulante es predecible y no precisa monitorización de los tiempos de coagulación. El fármaco se elimina fundamentalmente por los riñones, mayormente sin alteraciones. La insuficiencia renal favorece su acumulación. El dabigatrán no se metaboliza por las isoenzimas del citocromo P450 y presenta escasas interacciones farmacológicas. Debe considerarse ajustar la dosis de dabigatrán en pacientes con edad avanzada, bajo peso corporal, alto riesgo hemorrágico o en tratamiento concomitante con verapamilo o antiagregantes plaquetarios.
Palabras clave
Los fármacos anticoagulantes han demostrado largamente su eficacia en la prevención de ictus y embolia sistémica en la fibrilación auricular (FA).
Para el tratamiento anticoagulante crónico domiciliario, hemos tenido disponibles tan sólo los antagonistas de la vitamina K (AVK), claramente superiores al placebo, y los antiagregantes como ácido acetilsalicílico o clopidogrel en la prevención del ictus en pacientes con FA1. Sin embargo, se estima que tan sólo el 50% de los pacientes con indicación de anticoagulación por FA reciben AVK2–4. Las limitaciones propias de los AVK tienen un papel importante en su infrautilización en la práctica clínica. La necesidad de monitorizar el grado de anticoagulación, el estrecho margen terapéutico, las interacciones farmacológicas y alimentarias y los ajustes frecuentes de dosis son algunas de las deficiencias conocidas de los AVK. En los ensayos clínicos en que se ha demostrado la eficacia de los AVK en la prevención de eventos cardioembólicos en la FA, los pacientes estuvieron en torno al 70% del tiempo en el margen de INR adecuado5. Sin embargo, en registros «de la vida real», se ha evidenciado que este tiempo es sensiblemente menor6–8. Es bien conocido que el riesgo de hemorragia se incrementa con valores elevados de INR y que INR < 2 se asocian a mayor riesgo de ictus9.
Estas limitaciones de la terapia con AVK han motivado el desarrollo de nuevos anticoagulantes orales. De tres fármacos que actúan como inhibidores directos de factores de la coagulación ya se han completado ensayos clínicos en fase III. Son dabigatrán, inhibidor directo de la trombina, y dos antagonistas del factor Xa, apixabán y rivaroxabán, que se presentan como alternativas a los AVK10–13. La aparición de estos fármacos abre una nueva era en la prevención del ictus en la FA. Esta revisión se centra en los aspectos farmacológicos del dabigatrán y su manejo clínico en la FA.
Farmacología del dabigatránDabigatrán etexilato es el profármaco no activo del dabigatrán. Tras su administración oral, el profármaco se hidroliza rápidamente a su forma activa, el dabigatrán, un potente inhibidor selectivo de la trombina14–16. Se trata de una pequeña molécula no peptídica que se encuentra permanentemente ionizada, por lo que hay que administrarla como profármaco para que se absorba por vía oral17.
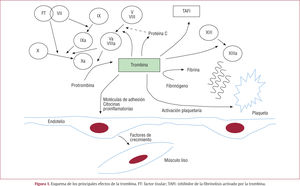
La trombina, principal efector de la hemostasiaLa trombina es una enzima clave en la formación del trombo. Su acción no se limita a la formación de fibrina soluble mediante la escisión del fibrinógeno (fig. 1), sino que activa también al factor XIIIa, que se encarga de formar los polímeros insolubles de la fibrina que constituyen el coágulo sanguíneo. La trombina aumenta asimismo la actividad de los factores V y VIII acelerando su propia formación. Por otro lado, reduce la actividad fibrinolítica a través de la activación del inhibidor de la fibrinolisis activado por la trombina (TAFI) y aumenta la agregación plaquetaria. La trombina favorece la aterogénesis aumentando la producción de moléculas de adhesión, citocinas, moléculas vasoactivas y factores de crecimiento de músculo liso por el endotelio18.
La trombina posee también efectos antitrombóticos, que predominan cuando se encuentra a concentraciones bajas. El principal es la activación de la proteína C, que actúa como un potente anticoagulante al destruir las formas activas de los factores V y VIII.
Mecanismo de acción de dabigatránDabigatrán ejerce su acción anticoagulante mediante la unión a la trombina, que de este modo queda incapacitada para interactuar con sus sustratos. Ejerce una potente inhibición de la trombina, selectiva, reversible y competitiva.
A diferencia de la heparina, que actúa sobre la trombina mediante la activación de la antitrombina III, los inhibidores directos de la trombina inactivan esta enzima de forma directa e independiente de otros cofactores. Los inhibidores directos de la trombina no actúan sólo sobre la trombina libre, como hace la heparina, sino también sobre la trombina unida al coágulo. La posibilidad de acceder al coágulo e inactivar allí la trombina es una importante ventaja que ofrecen los inhibidores directos de la trombina19–21.
La trombina posee un sitio activo y dos sitios de unión secundarios para reconocimiento y anclaje de sustratos21,22. La hirudina y sus derivados, inhibidores directos de la trombina de administración intravenosa, se unen al dominio externo 1 (de reconocimiento de sustratos) y esto determina un cambio de configuración en la trombina que facilita la unión de las hirudinas al centro activo de la trombina e inhibe así su actividad catalítica. En el caso de la bivalirudina, esta inhibición es sólo transitoria, lo que le confiere un mejor perfil de seguridad que el de la hirudina23. Dabigatrán, a diferencia de la hirudina, inactiva la trombina uniéndose sólo a su centro activo24.
Mediante la inhibición de la trombina, el dabigatrán reduce la formación de fibrina, amortigua la retroalimentación positiva de la cas cada de la coagulación, inhibe la activación plaquetaria mediada por la trombina y reduce la inhibición de la fibrinolisis.
Se puede cuantificar los efectos del dabigatrán mediante diferentes tests de coagulación. La relación entre dosis de dabigatrán y tiempos de coagulación se ha analizado en voluntarios sanos y enfermos14,25–27. El dabigatrán muestra efectos anticoagulantes proporcionales a su concentración en estudios in vitro. Dobla el tiempo de tromboplastina parcial activado (TTPA), el tiempo de protrombina (TP) y el test de ecarina a concentraciones de 0,23, 0,83 y 0,18uM respectivamente28. El TTPA valora la actividad de la vía intrínseca de la cascada de la coagulación. La administración de dabigatrán prolonga el TTPA proporcionalmente a su dosis, de modo que un paciente que toma crónicamente la dosis de dabigatrán 150mg dos veces al día presentará un TTPA aproximadamente el doble que un paciente control27. El TP y la INR, estimadores de la vía extrínseca de la coagulación, no son buenos tests para valorar el efecto de dabigatrán. De hecho, dabigatrán tiene escaso efecto en la INR a dosis de uso clínico. En general, se recomienda el TTPA para descartar un exceso de anticoagulación inducido por dabigatrán en pacientes con sangrado o riesgo de sangrado. Sin embargo, el TTPA carece de adecuada sensibilidad para cuantificar el efecto anticoagulante, especialmente a concentraciones altas de dabigatrán. Actualmente, está disponible el tiempo de trombina diluida (TTd) para determinar la concentración plasmática de dabigatrán. Unas concentraciones plasmáticas > 200 ng/ml en el nadir de niveles en la dosificación de 150mg dos veces al día (10–16h tras la dosis previa) se asocian a mayor riesgo de sangrado29.
FarmacocinéticaTras su administración oral, el dabigatrán etexilato se metaboliza rápidamente a su forma activa por esterasas en el intestino. Tras su absorción, comparten la circulación portal la forma activa y el profármaco, que termina por ser hidrolizado por esterasas en el hígado y el plasma15. La biodisponibilidad oral de dabigatrán etexilato es del 6,5% (tabla 1)30. Cabe destacar que la biodisponibilidad puede aumentar hasta el 70% si se toman los gránulos sin el recubrimiento de la cápsula. Para evitar las sobredosis, se debe avisar a los pacientes de que no abran las cápsulas y no tomen los gránulos sueltos o mezclados con alimentos29.
Características farmacocinéticas de dabigatrán etexilato y warfarina
| Dabigatrán etexilato | Warfarina | |
|---|---|---|
| Absorción | Rápida. Concentración pico a las 2h de la administración oral | Concentración pico variable, 2–8h |
| Biodisponibilidad | Baja (6,5%) | Alta (> 90%) |
| Distribución | Volumen de distribución, 60–70 l. Escasa unión a proteínas | Volumen de distribución, 0,14 l/kg. Alta tasa de unión a proteínas |
| Metabolismo | Rápida conversión de dabigatrán etexilato a dabigatrán. Se elimina en su mayoría inalterado | Fármaco activo. Transformación hepática en metabolitos inactivos |
| Vida media | 12–14h | 25–60h |
| Interacciones | Verapamilo, ketoconazol sistémico, ciclosporina, itraconazol, tacrolimus | Múltiples interacciones farmacológicas y alimentarias |
| Eliminación | 80% renal | Renal y biliar |
Dabigatrán etexilato tiene una mejor absorción en el medio ácido del tracto digestivo, por lo que, para reducir las variaciones en la absorción por cambios en el pH gastrointestinal, la formulación del producto incluye ácido tartárico, lo que permite evitar los problemas de administrarlo junto con inhibidores de la bomba de protones.
En condiciones normales, la concentración plasmática máxima de dabigatrán se registra a las 2h de su administración. Paralelamente, la intensidad de la anticoagulación alcanza su pico. Pasadas 12h, la intensidad de la anticoagulación se sitúa aproximadamente en la mitad del máximo14,27,31. Con una posología en dos dosis diarias, se alcanza un estado estacionario de concentración plasmática tras 2–3 días de tratamiento.
Dabigatrán se une escasamente a las proteínas plasmáticas y su volumen de distribución es de 60–70 l.
La vida media de dabigatrán es de aproximadamente 12–14h14. La eliminación de dabigatrán es fundamentalmente renal (en torno al 80% de dabigatrán se elimina por esa vía, en su mayor parte sin haber sido modificado). La eliminación fecal es menor del 6%. Aproximadamente el 20% del dabigatrán absorbido se conjuga con el ácido glucurónico y forma complejos farmacológicamente activos15.
Interacciones farmacológicasDabigatrán no se metaboliza por las enzimas del citocromo P450, lo que le confiere un buen perfil respecto a posibles interacciones farmacológicas. No interacciona con digoxina ni con atorvastatina32,33. Sin embargo, el dabigatrán etexilato es sustrato de la glucoproteína P, un transportador de membrana que regula el flujo celular de multitud de fármacos, hormonas y nutrientes. Esta relación determinará las principales interacciones farmacológicas del dabigatrán. Diversos fármacos, como la rifampicina, la hierba de San Juan o la carbamazepina, aumentan la actividad de la glucoproteína P, lo que puede causar una reducción en la concentración plasmática del dabigatrán al reducir su reabsorción en el tubo digestivo16. En sentido opuesto, inhibidores de la glucoproteína P como la amiodarona, la quinidina o el verapamilo pueden incrementar la concentración plasmática de dabigatrán.
El uso concomitante de inhibidores potentes de la glucoproteína P, como el ketoconazol por vía sistémica, la ciclosporina, el itraconazol o el tacrolimus, está contraindicado por el riesgo de acumulación de dabigatrán29. En los pacientes del estudio RE-LY, la administración conjunta de amiodarona y verapamilo supuso un aumento en la biodisponibilidad del dabigatrán del 12 y el 23% respectivamente34. Sin embargo, no se encontró interacción significativa con diltiazem34.
La interacción del dabigatrán etexilato con verapamilo depende de la formulación de este y el tiempo de administración. El efecto es menor con verapamilo de liberación prolongada. En la FA no valvular, el uso concomitante de verapamilo y dabigatrán etexilato obliga a una estrecha vigilancia, especialmente en pacientes con riesgo de insuficiencia renal. En esta situación se recomienda la administración de la dosis de 110mg dos veces al día y tomar ambos fármacos a la vez29. Los inhibidores de la bomba de protones reducen ligeramente la absorción de dabigatrán, pero sin impacto clínico significativo34.
Las interacciones farmacodinámicas con otros antitrombóticos aún están escasamente estudiadas. En un ensayo en fase II sobre prevención de trombosis venosa tras cirugía de cadera, las hemorragias fueron más frecuentes en los pacientes que tomaban ácido acetilsalicílico además de dabigatrán 150mg dos veces al día (el 22 frente al 15%). En ese estudio sólo aparecieron hemorragias mayores con la asociación de ácido acetilsalicílico a dabigatrán 300mg dos veces al día35. Aproximadamente el 40% de los pacientes en el estudio RE-LY estaban en tratamiento concomitante con ácido acetilsalicílico al inicio del estudio y en torno al 20% lo tomaba de manera continua durante el seguimiento. El uso concomitante de ácido acetilsalicílico se asoció a un aumento de hemorragias tanto en el grupo tratado con warfarina como en los grupos de dabigatrán36. El análisis de subgrupos indica que el beneficio obtenido con dabigatrán frente a warfarina se mantiene independientemente del uso concomitante de antiplaquetarios, con menor tasa de sangrados mayores con la dosis de 110mg dos veces al día37.
El uso de dabigatrán en triple terapia se debe considerar cuidadosamente. La adición de dabigatrán 150mg dos veces al día a la doble antiagregación en pacientes tras infarto de miocardio cuadriplicó el riesgo de sangrado en un ensayo en fase II38.
Reacciones adversasEn el estudio RE-LY, el 18% de los pacientes en tratamiento con warfarina sufrió algún tipo de sangrado, frente al 14 y el 16% en los grupos de dabigatrán 110 y 140mg respectivamente (diferencias estadísticamente significativas)12. La dosis de dabigatrán 110mg se asoció a menor riesgo de hemorragia mayor comparado con warfarina (riesgo relativo [RR] = 0,8; intervalo de confianza del 95% [IC95%], 0,7–0,93), sin que se encontraran diferencias entre el grupo de warfarina y el que recibió la dosis de 150mg dos comprimidos al día. Sin embargo, dabigatrán etexilato 150mg presentó mayor tasa de hemorragia gastrointestinal que la warfarina (el 1,5%/año frente al 1%/año). El riesgo de hemorragia intracraneal fue superior en el grupo de warfarina que en el de dabigatrán etexilato en sus dos dosificaciones (RR = 0,31 para dabigatrán 110mgy RR = 0,4 para dabigatrán 150mg). Cabe destacar que la tasa de hemorragia intracraneal fue superior en el brazo de warfarina (0,7%/año) que la encontrada en estudios previos con warfarina (0,2%/año)1. Los hallazgos relativos al sangrado en el ensayo RE-LY se esquematizan en la tabla 2.
Comparación del riesgo de sangrado entre los grupos de tratamiento del estudio RE-LY
| Dabigatrán 110mg frente a warfarina | Dabigatrán 150mg frente a warfarina | |
|---|---|---|
| Sangrado menor | Inferior | Inferior |
| Sangrado mayor | Inferior | Igual |
| Hemorragia gastrointestinal | Igual | Superior |
| Hemorragia intracraneal | Inferior | Inferior |
Se definió sangrado mayor como una reducción de la hemoglobina de al menos 20g/l, necesidad de transfusión de dos o más unidades de sangre o hemorragia sintomática de algún área u órgano crítico (intraocular, intracraneal, intraespinal, retroperitoneal, intramuscular con síndrome compartimental, articular o pericárdico)12.
En un análisis post-hoc de los resultados del estudio RE-LY se ha señalado que el beneficio en cuanto a la reducción del riesgo hemorrágico de dabigatrán en dosis de 150mg dos veces al día frente a warfarina es patente tan sólo en centros con mal control de la INR. Dabigatrán 110mg fue superior a la warfarina respecto a los sangrados mayores, y ambas dosis en cuanto a hemorragia intracraneal, independientemente de la calidad del control de la INR39.
La tasa de infarto de miocardio fue superior en cifras, aunque no estadísticamente significativo, con dabigatrán que con warfarina en el estudio RE-LY (warfarina, 0,64%/año; dabigatrán 110mg, 0,82%/año; dabigatrán 150mg, 0,81%/año)40. Otro inhibidor directo de la trombina, el ximelagatrán, mostró resultados contradictorios en dos estudios sobre el riesgo de infarto agudo de miocardio41. No está claro si este hallazgo se debe a un efecto adverso del dabigatrán o a un efecto protector de la warfarina contra el infarto42.
La dispepsia fue el único efecto adverso significativamente superior con dabigatrán que con warfarina en el estudio RE-LY. En torno a un 11–12% de los pacientes tratados con dabigatrán sufrieron dispepsia, frente al 6% en el grupo de warfarina. Dabigatrán no mostró evidencia de hepatotoxicidad12.
ContraindicacionesLas principales contraindicaciones de dabigatrán etexilato se resumen en la tabla 3.
Contraindicaciones de dabigatrán etexilato
| Insuficiencia renal grave (aclaramiento de creatinina < 30ml/min) |
| Lesiones orgánicas con riesgo de hemorragia |
| Hemorragia activa |
| Alteración de la hemostasia |
| Enfermedad hepática que pueda afectar a la supervivencia |
| Tratamiento concomitante con ketoconazol (vía sistémica), ciclosporina, itraconazol o tacrolimus |
| Hipersensibilidad a alguno de sus componentes |
Dabigatrán se presenta como una alternativa a los AVK en la FA. Sus características farmacológicas permiten su uso sin necesidad de monitorizar la intensidad de la anticoagulación ni realizar ajustes de dosis. Sin embargo, para su correcta utilización se debe tener en cuenta ciertas precauciones.
Dosificación en poblaciones especialesLa dosis de 150mg de dabigatrán etexilato dos veces al día es la recomendada como alternativa a los AVK en pacientes con FA no valvular y riesgo significativo de embolia (CHADS2 > 1)43,44.
Dado que la eliminación de dabigatrán es fundamentalmente renal, su uso está contraindicado en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30ml/min). Comparados con controles sanos, el área bajo la curva de concentración plasmática de dabigatrán pasa a ser 1,5,3,2 y 6,3 veces mayor en pacientes con insuficiencia renal leve, moderada y grave respectivamente26. La dosis recomendada en pacientes con insuficiencia renal leve-moderada sigue siendo la de 150mg dos veces al día, si bien debe realizarse un seguimiento clínico estrecho, y es adecuado reducir la dosis a 110mg dos veces al día en pacientes con elevado riesgo de sangrado.
Debe evaluarse la función renal antes del inicio del tratamiento y anualmente en pacientes mayores de 75 años. Igualmente, debe reevaluarse en caso de aparición de alguna situación clínica en la que se pueda deteriorar la función renal como, por ejemplo, en caso de sepsis o deshidratación45.
En personas de edad avanzada, comparadas con sujetos jóvenes, se ha observado un aumento de en torno el 50% en la concentración plasmática de dabigatrán46. En un subanálisis del estudio RE-LY, se ha analizado el riesgo de sangrado en función de la edad en cada uno de los grupos tratados. En los pacientes menores de 75 años, las dos dosis de dabigatrán mostraron menor riesgo hemorrágico frente a la warfarina. Por contra, en los pacientes mayores de 75 años, el riesgo de hemorragia mayor fue similar con warfarina que con dabigatrán 110mg y tendió a ser superior con dabigatrán 150mg (el 4,37, el 4,43 y el 5,10% por año respectivamente)36. En pacientes mayores de 75 años, la dosis de 220mg al día de dabigatrán etexilato parece la más adecuada29.
No hay información clínica suficiente sobre el uso de dabigatrán etexilato en pacientes con insuficiencia hepática. Dado que en el estudio RE-LY se excluyó a los pacientes con transaminasas 2 veces por encima de la normalidad, su uso está contraindicado en estas circunstancias. En un estudio30 se comparó el perfil farmacocinético y el efecto de dabigatrán etexilato en voluntarios sanos y en pacientes con insuficiencia hepática moderada (Child-Pugh B), sin que se encontraran diferencias entre ambos grupos.
El peso corporal no modifica de manera significativa la intensidad del efecto anticoagulante de dabigatrán, por lo que no parece necesario ajustar la dosis por el peso34,47. Sin embargo, hay escasa información sobre su uso en pacientes de menos de 50kg de peso, y se debe utilizar con precaución en este grupo de pacientes. Se han comunicado casos de hemorragia grave en pacientes de bajo peso, edad avanzada e insuficiencia renal48.
Al iniciar el tratamiento con dabigatrán, se debe evaluar cuidadosamente el riesgo de hemorragia. Existen varias escalas para estimar el riesgo de sangrado. La puntuación HAS-BLED contabiliza como factores de riesgo la hipertensión, la alteración de las funciones renal y hepática (1 punto cada uno), ictus previo, antecedentes o predisposición a hemorragias, INR lábil, edad avanzada y uso concomitante de fármacos (antiinflamatorios no esteroideos o antiagregantes) o alcohol (1 punto cada uno)49. En pacientes con elevado riesgo de sangrado (HAS-BLED > 3) se puede considerar la dosis de dabigatrán 110mg dos veces al día.
Cambios de tratamiento anticoagulanteLos pacientes anticoagulados con AVK que vayan a cambiar a dabigatrán etexilato deben someterse a un control estrecho de INR tras la suspensión del AVK. En el momento en que la INR sea < 2, se puede iniciar la administración de dabigatrán. En el caso opuesto, los pacientes que pasen de dabigatrán a AVK, se debe comenzar el tratamiento con AVK 3 días antes de suspender el dabigatrán etexilato. En caso de insuficiencia renal moderada (aclaramiento de creatinina 30–50ml/min), el inicio del AVK debe realizarse sólo 2 días antes de suspender el dabigatrán.
Para los pacientes anticoagulados con heparina de bajo peso molecular, se recomienda administrar la primera dosis de dabigatrán etexilato 0–2h antes del momento que correspondería a la siguiente dosis de heparina. Para pacientes con heparina no fraccionada en infusión continua, se recomienda la primera dosis de dabigatrán al suspender la infusión. En el sentido opuesto, si un paciente con dabigatrán tiene que pasar a anticoagulación parenteral, se recomienda esperar 12h tras la última dosis de dabigatrán antes de iniciar el nuevo anticoagulante parenteral29.
Preparación para una intervenciónLos pacientes que están en tratamiento con dabigatrán etexilato y van a ser sometidos a una intervención deben suspender el tratamiento 24–48h antes del procedimiento. En general, se recomienda 24h para cirugía menor y 48h para cirugía mayor o en caso de pacientes de alto riesgo de sangrado. En pacientes con insuficiencia renal moderada (aclaramiento de creatinina 30–50ml/min), se recomienda prolongar estos plazos a 2 y 4 días, respectivamente.
En pacientes con alto riesgo de sangrado, y en caso de necesidad de cirugía urgente, puede ser de ayuda cuantificar el grado de anticoagulación antes de la intervención, preferiblemente con el TTd o, en su defecto, con el TTPa27. Unos valores de TTPA > 80 s a las 12h de la dosis previa de dabigatrán hacen recomendable retrasar la intervención por alto riesgo de hemorragia.
No disponemos aún de información suficiente acerca del manejo de dabigatrán etexilato en el contexto de la ablación de la FA. Se han publicado los resultados de una serie de pacientes en los que se inició el tratamiento con dabigatrán etexilato inmediatamente tras la ablación. La anticoagulación se inició tras el procedimiento con enoxaparina, durante las primeras 24h, y se administró la primera dosis de dabigatrán a las 22h de la intervención. No se comunicaron complicaciones embólicas ni hemorrágicas en esa serie50. En una reciente comunicación, se comparó a 47 pacientes remitidos para ablación anticoagulados con dabigatrán frente a 54 con warfarina. El dabigatrán se suspendió 12–24h antes del procedimiento y se reinició inmediatamente después. No aparecieron embolias ni hemorragias mayores periprocedimiento en ninguno de los dos grupos51. Es probable que dabigatrán simplifique en el futuro los protocolos de anticoagulación en el contexto de la ablación de FA.
Hemorragia durante tratamiento con dabigatránEl primer paso en el tratamiento de la hemorragia en un paciente que toma dabigatrán es suspender el fármaco. Actualmente no existe un antídoto específico para revertir los efectos del dabigatrán. En caso de hemorragia leve, puede ser suficiente con la suspensión de la medicación y aplicar medidas de vigilancia27. Es fundamental mantener una diuresis adecuada, ya que la eliminación del dabigatrán es fundamentalmente renal. En caso de hemorragia con repercusión clínica moderada-grave, si la actuación (compresión, cirugía, etc.) sobre el foco del sangrado no logra contener la hemorragia, puede ser necesario realizar hemodiálisis. La hemodiálisis es capaz de eliminar de la circulación sanguínea un 60–70% del fármaco26. El plasma fresco no revierte los efectos del dabigatrán y su uso debe reservarse para los casos en que se desarrolle una coagulopatía dilucional.
En caso de hemorragia potencialmente fatal que no responda a las medidas anteriores, se puede utilizar antagonistas no específicos como la desmopresina o agentes antifibrinolíticos52. El factor VII activado recombinante es un potente procoagulante. En un modelo animal, redujo el TTPa y el tiempo de hemorragia ante dosis elevadas de dabigatrán53. Sin embargo, no hay información clínica sobre uso en hemorragia activa. Otra opción es el concentrado de complejo de protrombina, aunque en un estudio reciente en voluntarios sanos no logró revertir los efectos anticoagulantes del dabigatrán54. En la figura 2 se esquematizan las medidas terapéuticas para la hemorragia en pacientes con dabigatrán.
Esquema de manejo de la hemorragia para pacientes en tratamiento con dabigatrán. De izquierda a derecha, se señalan las medidas que hay que tomar escalonadamente en función de la severidad del sangrado y la respuesta al tratamiento. Los antagonistas no específicos, como el factor VII activado recombinante, tienen escasa evidencia en esta situación clínica.
Dabigatrán se presenta como una alternativa a los AVK para la anticoagulación oral en pacientes con FA no valvular. Dabigatrán etexilato es un profármaco de administración oral que rápidamente se transforma en dabigatrán, un potente inhibidor directo de la trombina. Su actividad anticoagulante es predecible y lo suficientemente estable para no precisar monitorización durante el tratamiento crónico. Presenta un perfil farmacocinético favorable, con escasa unión a proteínas y eliminación fundamentalmente renal, por lo que está contraindicado en la insuficiencia renal grave. La dosis recomendada en FA es de 150mg dos veces al día. La dosis de 110mg dos veces al día puede considerarse en pacientes con edad avanzada, bajo peso corporal, alto riesgo hemorrágico o tratamiento concomitante con verapamilo o antiagregantes.
Conflicto de interesesNinguno.