Palabras clave
INTRODUCCIÓN
Una de las preguntas más comunes y difíciles de resolver adecuadamente cuando se examina una coronariografía de contraste es si determinada lesión es o no significativa, si es capaz de producir isquemia y si requiere tratamiento. Se ha sugerido que se plantean dudas sobre la significación de las lesiones hasta en un 30% de las lesiones en las que se realiza angioplastia1. Con frecuencia, la respuesta es diversa entre el grupo de observadores, de consenso difícil, y la discusión concluye con un reconocimiento general de las limitaciones de la técnica para la valoración de las lesiones intermedias (40-70% de estenosis por diámetro). Esta puesta al día pretende repasar algunas de las alternativas de las que se dispone hoy día en el laboratorio de hemodinámica para tratar de responder de una manera científica a esa incertidumbre, así como sus ventajas y limitaciones.
PAPEL Y LIMITACIONES DE LA ANGIOGRAFÍA DE CONTRASTE EN LA VALORACIÓN DE LAS LESIONES INTERMEDIAS
La evaluación de la severidad de las lesiones coronarias se realiza, desde hace 5 décadas, mediante angiografía de contraste. Hace 45 años, por accidente, el Dr. F. Mason inyectó selectivamente en la arteria coronaria derecha de un paciente en el que se pretendía realizar una aortografía. En aquel entonces, 1958, se asumía, por semejanza con lo que se había señalado en el modelo experimental, que la consecuencia inmediata de la inyección selectiva sería el desencadenamiento de arritmias ventriculares malignas a causa de la inducción de una hipoxia asimétrica transitoria. La constatación de que se podía inyectar de manera selectiva de una forma razonablemente segura proporcionó una herramienta esencial para el estudio, en las últimas 5 décadas, de la historia natural de la enfermedad coronaria, así como para la comprensión de la relación entre los síndromes coronarios agudos y la complicación de la placa de ateroma y la introducción de diversos tratamientos, como la fibrinólisis o la angioplastia percutánea.
Los trabajos pioneros de Gould et al2,3 permitieron describir, en el modelo experimental, la relación entre la severidad anatómica de la estenosis y la resistencia que ésta induce al flujo sanguíneo. En el modelo experimental se acepta que hace falta una reducción mayor del 75% de la sección de corte del vaso (equivalente al 50% de estenosis por diámetro) para que se produzca una disminución del flujo sanguíneo coronario capaz de producir isquemia con el esfuerzo. Esta evidencia experimental se ha trasladado a la clínica, donde se ha generalizado la clasificación de las estenosis con un diámetro ≥ 50% como significativas por su teórica capacidad para inducir isquemia. Sin embargo, en las últimas décadas se han hecho evidentes las múltiples limitaciones de la angiografía de contraste para la evaluación de la significación de las lesiones. Así, se ha constatado la falta de precisión de la estimación visual de la severidad de la estenosis respecto a las técnicas de cuantificación automática, especialmente en lesiones moderadas4, donde se tiende a infraestimar las lesiones inferiores al 40% y a sobrestimar aquellas ≥ 50%. También se ha observado la dificultad de distinguir entre las lesiones intermedias que producen o no isquemia5. Asimismo, se ha señalado la infraestimación del grado de enfermedad coronaria cuando se compara con la histología, lo que se ha atribuido a que la enfermedad suele ser difusa6 y a que la angiografía compara característicamente la severidad de la lesión con un segmento de referencia que se presume sano (porcentaje de estenosis por diámetro). Si el segmento de referencia también está enfermo, el grado de estenosis producido por la lesión lógicamente se infraestima. Este hecho se ha observado también in vivo casi como una constante con la disponibilidad de la ecografía intravascular7, que ha demostrado que menos del 10% de los segmentos de referencia considerados como normales realmente lo son, y que, de media, el 50% de la luz de estos segmentos de referencia están ocupados por placa.
Por otro lado, se sabe que la mayoría de los pacientes que se someten a una angiografía coronaria para la evaluación de un dolor torácico lo hacen sin que se haya realizado previamente una prueba no invasiva de detección de isquemia8, lo que dificulta la evaluación de la significación funcional de las lesiones. En la actualidad, esta tendencia se ha incrementado y cabe esperar que en los próximos años se acentúe aún más, a tenor de las actuales recomendaciones de las guías de tratamiento de los síndromes coronarios agudos, que favorecen un tratamiento invasivo precoz9.
La relativa insensibilidad de la angiografía de contraste para detectar las lesiones intermedias capaces de inducir isquemia, así como el elevado número de pacientes sin una evaluación precisa no invasiva de éstas, han despertado el interés por disponer de nuevas técnicas capaces de evaluar la significación fisiológica de las lesiones intermedias en el laboratorio de hemodinámica. A continuación revisaremos los 3 métodos más utilizados en la actualidad: la reserva de flujo coronario (RFC), evaluada por guía Doppler, la reserva fraccional de flujo miocárdico (RFF), evaluada por guía de presión, y la ecografía intravascular. Sin embargo, es necesario reseñar que disponer de técnicas de diagnóstico complementario no significa que se deba descuidar la realización de una angiografía cuidadosa, la cual, junto con los datos clínicos, es suficiente para valorar adecuadamente una parte sustancial de las lesiones coronarias.
ALGUNOS PRINCIPIOS DE FISIOPATOLOGÍA CORONARIA
Las bases fisiológicas sobre las que asienta el uso de sensores de flujo y de presión para la evaluación de la significación de las lesiones son sencillas. El flujo sanguíneo coronario en reposo se incrementa varios órdenes de magnitud en respuesta a las demandas de oxígeno del miocardio o de estímulos farmacológicos. En condiciones normales, la mayor parte de la resistencia al flujo se debe a las arteriolas precapilares, mientras que la inducida por las arterias epicárdicas es trivial. Una estenosis coronaria se considera significativa cuando es capaz de disminuir el flujo sanguíneo coronario y, por tanto, de inducir isquemia con el esfuerzo. Cuando una estenosis induce un aumento de la resistencia al flujo coronario en las arterias de conducción epicárdicas, la microvasculatura distal se dilata para mantener un flujo regional basal suficiente para cubrir la demanda miocárdica de oxígeno. Todo ello conlleva una serie de cambios en el flujo y la presión de la sangre.
Consecuencias en el flujo
Según la severidad de la estenosis, el flujo en reposo distal a la estenosis puede estar disminuido, aunque habitualmente suele ser suficiente para cubrir las necesidades metabólicas basales del miocardio. Un aumento del consumo de oxígeno miocárdico en estas circunstancias o un estímulo hiperémico artificial, producen aumento del flujo sanguíneo distal menor del esperable en esa región si no existiera la estenosis o en comparación con otra región sin estenosis.
Consecuencias en la presión
Una estenosis coronaria epicárdica capaz de incrementar la resistencia al flujo sanguíneo produce una pérdida de presión distal debida a la disminución de la energía cinética en fricción viscosa, turbulencia y separación de flujo10. Como consecuencia, se crea una diferencia, o gradiente, de presión antes y después de la estenosis. La diferencia de presión está directamente relacionada con el flujo sanguíneo y, en situación de hiperemia máxima con vasodilatación arteriolar coronaria máxima, la relación entre presión y flujo coronario es lineal.
RESERVA DE FLUJO CORONARIO EVALUADA POR GUÍA DOPPLER
Concepto
La RFC se define como el cociente entre el flujo sanguíneo coronario durante la hiperemia máxima y el flujo coronario basal. Asumiendo un área de corte arterial estable, la velocidad de la sangre es proporcional al flujo y, por tanto, la RFC puede estimarse midiendo la velocidad sanguínea en reposo y durante vasodilatación, con hiperemia máxima. En pacientes sin lesiones coronarias, la RFC es > 2 y puede llegar hasta 5. En pacientes jóvenes con unas arterias normales observadas mediante ecografía intravascular suele ser > 3, aunque en pacientes con dolor torácico y arterias angiográficamente normales suele ser algo menor, lo que sugiere una enfermedad microvascular o macrovascular no detectable por angiografía11.
Técnica y uso clínico
La medición de la velocidad sanguínea intracoronaria se realiza mediante una guía similar a la de angioplastia (0,014 pulgadas, 175 cm de longitud) dirigible, con un transductor piezoeléctrico en la punta. La punta de la guía que contiene el transductor se posiciona distalmente a la estenosis, y la parte proximal se conecta a una consola para el análisis de la señal. El transductor emite y recibe ultrasonidos que rebotan en los hematíes que circulan por la arteria, y la diferencia entre las frecuencias de emisión y de retorno del ultrasonido permite calcular la velocidad de la sangre, de acuerdo con la expresión:
donde V es la velocidad de la sangre, F0 la frecuencia de transmisión del transductor, F1 la frecuencia de retorno, C la constante para la velocidad del sonido en la sangre y Ø el ángulo de incidencia de los ultrasonidos.
En los equipos actuales se utiliza el análisis espectral de las imágenes con la transformada rápida de Fourier (fig. 1) y la consola mide o calcula automáticamente diferentes parámetros de la velocidad de la sangre. El cociente entre la velocidad sanguínea tras la administración de un estímulo vasodilatador máximo y la velocidad sanguínea basal define la RFC. El estímulo vasodilatador más utilizado es la adenosina, administrada en bolo intracoronario o en infusión intravenosa continua. Otros agentes farmacológicos, como la papaverina, también se han usado profusamente con anterioridad, aunque en la actualidad su empleo es más raro, en el caso concreto de la papaverina por su capacidad de inducir arritmias ventriculares. Se debe administrar nitroglicerina intracoronaria para normalizar el tono arterial antes de medir las velocidades. Se presume que el área de corte del vaso no varía sustancialmente entre el estado basal y la inducción de hiperemia máxima, por lo que es posible calcular el flujo coronario (ml/s) multiplicando la velocidad de la sangre (cm/s) por el área de corte arterial (cm2).
Fig. 1. Registros de velocidad de flujo coronario con guía Doppler. Los paneles superiores de cada figura, A y B, corresponden al registro de velocidad en tiempo real. Los paneles inferiores izquierdos de cada figura corresponden a la medición basal de velocidades y los paneles inferiores derechos a la velocidad tras hiperemia máxima con adenosina. El cociente de las velocidades medias pico (APV) en hiperemia y en situación basal es la reserva de flujo coronario (RFC). En A la RFC es de 2 y en B, de 1,3, lo que indica que la lesión evaluada es severa o que existe daño microvascular.
También se han utilizado otros parámetros Doppler para valorar la severidad de las lesiones epicárdicas, como el cociente de velocidades proximal y distal (P/D) o el cociente de velocidad diastólica y sistólica (RVDS). En las arterias coronarias, el volumen de flujo sanguíneo y el área de corte arterial se reducen de forma proporcional a lo largo del vaso. De esta forma, para arterias con un diámetro > 2 mm, la velocidad en la parte distal del vaso es similar a la de la parte proximal y el cociente P/D, cercano a 1. En las estenosis significativas se obseva un cociente P/D > 1,712. Asimismo, en las estenosis significativas se altera el normal predominio del flujo diastólico con respecto al sistólico, y el RVDS, que normalmente es > 2, se reduce a valores cercanos a la unidad13. Por desgracia, tanto el P/D como el RVDS presentan una variabilidad y una falta de especificidad elevadas que hacen que sean muy poco utilizados en la práctica clínica14.
Limitaciones
Por su propia definición, las circunstancias que alteran el flujo coronario basal o disminuyen el máximo grado de hiperemia pueden alterar la RFC. Una característica de la RFC es que depende de las condiciones hemodinámicas. Así, por ejemplo, la taquicardia incrementa el flujo sanguíneo basal15, por lo que es un factor a tener en cuenta en los estudios seriados. Asimismo, factores que aumentan el consumo de oxígeno, como la anemia o el hipertiroidismo, o los cambios en las condiciones de carga o contractilidad, pueden alterar el flujo sanguíneo basal. Wieneke et al16 han propuesto un factor de corrección para tener en cuenta el flujo sanguíneo basal y la edad del paciente, en lo que se conoce como RFC corregida.
La RFC evalúa conjuntamente los componentes epicárdico coronario y microvascular. Una RFC > 2 indica la normalidad de ambos componentes, mientras que las estenosis en las arterias epicárdicas o la disfunción de la microvasculatura alteran la reserva de flujo. Así, se ha descrito una RFC anormal en pacientes con hipertensión esencial o estenosis aórtica con unas arterias epicárdicas angiográficamente normales, así como en pacientes diabéticos o en situaciones de isquemia aguda o crónica17,18. Asimismo, después de un infarto agudo de miocardio, el daño microvascular puede hacer disminuir la RFC, independientemente de la existencia de una estenosis epicárdica19. Para intentar separar el componente epicárdico del microvascular y poder evaluar de una forma más directa la severidad de la estenosis epicárdica, sin factores de confusión, se ha sugerido el uso de la RFC relativa (rRFC). La rRFC es el cociente de la RFC en la arteria con la estenosis a evaluar y la RFC en un arteria de referencia sin estenosis. Suponiendo que la respuesta de la microvasculatura al estímulo hiperémico es similar en los 2 territorios estudiados, el cociente refleja la repercusión de la lesión epicárdica en el flujo sanguíneo coronario. El valor normal de rRFC se sitúa entre 0,75 y 120,21. Lógicamente, la rRFC no se puede usar en pacientes con enfermedad de 3 vasos, en los que no se puede obtener una RFC de referencia. Asimismo, tampoco es utilizable en pacientes en los que se sospeche que la respuesta microvascular no es homogénea en los distintos territorios miocárdicos, como en enfermos con disfunción ventricular segmentaria, infarto de miocardio, etc.
Validación en la valoración de lesiones intermedias (tabla 1)
Varios estudios han valorado la utilidad de la medición de la RFC por Doppler en la evaluación de las lesiones intermedias. En un estudio pionero, hace ya una década, Miller et al22 compararon la RFC con técnicas de perfusión con isótopos en 27 pacientes con lesiones intermedias (30-70% de estenosis por diámetro). Los 14 pacientes con una RFC < 2 determinada por Doppler presentaban isquemia reversible en el estudio con isótopos, mientras que 10 de los 13 pacientes con una RFC > 2 tenían un estudio normal. La concordancia entre las 2 técnicas era del 89%. Joye et al23, en 30 pacientes con lesiones intermedias, también encontraron una excelente correlación entre estas 2 técnicas, con una sensibilidad y especificidad del 94 y 95%, respectivamente. Desafortunadamente, estudios más recientes, realizados en cohortes más amplias de pacientes y comparados con estudios de perfusión con isótopos o con ecocardiografía de estrés24-26,21, han señalado una concordancia menor con los resultados de la RFC, con un rango entre el 72 y el 84%.
Como se ha mencionado con anterioridad, se ha estudiado también el valor de la rRFC en un intento de eliminar la dependencia de la RFC de la respuesta microvascular. Baumgart et al27 estudiaron la relación entre la RFC, la rRFC, la RFF (véase el apartado siguiente) y el porcentaje de estenosis por área mediante ultrasonidos en 24 lesiones. La RFF y la rRFC presentaron una buena correlación con el porcentaje de estenosis por área (r = 0,89 y r = 0,79, respectivamente; p < 0,0001). Asimismo, existía una buena correlación entre la RFF y la rRFC (r = 0,91; p < 0,0001), pero no con la RFC absoluta (r = 0,33; p = NS), lo que subraya la importante dependencia de este parámetro de la microvasculatura, así como la potencial mayor utilidad de la rRFC en la valoración de las lesiones epicárdicas. Estudios más recientes, como el de Chamuleau et al28, han encontrado una menor concordancia en los resultados de la prueba de perfusión con dipiridamol-MIBI con la RFC y la rRFC en pacientes con enfermedad de 2 vasos (76 y 78%, respectivamente), aunque también es conocida la menor precisión de los isótopos en la localización de las lesiones responsables en pacientes con enfermedad multivaso29.
RESERVA FRACCIONAL DE FLUJO MIOCÁRDICO EVALUADA POR GUÍA DE PRESIÓN
Concepto
La RFF se define como la relación entre el máximo flujo coronario al miocardio en presencia de una estenosis, dividido por el máximo flujo coronario que existiría en ese vaso si no hubiera esa estenosis30,31. Es decir, la fracción del flujo coronario máximo que puede ser transportado por ese vaso estenótico. En situación de hiperemia máxima, con vasodilatación arteriolar coronaria máxima, la relación entre presión y flujo coronario es lineal, lo que permite calcular la RFF. En la práctica clínica, este cálculo implica simplemente dividir la presión media distal a la estenosis por la presión aórtica media en situación de hiperemia máxima inducida mediante un estímulo farmacológico. En arterias normales sin estenosis y, por tanto, sin descenso de la presión, la RFF es, lógicamente, igual a 1. Algunos autores han sugerido realizar el cálculo de la RFF sólo con el gradiente producido durante la diástole, dado que la mayor parte del flujo sanguíneo coronario se produce durante esta fase del ciclo; sin embargo, la superioridad clínica de este parámetro sobre la RFF convencional no está demostrada32.
Técnica y uso clínico
Los gradientes de presión inducidos por una estenosis se han medido desde hace años en la sala de hemodinámica. Se utilizaron con profusión para valorar la significación de lesiones intermedias, así como el resultado de la angioplastia con balón33,34. Posteriormente fueron abandonados porque los propios catéteres de angioplastia utilizados para la medición de los gradientes producen una cierta obstrucción al flujo y porque todavía no se conocía que esta relación entre presión y flujo sólo alcanza su verdadero sentido en situación de hiperemia máxima y no en reposo, ya que el gradiente de presión, lógicamente, depende del flujo. En el momento actual, para el cálculo de la RFF se utilizan guías de 0,014 pulgadas, de aspecto y manejabilidad similares a las guías utilizadas para la angioplastia convencional. La guía lleva incorporado un transductor de presión cerca de su punta, que se introduce distalmente a la lesión a estudiar; la parte proximal se conecta a una consola para el análisis de la señal. Después de obtener un registro basal de presiones, se aplica un estímulo hiperémico con el propósito de obtener una vasodilatación máxima, y se calcula la RFF como el cociente entre la presión media distal a la estenosis, medida mediante la guía de presión, y la presión media proximal a la lesión, medida con el catéter guía (fig. 2). Se acepta que una lesión es capaz de inducir isquemia cuando su RFF es < 0,7535,36. Además, la medición de la presión distal al balón inflado, por ejemplo durante un procedimiento intervencionista, refleja la presión de enclavamiento, lo que permite evaluar la circulación colateral. También es posible evaluar estenosis secuenciales múltiples. La RFF calculada con la presión media distal a la más distal de las estenosis refleja el deterioro del flujo inducido por la totalidad de las lesiones. Es posible también calcular la contribución de cada una de ellas por separado a la disminución de la RFF, aunque de una forma considerablemente más complicada en la que, además, es preciso ocluir la arteria para determinar la presión de enclavamiento37,38. Por último, también es posible evaluar la significación de un segmento difusamente enfermo pero sin ninguna lesión localizada que claramente sea más severa en la angiografía. Para ello, se mantiene una situación de hiperemia máxima con una infusión intravenosa de adenosina mientras se realiza una retirada cuidadosa del transductor a lo largo de todo el segmento arterial. La existencia de una RFF < 0,75 medida en la parte más distal de la arteria y que disminuye de forma gradual a lo largo de todo el trayecto del vaso demuestra la severidad de la estenosis de éste, así como la inexistencia de una lesión localizada que se pueda beneficiar de una dilatación percutánea. En resumen, la guía de presión proporciona una gran cantidad de información sobre la fisiopatología de la arteria coronaria estudiada y su uso ha sido validado en muchas de las situaciones clínicas con las que nos encontramos habitualmente.
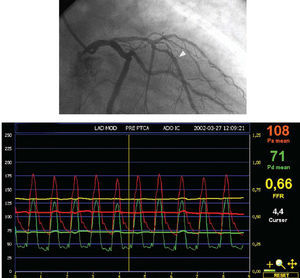
Fig. 2. Proyección oblicua anterior derecha donde se observa una lesión intermedia en el tercio medio de la descendente anterior después de una rama septal bien desarrollada. Existe también otra lesión ligera proximal a la rama septal. Tras colocar el transductor de la guía de presión distal a la estenosis (cabeza de flecha) e inducir hiperemia máxima con adenosina intravenosa, se registra una presión media de 71 mmHg en el transductor de la guía de presión y de 108 mmHg a través del catéter guía. En cuanto a la reserva fraccional de flujo miocárdico (RFF), el cociente entre las dos es 0,66, lo que indica que la lesión es significativa.
Limitaciones
El cálculo de la RFF se basa en la presunción de la relación lineal entre presión y flujo coronario cuando la hiperemia es máxima. Si no se consigue una hiperemia máxima, el gradiente de presión estaría infraestimado y se sobrestimaría la RFF, por lo que las lesiones con significado fisiológico podrían ser consideradas no significativas. El límite de 0,75 ha sido validado por De Bruyne y Pijls con el uso de papaverina intracoronaria y adenosina intravenosa en pacientes seleccionados, estables, con enfermedad de un vaso y con función ventricular izquierda normal35,36,39. Sin embargo, la mayoría de los laboratorios de hemodinámica utilizan como estímulo vasodilatador la adenosina intracoronaria, administrada a través del catéter guía, por su sencillez y rapidez, aunque aún no se ha aclarado de forma definitiva la dosis que realmente es capaz de inducir una vasodilatación máxima40. Una de las ventajas de esta técnica es que existe un límite categórico, 0,75, para considerar la lesión como capaz de inducir isquemia. Sin embargo, como siempre en biología, este límite es, probablemente, demasiado rígido, y se tiende a aceptar en la actualidad una zona gris entre 0,75 y 0,80. Por último, otra limitación es que, en caso de disfunción microvascular, como puede ocurrir después de un infarto, o en pacientes diabéticos o con hipertrofia ventricular izquierda, puede no lograrse la hiperemia máxima y, por tanto, sobrestimarse la RFF. A pesar de ello, se ha señalado que estos vasos probablemente no se beneficiarían de una revascularización, ya que las lesiones no producirían isquemia, aun con la máxima vasodilatación alcanzable.
Validación en la valoración de lesiones intermedias (tabla 2)
La correlación entre la RFF y los resultados de pruebas de detección no invasiva de isquemia en lesiones intermedias ha sido objeto de un cuidadoso estudio28,32,35,36,41. En un estudio pionero, Pijls et al36 midieron la RFF en 45 pacientes con estenosis coronarias intermedias en los que se realizó una prueba de esfuerzo, una prueba de perfusión coronaria con isótopos y una ecocardiografía de estrés. La totalidad de los 21 pacientes con RFF < 0,75 tenía evidencia de isquemia en al menos una de las pruebas no invasivas practicadas. En 21 de los 24 pacientes con RFF ≥ 0,75 no se indujo isquemia en ninguna de las pruebas no invasivas realizadas. La sensibilidad, especificidad y concordancia de la RFF fueron del 88, el 100 y el 93%, respectivamente. Sobre la base de estos resultados, se estableció el valor de 0,75 como límite para considerar que una lesión puede producir isquemia. Con posterioridad, en otras series se han reseñado resultados similares, con sensibilidades en torno al 90% y una concordancia > 90%32,41.
Hay que reseñar que algunos datos apoyan que es seguro no realizar una intervención en lesiones con una RFF > 0,7542-47. Bech et al46 estudiaron a 325 pacientes remitidos para angioplastia sin evidencia de isquemia a los que midió la RFF. Los pacientes con una RFF > 0,75 fueron aleatorizados a realizar (n = 90) o no realizar la angioplastia (n = 91). En los 144 pacientes con una RFF < 0,75 se llevó a cabo la angioplastia. La supervivencia libre de eventos fue similar en los pacientes de ambos grupos (el 92 frente al 89% a los 12 meses y el 89 frente al 83% a los 24 meses) y significativamente mayor que en el grupo con una RFF < 0,75 en los que la intervención se realizó directamente. Estos resultados sugieren que el cálculo de la RFF ayuda a identificar a los pacientes que se benefician de la revascularización.
USO COMBINADO DEL GRADIENTE DE PRESIÓN Y EL FLUJO CORONARIO PARA LA PREDICCIÓN DE LA SEVERIDAD DE LA LESIÓN
Recientemente se ha sugerido que la combinación de los datos de presión y de flujo o velocidad de la sangre obtenidos mediante la guía de presión y la guía Doppler puede proporcionar una información superior a la de cualquiera de las técnicas por separado. Meuwissen et al48 subrayaron, tras realizar una prueba de perfusión con isótopos en 151 pacientes con angina, que el mejor predictor de la presencia de un defecto reversible de perfusión era el índice de resistencia de la estenosis durante hiperemia. Es bien conocida la relación curvilínea entre flujo y gradiente de presión y, por tanto, parece lógico que la predicción de la severidad de la lesión basada en ambas variables y no solamente en una de ellas sea más precisa. Este índice normaliza el gradiente de presión por la velocidad o flujo coronario y, por tanto, puede resolver alguna de las condiciones en las que el flujo sea inadecuadamente alto (falso positivo de la RFF) o bajo (falso negativo de la RFF). Es previsible que en un futuro cercano existan transductores de velocidad y presión montados sobre la misma guía que hagan factible su uso en la práctica clínica diaria. Asimismo, se han desarrollado guías de presión, capaces también de medir la temperatura, con las que es posible medir el flujo coronario por termodilución, aunque todavía no están comercialmente disponibles49.
EVALUACIÓN POR ECOGRAFÍA INTRACORONARIA
Las múltiples limitaciones de la angiografía de contraste, esencialmente su incapacidad para visualizar de forma directa la placa de ateroma, así como proporcionar solamente una representación bidimensional de la silueta de la luz del vaso, impulsaron el desarrollo de técnicas alternativas de imagen com intracoronarios. El desarrollo de estos sistemas ha sido posible gracias a la miniaturización de los transductores, que en la actualidad son < 1 mm de diámetro, lo que permite introducirlos fácilmente en el interior de las arterias coronarias. Los principios sobre los que se asienta la obtención de imágenes son iguales a los de cualquier otro dispositivo ultrasónico de imagen. Los ultrasonidos se generan por uno o varios pequeños transductores e interrogan la circunferencia del vaso, obteniendo una imagen tomográfica, de corte arterial. Una pequeña parte de las ondas emitidas se refleja de nuevo en la pared hacia el transductor, fundamentalmente en las interfaces de tejidos, con distinta impedancia acústica. La magnitud de los ultrasonidos reflejados depende de la diferencia en la impedancia acústica de los dos tejidos adyacentes. A mayor ecogenicidad, mayor capacidad de reflejar los ultrasonidos y, por tanto, más brillante es su representación en la imagen. La alta frecuencia a la que operan los transductores intracoronarios (30-40 MHz) les confiere una excelente resolución espacial, es decir, una gran capacidad de discriminar entre objetos muy cercanos en la imagen obtenida. La resolución espacial axial, es decir, en la dirección del haz de ultrasonidos, es del orden de 80-150 µm, y la resolución lateral, o sea, la perpendicular al haz de ultrasonidos y al catéter, de unas 200-250 µm50,51. De esta forma, es posible obtener imágenes muy detalladas de la luz y la pared arteriales o de la lesión en estudio, incluyendo un cierto grado de caracterización tisular. La evaluación tomográfica que realiza esta técnica permite efectuar un análisis mucho más detallado de la severidad de la lesión (fig. 3), así como evaluar la existencia de enfermedad difusa, una de las causas más frecuentes de infraestimación de las lesiones por angiografía.
Fig. 3. A pesar de múltiples proyecciones angiográficas, la lesión de la primera rama marginal es de significación dudosa. Sin embargo, valorada por ecografía intravascular (B) se objetiva que el transductor (*) está abrazado por la placa de ateroma y sólo queda una pequeña luz residual a las 5 pm (cabeza de flecha), lo que constituye una lesión significativa. Obsérvese que existe un cierto grado de ateromatosis difusa con afección de los segmentos proximal (A) y distal (C) a la estenosis (cabeza de flecha).
Técnica
Existen 2 sistemas de ultrasonidos comercialmente disponibles para su uso intracoronario: mecánico y de estado sólido. En el caso del sistema mecánico, un solo transductor rota a 1.800 prm por medio de un cable externo, interrogando la circunferencia del vaso. El transductor está dentro de una vaina protectora que impide su contacto con la pared arterial. En los sistemas de estado sólido múltiples pequeños transductores, hasta 64 en los sistemas modernos, están montados de forma circunferencial sobre el catéter e interrogan cada uno a un sector de la circunferencia arterial. Los catéteres se introducen en el interior de las arterias coronarias enhebrados en una guía de angioplastia de forma análoga a la de un catéter-balón, interrogando la lesión en estudio mediante una retirada manual o automática a velocidad constante. Como en el caso de la guía de presión o la guía Doppler, hace falta anticoagular al paciente con 5.000-10.000 U de heparina y se debe utilizar nitroglicerina intracoronaria de forma sistemática para evitar el espasmo de la arteria. Las imágenes que se obtienen se almacenan en un soporte digital o en una cinta de vídeo para su posterior análisis. La superior definición de la información anatómica que proporcionan los ultrasonidos permite entender y resolver muchas de las imágenes ambiguas desde el punto de vista angiográfico.
Limitaciones
Los ultrasonidos proporcionan una información anatómica muy superior a la de la angiografía de contraste, pero no ofrecen una información funcional de la severidad de la lesión. Su principal limitación, pues, en la valoración de la severidad de las lesiones es que ésta se infiere de sus características anatómicas y no se valora directamente. Existe un riesgo inherente a cualquier instrumentación de un vaso coronario. El riesgo de acontecimientos adversos es pequeño, menos del 0,3% de complicaciones mayores, y se relaciona fundamentalmente con la evaluación de lesiones severas durante procedimientos intervencionistas52,53.
Validación en la valoración de lesiones intermedias (tabla 3)
Una serie de estudios ha intentado encontrar un punto de corte para calificar una lesión como significativa y potencialmente capaz de inducir isquemia. Los estudios han intentado validar los ultrasonidos comparándolos con distintos patrones de referencia invasivos y no invasivos. Abizaid et al54 estudiaron la relación entre el área luminal mínima evaluada por ecografía y la RFC evaluada por Doppler en 73 pacientes. En su estudio, un área luminal mínima < 4 mm2 tenía una concordancia del 89% con una RFC < 2. Nishioka et al55 estudiaron los hallazgos de la ecografía intravascular con los de perfusión miocárdica evaluada por isótopos en 70 pacientes con una mayoría de lesiones intermedias. De nuevo, un área luminal mínima por ecografía ≤ 4 mm2 tenía una sensibilidad del 88% y una especificidad del 90% para predecir defectos de perfusión en la prueba de imagen con isótopos. Otros parámetros ultrasónicos, como la carga de placa, es decir, la fracción del área del vaso ocupada por placa, obtenían datos de especificidad y sensibilidad algo inferiores, aunque en el rango del 80-90%.
También se ha investigado la relación entre los parámetros ecográficos y la RFF medida por guía de presión. Takagi et al56 encontraron en 51 lesiones, la mitad angiográficamente intermedias, una buena correlación entre la RFF y el área luminal mínima (r = 0,79; p < 0,0001) y la carga de placa (r = 0,77; p < 0,0001). Utilizando un criterio de corte de 3 mm2 de área luminal mínima, la sensibilidad de las imágenes con ultrasonidos para detectar una RFF < 0,75 fue del 83% y la especificidad, del 92%. Asimismo, al emplear como criterio de significación la presencia de una carga de placa > 60%, la sensibilidad de los ultrasonidos para detectar lesiones significativas por la RFF fue del 92% y la especificidad del 89%. Sin embargo, en una serie más reciente, Briguori et al57 han señalado concordancias menores. En esta serie de 53 lesiones, todas moderadas, la sensibilidad del criterio de área luminal mínima ≤ 4 mm2 para detectar lesiones significativas de acuerdo con el resultado de la RFF fue del 92%, pero su especificidad fue del 56%. El criterio de > 70% de carga de placa tenía una sensibilidad del 100% y una especificidad del 68%. Estos autores proponen la utilización combinada de una carga de placa > 70% y un diámetro luminal mínimo ≤ 1,8 mm, que en su estudio alcanzaba una sensibilidad del 100% y una especificidad del 76%.
Se ha evaluado la utilidad de alguno de estos criterios, no ya para predecir los hallazgos de isquemia en las pruebas funcionales, sino para predecir la aparición de eventos clínicos adversos en el seguimiento. Abizaid et al58 reseñaron que un área luminal mínima ≥ 4 mm2 o un diámetro luminal mínimo ≥ 2 mm predecían una baja incidencia de muerte o infarto de miocardio, del 2% en los 13 meses posteriores. Los autores sugieren que siguiendo estos criterios se puede no realizar la intervención con buenos resultados clínicos.
¿CUÁNDO UTILIZAR UNA U OTRA TÉCNICA? VENTAJAS Y DESVENTAJAS (tabla 4)
El uso de la RFC presenta varias limitaciones. Es una variable dependiente de las condiciones hemodinámicas, lo que disminuye su reproducibilidad potencial. Además, aunque se considera normal por encima de 2, este límite no es un claro punto de corte y varía de paciente a paciente. Es necesario ser meticuloso en la colocación de la guía Doppler, ya que el centrado del transductor en la arteria es esencial para la obtención de una señal adecuada. Por último, la RFC evalúa conjuntamente el componente epicárdico coronario y el componente microvascular. Por ello, los pacientes con una alteración microvascular (p. ej., hipertrofia miocárdica, diabetes) pueden tener una RFC anormal, aun sin tener lesiones epicárdicas significativas. Si esta afección es difusa se puede utilizar la rRFC para determinar la severidad de la estenosis epicárdica. Lógicamente, esto no es posible en pacientes con enfermedad de 3 vasos y, en cualquier caso, es necesario disponer e instrumentar un vaso distinto del que queremos evaluar.
Tanto la RFC por Doppler como la RFF por guía de presión sólo son adecuadamente evaluadas si se alcanza hiperemia máxima. Si no se logra, el gradiente de presión a través de la estenosis se infraestima y la RFF se sobrestima. Al contrario, la RFC se infraestima en ausencia de máxima hiperemia. Por ello, es esencial inducir una máxima vasodilatación. Por desgracia, en la práctica clínica, la mayor parte de los estudios se realizan con administración de adenosina intracoronaria, en aras de una mayor rapidez y comodidad, en vez de con adenosina intravenosa, que es el método con el que se ha validado la técnica. Las dosis idóneas para administración intracoronaria todavía son objeto de debate y, probablemente, las utilizadas sean claramente inferiores a las necesarias para inducir una vasodilatación máxima40. La RFF también se encuentra afectada por la presencia de enfermedad microvascular debido a la necesidad de obtener una hiperemia máxima. En el caso de daño microvascular, la RFF se sobrestimará. Sin embargo, seguirá proporcionando información útil, ya que un valor > 0,75 implica la ausencia de isquemia de ese miocardio. La RFF tiene la enorme ventaja de poseer un límite más categórico de normalidad, 1, y de inducción de isquemia, 0,75. Se puede medir en pacientes con enfermedad multivaso y toma en consideración la presencia de circulación colateral. Sin embargo, su uso no está validado y es razonable que sea menos útil en las lesiones responsables de síndromes inestables, donde factores dinámicos como la trombosis o cambios en el tono arterial desempeñan un papel importante. La principal limitación de la ecocardiografía intracoronaria es la de proporcionar sólo información anatómica y, a través de ella, estimar la significación funcional de la lesión. Ésta no siempre se correlaciona bien con la anatomía y, de hecho, no existe un claro punto de corte contrastado por completo que sea universalmente utilizable. Sin embargo, una de sus ventajas es que, al proporcionar un gran detalle anatómico, de carácter tomográfico, es capaz de resolver muchas de las imágenes ambiguas de la angiografía y facilitar la comprensión de sus causas, así como de orientar el tratamiento intervencionista en caso necesario. Por último, la interpretación de las imágenes, particularmente en casos dudosos, requiere un nivel de conocimiento de la técnica que representa una barrera para algunos hemodinamistas.
La experiencia del operador con las distintas técnicas es importante a la hora de decidir cuál de ellas utilizará para evaluar una lesión intermedia. Todas deben ser realizadas con especial meticulosidad si se quiere obtener una información fiable y ninguna está exenta de complicaciones, aunque su incidencia sea muy baja. Como consideración general, por todo lo expuesto, la guía de presión es, en el momento actual, la herramienta más útil para la valoración de lesiones de significación dudosa en el seno de lesiones estables (fig. 4). De hecho, su uso ha aumentado considerablemente en los últimos años en nuestro país, aunque sigue siendo limitado59. En el caso de lesiones en las que pueda ser especialmente útil entender su anatomía o composición para planear una intervención, la ecografía intravascular puede ser una buena alternativa si la experiencia del operador es adecuada.
Fig. 4. Un algoritmo de utilización de las diferentes pruebas de diagnóstico intracoronario para la evaluación de lesiones intermedias. RFF: reserva fraccional de flujo miocárdico; RFC: reserva de flujo coronario; rRFC: reserva de flujo coronario relativa.
Hay que reseñar, sin embargo, que el uso de métodos diagnósticos intracoronarios para la evaluación de lesiones angiográficamente dudosas sigue siendo bajo en nuestro país59. Su empleo se encuentra limitado por el tiempo adicional que indudablemente precisa, por el coste añadido que implica, en ocasiones por la falta de experiencia del operador, y también por la facilidad actual para el tratamiento de este tipo de lesiones. Esto último favorece que con frecuencia se traten incluso en un tiempo menor del requerido para su evaluación o que se difiera la decisión para evaluar clínicamente su repercusión en el paciente, con la confianza de poder abordarlos con facilidad en caso de ser necesario. Ante la epidemia creciente de pacientes que llegan a la sala de hemodinámica sin que se les hayan realizado pruebas no invasivas de detección de isquemia, quizá ha llegado el momento de que cada laboratorio se sienta cómodo con al menos una de estas técnicas.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. J. Botas.
Servicio de Cardiología. Hospital General Gregorio Marañón.
Dr. Esquerdo, 47. 28007 Madrid. España.
Correo electrónico: javbotas@jet.es