Palabras clave
INTRODUCCIÓN
La utilización de ácido acetilsalicílico (AAS) a dosis bajas (75-350 mg) en la prevención secundaria de enfermedades cardiovasculares (ECV) está plenamente aceptada y es reembolsada (el Sistema Nacional de Salud [SNS] español abona el 60% del precio del fármaco). Sin embargo, en individuos sin antecedentes de ECV, está menos aceptada, aunque 2 metaanálisis1,2, basados en los mismos 5 estudios, con más de 50.000 pacientes, han demostrado su efectividad3-7. Esto se debe a que en muchos países (España incluida) el AAS a dosis bajas todavía no está aprobado como tratamiento para la prevención primaria (PP) de la ECV y se lo ha relacionado con sangrado gastrointestinal (SGI) e ictus hemorrágico. Hayden et al1 demostraron que, de 1.000 individuos con un riesgo de sufrir un evento coronario (mortal o no mortal) del 5% en 5 años (p. ej., un varón de 50 años con colesterol LDL en 210 mg/dl y presión arterial sistólica de 140 mmHg), el AAS prevendría entre 6 y 20 infartos de miocardio (IM). Sin embargo, también causaría entre 0 y 2 ictus hemorrágicos y entre 2 y 4 episodios de SGI. Para personas con riesgo de enfermedad coronaria (EC) del 1% en 5 años (p. ej., un varón de 45 años sin factores de riesgo de ECV) prevendría entre 1 y 4 IM, pero causaría los mismos eventos hemorrágicos.
La American Heart Association8 recomienda el tratamiento con AAS en individuos con un riesgo anual ≥ 1%. Las guías europeas no especifican el umbral de riesgo, aunque manifiestan que en PP el AAS está recomendado en individuos con diabetes, con hipertensión arterial bien controlada y en varones con riesgo multifactorial alto de ECV9. El documento de consenso sobre el uso de agentes antiplaquetarios recomienda utilizar AAS en la PP de pacientes de alto riesgo: diabetes e hipertensión10.
Hasta la fecha no hemos hallado análisis económicos sobre el uso de AAS a dosis bajas en PP. Por tanto, las recomendaciones de tratamiento existentes se han hecho sin tener en cuenta las posibles implicaciones económicas. Este estudio tiene como objetivo aportar argumentos económicos a la discusión sobre el uso del AAS en la PP de la ECV y estimar el impacto presupuestario para el SNS español.
MÉTODOS
Estructura del modelo
Para estimar el coste-efectividad del tratamiento con AAS a dosis bajas en la PP de la ECV, se diseñó un modelo de Markov en Data Pro de TreeAgeTM. Se utilizaron ciclos de 1 año, con un horizonte total de 10 años, para correlacionarlo con los gráficos de predicción de riesgo utilizados por la segunda European Joint Task Force11. El modelo consistió en 5 estados de salud principales: sin antecedentes de ECV (sin EC conocida, sin enfermedad arterial periférica o enfermedad cerebrovascular), antecedentes de ictus, antecedentes de IM, antecedentes de ECV y muerte (fig. 1).
Fig. 1. Estructura simplificada del modelo de transición del estado de salud. AAS: ácido acetilsalicílico; EC: enfermedad coronaria; ECV: enfermedad cardiovascular; IM: infarto de miocardio.
Todos los hipotéticos sujetos empezaron en el modelo sin antecedentes de ECV. Cada año, cada uno de ellos tuvo un riesgo de ECV (definido como IM mortal, IM no mortal o muerte súbita), ictus (mortal o no mortal, isquémico o hemorrágico), o muerte por otra causa. Independientemente de esos riesgos, cada individuo tuvo un riesgo de SGI. Se asumió una distribución uniforme de los episodios durante el año, que se calculó utilizando una corrección de medio ciclo en el modelo de Markov (asumiendo que los eventos ocurren a mitad del año). Todos los riesgos dependieron de si el individuo había sido tratado con AAS o no.
Dentro del modelo de transición del estado de salud, los individuos con eventos mortales pasaron al estado de «muerte», los que habían tenido un primer ictus pasaron al estado «antecedente de ictus» y los que habían tenido un primer IM no mortal pasaron al estado «antecedente de IM». Los individuos restantes mantuvieron su estado «sin antecedentes de ECV».
Los individuos con un antecedente de ictus o IM presentaron un riesgo más alto de experimentar un nuevo evento. Cuando un individuo con un antecedente de ictus tuvo un IM no mortal, pasó al estado «antecedente de ECV». La misma transición se aplicó a los individuos con un antecedente de IM tras sufrir un ictus. Aquellos con un antecedente de ictus que habían tenido otro ictus mantuvieron su estado «antecedente de ictus». Los individuos con un antecedente de IM que habían tenido otro IM no mortal mantuvieron su estado «antecedente de IM». Se asumió que todos los individuos, independientemente del tratamiento original (placebo o AAS), serían tratados con AAS tras el primer evento de ECV. Distintas encuestas han demostrado que la frecuencia de la utilización del AAS después de un evento coronario agudo es aproximadamente del 90%11,12.
El tratamiento de un individuo con o sin AAS en la consulta clínica diaria depende de su riesgo de EC y de los efectos adversos. Además, la relación coste/efectividad del AAS dependerá del riesgo basal de EC. Se calculó el riesgo anual utilizando la ecuación de Framingham (en el momento de desarrollar el modelo no se disponía de la ecuación del SCORE)1,13. Para el caso base, se eligió un riesgo anual del 1,5% (aproximadamente del 15% a los 10 años). La elección del 15% está de acuerdo con las guías americanas y europeas sobre la utilización de AAS en PP. Además, el AAS reduce el riesgo de EC de manera similar a las estatinas (el 28% con AAS y el 31% con estatinas en el estudio WOSCOPS14). Dado que el AAS es un fármaco mucho más barato y que las estatinas están recomendadas para un riesgo de EC ≥ 20% a los 10 años, en el presente análisis se utilizó un umbral más bajo.
Los resultados se presentan como coste por años de vida ganados (AVG) y coste por años de vida ajustados por calidad (AVAC). Se aplicó una tasa de descuento del 3% a costes y resultados.
Datos clínicos
Los datos sobre la eficacia del AAS se extrajeron de los metaanálisis publicados en PP y los datos de prevención secundaria del grupo con AAS del ensayo CAPRIE1,2,15.
Un metaanálisis1 proporcionó información detallada (p. ej., riesgo anual, reducción de riesgo e intervalos de confianza [IC] del 95%) sobre el impacto del AAS en el riesgo de EC (definido como IM mortal, IM no mortal y muerte súbita), ictus total y todas las causas de mortalidad, así como sobre la relación entre EC mortal y no mortal. El otro2 proporcionó información adicional sobre la relación entre ictus mortal y no mortal y la proporción de ictus isquémicos.
En el modelo de transición del estado de salud puede elegirse el riesgo basal de EC. El riesgo de ictus está relacionado con el de EC. Según Hayden et al1, por cada evento coronario hay 0,54 eventos cerebrovasculares.
La tabla 1 muestra el riesgo anual de todas las complicaciones a partir de un riesgo basal de EC del 1,5%.
El estudio CAPRIE15 presenta resultados para individuos con antecedentes de IM e ictus isquémico y para la cohorte total de individuos con antecedentes de un evento vascular (tabla 1). El riesgo de un evento es mayor en prevención secundaria que en PP pero, tras un segundo IM o ictus, el riesgo de otro IM o ictus se mantiene igual en el modelo, ya que el estudio CAPRIE no especifica por separado el riesgo de nuevos eventos después de sufrir 2 o más.
Datos del coste
Se estudiaron los costes médicos directos desde la perspectiva del SNS. Todas las unidades monetarias se expresaron en euros de 2003. Se utilizaron los costes de los siguientes eventos: IM mortal, IM no mortal, ictus mortal, ictus isquémico no mortal, ictus hemorrágico no mortal, SGI y seguimiento tras un evento cardiovascular (IM, ictus o ambos).
Para calcular la mayoría de los costes para España se utilizó la Base de Datos de Costes Sanitarios SOIKOS (2004)16. En ella, con excepción del coste del ictus mortal, todos los costes agudos están definidos por grupos relacionados con el diagnóstico. Para calcular el coste del ictus mortal se utilizó el del ictus isquémico como base, asumiendo que el del ictus mortal está relacionado con el ictus no mortal, igual que el IM mortal lo está con el IM no mortal. Para el coste del seguimiento se utilizó los datos de Levy et al17. En ese estudio, el horizonte temporal fue de 2 años y los costes se dividieron en costes de manejo de la enfermedad en fase aguda y costes de seguimiento. Para España, los costes de hospitalización derivaron de bases de datos de hospitales y de tarifas nacionales, y los de seguimiento se calcularon utilizando un árbol de decisión desarrollado con datos sobre el manejo del paciente y el uso de recursos, obtenidos de la literatura, de estadísticas nacionales oficiales y de opiniones de expertos locales (panel Delphi). Se utilizaron los costes de 1999, que fueron recalculados utilizando el índice español de inflación médica para obtener los valores de 2003 (www.ine.es) (tabla 2).
Aunque el AAS no está actualmente financiado en PP en España, se asumió que sí lo estaba. Así, el copago del paciente sería del 40%. Se asumió, además, que en prevención secundaria la financiación era del 100%, ya que la mayoría de los pacientes estaba en las categorías que están completamente reembolsadas. El precio público de un comprimido de AAS de 100 mg era de 0,082 euros (precio de venta al público más impuesto al valor agregado)18.
Utilidades
Los datos sobre utilidad obtenidos de la literatura médica19,20 se basaron en el método Time-Trade-Off. Las utilidades para post-IM y postictus fueron 0,88 (IC del 95%, 0,84-0,93) y 0,68 (IC del 95%, 0,53-0,83), respectivamente. El porcentaje del IM se basó en 2 a 5 mediciones durante 1,5 años en 67 pacientes y el del ictus fue el resultado para ictus moderado de un metaanálisis de los estudios de utilidad19,20. Cuando se producía un IM agudo, se aplicaba una utilidad de 0 durante 1 semana21. Se determinó que una hemorragia extracraneal no tuviera secuelas permanentes y que disminuyera la utilidad durante 2 semanas (utilidad, 0,5 durante 2 semanas)22. Si el paciente tenía historia de ictus o de IM, se asumió que tenía la peor utilidad (utilidad del ictus).
Impacto presupuestario
Para estimar el número de pacientes que se puede tratar, se utilizaron 2 fuentes23,24. Marrugat et al23 estimaron el porcentaje de población con un riesgo bajo, medio y alto según una adaptación de la ecuación de riesgo de Framingham para España. Los porcentajes de población según el riesgo se registraron en función del sexo, el hábito tabáquico y la diabetes. Baena Díez et al24 comunicaron el porcentaje de población española fumadora y diabética por edad y sexo. Al combinar los datos de estos 2 estudios con el número de habitantes de España (www.ine.es), se obtuvo el número de pacientes con riesgo de sufrir un evento superior al 15 y el 20% a los 10 años, como muestra la tabla 3. Se asumió que dentro del grupo de riesgo moderado (riesgo del 10-19% a los 10 años) el mismo número de pacientes tenía un riesgo superior e inferior al 15%.
Análisis de sensibilidad
Se realizaron varios análisis de sensibilidad con las siguientes variables: riesgo basal de EC, tasas de descuento, riesgo de sangrado gastrointestinal, riesgo de ictus hemorrágico, coste de las complicaciones y utilidades.
Análisis de Monte Carlo
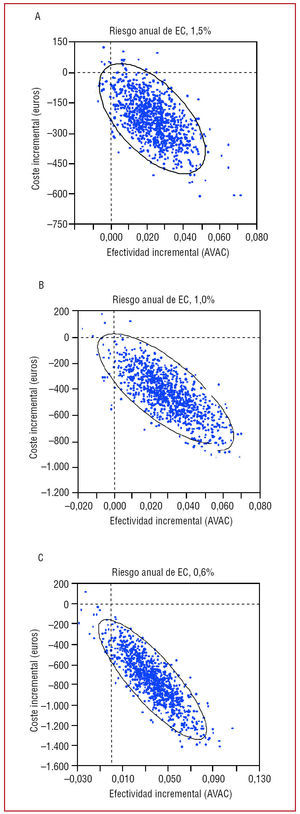
En el modelo, los efectos del AAS se incorporaron como estimación puntual con un IC del 95% (tabla 1). Éste se utilizó también para costes y utilidades (tabla 2). El modelo se aplicó 1.000 veces; cada simulación utilizó un valor aleatorio de la distribución de cada una de las variables del modelo. El análisis de Monte Carlo se realizó partiendo de los distintos riesgos anuales de EC en España (coste por AVAC ganado). Se estimó un riesgo anual del 0,6% (umbral para el tratamiento recomendado por la US Preventive Services Task Force1), del 1,0% (umbral recomendado por la American Heart Association8) y del 1,5%.
RESULTADOS
Validación del modelo
Para validar el modelo de transición del estado de salud, se comparó el número de eventos coronarios evitados, según el informe de Hayden et al1, con el número calculado en el presente estudio. Para un riesgo del 5% en 5 años, Hayden et al1 pronosticaron que se podría prevenir entre 6 y 20 eventos por cada 1.000 pacientes tratados, mientras que este modelo pronosticó entre 11 y 17 eventos prevenidos. Con un riesgo del 1% en 5 años se previene entre 1 y 4 (Hayden et al1); el presente análisis estimó que se evitaban entre 3 y 4 eventos.
Caso base
Para individuos con un riesgo anual de EC del 1,5% (riesgo a los 10 años, 14-15%), el coste a los 10 años fue de 5.768 euros (IC del 95%, 5.366-6.185 euros) sin AAS y de 4.971 euros (IC del 95%, 4.383-5.581 euros) con AAS. Por término medio, el tratamiento con AAS representó un ahorro de 797 euros (IC del 95%, 301-1.330 euros) por paciente en 10 años. Durante el primer año de terapia con AAS se obtuvo un ahorro medio de 19,30 euros (no significativo). Los ahorros significativos se aprecian tras 2 años de tratamiento. El número de AVG fue de 8,33 (IC del 95%, 8,32-8,34) y 8,36 (IC del 95%, 8,33-8,39), respectivamente, y el número de AVAC ganados fue de 8,20 (IC del 95%, 8,16-8,24) y 8,24 (IC del 95%, 8,18-8,29), respectivamente.
Análisis de sensibilidad
Variar la tasa de descuento entre el 0 y el 6% no cambia los resultados, ya que la administración de AAS tiene una efectividad mayor y costes menores.
En el caso base, el riesgo anual de EC se fijó en el 1,5%, lo que representó un ahorro para el SNS. El análisis de sensibilidad mostró que la terapia con AAS ya produce ahorros en los costes (aunque no significativos) cuando el riesgo anual de EC es ≥ 0,244% (fig. 2). Un riesgo de EC del 0,244% al año es, por ejemplo, el riesgo de un varón de 55 años o más, no fumador, sin diabetes o hipertensión diagnosticadas y con perfil lipídico normal.
Fig. 2. Impacto del riesgo anual de EC sobre el coste (basado en un riesgo anual de EC del 0,244%, umbral en el que el tratamiento con ácido acetilsalicílico produce un ahorro de costes). EC: enfermedad coronaria.
La decisión de tratar o no tratar con AAS depende del riesgo de EC y también del de efectos adversos. En el caso base, el riesgo de ictus fue 1,02 veces más alto con AAS que con placebo. El IC del 95% publicado por Hayden et al fue de 0,85-1,23. Aunque se aplique el límite superior, el tratamiento con AAS sigue siendo más barato y más efectivo que con placebo (tabla 4). En el caso base, el riesgo de SGI fue 1,7 veces mayor con AAS que con placebo. El IC del 95% publicado por Hayden et al fue 1,4-2,1. Aunque se aplique el límite superior, el tratamiento con AAS sigue siendo más barato y más efectivo que con placebo. Además, si se aplican los 2 límites superiores para los riesgos de ictus y de SGI, la terapia con AAS sigue ahorrando costes significativamente, incluso cuando el riesgo anual de EC disminuye al 0,6% (umbral para el tratamiento recomendado por la US Preventive Services Task Force1).
El cambio en el coste de las complicaciones basado en los IC del 95% mostrados en la tabla 2 no tuvo ningún impacto en los resultados. Además, el uso del IC del 95% sobre la utilidad del IM y del ictus no varió los resultados.
Análisis de Monte Carlo
Basándose en un riesgo anual de EC del 0,6, el 1,0 y el 1,5%, el tratamiento con AAS en España fue dominante en el 98,0, el 97,1 y el 97,8% de los casos, respectivamente (fig. 3).
Fig. 3. Análisis de Monte Carlo (coste/AVAC). AVAC: años de vida ajustados por calidad; EC: enfermedad coronaria.
Análisis del impacto presupuestario
Mediante la ejecución del modelo para riesgos anuales del 1,5 y el 2% (riesgo anual a los 10 años, ≥ 15% y 20%) y la combinación de los resultados con el número de pacientes que cumplían los criterios (tabla 3), se calculó que, ya en el primer año, una inversión de 22,3 millones de euros puede ahorrar unos 26,5 millones de euros (ahorros netos) en el presupuesto del SNS, si todos los pacientes incluibles (riesgo anual ≥ 1,5%) son tratados con AAS a dosis bajas. A partir de los 3 años, la inversión de 64,1 millones de euros supone aproximadamente 149,4 millones de euros de ahorro en dicho presupuesto si todos los pacientes incluibles son tratados con AAS a dosis bajas.
DISCUSIÓN
El análisis económico realizado demuestra que en pacientes con un riesgo de EC moderadamente incrementado (con un riesgo a los 10 años del 15%), la administración de AAS para la PP de los eventos cardiovasculares produce un ahorro de costes significativo desde la perspectiva del financiador público. Así, el tratamiento con AAS de un paciente con riesgo de EC moderadamente elevado para prevenir el primer evento cardiovascular ahorraría dinero al SNS español. Esto significa que, adicionalmente al beneficio clínico, por ejemplo en AVG, también hay argumentos económicos que apoyan el uso del AAS en PP. Muchas otras intervenciones en PP, e incluso en prevención secundaria, no representan ningún ahorro de costes.
Plans Rubio25 realizó una revisión sobre el coste-efectividad de los programas de prevención cardiovascular disponibles en España, en términos del coste neto por AVG. Los índices del análisis de coste-efectividad oscilaban entre 2.600 y 80.000 $/AVG en varones y entre 4.500 y 230.000 $/AVG en mujeres. En varones de 40 a 59 años, la clasificación del coste-efectividad creciente fue: dejar de fumar (2.608-3.738 $/AVG), tratamiento de la hipertensión moderada y grave (8.564-38.678 $/AVG), tratamiento de la hipertensión leve (11.906-59.840 $/AVG), tratamiento dietético (16.143-20.158 $/AVG) y tratamiento médico de la hipercolesterolemia (33.850-81.010 $/AVG). En mujeres, la clasificación fue: dejar de fumar (4.482-5.756 $/AVG), tratamiento de la hipertensión moderada y grave (9.585-57.983 $/AVG), tratamiento de la hipertensión leve (15.248-86.075 $/AVG), tratamiento dietético (57.175-62.154 $/AVG) y tratamiento médico de la hipercolesterolemia (104.100-259.150 $/AVG). Dado que el coste del AAS es inferior y produce más años de vida o AVAC ganados, no tiene sentido calcular la relación coste/efectividad incremental. De hecho, los valores negativos son difíciles de interpretar.
El coste del AAS es muy bajo y el posible ahorro para el SNS puede ser importante. En la página web de la Organización para la Cooperación y el Desarrollo Económicos (OCDE: www.oecd.org) hay información sobre el gasto en fármacos y en salud. En España, en 2001, se gastó 64.500 millones de euros en salud. De ellos, el 17,8% (según los últimos datos disponibles, de 1990) se destinó a fármacos (11.500 millones de euros). De esta manera, la financiación del AAS en la PP de la EC supondría, si todos los pacientes elegibles tomaran AAS, un incremento del presupuesto en fármacos de 22,3 millones de euros (0,2%), pero significaría una disminución del total del presupuesto en asistencia sanitaria de 26,5 millones de euros (0,04%).
La validez de estos resultados está respaldada por los análisis de sensibilidad. Considerando un riesgo ≥ 3% a los 10 años, el AAS, aunque no significativamente, es coste-efectivo y el ahorro se puede apreciar ya desde el primer año del tratamiento. La validación del modelo, comparando con los resultados descritos por Hayden et al, muestra que el número de eventos coronarios evitados fue muy similar, por lo que estos datos también respaldan nuestros resultados.
Puede parecer extraño que en el análisis de Monte Carlo, para riesgos anuales más bajos, el AAS fuera dominante en un porcentaje de pacientes mayor. Pero, tiene una explicación. La efectividad de emplear o no AAS no depende del riesgo anual de EC. El AAS siempre será más efectivo en la prevención de EC. Esta efectividad mejorada se define como una reducción del riesgo relativo que no depende del riesgo basal. En el riesgo anual más bajo, la reducción del riesgo relativo se mantiene, pero esto produce una reducción del riesgo absoluto más pequeña y también una reducción del error estándar. Al analizar la figura 3, se ve que los resultados están más agrupados y en rangos más bajos para los grupos con un menor riesgo anual de EC. Además, a menores índices de riesgo anual, el impacto de las complicaciones hemorrágicas (SGI e ictus hemorrágico) se hace más importante. El riesgo de estas complicaciones no cambia con el riesgo anual de EC. Por debajo de un riesgo anual de EC del 0,6%, el número de casos en que el AAS es dominante empieza a disminuir y es del 93%, con un riesgo anual del 0,5% y de menos del 90% si el riesgo anual es del 0,4%, debido al coste adicional de las complicaciones por hemorragia.
Este análisis apoya las recomendaciones internacionales para la PP de la ECV y muestra que, desde una perspectiva económica, las preocupaciones clínicas por los SGI o el ictus hemorrágico debidos a la terapia con AAS son menos relevantes en pacientes sin riesgo incrementado de SGI (estos últimos fueron excluidos de los ensayos individuales incluidos en los metaanálisis)3-7.
La ecuación de Framingham, tanto en España como en otros países europeos, se ha utilizado ampliamente, aunque se ha observado que su aplicación puede sobrestimar el riesgo coronario. Recientemente, han aparecido algunas adaptaciones de esta ecuación en España23,24,26, y también la ecuación del proyecto SCORE, basada en poblaciones de bajo y alto riesgo de países europeos13. Aplicar estas nuevas ecuaciones puede implicar que menos individuos tengan un riesgo alto (≥ 20% a los 10 años), lo que supone un efecto en el impacto presupuestario de los tratamientos que modifican el riesgo, y también afecta al resultado del impacto presupuestario presentado en este modelo. Estas ecuaciones se publicaron después del desarrollo del modelo de este estudio y, además, no tienen ningún efecto en los resultados del análisis de coste-efectividad aquí descrito, ya que este modelo se inició con un paciente hipotético con un cierto riesgo de sufrir un evento, y no considera características demográficas.
Este estudio presenta la limitación de haber usado resultados de metaanálisis que incluyeron, en períodos muy diferentes de estudio, distintos riesgos basales de EC y distintas dosis de AAS (75-500 mg/día). No disponer de datos no publicados sobre los metaanálisis y los estudios individuales llevó a utilizar supuestos adicionales (p. ej., el riesgo de muerte no relacionada con la ECV). Además, algunos costes (eventos mortales, seguimiento) se obtuvieron de pacientes con diabetes, lo cual pudo haber llevado a sobrestimar los costes, y así sobrestimar los beneficios del tratamiento con AAS. Sin embargo, creemos que los resultados obtenidos son válidos porque no hay datos que refieran que un IM o un ictus mortales deberían resultar más caros en pacientes con diabetes y porque los autores estudiados presentaban los costes relacionados con el tratamiento de la diabetes separadamente. Además, estos supuestos no cambiaron los resultados clínicos y los análisis de sensibilidad no revelaron ningún impacto significativo de estos datos en los costes en los resultados finales17.
En este análisis, el impacto del AAS puede haberse subestimado, ya que únicamente se evaluó su efecto sobre IM no mortal, IM mortal y muerte súbita. Pero la EC incluye también angina estable e inestable, y los metaanálisis de PP no incluían información sobre estos ítems. Sólo 2 estudios revisados incluyen el efecto del tratamiento con AAS en angina4,7, y en ellos se presentaron menos casos de angina en individuos que recibían AAS, pero no pudo apreciarse una diferencia significativa entre tratamientos.
CONCLUSIONES
La utilización de AAS en PP en pacientes con un riesgo ≥ 15% a los 10 años produciría un ahorro considerable de costes para el SNS español.
Estudio financiado por Bayer Healthcare AG.
Correspondencia: Dra. C. Piñol.
Unidad de Farmacoeconomía y RR.II. Q.F.Bayer, S.A.
Pau Clarís, 196. 08037 Barcelona. España.
Correo electrónico: carmen.pinol.cp@bayer.es
Recibido el 20 de octubre de 2005.
Aceptado para su publicación el 4 de mayo de 2006.