Palabras clave
INTRODUCCIÓN
La técnica de la ablación por radiofrecuencia de focos ectópicos localizados en la desembocadura de las venas pulmonares (VP), en pacientes con fibrilación auricular paroxística, ha despertado el interés por los métodos de imagen capaces de ofrecer una adecuada información anatómica de las VP1. El objetivo del presente estudio es determinar la utilidad de la angiorresonancia magnética (angio-RM) para el estudio anatómico sistemático de las VP.
PACIENTES Y MÉTODO
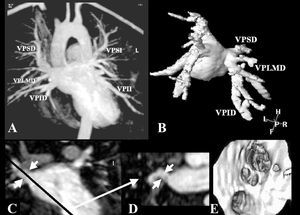
Se incluyó a 17 pacientes consecutivos en los que se realizaba un estudio de cardiorresonancia magnética (cardio-RM) en nuestro centro, siempre que precisara de la administración de contraste paramagnético. En todos los pacientes se realizaron secuencias angio-RM 3D (equipo Philips Intera 1.5T, Best, Países Bajos) durante la administración de gadoteridol 0,2 mmol/kg (ProHance, Bracco Internacional BV, Amsterdam, Países Bajos), a una velocidad de infusión de 3 ml/s. El análisis detallado de las imágenes se realizó a partir de imágenes proyectadas (fig. 1A), sólidas tridimensionales (fig. 1B), tomográficas (fig. 1 C y D) y por endoscopia virtual (fig. 1E), y con la utilización de un software especializado (Easy Vision, Philips Medical Systems, Best, Paises Bajos y MASS Plus V 5.0 MEDIS, Leiden, Países Bajos). Dada la forma irregular del orificio de desembocadura de las venas pulmonares, se sistematizó la medida de los ostium por medio de dos diámetros ortogonales (fig. 1 C y D), así como por el área croseccional, y se calcularon el valor medio y la desviación estandar de cada vena principal. Se utilizó la prueba de la t de Student como método de comparación de medias entre variables numéricas y se consideraron significativos los valores de p < 0,05.
Fig. 1. Modalidades de visualización de las venas pulmonares (VP) obtenidas en un paciente con la vena del lóbulo medio derecho (VPLMD) independiente. A: imagen MIP (maximal intensity projection) en la que se observa el conjunto de las VP proyectadas en un solo plano. B: imagen sólida tridimensional, obtenida por posprocesado del volumen de adquisión original, en la que destaca la independencia de la VPLMD. C: plano coronal orientado sobre el eje longitudinal de la VP superior derecha (VPSD). Ostium delimitado por las flechas. La línea corresponde a la programación del corte ortogonal obtenido en D. E: imagen intracavitaria de la aurícula izquierda, orientada a la desembocadura de las VP derechas, obtenida por endoscopia virtual en la estación de posprocesado. Se identifican tres ostium independientes correspondientes, de arriba abajo, a la VPSD, la VPLMD (obsérvese la confluencia de dos ramas, que a su vez forman un ostium claramente ovalado) y la VP inferior derecha (VPID).
RESULTADOS
En todos los pacientes se obtuvieron imágenes interpretables de buena calidad. En la tabla 1 se muestran las características del grupo estudiado y los valores de las mediciones.
El diámetro de los ostium osciló entre 9 y 22 mm. Si bien el valor medio de los diámetros de cada uno de los ostium en cualquier eje fue similar en todas las VP, las áreas calculadas eran superiores en las VP derechas con respecto a las izquierdas, con diferencias significativas entre el área de la VP inferior izquierda (6,2 ± 1,9 cm²) y las de la VP superior derecha (8,0 ± 2,4 cm²; p = 0,02) e inferior derecha (7,6 ± 1,9 cm²; p = 0,04) respectivamente.
Un 35% de los ostia tenía forma elíptica, definida como una diferencia ≥ 3 mm entre los dos diámetros ortogonales. Esto era más manifiesto en las VP inferiores (el 72% de los casos con ostium elíptico) que en las superiores, y la VP inferior izquierda era la que con más frecuencia tenía un ostium elíptico (el 61% de todos los pacientes).
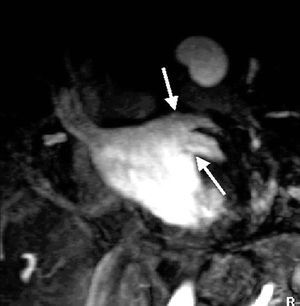
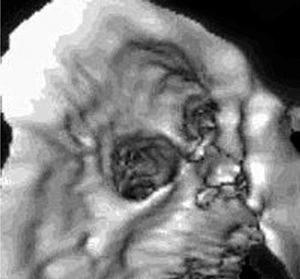
En cuanto al número de ostia, en 14 pacientes (82% del total) se visualizaron 4, en 2 pacientes (12%) se visualizaron 5, correspondiendo el ostium supernumerario a una desembocadura independiente de la VP media derecha (fig. 2), y en 1 paciente (6%) se identificaron 3, al haber una desembocadura confluente de las dos VP izquierdas (fig. 3). Estos últimos 3 pacientes correspondían a casos preablación.
Fig. 2. Sección en plano oblicuo coronal en la que se visualiza la confluencia de las venas pulmonares izquierdas, que forman un gran ostium común en la aurícula izquierda.
Fig. 3. Mismo caso de la figura 2 en el que se muestra la visión intracavitaria del ostium común por endoscopia mitral.
En cuanto a las ramificaciones de las VP, en 10 pacientes (59%) se observó que la convergencia de las ramas de las VP derechas sucedía muy cerca del ostium y daba lugar a un tronco común corto, y en 5 pacientes (29%) no había un tronco común, al estar formado el ostium por la confluencia directa de las venas lobares (VP superior derecha, 3 casos; VP superior izquierda, 2 casos; VP inferior derecha, 1 caso). Consideradas en conjunto, se observó que las VP derechas se ramifican más precozmente que las VP izquierdas (el 74 frente al 10%).
DISCUSIÓN
Los resultados del estudio demuestran que la angio-RM es una técnica muy útil para el estudio anatómico sistemático de las VP, tal como han descrito otros autores2,3. Aunque la descripción completa de las características anatómicas de las venas pulmonares se puede realizar en todos los pacientes a partir de la imágenes planares, la reconstrucción en formato sólido de 3 dimensiones (3D) resulta muy útil para proporcionar una visión espacial de las VP, mientras que la endoscopia virtual 3D ofrece imágenes muy orientativas de la disposición intracavitaria de los ostium de las VP. Esta información es útil para el electrofisiólogo y facilita la planificación y la realización del cateterismo de las VP. Por otra parte, la inocuidad de la técnica, no invasiva y no emisora de radiación ionizante, permite la realización ilimitada de estudios de seguimiento para descartar las posibles complicaciones secundarias a la ablación.
Los hallazgos morfológicos observados en nuestra serie se corresponden con los descritos en los tratados anatómicos clásicos4-6, incluido el hecho de que las VP superiores tienden a presentar áreas croseccionales mayores que las inferiores, al igual que sucede con las VP derechas respecto de las izquierdas, todo ello en concordancia con el tamaño de los lóbulos pulmonares. Asimismo, la medición del diámetro de los ostia, en planos ortogonales al eje longitudinal del vaso, permite precisar su morfología, que es de forma elíptica en un tercio de las VP estudiadas, hecho que justifica la recomendación de utilizar para su estudio técnicas de imagen tridimensional7. Por ello, además, los controles postablación para descartar estenosis en las venas ablacionadas deberán analizarse siempre en comparación con las imágenes de referencia obtenidas preablación.
En nuestra serie, los 3 pacientes con variantes en la desembocadura de las VP correspondían a casos preablación. Dado el reducido número de casos estudiados es aventurado relacionar estas anomalías con la presentación de fibrilación auricular paroxística y, aunque hay datos en la bibliografía que sugieren una mayor prevalencia de variantes morfológicas en pacientes con dicha arritmia8-11, no se ha podido demostrar hasta el momento una relación clara entre ambos hechos.
Una limitación del presente estudio es no haberlo realizado en voluntarios sanos, sino en una muestra heterogénea de pacientes con cardiopatía, lo que impide considerar como valores normales de referencia las medidas obtenidas en los ostium de las VP.
CONCLUSIONES
El conocimiento de la disposición anatómica y la morfología de las VP mediante angio-RM es de gran utilidad para el electrofisiólogo, ya que facilita el posicionamiento de los catéteres durante el procedimiento de ablación de las venas pulmonares. La disponibilidad de información exacta sobre la morfología de cada una de las VP debe suponer una ventaja para los estudios de seguimiento, que son ilimitados dado el carácter no invasivo y la ausencia de radiación de la cardio-RM.
AGRADECIMIENTOS
A Marc Gómez Godó y Ricard Cullell Salmerón, Diplomados Universitarios de Enfermería del Servicio de Radiodiagnóstico del Hospital de Sant Pau, por su colaboración en la realización de los estudios de angio-RM. A Han Rademaker, del Departamento de Resonancia Magnética de Philips Ibérica, S.A., por la cesión temporal del módulo de software de endoscopia virtual para la realización del presente artículo.
Correspondencia: Dr. F. Carreras.
Unidad de Imagen Cardíaca. Servicio de Cardiología.
Hospital de la Santa Creu y de Sant Pau.
Sant Antoni M. Claret, 167. 08025 Barcelona. España.
Correo electrónico: fcarreras@santpau.es