El síndrome coronario agudo es un proceso con una elevada morbimortalidad cuyo tratamiento está bien establecido en las guías clínicas desde hace años, no así todas las complicaciones que se derivan de él. El sangrado es uno de los principales efectos adversos de los fármacos antitrombóticos empleados en la actualidad y su incidencia real es desconocida. Sin embargo, está bien establecido que se trata de una situación que empeora el pronóstico de los pacientes tanto a corto como a largo plazo, y que es parcialmente evitable si se consigue identificar a los pacientes más vulnerables y se lleva a cabo una serie de medidas preventivas.
Palabras clave
2'3 difosfoglicerato.
ácido acetilsalicílico.
anticoagulación oral.
antiinflamatorios no esteroideos.
accidente isquémico transitorio.
citocromo P450.
fibrilación auricular.
glucoproteína IIb/IIIa.
hemoglobina.
heparina de bajo peso molecular.
heparina no fraccionada.
hipertensión arterial
intervencionismo coronario percutáneo.
razón normalizada internacional.
insuficiencia renal crónica.
síndrome coronario agudo.
síndrome coronario agudo sin elevación del ST.
La trombosis es el componente patogénico principal del síndrome coronario agudo (SCA); por ello, actualmente las piedras angulares del tratamiento son las terapias antiagregantes, anticoagulantes, trombolíticas y de revascularización percutánea. Gracias a su eficacia demostrada en numerosos ensayos clínicos, la mayoría de los pacientes que presentan un SCA son tratados con una combinación de varios fármacos, entre los que se incluyen: heparina no fraccionada (HNF), heparina de bajo peso molecular (HBPM), ácido acetilsalicílico (AAS), tienopiridinas, inhibidores de la glucoproteína IIb/IIIa (anti-GPIIb/IIIa), inhibidores de la trombina y fibrinolíticos. Aunque estos fármacos reducen el riesgo de complicaciones trombóticas, todos ellos, en virtud de su mecanismo de acción, aumentan el riesgo de sangrado.
En este artículo se analiza la importancia y el modo de estratificar el riesgo hemorrágico en pacientes con SCA y cómo adecuar el uso de las terapias disponibles en función de las características individuales de los pacientes.
importancia del problemaCada vez es mayor el número de terapias antitrombóticas disponibles para el tratamiento del SCA, pero en realidad son un arma de doble filo para el clínico, que debe tratar de equilibrar los beneficios de la reducción de eventos trombóticos con el riesgo de sangrado. En el pasado, se consideraba el sangrado como una consecuencia inevitable de la terapia antitrombótica, y evitarlo recibía importancia. Actualmente se estima que una hemorragia grave tiene lugar en un 3-5% de los SCA, siendo las hemorragias leves más frecuentes, un 5-10%1, 2. En cuanto a la localización, el sangrado más frecuente es el gastrointestinal (31,5%), seguido del sangrado en la zona de acceso vascular en los pacientes sometidos a revascularización percutánea (23,8%), sangrado retroperitoneal (6%) y genitourinario (4,8%)2. Pero, lo que es más importante, los pacientes que sufren hemorragias graves durante el ingreso por un SCA tienen 5 veces más riesgo de muerte, infarto de miocardio e ictus en los primeros 30 días, y este riesgo es independiente de si se practica o no revascularización percutánea1, 3.
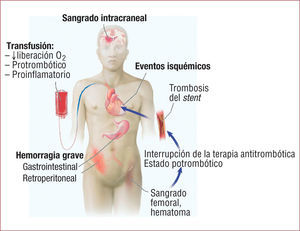
En realidad, el mecanismo por el que las hemorragias empeoran el pronóstico es poco conocido, pero es indudable que la anemia, la hipovolemia, la interrupción del tratamiento antitrombótico y la transfusión de concentrados de hematíes y otros hemoderivados tienen un impacto negativo en la evolución clínica4. Del hecho de presentar un evento hemorrágico en el contexto de un SCA se deriva una serie de consecuencias básicas: por un lado, los efectos adversos de un síndrome anémico agudo per se (hipotensión, hipoperfusión de órganos, bajo aporte de oxígeno a los tejidos, taquicardia refleja, etc.), que puede a su vez contribuir a desencadenar un evento isquémico; por otro lado, la necesidad de transfundir hemoderivados para restaurar adecuados hematocritos y aporte tisular de oxígeno y finalmente, la supresión del tratamiento antitrombótico (fig. 1).
Se ha visto que la mortalidad es mayor en pacientes en los que se suspende el tratamiento antitrombótico que en los que se mantiene a pesar del sangrado. Este hecho podría explicarse por un aumento del número de complicaciones trombóticas e isquémicas que, en definitiva, son las causantes del SCA en cuestión5. Además, el hecho de transfundir a los pacientes que presentan eventos hemorrágicos y anemia secundaria también se asocia a un aumento de mortalidad tanto a los 30 días como al año6, 7, como se demostró en el registro CRUSADE8, en el que se analizó a 74.271 pacientes, y se vio que los que recibían una transfusión durante la hospitalización tenían mayor riesgo de muerte en el hospital y muerte por infarto de miocardio.
El mecanismo por el que las transfusiones se asocian a un aumento del riesgo de eventos trombóticos e isquémicos no está esclarecido del todo. En un principio parece razonable pensar que si se aumenta la hemoglobina (Hb) mediante una transfusión con concentrados de hematíes, aumentará la capacidad para liberar oxígeno a los tejidos; sin embargo, se ha observado que la transfusión no comporta que la oxigenación en los tejidos mejore9-11. Hasta ahora se había señalado que esto podría deberse a que los hematíes almacenados son deficitarios en 2'3 difosfoglicerato (2'3 DPG), lo que hace que el O2 tenga una alta afinidad por la Hb y se dificulte así la liberación de O2 a los tejidos12. Sin embargo, estudios experimentales indican que las concentraciones de 2'3 DPG se recuperan a las pocas horas de la transfusión y se cree que es posible que otros cambios estructurales y bioquímicos que se producen en las células almacenadas sean la causa de una alteración en su función in vivo13.
De este modo se cree que una pérdida de la flexibilidad de la membrana eritrocitaria, que haga perder a los hematíes su típica forma bicóncava, dificultaría su deformación al paso por los pequeños vasos, lo que precipitaría su rotura y favorecería la activación de un proceso trombótico en ellos. Del mismo modo, cambios en la forma de los eritrocitos pueden condicionar un descenso de la relación superficie/volumen, con aumento de la concentración de Hb, la fragilidad osmótica y la viscosidad, todos ellos factores que predisponen a la agregación de las células en los pequeños capilares, que produciría su obstrucción y desencadenaría isquemia en el tejido afecto14, 15.
Otra de las posibles explicaciones es el déficit microvascular de óxido nítrico, que condicionaría una alteración de la vasodilatación arteriolar16.
CONCEPTO DE SANGRADONo existe actualmente una definición universal y aceptada de sangrado. Las disponibles son las que se han empleado en los distintos ensayos clínicos o revisiones, y no siempre bajo una misma denominación (se han empleado diversos conceptos, como sangrado mayor, sangrado amenazante para la vida, sangrado excesivo, clínicamente significativo, menor, trivial, abierto, etc.), lo que dificulta aún más conocer la incidencia real de este problema. Así, por ejemplo, las definiciones usadas más ampliamente corresponden a las aportadas por los estudios TIMI17 y GUSTO18 o una combinación de ambas (tabla 1).
Definiciones de sangrado según los diferentes estudios
| TIMI | Sangrado mayorHemorragia intracranealCaída de la Hb > 5 g/dlCaída del hematocrito > 15%.Sangrado menorCaída de la Hb 3 g/dlCaída del hematocrito 10%Sangrado mínimoCualquier signo clínico (o imagen) de hemorragia asociado a una caída de Hb < 3 g/dl o caída del hematocrito del 9%. |
| GUSTO | Sangrado mayorCualquier hemorragia intracraneal o sangrado que ocasione deterioro hemodinámico y requiera una intervenciónSangrado moderadoSangrado que requiere transfusión pero no produce deterioro hemodinámicoSangrado leveEl que no cumple los criterios ni de mayor ni de moderado |
| ASSENT-3, 2001 | Necesidad de transfusión de hemoderivados o sangrado que produzca deterioro hemodinámico |
| CURE, 2001 | Sangrado fatalSangrado intraocular que produzca pérdida de visiónSangrado intracraneal sintomáticoCaída de la Hb en 5 g/dlSangrado que precise la administración de > 2 concentrados de hematíesSangrado que requiera intervención quirúrgicaHipotensión que requiera el uso de fármacos inotrópicos i.v. |
| ACUITY, 2004 | Sangrado intraocular o intracranealCaída de la Hb > 4 g/dl sin signos externos de sangrado o > 3 g/dl en presencia de un sangrado evidente Empleo de cualquier transfusión de hemoderivadosHematoma > 5 cm de diámetroReintervención por sangradoHemorragia en la zona de acceso vascular que requiera intrevención |
| ISTH 20051* | Caída de la Hb de 2 g/dl o transfusión o necesidad de transfundir > 2 concentrados de hematíesSangrado sintomático en un órgano crítico: intracraneal, intraespinal, intraocular, retroperitoneal, intraarticular, pericárdico o intramuscular con síndrome compartimentalSangrado fatal |
| OASIS-5, 2006 | Sangrado fatalSangrado sintomático intracraneal, retroperitoneal o intraocularCaída de la Hb > 3 g/dlTransfusión de > 2 concentrados de hematíes ante sangrado evidente |
| PLATO, 2009 | Sangrado fatalSangrado intracraneal, intraocular con pérdida permanente de visión, intrapericárdico, taponamiento cardiaco, shock hipovolémico e hipotensión severa debida a sangrado que requiera cirugía Caída de la Hb > 5 g/dl o necesidad de transfundir > 4 concentrados de hematíesSangrado que se asocie a caída de la Hb de 3–5 g/dl o que requiera transfusión de 2 o 3 concentrados de hematíes |
Hb: hemoglobina.
Al existir tal diversidad, las tasas de sangrado obtenidas en los diferentes estudios que comparan la eficacia y los efectos adversos de distintos fármacos resultan bastante dispares, lo que ocasiona que la incidencia real de este evento adverso no se conozca con precisión e incluso que no sea la verdaderamente reflejada por los estudios que evalúan dichos fármacos. Además, hasta ahora tampoco era frecuente evaluar el riesgo de sangrado con los fármacos antiagregantes o anticoagulantes para su aprobación y uso en el SCA, sino que ha sido a posteriori cuando, a través de los análisis de grandes registros, se ha conocido la verdadera problemática y ha obligado a hacer revisiones de los datos obtenidos en registros previos.
Por ejemplo, en el estudio SYNERGY19, en el que se comparaba enoxaparina con HNF en pacientes con SCASEST, la tasa de sangrado empleando la definición TIMI era del 9,7%, mientras que empleando la del estudio GUSTO era del 2,7%, una diferencia significativa. Un ejemplo de la heterogeneidad y la escasa uniformidad en el concepto de sangrado empleado en los distintos estudios lo tenemos en la tabla 1.
Hace unos años, el Subcomité de Control de Anticoagulación de la Sociedad Internacional de Trombosis y Hemostasia, a la vista del problema surgido, aportó una definición de sangrado mayor en pacientes no quirúrgicos20:
- –
Sangrado fatal y/o
- –
Sangrado sintomático en un área y un órgano crítico como intracraneal, intraespinal, intraocular, retroperitoneal, intraarticular, pericárdico o intramuscular asociado a síndrome compartimental y/o
- –
Sangrado que produzca una caída de la hemoglobina > 20 g/l (1,24 mmol/l) o que precise de la transfusión de > 2 concentrados de hematíes o sangre total.
Aunque la incidencia de sangrado puede variar en los distintos estudios y registros, parece haber consenso en cuanto a los principales factores relacionados con el aumento del riesgo en pacientes con SCA. Casi todos los estudios coinciden en que los siguientes factores son relevantes a la hora de predecir complicaciones hemorrágicas: edad avanzada, historia previa de sangrado, sexo femenino, bajo peso corporal, anemia, uso de procedimientos invasivos e insuficiencia renal. También se han propuesto factores como ser fumador activo, el uso de balón de contrapulsación, enfermedad arterial periférica, así como la diabetes mellitus2, 5, 21 (tabla 2). De todos ellos, la edad avanzada, los procedimientos invasivos y la función renal parecen ser los más importantes. Es por ello, en definitiva, que las características clínicas basales de los pacientes son de gran interés para poder identificar a aquellos que son más propensos a sufrir un evento hemorrágico.
Factores de riesgo de sangrado en cardiopatía isquémica
|
Pero no sólo son importantes dichas características basales, sino también las estrategias terapéuticas que llevamos a cabo, como por ejemplo el número y el tipo de fármacos antitrombóticos empleados, la duración de dicha terapia, la vía de acceso en los procedimientos de revascularización percutánea (radial o femoral), etc. Bajo este concepto se han propuesto diferentes escalas que permiten conocer dicho riesgo hemorrágico, como son las propuestas por CRUSADE22 y GRACE2 (tabla 3). El problema del empleo de estas escalas es que requieren el uso de un ordenador para poder introducir los datos y calcular el riesgo; además, en cada una de ellas se tiene en cuenta sólo algunos parámetros, lo que ocasiona que unas escalas difieran de otras y se dejen, probablemente, otras variables no identificadas. Por ello, se proponen nuevas escalas predictivas, aunque aún está pendiente que surja una que presente un elevado valor predictivo y sea de fácil aplicación clínica a la cabecera del paciente.
Principales escalas de riesgo de sangrado
| Escala CRUSADE | Escala GRACE | |||
| Parámetro | Puntos | Parámetro | Puntos | |
| Hematocrito basal (%) | Edad (años) | |||
| < 31 | 9 | < 40 | 0 | |
| 31-33,9 | 7 | 40-49 | 18 | |
| 34-36,9 | 3 | 50-59 | 36 | |
| 37-39,9 | 2 | 60-69 | 55 | |
| > 40 | 0 | 70-79 > | 73 | |
| 80 | 91 | |||
| Frecuencia cardiaca (lpm) | Presión arterial sistólica (mmHg) | |||
| < 70 | 0 | < 80 | 63 | |
| 71-80 | 1 | 80-99 | 58 | |
| 81-90 | 3 | 100-119 | 47 | |
| 91-100 | 6 | 120-139 | 37 | |
| 101-110 | 8 | 140-159 | 26 | |
| 111-120 | 10 | 160-199 | 11 | |
| > 121 | 11 | > 200 | 0 | |
| Sexo | Clase Killip | |||
| Varón | 0 | Killip I | 0 | |
| Mujer | 8 | Killip II | 21 | |
| Diabetes mellitus | Killip III | 43 | ||
| No | 0 | Killip IV | 64 | |
| Sí | 6 | Frecuencia cardiaca (lpm) | ||
| Aclaramiento de creatinina (ml/min) | < 70 | 0 | ||
| < 15 | 39 | 10-89 | 7 | |
| 15-30 | 35 | 90-109 | 13 | |
| 30-60 | 28 | 110-149 | 23 | |
| 60-90 | 17 | 150-199 | 36 | |
| 90-120 | 7 | > 200 | 46 | |
| > 120 | 0 | Creatinina | ||
| Presión arterial sistólica (mmHg) | 0-34 | 2 | ||
| < 90 | 10 | 35-70 | 5 | |
| 91-100 | 8 | 71-105 | 8 | |
| 101-120 | 5 | 106-140 | 11 | |
| 121-180 | 1 | 141-176 | 14 | |
| 181-200 | 3 | 177-353 | 23 | |
| > 201 | 5 | > 354 | 31 | |
| Otros factores de riesgo | ||||
| Insuficiencia cardiaca a la admisión | Parada cardiaca al ingreso | 43 | ||
| No | 0 | Marcadores cardiacos altos | 15 | |
| Sí | 7 | Supradesnivel del ST | 30 | |
| Enfermedad arterial periférica | ||||
| No | 0 | |||
| Sí | 7 | |||
| Categoría de riesgo | Puntuación en la escala | Categoría de riesgo Puntuación en la escala | Muertes intrahospitalarias (%) | |
| Riesgo muy bajo | < 20 | Riesgo bajo | < 108 | < 1 |
| Riesgo bajo | 21-30 | Riesgo intermedio | 109-140 | 1-3 |
| Riesgo moderado | 31-40 | Riesgo alto | > 140 | > 3 |
| Riesgo alto | 41-50 | |||
| Riesgo muy alto | > 50 | |||
| Categoría de riesgo | Puntuación en la escala | Muertes hasta 6 meses tras el alta (%) | ||
| Riesgo bajo | < 88 | < 3 | ||
| Riesgo intermedio | 89-118 | 3-8 | ||
| Riesgo alto | > 118 | > 8 |
Como ya hemos visto, el sangrado supone un peor pronóstico para los pacientes con SCASEST tanto a corto como a largo plazo, por lo que parece razonable tratar de poner todos los medios a nuestro alcance para tratar de prevenirlo o evitarlo en la medida de lo posible. De forma general, se podría decir que es necesario tratar de ajustar la dosis de los fármacos empleados en función de las características de los pacientes (peso, función renal, edad, sexo, etc.), valorar el riesgo individual de los pacientes a través de las escalas disponibles, tratar de conocer la farmacodinámica para evitar posibles interacciones farmacológicas y emplear los fármacos con menor riesgo de sangrado o mejor perfil de seguridad.
La mayoría de los pacientes con SCA serán dados de alta del ámbito hospitalario con al menos dos fármacos antiagregantes. Las dosis de ácido acetilsalicílico (AAS) de 75–100 mg/día representan el balance óptimo de riesgo-beneficio, ya que se asocian a un menor riesgo hemorrágico sin alterar su eficacia23. Dosis más altas de AAS (325 mg) no parecen asociarse a un aumento del riesgo de hemorragia a corto plazo; sin embargo, a largo plazo, sí. En los casos de doble antiagregación con clopidogrel más AAS, se recomienda mantenerla durante el menor tiempo posible y con la menor dosis eficaz de AAS posible, ya que ambos factores se asocian a un aumento del riesgo de hemorragia. Es importante el manejo de la doble antiagregación, sobre todo en los pacientes que van a ser sometidos a cirugía de revascularización miocárdica. En estos pacientes se ha demostrado que la combinación de clopidogrel con AAS se asocia a un 30% más riesgo de sangrado que en aquellos que reciben únicamente AAS. Del mismo modo, hay mayor riesgo de sangrado en los que mantienen la doble antiagregación en los 5 días previos a la cirugía24.
En caso de bajo riesgo trombótico, se debería suspender toda la medicación antitrombótica, de forma óptima en los 5 días previos en el caso de tratamiento con anticoagulantes orales y de 7 a 10 días para los fármacos antiplaquetarios25. En el caso del prasugrel, puede que el lapso entre la suspensión y la intervención quirúrgica deba ser superior, dado que su efecto es más potente. Un hecho interesante previo a la comercialización de prasugrel fue identificar al grupo de pacientes en que se contraindica su uso (antecedentes previos de ictus o AIT) y aquellos que presentan un mayor riesgo hemorrágico con las dosis estándar y, por ello, deben recibir la mitad de dosis (los mayores de 75 años y aquellos con bajo peso corporal, < 60 kg)26.
Debemos saber que tanto los ancianos como las mujeres constituyen grupos poblacionales en los que se ha demostrado que los fármacos antitrombínicos y anti-GPIIb/IIIa se suelen administrar a dosis excesivas, lo que se asocia a un aumento del riesgo de hemorragias27, 28. En estos grupos sería especialmente útil tratar de ajustar la dosis de dichos fármacos de forma más precisa, según el peso corporal y la función renal. Existen además dos anticoagulantes que actúan inhibiendo directamente la trombina con los que se ha demostrado una reducción de sangrado sin aumento de la incidencia de eventos isquémicos: se trata de la bivalirudina y el fondaparinux que, por su utilidad y características, deberían incorporarse a los algoritmos de tratamiento, sobre todo en pacientes sometidos a intervencionismo coronario29, 30.
En cuanto a la anticoagulación, se debe ajustar la dosis tanto de HNF como de HBPM al peso del paciente. Es especialmente importante ajustar la dosis de la HBPM a la función renal, sobre todo en pacientes ancianos, en los que es frecuente sobrestimar su función renal al considerar como indicador las cifras de creatinina en lugar de un parámetro mucho más fiable como el aclaramiento de creatinina (calculado por las fórmulas de CockcroftGault, MDRD, etc.), motivo por el que, en ocasiones, se tiende a sobredosificar la heparina en esta población31. Del mismo modo, se recomienda el control del grado de anticoagulación, medido mediante la determinación del factor anti-Xa, en embarazadas, obesos y nefrópatas32.
Las guías actuales recomiendan la terapia puente con HNF o HBPM para cubrir la terapia con anticoagulantes orales (ACO) suspendida temporalmente en los casos con riesgo de tromboembolia elevado33. No hay, sin embargo, estudios aleatorizados que comparen las dos estrategias en pacientes con ACO crónica sometidos a intervencionismo; se estima que alrededor del 4% de los pacientes con terapia puente con enoxaparina desarrollan una complicación grave relacionada con el acceso vascular, por lo que deberíamos seleccionar a los pacientes con riesgo trombótico importante, como prótesis mecánica mitral o tricuspídea, fibrilación auricular reumática o en prevención secundaria.
En los pacientes sometidos a ICP, se da un importante porcentaje de sangrados atribuibles a la zona de acceso vascular. El empleo de la arteria radial en vez de la femoral para la ICP se asocia a una reducción de las complicaciones hemorrágicas de un 50-60%, sin comprometer de manera significativa el éxito de la intervención34. Los dispositivos de cierre vascular son una alternativa a la compresión mecánica para mejorar la hemostasia en el lugar de punción femoral. Sin embargo, no se ha demostrado una reducción de las complicaciones.
Un 10-15% de los pacientes que ingresan por un SCA requerirán una cirugía urgente. En estos, se suspenderá el tratamiento con HNF 4–6 h antes. Se debe extremar la precaución del uso de HBPM, en particular cuando se usa como terapia puente, ya que su uso aumenta el riesgo de sangrado; se recomienda suspenderlo 12 h antes de la cirugía.
Por el contrario, no hay acuerdo unánime sobre cómo actuar con el tratamiento antiplaquetario, ya que en la cirugía urgente no es posible esperar los 7–10 días necesarios para que desaparezca su efecto. En pacientes que reciben aspirina y requieren cirugía coronaria, debería mantenerse el tratamiento porque, aunque se asocia a un riesgo hemorrágico ligeramente mayor35, se ha observado que conlleva una menor mortalidad perioperatoria36. Por el contrario, no hay datos que indiquen ventaja alguna del mantenimiento de clopidogrel que, sin embargo, podría asociarse a un mayor riesgo hemorrágico, incluso si la cirugía es sin bomba extracorpórea. El uso de transfusiones de plaquetas no se asocia a un claro beneficio clínico37.
La cirugía en pacientes a los que se ha implantado un stent recientemente merece una consideración especial, ya que el riesgo de trombosis del stent puede ser elevado si se suspende el tratamiento antiagregante, lo que lleva a recomendar el retraso de la cirugía o incluso realizarla con doble antiagregación38.
MANEJO DE LA HEMORRAGIAEl sangrado en pacientes con terapias antitrombóticas debe tratarse como cualquier otro, garantizando en primer lugar la estabilidad hemodinámica del paciente mediante el aporte de fluidos intravenosos, fármacos vasoactivos e incluso transfusión de hematíes cuando sea necesario; controlar la hemorragia realizando hemostasia si es posible (p. ej., de forma endoscópica en sangrados digestivos) o cirugía en situaciones que lo requieran, y valorar la retirada de la terapia antritrombótica. De forma general, los sangrados menores no requieren la retirada de clopidogrel, a no ser que el sangrado sea persistente, en cuyo caso estaría justificado39. En caso de sangrados mayores, si no se puede controlar la hemorragia con las intervenciones apropiadas (cirugía, compresión), debe interrumpirse el tratamiento con clopidogrel, manteniendo la aspirina39. En los pacientes a los que se ha implantado recientemente un stent coronario, se debe sopesar la suspensión del clopidogrel, valorando el riesgo hemorrágico frente al trombótico, sabiendo que éste es máximo a los 4–5 días pero que puede persistir hasta 30 días tras la retirada del fármaco.
SCA EN LA FIBRILACIÓN AURICULARLa fibrilación auricular (FA) es una de las arritmias más prevalentes y es por todos conocido que dicha prevalencia aumenta con la edad. El grupo de pacientes con FA que presenta un SCA constituye un grupo especial, ya que en ellos hay que equilibrar el riesgo de eventos tromboembólicos sistémicos y el riesgo hemorrágico de las terapias anticoagulantes y antiagregantes empleadas. En el registro GYSCA (Guías y Síndrome Coronario Agudo) se observó que la proporción de pacientes con SCASEST que presentaban además FA era del 9,2%. Estos pacientes estarán tratados de forma crónica, en función de su riesgo embólico (escala CHADS2) con AAS o ACO, y a dicho tratamiento habría que asociar el propio del SCA, la doble antiagregación. Hemos de tener en cuenta que no hay estudios publicados sobre la estrategia óptima de tratamiento en pacientes anticoagulados que se someten a intervencionismo coronario y que las diferentes estrategias propuestas no han sido probadas en ensayos aleatorizados, por lo que este tipo de pacientes son un problema clínico real.
Recientemente se ha publicado un documento de consenso para pacientes con FA que presentan SCA o van a ser sometidos a ICP e implante de un stent40. Se estima que aproximadamente un 5% de los pacientes que van a ser sometidos a ICP están tratados de forma crónica con ACO debido a su arritmia. En estos casos, cabe preguntarse qué hacer, qué tratamiento antitrombótico es el más adecuado y con qué duración. Estudios observacionales han demostrado que la doble antiagregación sola no es una opción adecuada en los pacientes con FA que sufren un infarto de miocardio, ya que aumenta la mortalidad. El empleo de terapias puente con heparina queda relegado para casos con riesgo tromboembólico alto (portadores de prótesis valvulares, ictus embolígeno previo), dado que su uso se asocia a un aumento del riesgo de sangrado en la zona de punción en los pacientes sometidos a ICP. Este riesgo de sangrado se reduce si se emplea la arteria radial como acceso vascular. Del mismo modo, se deben evitar los anti-GPIIb/IIIa, y en casos concretos de alto riesgo, podría emplearse bivalirudina, con menor tasa de eventos hemorrágicos.
El ICP puede realizarse manteniendo la ACO y, en caso de precisar un stent, se optará inicialmente por los no farmacoactivos o metálicos, ya que son menos trombogénicos y requieren un menor tiempo de doble antiagregación. Tras el procedimiento debe mantenerse los ACO asociados a doble terapia antiagregante (triple terapia), considerada en la actualidad la mejor opción para prevenir la trombosis del stent y la tromboembolia. En estos casos, la reducción del riesgo de sangrado se obtendría con un control estricto del INR, manteniéndolo en torno a 2–2,541. En los pacientes con un riesgo de sangrado muy alto, lo ideal sería realizar una angioplastia simple con balón, siempre y cuando el resultado anatómico final sea el adecuado.
Por último, queda destacar que los principales factores de riesgo de sangrado en pacientes que reciben ACO son la edad avanzada, hipertensión arterial no controlada, antecedentes de ictus o embolia previa, anemia, historia de sangrado, uso concomitante de fármacos que interfieran con la hemostasia, el mal control de la anticoagulación y la duración del tratamiento42 (tabla 4).
Factores de riesgo de sangrado en pacientes bajo anticoagulación oral
| Intensidad de la anticoagulación (INR) y su duración | |
| Características clínicas de los pacientes | Edad |
| Comorbilidades (HTA, IRC, hepatopatías, anemia) | |
| Antecedentes de sangrado | |
| Antecedentes de ictus | |
| Uso concomitante de fármacos que alteren la hemostasia | Antiagregantes plaquetarios, AINE, fármacos que interfieran con la intensidad de la anticoagulación (inhibidores e inductores del CYP450) |
AINE: antiinflamatorios no esteroideos; HTA: hipertensión arterial; IRC: insuficiencia renal crónica.
El sangrado debido al uso de terapias antitrombóticas en el contexto del SCA es un problema real, por lo que debe tenerse en cuenta e identificar los principales factores de riesgo relacionados con él y las posibles medidas preventivas que se pueden llevar a cabo. Urge la implantación de una escala de sangrado sencilla y estandarizada que pueda emplearse de forma generalizada y proporcione cierto apoyo en la toma de decisiones. Del mismo modo, se necesita una definición clara y sencilla que sea mayoritariamente aceptada y permita conocer con fidelidad la magnitud del problema, para incorporarla a los diversos ensayos clínicos y conocer el beneficio neto de cada nueva terapia antitrombótica.
En definitiva, no basta con conocer en profundidad el tratamiento de una patología, sino que también debemos asumir las consecuencias derivadas del mismo.
agradecimientosAl Dr. Alvaro Merino por su colaboración en la redacción de este manuscrito. La Dra. Diana Hernández-Romero disfruta de un contrato posdoctoral «Sara-Borrell» del Instituto de Salud Carlos III.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.