La endocarditis infecciosa es una enfermedad poco frecuente, con una incidencia estimada de entre 3,1 y 3,7 episodios cada 100.000 habitantes y año, que es máxima en personas de edad avanzada. Los microorganismos que más frecuentemente causan la infección son las diferentes especies de estafilococos y estreptococos. En las últimas décadas ha cambiado el espectro de las cardiopatías que predisponen a padecer una endocarditis, ya que las cardiopatías degenerativas son las valvulopatías más frecuentes y ha aumentado de manera notable el número de pacientes con endocarditis infecciosa sin valvulopatía conocida previamente. Por otro lado, hasta un tercio de los pacientes con endocarditis infecciosa adquieren la infección como consecuencia de un contacto estrecho con el sistema sanitario, y estos pacientes son más frágiles, hecho que condiciona una mayor mortalidad hospitalaria. Como consecuencia de estos importantes cambios epidemiológicos, la profilaxis antibiótica es capaz de prevenir pocos casos de endocarditis infecciosa. Pese a indudables avances en el tratamiento médico y quirúrgico, la mortalidad hospitalaria de los pacientes con endocarditis infecciosa es elevada. Aun así, hay margen de mejora en la prevención de bacteriemias hospitalarias, la detección precoz de la infección en pacientes con riesgo conocido, la identificación rápida de enfermos con mayor riesgo de complicaciones y la formación de equipos multidisciplinarios para el manejo de esta enfermedad.
Full English text available from:www.revespcardiol.org/en
Palabras clave
La Sociedad Europea de Cardiología, en su última guía de 2009, define la endocarditis infecciosa (EI) como una enfermedad peculiar por tres motivos. En primer lugar, su incidencia y su mortalidad no se han modificado en los últimos 30 años pese a avances indiscutibles en el diagnóstico y el tratamiento. En segundo lugar, se trata de una entidad sumamente heterogénea que puede manifestarse clínicamente de muchas formas, dependiendo de la enfermedad de base del paciente, el microorganismo causante y la presencia de complicaciones locales y a distancia, por lo que su manejo requiere la constitución de grupos de trabajo multidisciplinarios. Por último, con frecuencia las guías están basadas en opiniones de expertos, dada la ausencia de estudios aleatorizados1.
En las últimas décadas, la EI ha tenido importantes cambios epidemiológicos en países industrializados2. Las poblaciones en riesgo de sufrir esta infección se han modificado. Actualmente, el grueso de los pacientes no son jóvenes con valvulopatía reumática conocida, sino personas de edad avanzada sin enfermedad valvular aparente3. Por otro lado, el mecanismo de adquisición de la EI también ha variado, pues el antecedente de manipulación dentaria antes del inicio de los síntomas es anecdótico y, por el contrario, un porcentaje importante de los pacientes adquieren la infección como consecuencia de procedimientos realizados en el ámbito hospitalario4.
La producción científica de los hospitales españoles en los últimos 20 años (1994-2013) sobre la EI es considerable y la tendencia es creciente, tanto en el número como en la relevancia de los manuscritos, hecho que nos permite conocer con bastante exactitud la epidemiología actual de esta enfermedad en nuestro país.
INCIDENCIA DE LA ENDOCARDITIS INFECCIOSANo existen estudios poblacionales sobre EI en España, por lo que no es posible conocer la incidencia de esta enfermedad en nuestro medio. Sin embargo, es fácil pensar que no debe ser muy diferente de la de Francia, país donde periódicamente se realizan estudios observacionales a escala poblacional. De ellos se desprende que la incidencia de la EI es baja, pero con una tendencia lentamente creciente: en 1991 se estimó, estandarizada por edad y sexo, en 2,4 episodios/100.000 habitantes/año5; en 1999, 3,1 (intervalo de confianza del 95% [IC95%], 2,8-3,5)6 y en 2008, 3,4 (IC95%, 3,1-3,7)7. Aunque esta es la incidencia en la población general, es máxima entre los varones 75-79 años (19,4 episodios/100.000 habitantes/año)7.
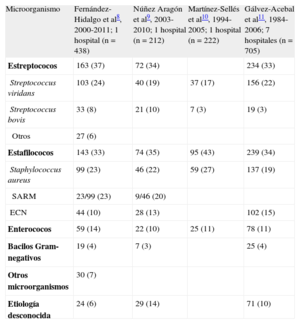
ETIOLOGÍALa tabla 1 muestra la etiología de la EI en cuatro series contemporáneas españolas8–11. Como se puede apreciar, las diferentes especies de estreptococos y estafilococos constituyen los dos grupos de microorganismos causales de la EI más importantes por orden de frecuencia (aproximadamente dos tercios de todos los episodios), seguidos por las diferentes especies de enterococo, que suman alrededor de un 10% de todos los casos.
Etiología de la endocarditis infecciosa en diferentes series españolas
| Microorganismo | Fernández-Hidalgo et al8, 2000-2011; 1 hospital (n=438) | Núñez Aragón et al9, 2003-2010; 1 hospital (n=212) | Martínez-Sellés et al10, 1994-2005; 1 hospital (n=222) | Gálvez-Acebal et al11, 1984-2006; 7 hospitales (n=705) |
| Estreptococos | 163 (37) | 72 (34) | 234 (33) | |
| Streptococcus viridans | 103 (24) | 40 (19) | 37 (17) | 156 (22) |
| Streptococcus bovis | 33 (8) | 21 (10) | 7 (3) | 19 (3) |
| Otros | 27 (6) | |||
| Estafilococos | 143 (33) | 74 (35) | 95 (43) | 239 (34) |
| Staphylococcus aureus | 99 (23) | 46 (22) | 59 (27) | 137 (19) |
| SARM | 23/99 (23) | 9/46 (20) | ||
| ECN | 44 (10) | 28 (13) | 102 (15) | |
| Enterococos | 59 (14) | 22 (10) | 25 (11) | 78 (11) |
| Bacilos Gram-negativos | 19 (4) | 7 (3) | 25 (4) | |
| Otros microorganismos | 30 (7) | |||
| Etiología desconocida | 24 (6) | 29 (14) | 71 (10) |
ECN: estafilococos coagulasa negativo; SARM: Staphylococcus aureus resistente a la meticilina.
Los valores expresan n (%).
Debido a los importantes cambios epidemiológicos de la EI acaecidos en los últimos años2, cada vez son más frecuentes las infecciones por cepas de Staphylococcus aureus resistente a la meticilina, hecho que dificulta el tratamiento médico de estos pacientes12. Por otro lado, una población envejecida también es el origen de un aumento de las infecciones por estreptococos del grupo bovis13 y enterococos14. Finalmente, aunque la EI por fiebre Q es infrecuente (el 3% de todos los casos), es de destacar la contribución de los grupos españoles a la comprensión de esta entidad15.
FACTORES DE RIESGO CARDIOLÓGICOSEn las últimas décadas ha cambiado el espectro de las cardiopatías que predisponen a padecer una endocarditis. Estos cambios se evidenciaron en Europa en el estudio del Euro Heart Survey16, en el que se observó que las cardiopatías degenerativas eran las valvulopatías predisponentes más frecuentes y que, por otra parte, había aumentado de manera notable el número de pacientes que sufrían una endocarditis sin cardiopatía conocida previamente. En nuestro país, distintos trabajos muestran resultados similares. Así, Castillo et al3 comunican la experiencia con 228 pacientes estudiados entre 1987 y 2009: la valvulopatía reumática y las cardiopatías congénitas han disminuido significativamente, el prolapso de la válvula mitral es la cardiopatía más común en todo el estudio y ha aumentado de manera muy significativa la proporción de pacientes sin una cardiopatía predisponente (del 25 al 57% en los años más recientes). En cuanto a las endocarditis protésicas se está incrementando el número de endocarditis protésicas tardías respecto a las precoces17. Un estudio español18 confirma esta tendencia al señalar una disminución de la endocarditis protésica precoz del 0,94% entre 1970 y 1986 al 0,34% entre 1987 y 2003. Sin embargo, Alonso-Valle et al19 comunican que en su experiencia las incidencias de endocarditis protésica precoz y tardía no variaron en su estudio, que se prolongó desde 1986 hasta 2005. Debe destacarse el aumento notable de la incidencia de endocarditis en marcapasos y otros dispositivos20, que constituyen alrededor del 3% de las endocarditis en la serie del Hospital Vall d’Hebron.
FACTORES DE RIESGO NO CARDIOLÓGICOSInfecciones relacionadas con la atención sanitariaComo ya se ha comentado previamente, en la actualidad un porcentaje importante de los pacientes con EI adquieren la infección como consecuencia de un contacto estrecho con el sistema sanitario (hasta un 35%, según las series)4,9,21. El término endocarditis relacionada con la atención sanitaria (ERAS) incluye las EI nosocomiales, adquiridas durante un ingreso hospitalario, y las nosohusiales, adquiridas como consecuencia de una manipulación realizada en el ámbito ambulatorio (hemodiálisis, sondajes urinarios o cateterismos cardiacos, por poner algunos ejemplos).
Pese a la heterogeneidad de los estudios sobre la ERAS, todos coinciden en que la bacteriemia relacionada con el catéter vascular es el más frecuente factor de riesgo de contraer la infección (hasta en un 63% de los casos), seguido por las manipulaciones urológicas (hasta el 14%).
En comparación con los pacientes que adquieren la EI en la comunidad, aquellos con ERAS son más frágiles: tienen una media de edad hasta 8 años superior; se hallan en peor estado basal medido tanto por el índice de Charlson22 como por el porcentaje individual de diabetes mellitus, insuficiencia renal crónica o neoplasias; presentan más infecciones estafilocócicas y enterocócicas, así como una mortalidad hospitalaria superior. De hecho, contraer la ERAS es un factor independiente de mortalidad hospitalaria y acumulada a 1 año4,9. Por ello, es fundamental extremar las medidas de asepsia ante la realización de cualquier procedimiento invasivo.
De los pacientes con ERAS, merece la pena destacar el subgrupo de los enfermos en tratamiento sustitutivo con hemodiálisis, que en las series generales representan hasta un 6% del total de pacientes con EI4,11,23. En ellos, los factores predisponentes son la inmunodeficiencia asociada a la enfermedad renal, la calcificación valvular por alteración del metabolismo fosfocálcico y, muy especialmente, la presencia de un acceso vascular en continuo uso. En concreto, se estima que el riesgo relativo de bacteriemia es 7,6 en los portadores de catéteres, frente a 1,3 en los portadores de fístulas24. Es difícil establecer la incidencia real de la EI en esta población, ya que las bacteriemias relacionadas con el catéter vascular son frecuentes, no se realizan estudios ecocardiográficos de manera sistemática en cada uno de los episodios de bacteriemia y, aunque fuera así, las calcificaciones valvulares pueden hacer muy difícil interpretar las imágenes obtenidas. De todas formas, se estima que la incidencia de la EI en pacientes en hemodiálisis es hasta 60 veces superior a la de la población general6,25 y, de igual forma, la mortalidad hospitalaria es superior en este grupo de pacientes23.
EdadLa incidencia de la EI es máxima en personas de edad avanzada7, ya que en ellas la prevalencia de cardiopatías predisponentes y afecciones genitourinarias y gastrointestinales es superior a la de la población más joven26. En consecuencia, tienen un contacto más estrecho con el sistema sanitario y presentan una proporción superior de ERAS.
En la experiencia del Hospital Vall d’Hebron, en las últimas dos décadas la mediana de edad de los pacientes con EI se ha incrementado en unos 15 años8,27, y actualmente es 66. Con la edad aumenta el porcentaje de infecciones por enterococo y estreptococos del grupo S. bovis26 y disminuyen las embolias periféricas sintomáticas y los fenómenos inmunitarios. Aunque es evidente que la mortalidad de los mayores de 65 años es superior a la de los pacientes más jóvenes28, no hay consenso respecto a si la edad es un factor independiente de riesgo de muerte, ya que diversos estudios han demostrado resultados dispares. En la misma línea, tampoco hay acuerdo en cuanto a si la mortalidad quirúrgica es mayor en este grupo de enfermos26,29,30.
De los mayores de 65 años, los octogenarios presentan más infecciones estreptocócicas y menos vegetaciones, se los somete a cirugía de recambio valvular con menos frecuencia y sufren menos mortalidad hospitalaria30.
Cirrosis hepáticaEn las diferentes cohortes españolas, la prevalencia de hepatopatía crónica de los pacientes con EI oscila entre el 5 y el 17%11,31, mientras que la de cirrosis hepática es hasta del 10%32.
La cirrosis predispone al desarrollo de infecciones concomitantes, tanto por la inmunodepresión asociada a la hepatopatía como por los procedimientos invasivos ambulatorios y los frecuentes ingresos hospitalarios. De hecho, una serie reciente demuestra que alrededor del 40% de los pacientes cirróticos padecían una ERAS, frente a menos del 20% del resto de la población con EI32. En este mismo estudio, los pacientes cirróticos tenían una media de edad 10 años menor que los pacientes sin hepatopatía; el microorganismo aislado más frecuentemente fue S. aureus (25%), seguido por los estreptococos betahemolíticos (20%), y la mortalidad cruda fue del 51% (el 17% entre los pacientes en estadio Child A y aproximadamente el 75% en estadios Child B y C). Esta mortalidad se ha corroborado en un estudio multicéntrico11, por lo que la cirugía debería indicarse de manera muy cuidadosa a estos pacientes, más aún en el caso de enfermedad hepática avanzada.
Adicción a drogas por vía parenteralUno de los cambios más importantes que se han producido en la epidemiología de la EI en España ha sido la disminución en el porcentaje de EI que tienen lugar en adictos a drogas por vía parenteral. Si bien este fue un problema importante en las décadas de los ochenta y los noventa, en algunas series hasta el 25% de todos los episodios de EI33, hoy tiene una importancia menor. Muestra de ello es que, en una serie contemporánea de EI tratados en nuestro centro (2000-2011), el 6% de los pacientes son adictos, la mayor parte de ellos concentrados en los primeros años, mientras que la prevalencia actual es menor del 3%. Un porcentaje similar (7%) puede observarse en la cohorte andaluza que incluye a pacientes entre 1984 y 200611.
FACTORES PROTECTORESProfilaxis antibióticaEl papel de la profilaxis antibiótica en la prevención de la endocarditis ha sido motivo de gran debate en las últimas décadas. Se ha cuestionado su utilidad y distintas sociedades nacionales han reevaluado la literatura médica existente y han promovido nuevas recomendaciones; las más extremas son las guías del National Institute for Clinical Excellence, que abogan por no administrar profilaxis antibiótica en ningún caso34. Las guías europeas de endocarditis, adoptadas por la Sociedad Española de Cardiología1, limitan la administración de profilaxis antibiótica a los pacientes de alto riesgo, es decir, pacientes con prótesis valvulares, cardiopatías congénitas complejas o que ya han sufrido un episodio de endocarditis. Las guías americanas son muy similares35. En la tabla 2 se resumen las normas sobre profilaxis antibiótica del Hospital Vall d’Hebron.
Profilaxis antibiótica. Cuándo y cómo realizarla. Normas que se utilizan en el Hospital Vall d’Hebron de Barcelona
| Solo se indica a pacientes de alto riesgo que se someten a procedimientos que comportan alto riesgo de bacteriemia | |
| 1. ¿Quién ha de recibir profilaxis antibiótica? | • Pacientes con prótesis valvulares o con material protésico utilizado en procedimientos de reparación valvular (anillos)• Pacientes con antecedentes de haber sufrido una endocarditis infecciosa• Pacientes con ciertos tipos de cardiopatías congénitas:a) Pacientes con cardiopatías cianóticas que no se han sometido a cirugía o con defectos residuales o portadores de shunts o conductosb) Pacientes con cardiopatías congenitas sometidos a reparación completa con material protésico (mediante cirugía o técnica percutánea) durante los primeros 6 meses tras el procedimientoc) Pacientes en quienes persiste un defecto residual en la zona de implantación de material protésico |
| 2. ¿Qué procedimientos obligan a administrar profilaxis antibiótica? | Solo los procedimientos dentales que precisen manipulacion de la encía o de la región periapical del diente o perforación de la mucosa oralNo existe indicación de profilaxis antibiótica en otros procedimientos dentales, procedimienros respiratorios (broncoscopia, laringoscopia, intubación), procedimientos del tubo digestivo y del aparato genitourinario (gastroscopia, colonoscopia, ecocardiograma transesofágico, cistoscopia) y procedimientos en la piel o partes blandas |
| 3. ¿Qué pauta antibiótica se recomienda cuando la profilaxis está indicada? | • Sin alergia, amoxicilina o ampicilina 2g oral o intravenosa, dosis única (30-60min antes del procedimiento)• Alérgicos, clindamicina 600mg oral o intravenosa, dosis única (30-60min antes del procedimiento) |
Es evidente que estas nuevas recomendaciones cambian una práctica médica muy establecida y, por otra parte, el grado de difusión y conocimiento de ellas entre los dentistas en nuestro país es pobre36. Un artículo recientemente publicado en Revista Española de Cardiología37 defendía la utilización de las recomendaciones de la Sociedad Europea de Cardiología. Sin embargo, hay dudas entre los cardiólogos clínicos y los dentistas, como se ha reflejado en «Cartas al Editor»38. Algunos cardiólogos y dentistas temen que no aplicar profilaxis a pacientes valvulares pueda causar un rebrote en la incidencia de endocarditis debida a microorganismos de la cavidad oral. Sin embargo, un estudio reciente parece tranquilizar al respecto, ya que el número de endocarditis no ha variado tras la aplicación de las nuevas guías39. Como señalan Falces y Miró37, es conveniente difundir las nuevas pautas entre cardiólogos y dentistas y hacerlo de manera coordinada, como se ha hecho, por ejemplo, en Cataluña, donde las sociedades de cardiología y odontoestomatología han elaborado un documento conjunto40.
Un aspecto muy importante que destacan las guías europeas es el papel crucial de las medidas preventivas generales. Estas incluyen la educación del paciente para que tenga una buena higiene dental, con revisiones periódicas al dentista y, sobre todo, antes de proceder a una cirugía valvular. También debe instruirse a los pacientes de los posibles riesgos inherentes a la práctica de tatuajes o colocación de piercings en ambientes no estériles41. Por último, teniendo en cuenta el aumento cada vez mayor de las ERAS como consecuencia de un contacto estrecho con el sistema sanitario, es importantísimo extremar las medidas de asepsia ante toda manipulación médica, sobre todo ante la inserción de vías venosas, especialmente en los pacientes con riesgo de padecer una endocarditis. Asimismo, los pacientes de riesgo deben ser instruidos sobre qué conducta seguir en caso de fiebre. De esta manera, se puede conseguir un diagnóstico más precoz y, consiguientemente, una mejora pronóstica (tabla 3).
Normas que se entregan a los pacientes, tras el alta hospitalaria y tras la cirugía valvular o congénita, en la Unidad de Valvulopatías del Hospital Vall d’Hebron de Barcelona
| Lavado diario de los dientes |
| Visita regular al dentista, al menos una vez al año. Visita obligada antes de una cirugía valvular electiva |
| En caso de fiebre superior a 37°C durante unos días, no tome antibióticos sin consultar previamente con su médico y valorar la posibilidad de tener una infección en las válvulas o en las prótesis |
| Si sospecha infección de las prótesis o de las válvulas, acuda al hospital más próximo para valoración |
| Si su hospital de referencia es el Hospital Vall d’Hebron, acuda al Hospital de Día de Enfermedades Infecciosas (abierto de lunes a viernes de 9.00 a 15.00). Fuera de este horario, acuda a urgencias |
Recientemente se ha especulado sobre el posible papel del sexo en el pronóstico de la EI. Un estudio de la Universidad de Duke42 parecía mostrar que las mujeres se intervenían menos que los varones y que la mortalidad era mayor entre las mujeres, a pesar de que en el análisis multivariable el sexo no era un factor predictivo de mortalidad. Los autores concluían que los cambios en la estrategia terapéutica y la mortalidad se debían a las mayores comorbilidades de las mujeres con endocarditis. En nuestro país, Castillo et al43 también observaron que entre sus pacientes con endocarditis las mujeres se intervenían menos que los varones, y esto se asociaba a mayor mortalidad. Nuestro grupo44 obtuvo resultados similares, con menor tasa de cirugía en la fase activa en las mujeres y mayor mortalidad, pese a tener un número de complicaciones similar, probablemente en relación con un porcentaje de ERAS mayor. Más recientemente, Sevilla et al45 han comunicado su experiencia con un total de 621 casos de endocarditis, y observaron que las mujeres eran mayores, tenían con más frecuencia diabetes mellitus y enfermedad nosocomial, pero no observaron diferencias en cuanto a la realización de cirugía o la mortalidad.
CIRUGÍASin duda el aspecto más difícil del manejo de los pacientes con EI sea decidir si el paciente es tributario de tratamiento quirúrgico y en qué momento debe realizarse la intervención. Por una parte, la cirugía estaría indicada para prevenir la muerte o graves complicaciones, pero a su vez la cirugía en la fase aguda de la enfermedad es de alto riesgo. Por ello debería realizarse en pacientes con clara indicación y en ausencia de comorbilidades o graves complicaciones que hicieran que la posibilidad de sobrevivir fuera remota. En principio no se considera que la edad de los pacientes deba ser una contraindicación para proceder a la intervención si esta es necesaria. En España se ha publicado recientemente la experiencia de un grupo en la cirugía de la endocarditis de pacientes octogenarios30. La guía de la Sociedad Europea de Cardiología 1 describe cuáles han de ser los pacientes en quienes la cirugía se debe considerar, y también propone cierto momento ideal para proceder a ella. Recientemente se han publicado también unas guías sobre el tratamiento quirúrgico de la endocarditis realizadas por la Society of Thoracic Surgeons46. Sin embargo, pese a estas sistematizaciones, cada caso de endocarditis es un caso particular en el que coexisten múltiples variables que hacen que la decisión de cirugía y su momento más oportuno deba considerarse de manera individual.
Parece bien establecido, sin embargo, que existen tres principales situaciones en las que debe pensarse seriamente el tratamiento quirúrgico en la fase activa de la enfermedad. Estas son la insuficiencia cardiaca secundaria a la disfunción valvular ocasionada por la endocarditis, la persistencia del cuadro séptico pese a tratamiento antibiótico correcto (situación que muchas veces se acompaña de graves destrucciones valvulares o abscesos perivalvulares) y el miedo a la aparición de embolia sistémica en pacientes con vegetaciones de gran tamaño47.
El grado de urgencia con que debe procederse a la cirugía es otro motivo de controversia. En las guías se habla de indicaciones de carácter emergente, urgente (en la primera semana de tratamiento) y electiva. Sin embargo, en la literatura médica hay pocos datos para sostener este tipo de consejos. San Román et al48 han diseñado un ensayo clínico multicéntrico para evaluar el papel de la cirugía precoz. En ausencia de evidencias claras en la literatura médica, lo que sin duda parece aconsejable es que todo paciente con EI sea tratado, si es posible, en centros que dispongan de cirugía cardiaca o que puedan consultar desde el momento del diagnóstico con centros especializados49. De esta manera, la indicación y el momento de proceder a la intervención lo decidirán equipos expertos, de ser posible, antes de que la enfermedad tenga ya complicaciones graves que oscurezcan en gran manera el pronóstico.
PRONÓSTICO A CORTO Y LARGO PLAZOPese a los indudables avances en el tratamiento médico y quirúrgico, la mortalidad de la EI persiste prácticamente invariable en las últimas décadas, hecho que puede explicarse por los grandes cambios epidemiológicos que han sucedido y motivan que hoy la EI sea una enfermedad de personas de edad avanzada con importantes comorbilidades.
En las series de EI sobre válvulas izquierdas del Hospital Vall d’Hebron tratadas entre 2000 y 2011, la mortalidad hospitalaria fue del 29% (el 26% en EI sobre válvulas nativas y el 39% en EI sobre válvulas protésicas)8. Hallamos porcentajes similares en la serie andaluza, cuya mortalidad bruta durante el periodo de estudio fue del 30% (el 26% entre 1984 y 1995 y el 32% entre 1996 y 2006)11. Cabe señalar que en ambos estudios se garantizó la inclusión consecutiva de todos los episodios de EI sobre válvulas izquierdas.
Conocemos que la mortalidad hospitalaria o precoz de la EI depende de forma muy importante de factores asociados con la infección y sus complicaciones. En concreto, el 30% de los fallecimientos se deben a insuficiencia cardiaca; el 20%, a complicaciones neurológicas, y el 10%, a infección no controlada8. Sin embargo, la mortalidad a largo plazo depende exclusivamente de las enfermedades de base del paciente.
Son numerosos los trabajos que evalúan los múltiples factores de riesgo de muerte por EI. Sin embargo, merece la pena insistir en los factores o actitudes modificables que pueden alterar el curso natural de esta enfermedad. En primer lugar, teniendo en cuenta el porcentaje de ERAS, se debe extremar las medidas de asepsia ante la realización de cualquier procedimiento invasivo, se conozca o no la presencia de cardiopatía predisponente, ya que se puede evitar un tercio de todos los episodios de EI4. En segundo lugar, se debería mejorar el diagnóstico de estos pacientes, para lo cual las propias personas en riesgo deben ser conscientes de este hecho y acudir precozmente a sus centros de referencia ante la aparición de fiebre de etiología desconocida o un síndrome constitucional. En tercer lugar, una vez realizado el diagnóstico, los pacientes deberían ser tratados por equipos multidisciplinarios con experiencia en la toma de decisiones sobre esta patología, ya que habitualmente no son fáciles50,51 y esta forma de trabajar ha mostrado beneficios indiscutibles33,52. Finalmente, es posible identificar tempranamente qué pacientes requerirán cirugía con mayor probabilidad o tienen más riesgo de muerte53, hecho que permite el traslado precoz de pacientes a hospitales de referencia con cirugía cardiaca.
TRATAMIENTO ANTIBIÓTICO AMBULATORIOEl tratamiento médico de la EI se basa en la administración de antibióticos por vía endovenosa durante un periodo que habitualmente oscila entre las 4 y las 6 semanas, hecho que condiciona estancias hospitalarias largas. Sin embargo, se sabe que, en pacientes estables y con buen estado general, el riesgo de aparición de complicaciones es mínimo tras las primeras 2 semanas de antibiótico, lo cual permite finalizar el tratamiento fuera del hospital. Otro grupo de pacientes en que esta estrategia es factible son los enfermos sometidos muy precozmente a recambio valvular que evolucionan favorablemente. Además de la reducción del coste económico que supone la administración ambulatoria de antibióticos, se debe tener en cuenta que esta medida mejora la calidad de vida de los pacientes. Todo ello ha hecho que se incluya a un porcentaje creciente de pacientes con EI en programas de administración de antibióticos fuera del hospital, tanto a través de los llamados hospitales de día como en unidades de hospitalización a domicilio54,55. En la experiencia del Hospital Vall d’Hebron, aproximadamente un tercio de los pacientes que sobreviven a la infección finalizan el tratamiento antibiótico de esta forma.
CONCLUSIONESActualmente, en el Estado español, en tanto que país industrializado, la EI es una enfermedad poco frecuente que tiene lugar en personas de edad avanzada sin cardiopatía predisponente conocida y, en muchas ocasiones, como consecuencia de un contacto estrecho con el sistema sanitario. Pese a los continuos avances en el tratamiento médico y quirúrgico de esta enfermedad, la mortalidad de la EI se mantiene estable. Sin embargo, hay un claro margen de mejora en la prevención de episodios de bacteriemia relacionada con el catéter, el diagnóstico precoz de la infección, la identificación de pacientes con mayor riesgo de requerir cirugía o de fallecer durante el ingreso, así como en la formación de grupos multidisciplinarios con experiencia en el manejo médico y quirúrgico de esta enfermedad.
CONFLICTO DE INTERESESNinguno.