La enfermedad coronaria (EC) y la estenosis aórtica (EAo) coexisten frecuentemente y comparten factores de riesgo con similar patogénesis. En los estudios aleatorizados de cirugía frente a reemplazo percutáneo de la válvula aórtica (TAVI), la prevalencia de EC ha ido disminuyendo en paralelo al riesgo quirúrgico del paciente, de un ∼80% en los estudios iniciales1 hasta un 28 y un 16% en el PARTNER 3 y el Evolut Low Risk respectivamente. La afección multivaso está presente en el 50% de los pacientes con EC significativa2. El riesgo del reemplazo quirúrgico de la válvula aórtica aumenta en presencia de EC, por lo que está indicada la revascularización quirúrgica concomitante en la gran mayoría de estos pacientes3. Sin embargo, en el momento de plantear una estrategia terapéutica percutánea, hay claras diferencias y varios puntos controvertidos. Para empezar, no se ha demostrado de forma consistente el impacto de la EC en pacientes que se someten a TAVI, con resultados dispares entre los diferentes y múltiples estudios. En segundo lugar, se desconoce si la revascularización percutánea modifica el hipotético peor pronóstico de estos pacientes (añadido al beneficio del tratamiento de la valvulopatía). Y, por último, en este caso no es necesario revascularizar simultáneamente a los pacientes, por lo que el momento apropiado de hacerlo es otro punto a definir.
Múltiples estudios han intentado determinar si existe o no una influencia deletérea de la EC a corto y largo plazo tras el TAVI. Mientras que algunos de ellos han encontrado una asociación negativa entre la EC y el pronóstico del paciente4, la gran mayoría no ha conseguido demostrar dicho impacto1,5–7 o solo en subgrupos concretos con EC muy extensa2,8. En un artículo reciente publicado en Revista Española de Cardiología, Aurigemma et al.9 presentan los resultados de un estudio unicéntrico retrospectivo que se suma a este numeroso grupo de estudios que intentan aclarar esta cuestión tan transcendente. Evaluaron el impacto pronóstico del miocardio en riesgo y el grado de revascularización en pacientes con EC tratados mediante TAVI. Definieron EC como la presencia de una estenosis ≥ 70% en un vaso coronario epicárdico mayor o el antecedente de revascularización coronaria percutánea o quirúrgica. Con el fin de solventar alguna de las limitaciones de los estudios previos que realizaron un análisis meramente dicotómico de la EC (presente o ausente), los autores calcularon la puntación British Cardiovascular Intervention Society myocardial jeopardy score (BCIS-JS) para valorar el miocardio en riesgo antes del procedimiento dentro del grupo de pacientes con EC. En función de ello, dividieron a la población de estudio en 3 grupos de interés: sin EC (n=223), con EC-BCIS-JS ≤ 4 (n=94) y con EC-BCIS-JS> 4 (n=86). El objetivo primario fue la tasa combinada de eventos adversos mayores (muerte, infarto agudo de miocardio no mortal, ictus no mortal o revascularización coronaria) a largo plazo. Los autores concluyen que el grupo de EC-BCIS-JS> 4 tiene un mayor número de eventos en el seguimiento y que una revascularización más completa antes del TAVI puede mejorar el pronóstico.
Hay varios puntos que se deben resaltar de esta publicación. Como se ha comentado, una de las mayores limitaciones de algunos de los estudios precedentes es el análisis de la EC como una variable dicotómica, sin tener en cuenta su extensión, su gravedad o la repercusión miocárdica. Sin embargo, Aurigemma et al. llevaron a cabo una aproximación más precisa de la EC, calculando el miocardio en riesgo a través de la puntuación del BCIS-JS (intervalo, 0-12). La mediana del BCIS-JS fue de 4,0 [intervalo intercuartílico, 3,3-4,7], lo cual refleja que en la muestra estudiada más del 75% tenía poco miocardio en riesgo10 y, consecuentemente, que la EC en el momento del TAVI no era muy extensa. De hecho, este hallazgo concuerda con que más de la mitad de los pacientes solo tenían enfermedad en segmentos medios (en uno o dos vasos), enfermedad aislada de la coronaria derecha o de vasos secundarios. Asimismo, el intervalo intercuartílico tan pequeño indica que la gran mayoría de los pacientes se encontraban en un margen muy estrecho, por lo que las posibilidades de detectar diferencias en función de la extensión de la EC disminuyen. A pesar de esta representación numérica del miocardio en riesgo, los autores dividieron a los pacientes con EC en 2 grupos (≤ 4 y> 4). Al convertir el miocardio en riesgo en una variable binaria, los autores simplifican el análisis y pueden facilitar la comprensión de los resultados, pero pueden perder la posibilidad de identificar el comportamiento de esta variable como factor pronóstico, su fuerza de asociación o el punto de corte óptimo en el análisis del impacto de la EC tras el TAVI.
En segundo lugar, el valor de p aportado por los autores es limítrofe (0,049); además, al ser un valor general para los 3 grupos comparados, no puede identificar cuál es el que se diferencia del resto. De hecho, el análisis visual de la curva de supervivencia del objetivo primario refleja que las curvas no son proporcionales a lo largo del tiempo. La tasa de eventos a los 3 años es similar entre los 2 grupos con EC, y luego se equiparan los grupos sin EC y con EC-BCIS-JS ≤ 4. Si el análisis se hubiese truncado a los 3 años de seguimiento, los resultados podrían haber sido diferentes. Con esta variación asimétrica del riesgo a lo largo del tiempo entre los 3 grupos, es muy posible que no se cumpla el supuesto de proporcionalidad, por lo que la regresión de Cox para el análisis multivariado no debería aplicarse. No es sorprendente que la mortalidad total sea ligeramente mayor entre los pacientes con EC, dado que presentan más comorbilidades y peor perfil de riesgo. Lo realmente interesante sería discriminar la causa de muerte para determinar si se debe a la propia EC y su progresión o a otras causas con impacto a largo plazo para poder sacar conclusiones más firmes.
El tercer punto que destacar es el amplio periodo de inclusión (9 años) y consecuentemente el amplio intervalo de seguimiento (entre 3 meses y 9 años). La evolución en los últimos 10 años en el tratamiento percutáneo de la valvulopatía aórtica ha sido enorme, con importantes cambios tanto en la selección de pacientes como en la planificación y ejecución del procedimiento y el tratamiento de sus complicaciones; al mismo tiempo, también se modificó el propio tratamiento de la EC. En las series iniciales de TAVI, con una población añosa y alta prevalencia de EC, el potencial impacto de esta en el pronóstico se ha visto diluido posiblemente por complicaciones periprocedimiento a corto plazo y otras enfermedades con mayor influencia en la supervivencia a largo plazo. Habrá que esperar a estudios con población más joven y seguimiento a más largo plazo para determinar si la EC tiene un impacto real en la supervivencia. En cuanto al tratamiento de la EC, en las etapas más iniciales la posición mayoritaria era tratarla antes o durante el TAVI. Con el paso de los años, este concepto viró hacía un enfoque más conservador, incluso en EC de vasos principales y proximales, gracias al conocimiento de la técnica, los mejores resultados del procedimiento y las recomendaciones de las guías. Sin embargo, el diseño del estudio no permite controlar estos factores ni la propia estrategia utilizada de revascularización. De hecho, en un análisis adicional que realizan los autores, se expone de manera ambigua el impacto de la revascularización en los eventos clínicos. Concluyen que los pacientes con mayor índice de revascularización tienen un pronóstico mejor que los de menor índice. Estos hallazgos están en contradicción con los resultados del único estudio aleatorizado publicado hasta el momento11, en el que los pacientes con EC y revascularización tuvieron una tasa de eventos (muerte o rehospitalización) al año similar a la del grupo sin revascularización (sin llegar a cumplir los criterios de no inferioridad) y con una tasa mayor de sangrados en el grupo con revascularización. En el estudio de Aurigemma et al. no se especifica el método que guió la revascularización y se analizaron de manera equiparable cualquier revascularización percutánea o quirúrgica a la que se hubiese sometido el paciente en algún momento de su historia clínica y la revascularización percutánea inmediatamente previa al TAVI. Lamentablemente no se indicó la forma de presentación clínica (presencia de síntomas, grado de angina, etc., o si fue un hallazgo en el estudio previo a la intervención) ni la complejidad de las lesiones coronarias. Estos puntos ponen de manifiesto la dificultad que encontramos al valorar esta compleja patología, lo cual complica su análisis y la ejecución de estudios estandarizados para poder extraer conclusiones firmes.
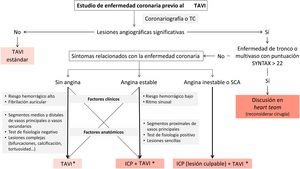
Actualmente las guías recomiendan considerar el tratamiento percutáneo de la EC en pacientes con indicación de TAVI en arterias con lesiones de más del 70% y segmentos proximales. Sin embargo, el algoritmo terapéutico puede llegar a ser más complejo si se tienen en cuenta factores clínicos y anatómicos (figura 1). En primer lugar, la forma de presentación de la EC (aguda, crónica o hallazgo casual) y los propios síntomas de la valvulopatía aórtica pueden inclinar la balanza hacia un tratamiento u otro. De hecho, en un estudio reciente solo los síndromes coronarios agudos determinaron un peor pronóstico en estos pacientes12, mientras que la revascularización en la EC crónica no ha demostrado beneficio en este11 y otros contextos clínicos13. En consecuencia, es controvertido que la revascularización percutánea aporte beneficio, dado que generalmente no es un procedimiento de bajo riesgo en pacientes con EAo hemodinámicamente significativa, lo que puede ocasionar una descompensación aguda o riesgos a medio plazo. La revascularización percutánea antes o durante el TAVI implica un tratamiento antiagregante más intensivo después, que se ha asociado con mayores eventos hemorrágicos en pacientes en ritmo sinusal y fibrilación auricular tras el TAVI11,14,15. El papel de la fisiología coronaria está consolidado en la EC estable, con una reducción del número de intervenciones percutáneas cuando se aplica sistemáticamente en lesiones de entre el 30 y el 80%. Aunque en el contexto de la EAo grave hay que tener ciertas consideraciones en la interpretación de los resultados, especialmente cuanto más grave sea la estenosis valvular, los índices de hiperemia y, sobre todo, los de reposo y el cociente de flujo cuantitativo son medios más precisos que el análisis angiográfico visual para guiar la revascularización16. La evaluación minuciosa de la EC se debe tener en cuenta en el algoritmo terapéutico, dado que las complicaciones son más frecuentes en las lesiones complejas, que a su vez son más prevalentes en esta población. Por otra parte, la revascularización tras el tratamiento de la valvulopatía, en una segunda intervención, también es una opción. Para ello, es de especial importancia considerar la selección de una prótesis que facilite el acceso a las coronarias y un implante que evite el solapamiento de las comisuras con los ostium coronarios. De esta forma, el tipo de prótesis percutánea y la técnica de implante también deberían incluirse en el algoritmo de la toma de decisiones de esta compleja entidad clínica.
Algoritmo de tratamiento de la enfermedad coronaria en pacientes aceptados para reemplazo percutáneo de la válvula aórtica. El asterisco indica una selección de prótesis con características favorables para un nuevo acceso coronario (stent corto, intraanular, celdas grandes) y técnica de implante con alineamiento comisural. ICP: intervención coronaria percutánea; TAVI: reemplazo percutáneo de la válvula aórtica; SCA: síndrome coronario agudo; TC: tomografía computarizada.
Este estudio de la Revista Española de Cardiología se añade a un amplio conjunto de publicaciones previas que analizan si la propia EC de los pacientes con EAo confiere un peor pronóstico, es un mero marcador de riesgo o si realmente su tratamiento impacta en la supervivencia. A partir de la información proveniente de ensayos clínicos, la revascularización sistemática previa al TAVI en pacientes con EC crónica asintomática o con síntomas estables es difícilmente justificable. Hasta que nuevos estudios clínicos aleatorizados respalden otra estrategia, el equilibrio riesgo-beneficio de cada intervención junto con la individualización del tratamiento deberían guiar nuestra práctica clínica diaria.
FINANCIACIÓNSin financiación.
CONFLICTO DE INTERESESL. Nombela-Franco tiene una beca de investigación (INT19/00040) del Ministerio de Ciencia e Innovación de España (Instituto de Salud Carlos III) y es proctor de Edwards Lifesciences y de Abbott Vascular. G. Tirado-Conte tiene un contrato de investigación «Rio Hortega» (CM21/00091) del Ministerio de Ciencia e Innovación de España (Instituto de Salud Carlos III). Los demás autores no tienen conflictos de intereses en relación con este artículo.