La enfermedad cardiovascular es la afección crónica grave más prevalente en los países industrializados y está aumentando rápidamente. Tiene un carácter multisistémico, y con frecuencia afecta a varios lechos vasculares a la vez. El espectro clínico del paciente en riesgo comprende desde el individuo con factores de riesgo hasta el paciente con síndromes vasculares agudos, pasando por el paciente con eventos remotos. La aplicación indiscriminada de métodos de diagnóstico en población asintomática de baja-intermedia prevalencia conlleva con frecuencia más morbilidad de la que se pretende evitar y esto es así sobre todo cuando hablamos de criba de la enfermedad cerebrovascular. Precisamos de algoritmos que incorporen los datos clínicos y la información proporcionada por nuevas tecnologías a un coste razonable para que seamos capaces de realizar una detección coste-eficaz de enfermedad cerebrovascular severa que se pueda beneficiar de una intervención precoz en la fase asintomática de la enfermedad.
Palabras clave
La enfermedad vascular (EV) es la afección crónica grave más prevalente en los países industrializados. En España es la primera causa de muerte de las mujeres y la segunda de los varones1. La enfermedad cerebrovascular (ECV) constituye el 29% de la mortalidad por EV, con predominio relativo en las mujeres (31%) respecto a los varones (27%). Además, es la cuarta causa de pérdida de años de vida ajustados por discapacidad, tras la demencia, la depresión y la cardiopatía isquémica. Su impacto es devastador no sólo en lo que se refiere a la mortalidad relacionada con el primer evento (el 20% precoz y el 50% a los 5 años) o sus frecuentes recurrencias (el 25% recurre con una mortalidad próxima al 50%), sino en lo que se refiere a las consecuencias sociales que se derivan de él, como limitación funcional, dependencia física y costes sociales.
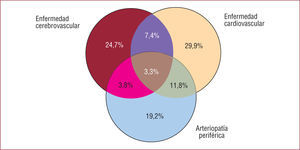
Tiene un carácter multisistémico y con frecuencia afecta a varios lechos vasculares a la vez2–4 (fig. 1). La ECV comparte en buena medida la fisiopatología y los factores de riesgo de las demás localizaciones de la aterosclerosis, aunque con algunas connotaciones especiales. Por un lado, la edad, el sexo y la raza son factores no modificables que influyen sobremanera en la incidencia de un accidente cerebrovascular (ACV). En adultos, el riesgo de ACV se dobla por cada década de vida y los varones tienen más riesgo que las mujeres. Por otro lado, de los factores modificables, la hipertensión arterial (HTA) figura a la cabeza, aunque la diabetes mellitus, la hipercolesterolemia o el tabaquismo (entre otros) tienen un papel importante. La fibrilación auricular es un factor de riesgo específico causante de parte de la ECV, sobre todo en pacientes con cardiopatía asociada. Así, la mayoría de los ACV son de naturaleza aterotrombótica y un porcentaje pequeño tiene un origen embólico o hemorrágico5.
Carácter ubicuo de la enfermedad cardiovascular aterotrombótica. CAPRIE Steering Committee2.
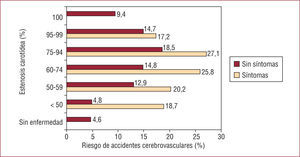
Las localizaciones más frecuentes de la ECV son la bifurcación carotídea, las arterias carótidas internas y las arterias vertebrales proximales. La prevalencia de ECV severa en la población general es escasa, en torno a un 0,5-1,7% de enfermedad severa (obstrucción > 70%) y un 4,2% de enfermedad moderada (> 50%)6,7, lo que es de gran importancia a la hora de plantear la conveniencia de poner en práctica estrategias de criba poblacional. La severidad de la ECV, la presencia de síntomas recientes y las características anatómicas de la placa determinan el riesgo de ACV. A mayor severidad de la estenosis, el riesgo de ACV aumenta. Por otro lado, la presencia de síntomas atribuibles a isquemia cerebral (accidente isquémico transitorio, déficit isquémicos reversibles, ACV, ceguera monocular, afasia o amaurosis fugax) aumenta también el riesgo de recurrencia de la isquemia cerebral, sobre todo en las primeras semanas tras el inicio de los síntomas8 (fig. 2). Además, las placas irregulares con gran core lipídico, cápsula fibrosa fina y/o ulceraciones en su superficie incrementan notablemente el riesgo de ACV. Estos datos tienen importancia capital para la planificación del tratamiento ulterior.
Riesgo de accidente cerebrovascular en función de la severidad de la estenosis carotídea y la presencia de síntomas recientes de isquemia cerebral. Nótese que el riesgo de accidente cerebrovascular homolateral (seguimiento a 5 años) aumenta de forma progresiva (sobre todo en sintomáticos) hasta niveles de suboclusión/oclusión completa en que el riesgo disminuye. Tomado de Inzitari et al8.
La enfermedad coronaria es una situación de riesgo aumentado de eventos vasculares, incluido el ACV. El riesgo está en función de la proximidad en el tiempo del último evento. Los pacientes con episodios coronarios agudos recientes tienen un riesgo muy aumentado de ACV en los primeros días a semanas, mientras que, a medida que transcurre el tiempo, el riesgo se aproxima al del paciente coronario crónico9. En el paciente con infarto agudo de miocardio (IAM) reciente, la mayoría de los ACV ocurre en los primeros días tras el episodio coronario. El ACV isquémico (la inmensa mayoría) ocurre en pacientes con factores de riesgo, como aterosclerosis o fibrilación auricular, mientras que el hemorrágico está relacionado con HTA, rotura de aneurismas o terapia trombolítica. La incidencia de ACV intrahospitalario en multitud de estudios de pacientes con síndrome coronario agudo con elevación de segmento ST (SCACEST) de la era trombolítica está en torno a un 0,7-2,5%>9–11. Parece que el tratamiento trombolítico ha tenido escasa influencia en la incidencia total de ACV, aunque se lo considera causa de un aumento en la mortalidad vinculado a un cambio en el perfil del ACV, con un aumento de los hemorrágicos a expensas de los embólicos12. El registro GRACE comprobó que el riesgo de ACV intrahospitalario es mayor en pacientes con SCACEST (1,3%) que en pacientes sin elevación de segmento ST (SCASEST) (0,9%) o con angina inestable (0,5%)10. Los factores de riesgo asociados fueron edad avanzada, fibrilación auricular, ACV previo, HTA, elevación enzimática inicial, localización anterior del IAM, cirugía de derivación aortocoronaria o la clase Killip, entre otros. Tras el alta hospitalaria, los factores de riesgo que han sido relacionados con una mayor incidencia de ACV son el antecedente de ACV durante la fase hospitalaria10 y la edad avanzada, la fibrilación auricular (prehospitalaria o intrahospitalaria) y el SCACEST13,14. Este patrón de presentación cambiante en el tiempo indica, por un lado, causas directamente relacionadas con el infarto, su tamaño y sus complicaciones y, por otro, la concurrencia de factores relacionados con un «ambiente humoral» desfavorable que justificaría que haya pacientes con vulnerabilidad sistémica y manifestaciones relacionadas con la inestabilización simultánea de varias lesiones crónicas anteriormente estables. La incorporación de técnicas que identifiquen «situaciones o pacientes vulnerables» mediante marcadores circulantes provenientes de la placa inestable15 o técnicas sofisticadas como la termografía, la tomografía por emisión de positrones (PET), la tomografía por emisión monofotónica (SPECT), la espectroscopia de infrarrojos, la resonancia magnética (RM) potenciada con contraste o la angiografía con tomografía computarizada (TC) multidetectores16,17 constituye un sólido paso en este sentido.
A diferencia del reinfarto o la insuficiencia cardiaca tras un IAM, el ACV tras IAM está aumentando. Ello prueba, de alguna manera, que los tratamientos que se están aplicando para el tratamiento del IAM no consiguen conferir la protección cerebrovascular pretendida. La anticoagulación sistemática en la población que ya ha sufrido un IAM podría parecer una medida pertinente. Sin embargo, todos los ensayos clínicos realizados tanto en pacientes tras un síndrome coronario agudo como con disfunción ventricular en ritmo sinusal no han demostrado beneficio a corto, medio o largo plazo de la combinación ácido acetilsalicílico (AAS) + warfarina o clopidogrel + warfarina en comparación con AAS solo, si bien el riesgo de ACV tiende a ser menor18–21. A día de hoy, las indicaciones de anticoagulación del paciente tras IAM son muy restringidas y limitadas al paciente que no tolera AAS o clopidogrel, el paciente con indicaciones obligadas de anticoagulación (fibrilación auricular o prótesis) y el paciente con trombo móvil que protruye al interior del ventrículo izquierdo22. El recientemente publicado WATCH Trial, diseñado para testar la eficacia comparada de AAS, clopidogrel o warfarina en pacientes con disfunción sistólica severa en ritmo sinusal, no ha aclarado la mayoría de las dudas planteadas18.
CRIBA DE ENFERMEDAD VASCULAR CEREBRAL ASINTOMÁTICANo existen dudas respecto de la eficacia y la eficiencia de la búsqueda de enfermedad carotídea en sujetos con síntomas neurológicos (accidente isquémico transitorio, amaurosis fugax de menos de 24 h de duración y ACV menor con síntomas también de menos de 24 h de duración), ya que la endarterectomía precoz se sigue de una importante disminución de la tasa de nuevos eventos isquémicos cerebrales que compensa las complicaciones iniciales que el procedimiento conlleva23,24. Sin embargo, la enfermedad asintomática es mucho menos agresiva. Buscar enfermedad asintomática es menos «rentable» a escala poblacional, ya que el número que es necesario cribar (NNS) para detectar enfermedad (y después evitar un ACV) aumenta considerablemente, lo que amenaza el coste-eficacia de cribar a muchos grupos poblacionales que no tienen un riesgo alto o muy alto de estenosis carotídea severa25. El coste-eficacia de cribar enfermedad carotídea severa, en cuanto a coste por años de vida ganados ajustados por calidad de vida (QALY), ha sido analizado en comparación con otras intervenciones habituales en salud pública26,27 (tabla 1). Tras la publicación de los estudios ACAS (Asymptomatic Carotid Atherosclerosis Study)28 y el ACST (Asymptomatic Carotid Surgery Trial)29, se ha establecido el beneficio del tratamiento quirúrgico también en ciertos subgrupos de pacientes con enfermedad asintomática y probabilidad elevada de complicaciones, lo que definitivamente posibilita cribar a cierta población asintomática con alto riesgo. Esta criba se puede llevar a cabo de varias maneras:
- 1.
Búsqueda de soplo carotídeo: éste es un pobre predictor de enfermedad carotídea subyacente o de riesgo de ACV. En el Framingham Heart Study, el soplo carotídeo se asoció a un riesgo relativo (RR) aproximado de 2 en la incidencia de ACV. Sin embargo, la mayoría de los ACV ocurrió en un territorio vascular diferente que el del soplo, lo que indica que es más bien un indicador de enfermedad aterosclerótica que de riesgo de ACV homolateral30. A diferencia de los soplos femorales, que sí son un exponente fiel de la presencia de placas femorales e índice tobillo-brazo (ITB) patológico, los soplos carotídeos añaden poco a la estratificación por los factores de riesgo en lo que se refiere a la detección de placas, estenosis significativa o grosor íntimamedia carotídeo aumentado31. La sensibilidad y la especificidad del soplo carotídeo para la detección de enfermedad carotídea severa en el estudio NASCET23 fueron del 63 y el 61%, respectivamente.
- 2.
Cribar subgrupos con riesgo elevado: cribar a población de bajo riesgo causaría más daño que los potenciales beneficios que podría aportar32. Ha de ponerse el empeño en encontrar formas de seleccionar subpoblaciones de pacientes con elevada prevalencia (> 20%) de enfermedad carotídea severa para encontrar un beneficio asociado. El problema surge si tenemos en cuenta que no existe un método fiable para encontrar tales subpoblaciones de tan alta prevalencia de enfermedad severa. En este sentido, ha habido intentos de desarrollar modelos de predicción estimando la probabilidad de la enfermedad en función de la situación de varios factores de riesgo, con resultados en general desalentadores, en la predicción de ECV clínica en prevención tanto primaria30,33 como secundaria34. Una validación externa de los predictores de riesgo identificados en el Cardiovascular Health Study (edad > 65 años, hábito tabáquico actual, historia de enfermedad coronaria e hiperlipemia) fue capaz de identificar una población de raza blanca con una prevalencia del 19%35. Qureshi et al36 identificaron cuatro factores predictores de enfermedad carotídea > 60% (edad > 65 años [RR = 4,1], tabaquismo actual [RR = 2], enfermedad coronaria [RR = 2,4] e hipercolesterolemia [RR = 1,9]) en la población general incluida en el Western New York Stroke Screening Program, y basándose en ellos consiguieron establecer grupos de riesgo entre el 7 y el 35% de prevalencia de enfermedad carotídea severa36. Otros autores también otorgan un valor predictivo elevado a la enfermedad coronaria o a un ITB anormal25,34. Sin embargo, las guías para cribar enfermedad carotídea asintomática según la American Society of Neuroimaging37 sólo consideran aceptable cribar a pacientes de edad > 65 años con más de tres factores de riesgo, EAP sintomática o antes de la cirugía de revascularización coronaria en pacientes seleccionados. La aterosclerosis precoz (con o —sobre todo— sin hiperhomocisteinemia concomitante), el aneurisma de aorta abdominal o la estenosis de arteria renal son situaciones para las que no hay evidencia a favor o la evidencia actual es contraria a la criba sistemática (tabla 2).
Tabla 2.Indicaciones de cribado de enfermedad carotídea en pacientes con factores de riesgo y/o antecedentes de enfermedad vascular de localización no cerebrovascular
Nivel de recomendación Población general E Población general con más de tres FRCV A Previo a CABG (pacientes seleccionados) B AAA sin síntomas neurológicos E Estenosis en la arteria renal (pacientes seleccionados) Sin datos Aterosclerosis prematura Sin datos Aterosclerosis prematura + hiperhomocisteinemia E EAP sintomática A EAP asintomática E AAA: aneurisma de aorta abdominal; CABG: cirugía de revascularización coronaria; EAP: enfermedad arterial periférica; FRCV: factores de riesgo cardiovascular.
Recomendaciones de la American Society of Neuroimaging, 2007. Los niveles de recomendación van desde A (búsqueda y tratamiento recomendados) hasta E (búsqueda y tratamiento no recomendados). Modificado de Qureshi et al37.
Coste-eficacia comparado de procesos comunes de atención médica y tratamiento en medicina cardiovascular y renal
| Proceso | Coste estimado |
| Hipertensión arterial | 12.000-42.000 |
| Cirugía coronaria sobre el TCI | 6.300-7.000 |
| Diálisis renal | 30.000-35.000 |
| Criba de enfermedad carotídea asintomática (+ eventual EC) | |
| Prevalencia baja-intermedia y tasa de complicaciones perioperatorias (ideal) del 1,33% | 120.000 |
| Prevalencia baja-intermedia y tasa de complicaciones perioperatorias (realista) de un 3-4% | 197.000-318.000 |
| Población con alta prevalencia (> 20%) | 35.130 |
Coste expresado en dólares estadounidenses de 1990-1993 por año de vida ganado ajustado por calidad de vida (QALY). Se considera que las intervenciones que cuestan menos de 50.000 dólares/QALY son coste-eficaces y que las de más de 100.000 dólares no lo son. Cribar enfermedad carotídea asintomática en situaciones de prevalencia baja-intermedia de enfermedad carotídea severa no sería coste-eficaz aun en las mejores condiciones de cirugía de muy bajo riesgo, que no se cumplirían en la mayoría de los centros que realizan estas intervenciones. Cribar a la población de muy elevada prevalencia de enfermedad carotídea sí puede resultar coste-eficaz. Tomado de Lee et al26 y Derdeyn et al27.
EC: endarterectomía carotídea; TCI: tronco común izquierdo.
El diagnóstico de la arteriopatía carotídea comienza con una historia y una exploración física minuciosas y se sigue de la realización de una batería (más o menos extensa) de pruebas diagnósticas encaminadas a la detección y posterior estratificación de la severidad de la lesión. De forma casi unánime, se utilizan ultrasonidos dúplex (USD) para una primera criba por sus elevadas sensibilidad (83-88%) y especificidad (76-89%) —sólo ligeramente inferiores a los de la de angio-RM (un 86–92 y un 76-94% respectivamente)—, su nula morbilidad y su bajo coste en comparación con otras técnicas. Además, tiene la ventaja de proporcionar información valiosa sobre la composición de la placa. No se pueden obviar sus desventajas, como la limitación para la discriminación de lesiones < 50%, la valoración de lesiones muy calcificadas, la imposibilidad de valorar la circulación intracraneal y la excesiva dependencia de la experiencia del ecografista que determina una importante variabilidad entre laboratorios. Otra limitación es la ausencia de criterios dúplex consensuados para la definición del grado de estenosis38–40 (tabla 3). Ante un resultado negativo (ausencia de enfermedad o estenosis < 60%), no se toman otras medidas encaminadas a refinar el diagnóstico. Ante el hallazgo de una enfermedad severa, se plantean diferentes estrategias diagnóstico-terapéuticas que a día de hoy no han sido consensuadas.
Falta de unanimidad en los criterios de diagnóstico de severidad de estenosis carotídea por ecografía dúplex
| PVS | VTD | ACI/ACC | |
| > 30% de estenosis | |||
| AbuRahma et al38 | > 154 | > 42 | — |
| > 50% de estenosis | |||
| AbuRahma et al38 | > 224 | > 88 | > 3,4 |
| Shaalan et al39 | > 155 | — | > 2 |
| Jahromi et al40 | > 130 | ||
| > 70% estenosis | |||
| Jahromi et al40 | > 200 | ||
| > 80% estenosis | |||
| AbuRahma et al38 | > 325 | > 119 | — |
| Shaalan et al39 | > 370 | > 140 | > 6 |
ACI/ACC: relación entre las velocidades máximas en la arteria carótida interna y la arteria carótida común; PVS: velocidad sistólica máxima (cm/s); VTD: velocidad telediastólica (cm/s).
Tiene la ventaja de evitar el riesgo que cualquiera de las estrategias diagnósticas confirmatorias conlleva y reduce el coste total. Tiene el inconveniente de su especificidad subóptima, que en contadas ocasiones puede llevar a cirugía a pacientes que no lo requerirían. Además, no diagnostica enfermedad intracraneal. Actualmente pocos centros son fieles a esta estrategia y la mayoría recurre a una segunda modalidad diagnóstica confirmatoria, ya sea invasiva o no invasiva.
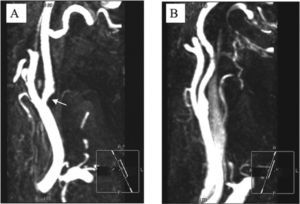
Estrategia de confirmación diagnóstica mediante RMEs la defendida por muchos en un intento de reducir al mínimo la morbilidad relacionada con las otras estrategias más agresivas. Evita la morbilidad por uso de contraste y no conlleva exposición a radiación ionizante. Su sensibilidad y especificidad son algo superiores a las del USD, aunque ello depende del grado de estenosis, y se han comunicado excelentes valores de sensibilidad y especificidad con la técnica TOF (time-of-flight) de RM y, sobre todo, con la más moderna técnica de RM potenciada con contraste para estenosis severa u oclusiones totales (sensibilidad, 91-99%; especificidad, 94-99%). Estos valores son sensiblemente menores para estenosis < 50% (sensibilidad, 38-66%)41. Tiene la ventaja adicional de ser menos dependiente del técnico aunque, entre otras desventajas, es cara y no aplicable a pacientes críticos, con implantes metálicos o claustrofóbicos. Además, proporciona al cirujano información fidedigna del estado de las arterias intracraneales (fig. 3). En casos de discordancia entre USD y RM, se aconseja proceder a una angiografía con técnica de sustracción digital (ASD). Actualmente, la angio-TC multidetectores se ha convertido en una alternativa válida a la RM que proporciona sensibilidad, especificidad y valores predictivos similares a los de ésta, y puede llegar a sustituirla en centros con disponibilidad y experiencia en su utilización. Parece que además la angio-TC muestra un importante potencial en la detección de ulceraciones16 y en la caracterización de las placas carotídeas que puede contribuir a refinar el riesgo de un futuro ACV42.
A: imagen de angiorresonancia magnética potenciada con contraste en paciente con estenosis del origen de la carótida interna derecha. B: imagen de la carótida izquierda normal en el mismo paciente. (Cortesía de la Dra. Victoria Vázquez; Servicio de Radiología, Hospital Virgen de la Arrixaca, Murcia.)
A partir de los grandes estudios ECST24 y NASCET23, que utilizaron ASD, se la considera el estándar para determinar la severidad de la estenosis carotídea, pero no para la detección de ulceraciones de la pared, un importante factor de riesgo adicional de un futuro ACV. Sus principales inconvenientes son la morbimortalidad que conlleva (el 4% de accidentes isquémicos transitorios o ACV menores, el 1% de ACV mayores y < 1% de muerte) y el elevado coste derivado del propio procedimiento y del pertinente ingreso hospitalario. Sin embargo, su uso se hace necesario ante el resultado contradictorio de las técnicas no invasivas citadas, así como en estrategias (cada vez más extendidas) que utilizan angioplastia e implante de stent carotídeo en lugar de endarterectomía carotídea.
CONCLUSIONESLa enfermedad cerebrovascular severa en pacientes asintomáticos es poco prevalente y su búsqueda sistemática puede llevar a consecuencias deletéreas. Únicamente el cribado de poblaciones seleccionadas con elevada prevalencia (probablemente > 20%) podría resultar coste-eficaz. Las vagas y escasas recomendaciones de sociedades científicas disponibles hasta el momento aconsejan cribar a pacientes con más de tres factores de riesgo, enfermedad arterial periférica sintomática o antes de la cirugía de revascularización coronaria en pacientes seleccionados, pero no según la sola enfermedad coronaria previa. Su detección ha de hacerse con USD, aunque con frecuencia es necesaria alguna técnica confirmatoria para planear la mejor estrategia de tratamiento posible. En la mayoría de los casos, la RM potenciada con contraste es la técnica de elección para una correcta definición anatómica con vistas al tratamiento quirúrgico o intervencionista.