La nefropatía inducida por contraste (NIC) es una potencial complicación de los procedimientos que requieren la administración de medio de contraste yodado. El RenalGuard, que suministra una adecuada hidratación combinada con diuresis inducida por furosemida, es una alternativa a las estrategias convencionales de hidratación. Según la literatura disponible, la evidencia sobre el RenalGuard no es concluyente, por lo que hemos realizado un metanálisis utilizando una construcción bayesiana.
MétodosSe realizaron búsquedas en Medline, Cochrane Library y Web of Science de ensayos aleatorizados de RenalGuard frente a estrategias estándar de hidratación periprocedimiento. El objetivo primario fue el desarrollo de NIC. Los objetivos secundarios fueron muerte por cualquier causa, shock cardiogénico, edema agudo de pulmón (EAP) e insuficiencia renal que requería terapia de reemplazo renal. Para cada resultado se calculó un riesgo relativo (RR) con el correspondiente intervalo de credibilidad del 95% (ICr95%). Registro número CRD42022378489 en PROSPERO database.
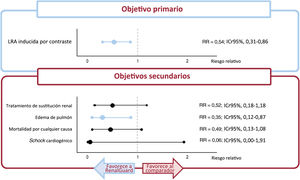
ResultadosSe incluyeron 6 estudios. El RenalGuard se asoció con una reducción relativa significativa de NIC (mediana de RR=0,54; ICr95%, 0,31-0,86) y EAP (mediana de RR=0,35; 95%ICr, 0,12-0,87). No se observaron diferencias significativas para los otros parámetros secundarios [muerte por cualquier causa (RR=0,49; ICr95%, 0,13-1,08), shock cardiogénico (RR=0,06; ICr95%, 0,00-1,91), terapia de reemplazo renal (RR=0,52; ICr95%, 0,18-1,18)]. El análisis Bayesiano también mostró que el RenalGuard obtuvo una alta probabilidad de posicionarse primero con respecto a todos los objetivos secundarios. Estos resultados fueron consistentes en múltiples análisis de sensibilidad.
ConclusionesEn los pacientes sometidos a procedimientos cardiovasculares percutáneos, el RenalGuard se asoció con un menor riesgo de NIC y EAP.
Palabras clave
La nefropatía inducida por contraste (NIC) es una complicación de las intervenciones que requieren la administración intravascular de medios de contraste yodados1–3 y el riesgo de que aparezca depende de los factores relacionados con el paciente y la intervención4. Los predictores independientes más potentes de NIC relacionados con el paciente y la intervención son la enfermedad renal crónica y el uso de grandes volúmenes de medio de contraste, respectivamente5–8. Las estrategias para la prevención de la NIC hasta ahora se han centrado en la reposición del volumen intravascular (mediante el uso periprocedimiento de solución salina isotónica, solución salina semiisotónica o bicarbonato sódico isotónico), fármacos (acetilcisteína o estatinas) y tratamientos de sustitución renal. Aunque se han publicado varios estudios observacionales y ensayos controlados aleatorizados, no hay evidencia sólida de beneficio con estos tratamientos9–13. La guía de práctica clínica vigente recomienda administrar líquidos intravenosos periprocedimiento y reducir la cantidad de medio de contraste como intervenciones básicas para atenuar el riesgo de NIC14.
RenalGuard (PLC Medical Systems, EE. UU.) es un sistema diseñado para garantizar la hidratación adecuada al tiempo que ofrece una depuración del medio de contraste; el sistema proporciona hidratación intravenosa isotónica al instante combinada con una elevada diuresis inducida por furosemida en el intento de prevenir cuadros clínicos de hiper- o hipovolemia15. Hasta la fecha, se han realizado pruebas con RenalGuard en algún pequeño ensayo aleatorizado, con escasa potencia para detectar diferencias en los principales objetivos clínicos y una elevada variabilidad en las características e intervenciones de los pacientes16–21. Se dispone de metanálisis de RenalGuard, pero sus conclusiones están limitadas por la inclusión de estudios observacionales. Además, estos metanálisis utilizaron principalmente modelos frecuentistas, que son limitados cuando se tiene en cuenta la variabilidad entre ensayos o si hay bajos niveles de eventos22–24. Por último, hay disponible un nuevo ensayo de RenalGuard que no se incluyó en los metanálisis anteriores21.
En este contexto, se utilizó un enfoque bayesiano para hacer un metanálisis de RenalGuard como estrategia preventiva de la NIC en pacientes sometidos a intervenciones cardiovasculares percutáneas para: a) aumentar la potencia estadística de los ensayos individuales para evaluar resultados poco frecuentes; b) evitar las limitaciones metodológicas de los metanálisis frecuentistas anteriores, y c) actualizar los metanálisis previos basándose en la evidencia disponible más reciente.
MÉTODOSEstrategia de búsqueda, criterios de selección y recopilación de datos
Este metanálisis se realizó conforme a las recomendaciones de la Colaboración Cochrane y Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA) (tabla 1 del material adicional)25; su protocolo está registrado en la base de datos Prospective Register of Systematic Reviews (PROSPERO; CRD42022378489). Se incluyeron estudios seleccionados en el análisis si: a) tenían un diseño aleatorizado, independientemente del estado de publicación y el idioma; b) incluían ≥ 100 pacientes; c) los pacientes adultos seleccionados tenían ≥ 18 años y se les habían realizado intervenciones cardiovasculares percutáneas; d) comparaban la coincidencia inmediata de la hidratación intravenosa isotónica con la diuresis inducida por furosemida mediante RenalGuard frente a la hidratación periprocedimiento estándar con solución salina intravenosa, y e) notificaban al menos 1 de los objetivos de interés preespecificados.
Se llevó a cabo una búsqueda digital sistemática en las bases de datos Medline (a través de PubMed), Cochrane y Web of Science desde su inicio hasta el 15 de noviembre de 2022. Los términos de búsqueda incluyeron «percutaneous cardiovascular intervention», «coronary angiography», «percutaneous coronary intervention», «percutaneous left atrial appendage closure», «transcatheter aortic valve implantation», «contrast induced acute kidney injury», «acute kidney injury», «acute renal failure», «contrast induced nephropathy», «RenalGuard» y sus combinaciones. En las tablas 2, 3 y 4 del material adicional se muestran más detalles sobre la estrategia de búsqueda. Dos investigadores (GO y MS) realizaron de forma independiente la búsqueda bibliográfica y sus hallazgos se fusionaron. Después de la eliminación de las duplicidades, se seleccionó por título y resumen, seguido de la selección de texto completo de los artículos y de su material suplementario disponibles (CL, GO y MS) (figura 1 del material adicional). Las discrepancias se resolvieron por consenso con uno de los autores principales. Se extrajeron y se tabularon los datos de los estudios seleccionados y se recopilaron las tasas de incidencia de los objetivos de interés tanto del grupo de intervención como del grupo de control.
Evaluación del riesgo de sesgoEl riesgo de sesgo de cada ensayo lo evaluaron por separado 2 investigadores (GO y CL) utilizando la escala Risk-of-Bias-tool 2 (RoB 2) de la Colaboración Cochrane (figura 2 del material adicional). El sesgo de publicación se evaluó por medio de las pruebas de regresión de Egger y visualmente mediante gráficos de embudo.
ObjetivosEl objetivo primario fue NIC. Los objetivos secundarios fueron NIC que requirió tratamiento de sustitución renal, muerte por cualquier causa, shock cardiogénico y edema agudo de pulmón. Todos los resultados del metanálisis se comunicaron de acuerdo con las respectivas definiciones del estudio y se analizaron en el seguimiento más largo disponible.
Análisis estadísticosPrimero se hizo un metanálisis bilateral de los objetivos del estudio utilizando un modelo bayesiano de efectos aleatorios por grupo. Las probabilidades del modelo se calcularon usando una simulación de Monte Carlo con las cadenas de Markov, ejecutando 4 cadenas con valores iniciales sobredispersos. El muestreo de Gibbs se basó en 50.000 imputaciones después de descartar 7.000 repeticiones (periodo de rodaje, o burn-in period) y se utilizaron grandes distribuciones previas poco informativas para deducir distribuciones posteriores. La inferencia posterior se resumió como la mediana del riesgo relativo (RR) posterior y el intervalo de credibilidad del 95% (ICr95%). La probabilidad de que RenalGuard redujera el número de eventos en comparación con los controles también se calculó utilizando la probabilidad posterior acumulada, expresada como un porcentaje. La convergencia de la cadena se comprobó tanto por evaluación gráfica como por evaluación de los estadígrafos de Gelman-Rubin, asumiendo la convergencia si esta última fuera < 1,2. La heterogeneidad se calculó como I2 y se clasificó como baja (< 30%), moderada (30-50%) o alta (> 50%).
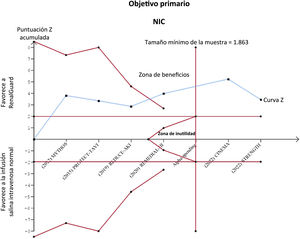
También se estudió la precisión, la incertidumbre y la conclusividad de la evidencia actual mediante análisis secuenciales del ensayo26. Ese análisis permite el cálculo del tamaño de la muestra requerido necesario para definir un resultado como «concluyente» o no (basado en el número de eventos observados en los ensayos y la reducción del riesgo relativo acumulativo del metanálisis ajustado a la heterogeneidad entre ensayos) y para ajustar el riesgo de error de tipo I debido a pruebas de significación repetidas, al mostrar la relación entre la curva Z de la evidencia acumulada y un conjunto de límites de beneficio o inutilidad.
Asimismo, se examinaron las fuentes potenciales de heterogeneidad mediante un metanálisis multivariante de efectos aleatorios que incluía los objetivos preespecificados como variables dependientes, y varios análisis de subgrupos a posteriori, como un análisis dejando uno fuera (leave-one-out) y análisis restringidos a: a) estudios de pacientes con una tasa de filtrado glomerular estimado (TFGe) basal <60ml/min/1,73 m2; b) estudios de pacientes a quienes se les realizaron intervenciones complicadas o no; c) estudios que comunican la definición de Kidney Disease: Improving Global Outcomes (KDIGO) de NIC, y d) estudios que incluyen solo intervenciones quirúrgicas programadas. Por último, se realizó un análisis de metarregresión bayesiana de efectos aleatorios del objetivo primario en que se examinaron el papel de la edad, la fracción de eyección inicial, la tasa de filtrado glomerular inicial, el uso de diuréticos al inicio del estudio y los antecedentes en el uso de estatinas al inicio del estudio.
Todos los análisis estadísticos se realizaron con JAGS, versión 4.3.0; R, versión 4.0.5 (R Foundation for Statistical Computing), utilizando los paquetes metaphor, mvmeta y R2jags, y el software TSA (Trial Sequential Analysis), versión 9.0.5.10 beta.
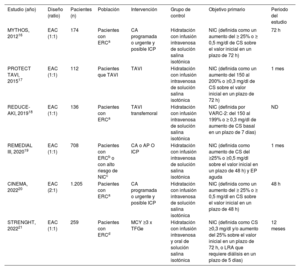
RESULTADOSSelección de estudios y riesgo de sesgoTras la fusión de datos de búsquedas independientes y la eliminación de duplicidades, identificamos 261 artículos potencialmente admisibles. Los resultados de búsqueda de cada base de datos se presentan en las tablas 2, 3 y 4 del material adicional. Después de la selección por título, resumen y texto completo, 6 estudios (n=2.590 pacientes) se ajustaban a los criterios de inclusión en el metanálisis y se evaluaron en función de su calidad (figura 1 del material adicional). Las principales características de los ensayos incluidos se resumen en la tabla 1. En resumen, 2 estudios incluyeron solo a pacientes que se habían sometido a intervención coronaria percutánea programada o urgente16,20 y 1 también incluyó a pacientes sometidos a intervenciones periféricas19; 1 estudio seleccionó a pacientes a quienes se les habían realizado intervenciones coronarias, periféricas o estructurales complicadas21, y 2 estudios incluyeron solo a pacientes a quienes se les realizó implante percutáneo de válvula aórtica17,18. La definición de NIC varió ligeramente entre los estudios, con valores de corte para la creatinina sérica que oscilaban entre ≥ 0,3 y ≥ 0,5mg/dl, y mediciones en un plazo de 72horas en 3 ensayos16,17,21, en un plazo de 48horas en 2 ensayos19,20 y en 7 días en 1 ensayo18. Los 6 estudios presentaron un riesgo bajo de sesgo según la herramienta de evaluación RoB-2 (figura 2 del material adicional).
Características principales de los ensayos controlados incluidos
| Estudio (año) | Diseño (ratio) | Pacientes (n) | Población | Intervención | Grupo de control | Objetivo primario | Periodo del estudio |
|---|---|---|---|---|---|---|---|
| MYTHOS, 201216 | EAC (1:1) | 174 | Pacientes con ERCa | CA programada o urgente y posible ICP | Hidratación con infusión intravenosa de solución salina isotónica | NIC (definida como un aumento del ≥ 25% o ≥ 0,5 mg/dl de CS sobre el valor inicial en un plazo de 72 h) | 72 h |
| PROTECT TAVI, 201517 | EAC (1:1) | 112 | Pacientes que TAVI | TAVI | Hidratación con infusión intravenosa de solución salina isotónica | NIC (definida como un aumento del 150 al 200% o ≥0,3 mg/dl de CS sobre el valor inicial en un plazo de 72 h) | 1 mes |
| REDUCE-AKI, 201918 | EAC (1:1) | 136 | Pacientes con ERCa | TAVI transfemoral | Hidratación con infusión intravenosa de solución salina isotónica | NIC (definida por VARC-2: del 150 al 199% o ≥ 0,3 mg/dl de aumento de CS basal en un plazo de 7 días) | ND |
| REMEDIAL III, 202019 | EAC (1:1) | 708 | Pacientes con ERCb o con alto riesgo de NICc | CA o AP O ICP | Hidratación con infusión intravenosa de solución salina isotónica | NIC (definida como aumento de CS del ≥25% o ≥0,5 mg/dl sobre el valor inicial en un plazo de 48 h) y EP aguda | 1 mes |
| CINEMA, 202220 | EAC (2:1) | 1.205 | Pacientes con ERCa | CA programada o urgente y posible ICP | Hidratación con infusión intravenosa de solución salina isotónica | NIC (definida como un aumento del ≥ 25% o ≥ 0,5 mg/dl en CS sobre el valor inicial en un plazo de 48 h) | 48 h |
| STRENGHT, 202221 | EAC (1:1) | 259 | Pacientes con ERCd | MCY ≥3 x TFGe | Hidratación con infusión intravenosa y oral de solución salina isotónica | NIC (definida como CS ≥0,3 mg/dl y/o aumento del 25% sobre el valor inicial en un plazo de 72 h, o LRA que requiere diálisis en un plazo de 5 días) | 12 meses |
AP: angiografía periférica; CA: coronariografía; CS: creatinina sérica; EAC: ensayo aleatorizado controlado; EP: embolia pulmonar; ERC: enfermedad renal crónica; ICP: intervención coronaria percutánea; NIC: nefropatía inducida por contraste; MCY: medio de contraste yodado; ND: no disponible; TFGe: tasa de filtrado glomerular estimado; TAVI: implante percutáneo de válvula aórtica.
RenalGuard se asoció con una reducción significativa del 46% en el objetivo primario de NIC en comparación con la infusión salina periprocedimiento estándar (RR medio, 0,54; ICr95%, 0,31-0,86), lo que muestra una probabilidad del 99,9% de reducir el riesgo de NIC (figura 1). Se observó heterogeneidad moderada (I2=39%). En el análisis secuencial del ensayo, la curva Z de RenalGuard se situó en el área de beneficio y cruzó el tamaño de información requerido, lo que sugiere que la evidencia actual de NIC es concluyente (figura 2).
No se observaron diferencias estadísticamente significativas entre RenalGuard y los controles en el riesgo de tratamiento de sustitución renal (RR medio, 0,52; ICr95%, 0,18-1,18), muerte por cualquier causa (RR medio, 0,49; ICr95%, 0,13-1,08) o shock cardiogénico (RR medio, 0,06; ICr95%, 0,00-1,91) (figura 1). Por el contrario, RenalGuard se asoció con el 65% de riesgo significativamente menor de edema agudo de pulmón (RR medio, 0,35; ICr95%, 0,12-0,87). RenalGuard tuvo una alta probabilidad de ocupar el primer lugar respecto a todos los objetivos secundarios (el 95,2% en el caso del tratamiento de sustitución renal, el 96,6% en la muerte por cualquier causa, el 82,3% en el caso del shock cardiogénico y el 98,5% en el edema de pulmón, respectivamente). No se encontró heterogeneidad en ninguno de los objetivos secundarios (I2=0%). En el análisis secuencial del ensayo del tratamiento de sustitución renal y la mortalidad por cualquier causa, no se alcanzó el tamaño de información requerido; sin embargo, la curva Z de la mortalidad por cualquier causa entró en la zona de inutilidad. En cambio, la curva Z del edema de pulmón aterrizó en la zona de beneficio y sobrepasó el número mínimo de pacientes requeridos para apoyar este resultado. Dado que solo 2 ensayos incluyeron el shock cardiogénico como objetivo y no hubo eventos en ninguno, no fue posible calcular el tamaño de la muestra requerido para encontrar una diferencia significativa. La figura 3 muestra los resultados del análisis secuencial del ensayo de los otros objetivos secundarios.
Análisis de sensibilidadLa tabla 2 muestra los resultados de los análisis de sensibilidad de los objetivos del estudio. En todos los análisis, el efecto del tratamiento de RenalGuard sobre el objetivo primario fue direccionalmente concordante con los resultados del análisis principal. También se encontraron resultados similares en todos los demás objetivos. El análisis dejando uno fuera identificó posibles fuentes de heterogeneidad (tabla 3). En concreto, el tamaño del efecto de NIC fue mayor después de la eliminación del ensayo STRENGHT (RR medio = 0,49; ICr95%, 0,27-0,74). La eliminación de cualquier otro ensayo, excepto MYTHOS, dio como resultado una pérdida de significación estadística. Respecto al edema de pulmón, se observaron resultados similares después de la eliminación de PROTECT TAVI y REDUCE-AKI (RR medio, 0,37; ICr95%, 0,13-0,98 y RR medio = 0,32; ICr95%, 0,09-0,96, respectivamente), mientras que la eliminación de cualquier otro ensayo dio como resultado una pérdida de significación estadística. No se detectaron fuentes de confusión en ninguno de los otros objetivos. Por el contrario, la metarregresión y el metanálisis multivariante no mostraron fuentes significativas de heterogeneidad entre las covariables analizadas (figura 3 del material adicional).
Análisis de sensibilidad de los objetivos preespecificados
| Análisis frecuentista | |
| Objetivo | Riesgo relativo (intervalo de credibilidad del 95%) |
| NIC | 0,58 (0,42-0,79) * |
| Tratamiento de sustitución renal | 0,74 (0,37-1,48) |
| Edema de pulmón | 0,46 (0,23-0,91) * |
| Muerte por cualquier causa | 0,69 (0,42-1,15) |
| Shock cardiogénico | 0,70 (0,04-11,10) |
| Metanálisis multivariante | |
| Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,59 (0,45-0,77)* |
| Tratamiento de sustitución renal | 0,74 (0,37-1,48) |
| Edema de pulmón | 0,47 (0,25-0,87)* |
| Muerte por cualquier causa | 0,64 (0,38-1,10) |
| Shock cardiogénico | 0,70 (0,14-3,44) |
| Pacientes a quienes no se les han realizado intervenciones complicadas | |
| Criterio de Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,57 (0,30-1,11) |
| Tratamiento de sustitución renal | 0,68 (0,20-2,26) |
| Edema de pulmón | 0,34 (0,09-1,32) |
| Muerte por cualquier causa | 0,30 (0,03-1,65) |
| Shock cardiogénico | 0,10 (0,00-6,52) |
| Pacientes a quienes se les han realizado intervenciones complicadas | |
| Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,46 (0,11-1,82) |
| Tratamiento de sustitución renal | 0,23 (0,03-1,42) |
| Edema de pulmón | 0,36 (0,04-2,54) |
| Muerte por cualquier causa | 0,57 (0,12-1,98) |
| Shock cardiogénico | 0,13 (0,00-9,21) |
| Limitación de la evaluación de NIC a 48horas después de la intervención | |
| Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,56 (0,16-2,03) |
| Tratamiento de sustitución renal | 0,75 (0,15-3,73) |
| Edema de pulmón | 0,36 (0,04-2,54) |
| Muerte por cualquier causa | 0,37 (0,04-2,57) |
| Shock cardiogénico | 0,10 (0,00-6,52) |
| Pacientes a quienes se les han realizado intervenciones programadas | |
| Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,60 (0,25-1,34) |
| Tratamiento de sustitución renal | 0,44 (0,10-1,50) |
| Edema de pulmón | 0,28 (0,04-1,38) |
| Muerte por cualquier causa | 0,58 (0,16-1,58) |
| Shock cardiogénico | 0,06 (0,00-1,91) |
| Ensayos con definiciones de NIC que requieren un aumento de la creatinina de> 0,5 mg/dl | |
| Objetivo | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| NIC | 0,48 (0,16-1,23) |
| Tratamiento de sustitución renal | 0,60 (0,14-2,10) |
| Edema de pulmón | 0,28 (0,04-1,38) |
| Muerte por cualquier causa | 0,32 (0,05-1,43) |
| Shock cardiogénico | 0,06 (0,00-1,91) |
NIC: nefropatía inducida por contraste.
Análisis dejando uno fuera (leave-one-out analysis)
| NIC | |
| Ensayo excluido | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| Ensayo MYTHOS, 201216 | 0,59 (0,35-0,97) * |
| Ensayo PROTECT TAVI, 201517 | 0,58 (0,31-1,00) |
| Ensayo REDUCE-AKI, 201918 | 0,52 (0,23-1,02) |
| Ensayo REMEDIAL III, 202019 | 0,54 (0,24-1,05) |
| Ensayo CINEMA, 202220 | 0,53 (0,23-1,05) |
| Ensayo STRENGHT, 202221 | 0,49 (0,27-0,74) * |
| Tratamiento de sustitución renal | |
| Ensayo excluido | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| Ensayo MYTHOS, 201216 | 0,58 (0,18-1,46) |
| Ensayo PROTECT TAVI, 201517 | 0,55 (0,20-1,32) |
| Ensayo REDUCE-AKI, 201918 | 0,51 (0,14-1,32) |
| Ensayo REMEDIAL III, 202019 | 0,48 (0,12-1,36) |
| Ensayo CINEMA, 202220 | 0,39 (0,11-1,12) |
| Ensayo STRENGHT, 202221 | 0,54 (0,17-1,37) |
| Edema de pulmón | |
| Ensayo excluido | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| Ensayo MYTHOS, 201216 | 0,31 (0,08-1,04) |
| Ensayo PROTECT TAVI, 201517 | 0,37 (0,13-0,98) * |
| Ensayo REDUCE-AKI, 201918 | 0,32 (0,09-0,96) * |
| Ensayo REMEDIAL III, 202019 | 0,40 (0,11-1,23) |
| Ensayo CINEMA, 202220 | 0,34 (0,09-1,05) |
| Ensayo STRENGHT, 202221 | 0,35 (0,12-0,87) * |
| Muerte por cualquier causa | |
| Ensayo excluido | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| Ensayo MYTHOS, 201216 | 0,53 (0,12-1,28) |
| Ensayo PROTECT TAVI, 201517 | 0,48 (0,10-1,16) |
| Ensayo REDUCE-AKI, 201918 | 0,52 (0,15-1,19) |
| Ensayo REMEDIAL III, 202019 | 0,45 (0,08-1,27) |
| Ensayo CINEMA, 202220 | 0,53 (0,16-1,19) |
| Ensayo STRENGHT, 202221 | 0,32 (0,07-1,06) |
| Shockcardiogénico | |
| Ensayo excluido | Riesgo relativo medio (intervalo de credibilidad del 95%) |
| Ensayo MYTHOS, 201216 | 0,10 (0,00-6,52) |
| Ensayo PROTECT TAVI, 201517 | 0,06 (0,00-1,91) |
| Ensayo REDUCE-AKI, 201918 | 0,06 (0,00-1,91) |
| Ensayo REMEDIAL III, 202019 | 0,06 (0,00-1,91) |
| Ensayo CINEMA, 202220 | 0,13 (0,00-9,31) |
| Ensayo STRENGHT, 202221 | 0,06 (0,00-1,91) |
NIC: nefropatía inducida por contraste.
Ninguno de los objetivos evaluados mostró ningún sesgo de publicación significativo en la regresión de Egger o visualmente en los gráficos de embudo (figura 4 del material adicional).
DISCUSIÓNEn este metanálisis bayesiano, el sistema RenalGuard se asoció con un riesgo reducido de NIC y edema agudo de pulmón, sin diferencias en la mortalidad por cualquier causa, shock cardiogénico o insuficiencia renal aguda que requiriera tratamiento de sustitución renal en comparación con la hidratación intravenosa periprocedimiento estándar. Estos resultados se reprodujeron en varios análisis de sensibilidad, lo que resalta la valiosa función del sistema RenalGuard en la reducción de la incidencia de lesión renal después de intervenciones cardiovasculares que requieren la administración de grandes cantidades de medios de contraste. Es importante destacar que este resultado se obtuvo al tiempo que limitaba e incluso mejoraba las posibles consecuencias de las estrategias de hidratación incontrolada (es decir, sobrecarga de volumen y edema agudo de pulmón). Mediante el enfoque bayesiano, se pudo mostrar que el sistema RenalGuard tiene una probabilidad del 95% de ser superior al grupo de control en la reducción del riesgo de NIC.
La hidratación y la reducción de los medios de contraste son estrategias fundamentales en la prevención de la NIC9–14. Se ha sugerido adaptar el tratamiento de hidratación como alternativa a la hidratación convencional; sin embargo, a pesar de varios ensayos y registros observacionales que han evaluado este enfoque mediante el uso del sistema RenalGuard, la evidencia que lo sustenta continúa siendo escasa y no permite extraer conclusiones definitivas. En especial, la variabilidad de los pacientes incluidos en los ensayos clínicos (p. ej., debido a la falta de criterios para la selección de los mejores candidatos para el sistema RenalGuard) dio como resultado un nivel de evidencia bajo. Basándonos en estos antecedentes, nuestro objetivo fue resumir la evidencia más contemporánea de los ensayos aleatorizados disponibles del sistema RenalGuard y superar algunas limitaciones conocidas de los metanálisis frecuentistas, como su escasa capacidad de estimar los efectos agrupados de los tratamientos si había bajas cifras de eventos debido al uso de modelos de corrección por continuidad27 y su excesiva dependencia de los valores de p, que no representan la probabilidad directa real de respuesta al tratamiento28. Es importante destacar que, en comparación con los metanálisis publicados anteriormente, nuestro estudio se centra en la comparación directa del sistema RenalGuard con las estrategias de hidratación estándar y aporta información adicional mediante la inclusión de la evidencia más reciente sobre el tema y la evitación de la variabilidad (p. ej., «ruido») introducida por comparaciones indirectas29. Además, el uso de modelos de efectos aleatorios en lugar de modelos de efectos fijos nos permitió limitar la influencia de la variabilidad entre ensayos y las diferencias biológicas en los resultados generales. También se incluyó un análisis secuencial del ensayo, que no estaba disponible en otros metanálisis, lo que sugiere que el tamaño de la información recopilada hasta ahora en los ensayos aleatorizados disponibles es suficiente para afirmar que este resultado es concluyente.
Aunque el modo preciso de acción del sistema RenalGuard no se conoce bien, la alta diuresis lograda por medio de la hidratación intravenosa adecuadamente combinada en nuestro metanálisis se tradujo en una disminución importante del 46% del riesgo relativo de NIC. Este resultado coincide con los de estudios previos23,24 y también está en consonancia con varios hallazgos histopatológicos que ponen de manifiesto hipoxia medular como causa de daño renal a través de la lesión de células tubulares30,31. Suponiendo que la hipovolemia es un factor de riesgo de hipoxia renal, se puede especular que lograr un buen equilibrio entre la perfusión renal y la diuresis adecuada tiene un efecto protector directo sobre las células tubulares, lo que reduce el riesgo de lesión32.
Todos nuestros análisis de sensibilidad preespecificados basados en definiciones variables, el momento de la evaluación (p. ej., el aumento de los niveles de creatinina plasmática en las 48horas posteriores al procedimiento) y/o los puntos de corte de diagnóstico (p. ej., el aumento de los niveles de creatinina plasmática>0,5mg/dl), favorecieron, al menos direccionalmente, el sistema RenalGuard. Curiosamente, el efecto del tratamiento fue aún mayor después de la exclusión de los ensayos de implante valvular aórtico percutáneo, lo que podría atribuirse a efectos hemodinámicos positivos después de la intervención (p. ej., debido a la reducción de la poscarga que dio como resultado un rendimiento cardiaco inotrópico mejor) que se oponen a la hipoxia medular y el daño celular tubular, reduciendo así el impacto relativo del sistema RenalGuard33.
Aunque, desde el punto de vista de la rentabilidad, la reducción de la NIC resulta atractiva34, debe reconocerse que el sistema RenalGuard podría representar una intervención potencialmente costosa. Recientemente se ha probado un enfoque más rudimentario y barato, basado en la idea de que un protocolo de hidratación agresivo guiado por mediciones invasivas de la presión del ventrículo izquierdo podría ser beneficioso para prevenir la NIC. Sin embargo, en comparación con los protocolos de hidratación estándar, los resultados fueron controvertidos35,36. Además, hasta la fecha, ningún estudio ha comparado directamente RenalGuard con esta estrategia y algunos problemas continúan sin resolverse. En concreto, debido al requisito de mediciones invasivas de la presión del ventrículo izquierdo para definir el nivel de líquido, la medida preventiva puede iniciarse solo poco antes de la administración del medio de contraste, neutralizando los beneficios potenciales de una hidratación más extensa antes de la intervención. Asimismo, como se comunicó en el ensayo POSEIDON37, este enfoque se tradujo en una mayor administración de líquidos que con la estrategia estándar. Estos problemas, junto con la falta de seguimiento de la diuresis combinada y con las mediciones de presión postoperatorias, plantearon algunas preocupaciones sobre la aplicación y el futuro de la hidratación guiada por mediciones invasivas de presión del ventrículo izquierdo como medida de prevención de NIC.
Es importante destacar que el beneficio del sistema RenalGuard no se produjo a costa de la seguridad. No se observaron diferencias en el riesgo de mortalidad por cualquier causa o shock cardiogénico, e incluso hubo una disminución del 65% del riesgo relativo de edema agudo de pulmón. La fuerte asociación protectora entre el sistema RenalGuard y el edema agudo de pulmón es un descubrimiento novedoso inesperado con implicaciones notables23. De hecho, el edema agudo de pulmón inevitablemente afecta al tratamiento y al pronóstico del paciente, sobre todo cuando su aparición se atribuye incorrectamente a un fallo agudo de la bomba y no a una sobrecarga incontrolada de líquidos, lo que puede conducir a pruebas posteriores inútiles e, incluso, dañinas. El efecto beneficioso de la reducción del edema agudo de pulmón en el grupo en estudio puede depender del uso de furosemida, un efecto mediado por el bloqueo de la reabsorción tubular de sodio en el asa de Henle, que disminuye la carga de trabajo tubular. Este efecto podría llevar a los médicos a considerar la administración de furosemida sola como una forma de prevenir el edema agudo de pulmón. Sin embargo, el uso de furosemida sin combinarla con una hidratación adecuada disminuye el volumen circulante efectivo y la vasodilatación mediada por prostaglandinas, lo que puede provocar deshidratación y aumentar el riesgo de lesión tubular38, reforzando así la evidencia y sugiriendo un valioso efecto sinérgico de la hidratación intravenosa isotónica al mismo tiempo combinada con una elevada diuresis facilitada por el uso de RenalGuard.
El análisis secuencial del ensayo indicó que el tamaño de la información recopilada hasta el momento en los ensayos aleatorizados disponibles era suficiente para afirmar que ese resultado fue concluyente. En cambio, no se encontraron diferencias con el sistema RenalGuard respecto a la reducción de la insuficiencia renal que requiere tratamiento de sustitución renal. Estos resultados no concuerdan con los de los metanálisis previos que muestran una menor necesidad de tratamiento de sustitución renal, posiblemente como consecuencia de incluir estrategias de tratamiento heterogéneas en el grupo de control con un bajo número de eventos22,23,39.
Al discutir sobre la validez externa de nuestros resultados y su aplicabilidad real en la práctica clínica, es importante señalar que todos los estudios incorporados en nuestro análisis incluyeron a pacientes con enfermedad renal crónica o considerados de alto riesgo para la afección. Por tanto, nuestros resultados demostraron efectos beneficiosos fiables del uso de RenalGuard en pacientes con un perfil de alto riesgo. Esto refuerza la importancia de la estratificación precisa del riesgo y la selección clínica para lograr el mejor resultado y reducir los costes médicos.
LimitacionesEste metanálisis tiene algunas limitaciones. La falta de datos de los pacientes nos permitió realizar solo un metanálisis de estudio, que puede estar influido por alguna variabilidad residual entre ensayos a pesar del uso de un enfoque bayesiano. Para reducir la influencia de esas diferencias, se utilizaron modelos de efectos aleatorios y numerosos análisis de sensibilidad. Algunos análisis de sensibilidad perdieron significación estadística como consecuencia de la relativamente pequeña cantidad de evidencia disponible, pero los resultados continuaron siendo similares direccionalmente y los efectos del tratamiento no se modificaron excesivamente.
CONCLUSIONESEn pacientes a quienes se les realizaron intervenciones cardiovasculares percutáneas, el uso del sistema RenalGuard se asoció con una menor incidencia de NIC y edema agudo de pulmón. Estos efectos positivos no se produjeron a costa de mayor mortalidad o shock cardiogénico.
- –
La evidencia sobre el sistema RenalGuard como estrategia preventiva de NIC en pacientes a quienes se les realizan intervenciones cardiovasculares que requieren la administración de medio de contraste yodado es escasa.
- –
Los metanálisis disponibles agruparon varias estrategias preventivas y utilizaron enfoques frecuentistas, que tienen limitaciones en el momento de extraer conclusiones definitivas.
- –
Con el uso de un modelo bayesiano de efectos aleatorios por grupo, se llegó a la conclusión de que el sistema RenalGuard está asociado con una reducción relativa significativa de NIC en comparación con la hidratación estándar, con un grado de evidencia que probablemente sea concluyente basado en el análisis secuencial del ensayo.
- –
Se encontró que el RenalGuard reduce considerablemente el riesgo de edema agudo de pulmón y no mostró problemas de seguridad significativos.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESG. Occhipinti concibió el estudio y redactó el original; C. Laudani realizó el análisis estadístico; M. Spagnolo participó en el diseño del estudio; A. Greco participó en el diseño del estudio y revisó el original; D. Capodanno revisó el contenido intelectual del original y supervisó y validó el estudio. Todos los autores leyeron y aprobaron el texto final.
CONFLICTO DE INTERESESNinguno.