Palabras clave
INTRODUCCION
La tecnología de ultrasonido intravascular (IVUS) apareció hace más de 30 años como ayuda en las intervenciones endovasculares1,2. La cuantificación de las imágenes de IVUS se ha hecho esencial en los últimos años para el entendimiento de la fisiopatología de la cardiopatía isquémica3 y en múltiples aspectos de la car-diología intervencionista4. Sin embargo, el análisis de las secuencias de IVUS requiere todavía en la actualidad una importante participación del observador y, como consecuencia, una gran inversión en esfuerzo humano.
El presente estudio surge de la necesidad de herramientas informáticas que permitan facilitar y automatizar en lo posible este análisis. Los trabajos previos han evaluado secuencias muy cortas y todavía no se han trasladado a la práctica diaria5-9.
Nos planteamos desarrollar un método informático que permitiera, con mínima participación del observador, una reconstrucción tridimensional de las secuencias de IVUS a partir de la cual fuera posible de una manera automática y rápida cuantificar las variables más ampliamente utilizadas (área de vaso, área de luz, volumen de placa y severidad de la lesión). Se valora la fiabilidad de esta herramienta y su rentabilidad en cuanto a ahorro de tiempo respecto al análisis manual.
MÉTODOS
Entorno del estudio
El desarrollo del método informático que se presenta se realizó a partir de la colaboración entre un grupo de cardiólogos intervencionistas y de ingenieros especializados en biomedicina. Obviamente, los aspectos más técnicos fueron implementados por los ingenieros, pero siempre con la supervisión y ajustándose a las necesidades que en cada etapa sugerían los cardiólogos.
Se utilizó para todo el proceso el paquete informático MATLAB 6.5 (The Mathworks Inc., Natick, MA, Estados Unidos) y todas las mediciones se ejecutaron «off-line» en una estación de trabajo específicamente dedicada al análisis de imágenes cardiológicas (HP Workstation xw6000, Intel Xeon 2.4 GHz, 2GB RAM) por un único observador experimentado.
Las secuencias de imágenes IVUS se obtuvieron con un equipo Clearview Ultra (Boston Scientific Corp., Natick, MA, Estados Unidos) con un catéter modelo Atlantis Plus 40 (40 MHz). La velocidad de retirada del catéter fue de 0,5 mm/s. Inicialmente, las secuencias de vídeo IVUS se registraron en una cinta VHS. Para digitalizar los vídeos se utilizó una tarjeta Pinnacle (Avid Technology Inc., M. View, California, Estados Unidos) que generó unas secuencias AVI codificadas con el códec PIM1 a una velocidad de 25 imágenes/s y con una resolución de 352 × 288 píxeles.
Procesamiento previo de imágenes
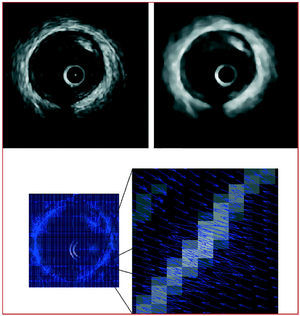
Con el fin de reducir el ruido granular propio de las imágenes obtenidas mediante ecos de ultrasonidos se utilizó un filtro de mediana que presenta la característica de reducir el ruido suavizando la imagen a la vez que realza los bordes de interés10. En la figura 1 (panel superior) se muestra el resultado de la aplicación del filtro sobre una imagen típica de IVUS.
Fig. 1. Panel superior: aplicación de un filtro de mediana a una imagen típica IVUS. La imagen IVUS (izquierda) presenta ruido granular producido por los ecos de ultrasonidos no deseados. En la imagen filtrada (derecha) se reduce el ruido y se realza el borde entre la túnica media y adventicia. Panel inferior: información de bordes de una imagen típica IVUS. Campo de fuerzas para toda la imagen (izquierda) y zoom del mismo (derecha), donde se puede apreciar la convergencia hacia el contorno media-adventicia.
Detección del contorno media-adventicia
El límite entre la capa media y la adventicia define el área del vaso11. Se obtuvo a partir de la técnica conocida como contornos activos (snakes)12,13, en la que el contorno se adapta progresivamente a cada imagen de la secuencia de forma automática. Sólo se debe especificar de forma manual aproximada el contorno de la primera imagen de la secuencia. En las imágenes IVUS, el límite media-adventicia presenta un contraste elevado, con lo cual el borde es relativamente sencillo de detectar. En presencia de sombras debidas a la guía del catéter o a una placa calcificada, el contorno se completa de manera suavizada y respeta la anatomía habitual del vaso. En la figura 1 (panel inferior) se muestra una imagen típica de IVUS con la información de bordes convenientemente detectada. En la figura 2 (panel superior izquierda) se puede observar un ejemplo de adaptación automática del contorno.
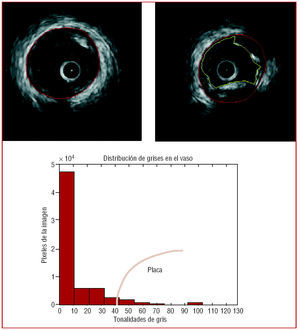
Fig. 2. Panel superior: adaptación automática del contorno media-adventicia. Panel central: distribución de la información de grises en una imagen típica de IVUS. El rango de tonalidades puede variar entre 0 (negro) y 255 (blanco). En rojo se indica la región donde la intensidad es suficiente como para estimar presencia de placa. Panel inferior: detección de los contornos de interés para una imagen típica de IVUS en presencia de placa calcificada. En rojo el contorno media-adventicia y en amarillo el contorno asociado a la luz.
El principal problema que presenta este método son los errores debidos a los saltos bruscos en la secuencia IVUS por los movimientos del catéter. Para prevenir este error se permitió al especialista especificar un cierto número de contornos adicionales siguiendo dos criterios: a) el primero se basó en la correlación entre imágenes sucesivas; si se detectaba una variación lo suficientemente sensible como para que el contorno se adaptara de manera errónea, se sugería especificar un nuevo contorno, y b) el segundo criterio se basó en la introducción de un contorno manual de forma periódica cada cierto número de imágenes. La definición manual de contornos se realizó en unos pocos minutos al inicio de la reconstrucción, mientras que el resto del proceso era totalmente automático.
Detección de luz y placa
Una vez la región del área del vaso había sido detectada, se discriminó el resto de la imagen y el método se centró en su análisis para diferenciar entre catéter, luz e íntima (o placa). La zona del catéter fue fácilmente detectable, ya que siempre ocupaba la misma región de la imagen. Para distinguir entre la región de luz y la placa o la íntima se utilizó un criterio de tonalidades de gris, tras la definición previa a partir de un estudio estadístico de los tonos de gris que corresponden a cada región14. La luz presentó tonalidades más oscuras, mientras que la placa y la íntima presentaron tonalidades más claras, e incluso eran brillantes en el caso de placa calcificada. En la figura 2 (panel inferior) se muestra un ejemplo de distribución de tonalidades de gris en el área de interés de una imagen IVUS, donde la región de tonos negros hace referencia a la zona externa al área del vaso. En la figura 2 (panel superior derecha) se muestra un ejemplo de detección de los dos contornos de interés: media-adventicia y luz. El área de placa se definió como la diferencia entre el área de vaso y el área de luz11.
Reconstrucción tridimensional
Tras obtener todos los contornos de la región que se iba a reconstruir, se procedió a la reconstrucción tridimensional. Se utilizó la técnica de superposición de contornos, otorgando a cada imagen, es decir, a cada par de contornos media-adventicia y luz, un espesor obtenido a partir de la velocidad de retirada del catéter (0,02 mm en este caso). Finalmente, se aplicaron las opciones gráficas para obtener un modelado tridimensional adecuado. En la figura 3 se muestran algunos ejemplos de reconstrucción tridimensional de arterias con presencia de placa (panel superior) y un ejemplo de toma de medidas realizada de forma automática a partir de una reconstrucción (panel inferior). La reconstrucción podía ser almacenada en cualquier soporte informático para análisis posteriores.
Fig. 3. Panel superior: ejemplos de reconstrucción de secciones de arterias de 5 mm de longitud. En rojo se muestra el contorno media-adventicia y en blanco, el contorno asociado a la luz. Panel inferior: ejemplo de toma automática de áreas realizada de forma automática.
Secuencias analizadas
Se estudió un total de 11 secuencias (2.300 imágenes en total): 8 secuencias de 250 imágenes sucesivas (equivalente a 5 mm de longitud de vaso cada una) y 3 secuencias de 100 imágenes sucesivas (equivalente a 2 mm de longitud de vaso cada una). Estas secuencias pertenecían a 11 pacientes consecutivos a los que se realizó un estudio de IVUS en nuestro laboratorio. Las secuencias se seleccionaron de manera aleatoria y todas ellas pertenecían a arterias nativas (5 a arteria coronaria derecha, 5 a arteria descendente anterior, una a arteria circunfleja) no tratadas previamente con angioplastia o stent intracoronario.
Análisis de variabilidad
Para la validación del método propuesto, el observador cuantificó manualmente las 2.300 imágenes del estudio. Con posterioridad se compararon con las medidas obtenidas tras la reconstrucción automática de cada una de las secuencias (variabilidad «manual-automático»).
En el análisis manual de cada secuencia se evaluaron las áreas de vaso y de luz, la presencia de zonas con lesión severa15: área < 4 mm² (en todas las imágenes) y el volumen de placa (de toda la secuencia), así como el tiempo empleado para el análisis. Estos datos se compararon con los obtenidos a partir del análisis automático de la reconstrucción tridimensional.
La variabilidad «intramanual» se calculó mediante la cuantificación de una secuencia de 100 imágenes 2 veces de manera manual (por un mismo observador y con un tiempo de separación de aproximadamente un mes entre las 2 mediciones). La variabilidad «intraautomática» (variabilidad del método desarrollado) se calculó cuantificando 2 veces de forma automática dicha secuencia (definiendo contornos diferentes). En ambos casos se definió la primera medida como estándar y se evaluó el error para la segunda. También se obtuvo la variabilidad normalizada (en mm²/mm²).
Análisis estadístico
Las variables continuas se expresaron como media ± desviación estándar. Las variables dicotómicas se expresaron como porcentajes. La correlación entre variables continuas se analizó mediante el coeficiente de correlación intraclase (CCI). Se valoró la variabilidad entre métodos (manual respecto al automático) mediante gráficos de Bland-Altman. Estas gráficas se utilizan para comparar dos técnicas de medición, manual y automática en este caso. Se representa en el eje de las ordenadas el error obtenido para cada par de medidas (manual-automática) y en el eje de las abscisas la media de dicho par de medidas. Se consideraron significativos los valores de p < 0,05. Para todos los análisis se utilizó el paquete estadístico SPSS 11.0 (SPSS Inc, Chicago, Ill, Estados Unidos).
RESULTADOS
Variabilidad interna del método manual y del método automático
En la tabla 1 se muestran los valores obtenidos para la variabilidad interna en el método manual y el método automático respecto al área de luz, el área de vaso y el volumen de placa.
A continuación se describe la variabilidad del método automático propuesto respecto al método de medida manual para medidas de áreas, el cálculo de volúmenes, el análisis de la severidad de la lesión y el coste temporal.
Medidas de áreas
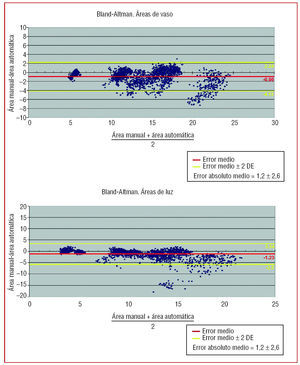
En la figura 4 se representan las gráficas de Bland-Altman con los resultados obtenidos para las medidas de área del vaso (panel superior) y área de la luz (panel inferior) en las 2.300 imágenes cuantificadas. Se detectó un error medio del método automático respecto al manual de 1,2 ± 1,3 mm² (0,08 ± 0,07 normalizado respecto al área real, esto es, por cada mm² de área se obtiene un error de 0,08 mm²) en la medida del área de vaso y de 1,6 ± 2,2 mm² (0,11 ± 0,11 normalizado) en la medida del área de luz.
Fig. 4. Panel superior: gráfica de Bland-Altman con las medidas obtenidas en los métodos manual y automático para el área del vaso. Panel inferior: gráfica de Bland-Altman con las medidas obtenidas en los métodos manual y automático para el área de la luz. DE: desviación estándar.
En 9 de las 11 secuencias (82%), el error medio del método automático respecto al manual para cuantificar las áreas de vaso y de luz fue < 1 mm² (0,86 ± 0,86 mm² para el vaso y 0,77 ± 0,71 mm² para la luz) y sólo en 2 de las 11 secuencias (18%) el error fue > 2 mm² (2,56 ± 1,69 mm² para el vaso y 3,75 ± 3,43 mm² para la luz). En estas 2 secuencias se detectaron saltos de imagen frecuentes debido al movimiento del catéter y amplias zonas de sombra debido a la presencia de placa calcificada; al repetir la reconstrucción tridimensional de estos casos con una mayor definición de puntos intermedios por parte del observador, el error en estas dos secuencias se redujo a menos de 1 mm², tanto para el área del vaso como para el área de la luz.
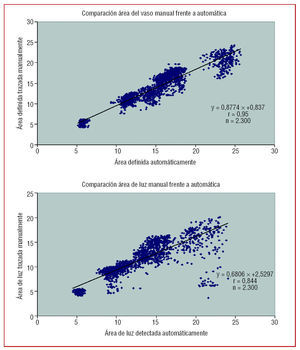
Respecto al coeficiente de correlación intraclase (CCI) empleado para medir el grado de concordancia entre las áreas medidas manual y automáticamente, se obtuvo para áreas de vaso un valor de 0,97 (intervalo de confianza [IC] del 95%, 0,96-0,97) y para áreas de luz un valor de 0,90 (IC del 95%, 0,89-0,91).
En la figura 5 se muestra la estrecha correlación entre las medidas obtenidas con los métodos manual y automático. Los escasos puntos con mayor dispersión en los gráficos de regresión y de Bland-Altman corresponden a zonas con saltos bruscos del catéter o amplias zonas de sombra en las dos secuencias comentadas previamente.
Fig. 5. Panel superior: gráfica de regresión con las medidas de área del vaso obtenidas en el método manual frente a las obtenidas en el método automático. Panel inferior: comparación de las medidas de área de la luz obtenidas en el método manual frente a las obtenidas en el método automático.
Severidad de la lesión
De las 11 secuencias analizadas, 3 de ellas presentaron zonas con áreas de luz < 4 mm², según la medición manual realizada por un observador experimentado. El método automático detectó la presencia de lesiones severas en los 3 casos. De las 240 imágenes (10,4% del total de imágenes analizadas) en las que la medición manual detectó un área de luz < 4 mm², el método automático mostró una precisión del 91% (218 de las 240) para identificarlas. En el resto de las imágenes, donde la medición manual no detectó área de luz < 4 mm², el método automático presentó una precisión del 99,4% (2.047 de 2.060).
Cálculo de volúmenes
En la tabla 2 se muestran los resultados obtenidos para las 8 secuencias de 250 imágenes con los métodos manual y automático para el cálculo del volumen de vaso, volumen de luz y volumen de placa. El error medio obtenido en el cálculo de volúmenes por el método automático respecto al manual fue de 4,9 ± 5,2 mm³ para vaso (0,06 ± 0,05 normalizando respecto al volumen real, es decir, un error de 0,06 mm³ por cada mm³), 7 ± 8,9 mm³ para luz (0,09 ± 0,08, normalizado) y 5,4 ± 3,9 mm³ para placa (0,5 ± 0,3, normalizado).
Análisis temporal
Para el análisis manual, el promedio de tiempo para la medición de una secuencia de 250 imágenes fue de 60 ± 10 min. Para el método automático propuesto, el tiempo medio necesario invertido por el operador fue de 10 ± 8 min (p < 0,0001 respecto al análisis manual).
DISCUSION
Hemos presentado nuestra experiencia inicial en la reconstrucción tridimensional y cuantificación automática de secuencias de IVUS de casos reales por medio de un método informático desarrollado conjuntamente por un grupo de cardiólogos intervencionistas y de ingenieros especializados en biomedicina. Los resultados sugieren que el método implementado es fiable, con escasa variabilidad respecto a la valoración manual de un observador experimentado, y destaca la exactitud en la detección de áreas de vaso y de luz (error normalizado del orden de 0,1) y en el cálculo de volúmenes (error normalizado < 0,1 para volúmenes de vaso y de luz). Este tipo de herramientas informáticas puede permitir en un futuro cercano el ahorro de un tiempo y esfuerzo humano considerables.
Durante los últimos años, el IVUS se ha convertido en una técnica fundamental no sólo en la práctica diaria16, sino también en diferentes campos de la investigación dentro del ámbito de la cardiopatía isquémica3 y la cardiología intervencionista4. Aspectos tales como el estudio de la placa inestable, la fisiopatología del síndrome coronario agudo o los procesos de reestenosis postangioplastia o post-stent, con todas las implicaciones que de ello se derivan, se han ido comprendiendo gracias en buena parte a la aportación del IVUS.
En la práctica diaria de las intervenciones en un laboratorio de hemodinámica, la toma de decisiones ha de ser rápida y, en este sentido, la información que se le solicita al IVUS es sencilla: severidad de una lesión, longitud, estimación grosera de la composición de la placa, etc. Todos estos datos se cuantifican de manera muy rápida por medio del software básico incluido en los equipos de IVUS. Lógicamente, en este escenario no son necesarios ni recomendables los análisis exhaustivos y costosos de toda la secuencia registrada. Incluso, en los análisis «off-line» actuales se suelen medir unas pocas imágenes manualmente, en intervalos de 0,5-1 mm, para así poder estimar los volúmenes, con lo que se sacrifica algo de precisión pero se obtienen medidas aceptables de una manera rápida.
Sin embargo, en el campo de la investigación se requiere la cuantificación de secuencias de miles de imágenes para una detallada valoración en múltiples niveles del volumen de placa, área de luz y de vaso, composición de la placa, etc. En la mayoría de los grupos y laboratorios centrales dedicados a este campo, las mediciones suelen llevarse a cabo gracias a la inversión en recursos humanos (cardiólogos, técnicos, becarios). La disponibilidad de una cuantificación automática fiable permitiría disminuir los esfuerzos dedicados a esta labor y derivar los recursos hacia otros aspectos.
Los intentos realizados hasta la actualidad en este tipo de métodos informáticos5-9 no se han trasladado todavía de forma generalizada a la práctica diaria. Si bien los resultados son prometedores, la validación en general se ha efectuado con secuencias de muy pocas imágenes2,8,9, probablemente por la dificultad para la reconstrucción cuando se trata de secuencias más largas debido a factores tales como la dificultad para la correcta identificación de bordes o las oscilaciones de la imagen por el movimiento del catéter.
En el presente estudio se muestra una serie muy amplia de 2.300 imágenes cuantificadas de manera automática y su correspondencia con los resultados derivados de la medición manual por un observador experimentado. En 8 de las secuencias se realizaron reconstrucciones de 250 imágenes consecutivas (5 mm), una extensión que, aunque todavía corta, es más larga que en series precedentes2,8,9. Los resultados obtenidos sugieren que:
1. El método implementado permite una reconstrucción fiable de las secuencias de IVUS con una variabilidad respecto a la medición manual muy escasa en la gran mayoría de las ocasiones. Sólo detectamos errores significativos en unos pocos puntos de dos de las secuencias (como queda reflejado en las gráficas de regresión y de Bland-Altman). Estos errores fueron motivados por múltiples saltos bruscos del catéter y por la aparición de amplias zonas de sombra. En cualquier caso, estas secuencias son fácilmente identificables al principio de la reconstrucción y pueden solucionarse añadiendo más puntos intermedios (por los dos métodos propuestos en nuestro estudio) o, en casos extremos, se puede recurrir a la cuantificación manual. Además, se puede apreciar en las gráficas de Bland-Altman que la mayor dispersión está asociada con tamaños de vaso mayores, con lo cual supone una penalización que, aunque se refleja en los valores de la media y la desviación estándar, a efectos clínicos se puede considerar aceptable, como se puede observar en los resultados obtenidos al normalizar el error.
2. Se logró una reducción muy significativa en el tiempo y el esfuerzo invertidos por el observador en cada caso. El método automático sólo requirió introducir manualmente el contorno media-adventicia de la primera imagen y de unas pocas imágenes intermedias (algo que se completó en pocos minutos al inicio de la reconstrucción). Por su parte, la medición manual precisó la delimitación de la media-adventicia y de la luz en cada imagen (500 contornos en una secuencia de 250 imágenes, muchos más en secuencias más largas). Aparte, la reconstrucción tridimensional automática permite un sencillo almacenaje de la información que es recuperable en cualquier momento de manera inmediata y con una «agradable» presentación, por lo que es posible obtener multitud de datos (volúmenes, áreas, longitudes de placa, vaso o luz de toda la secuencia o de sólo una parte de ésta que seleccionemos, zonas con área de vaso o luz menores de un umbral que se especifique, etc.). La recuperación de esta información de manera manual es obviamente mucho menos dinámica y supone de nuevo un consumo de tiempo en una labor no siempre gratificante.
Limitaciones
Las secuencias analizadas son mayores que en estudios previos, pero todavía cortas para una aplicación inmediata del método propuesto en la práctica diaria. No se han presentado secuencias previamente tratadas con stent; en cualquier caso, no parece que este factor suponga una limitación para las reconstrucciones automáticas. Respecto a la identificación de la composición de la placa, parece que la señal de radiofrecuencia aporta más información que la imagen de vídeo17,18; sin embargo, la experiencia inicial de nuestro grupo para la identificación automática de la composición de la placa en función de la escala de intensidades13 (que puede quedar implementada dentro de la reconstrucción tridimensional) sugiere una buena correlación con la interpretación visual de un observador experimentado.
CONCLUSIONES
El presente estudio refleja la necesidad de colaboración entre cardiólogos y bioingenieros en el campo de la imagen cardiovascular. El método informático presentado supone un avance más en la reconstrucción y cuantificación automática de la imagen de IVUS, para lo cual la limitación deriva más de la calidad de la imagen ecográfica ofrecida que de los modelos de reconstrucción y cuantificación. En un futuro cercano, herramientas como la presentada o muy parecidas permitirán reducir al mínimo el tiempo y el esfuerzo humano invertidos en la tediosa labor de la cuantificación manual.
Véase editorial en págs. 862-4
Este trabajo ha estado financiado por la beca RECAVA-FIS y la beca Grupos 04/042 de la Generalitat Valenciana.
Correspondencia: Dr. V. Bodí.
Servicio de Cardiología. Hospital Clínic i Universitari.
Avda. Blasco Ibáñez, 17. 46010 Valencia. España.
Correo electrónico: vicentbodi@hotmail.com
Recibido el 14 de octubre de 2005.
Aceptado para su publicación el 23 de marzo de 2006.