Desde la publicación de la guía de la Sociedad Europea de Cardiología (ESC) de 2015 sobre el tratamiento de la endocarditis se han publicado nuevos datos importantes que exigen la actualización de las recomendaciones, que se resumen en la guía actual de la ESC 20231,2. En este artículo, preparado por un grupo de expertos propuestos por el Comité de Guías de la Sociedad Española de Cardiología, se destacan las novedades más importantes, las consecuencias de su aplicación en nuestro entorno y las lagunas en los datos para mejorar el ejercicio de la medicina a nivel local.
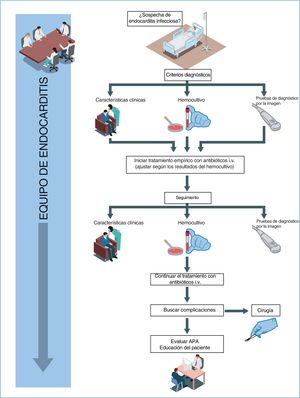
¿QUÉ NOVEDADES INCLUYE LA GUÍA?La guía refuerza la importancia del «equipo de endocarditis» y actualiza las dos mismas recomendaciones previas a IB: la necesidad de tratamiento de las endocarditis infecciosas (EI) complicadas en un centro especializado con un equipo de endocarditis y con instalaciones quirúrgicas adyacentes, y la necesidad de un contacto inicial y regular con dicho centro en los casos de EI no complicada (figura 1).
Este apartado es uno de los aspectos más novedosos de esta guía, comparado con la guía de 2015. La guía ESC 2023, aunque reconoce la ausencia de datos, ha ampliado sus recomendaciones y ha asumido la gravedad de la enfermedad y la muy baja incidencia de reacciones adversas graves después de la administración de una única dosis de antibiótico. En resumen, los cambios principales son los siguientes:
- •
Clase de recomendación reforzada de IIa a I en pacientes con alto riesgo de EI a quienes va a hacerse una intervención bucodental (nivel de evidencia B en el caso de EI previa y nivel de evidencia C en personas que llevan prótesis valvulares, como prótesis con catéter, y con cardiopatía congénita compleja).
- •
Se añadió la indicación IIaC para los pacientes tratados con reparación de la válvula mitral o tricúspide con catéter, IC para pacientes con dispositivos de asistencia ventricular y IIbC para pacientes que han recibido trasplante cardiaco a quienes hay que realizar una intervención dental con un alto riesgo de EI.
- •
Reintroducción de la posibilidad de profilaxis sistémica con antibióticos en intervenciones invasivas del aparato respiratorio, gastrointestinal o genitourinario, del aparato locomotor y la piel, con una clase de recomendación baja (IIbC).
- •
Se desaconseja administrar clindamicina a los pacientes alérgicos a betalactámicos, por el mayor riesgo de sufrir infecciones por Clostridium difficile, y se sustituye por macrólidos o doxiciclina.
- •
Se recomienda la administración perioperatoria de antibióticos profilácticos en cualquier implante de prótesis valvular (IB), de dispositivos electrónicos (IA) y de oclusores o injertos (IB). El antibiótico recomendado es la cefazolina (1g i.v.) en los implantes de dispositivos electrónicos y amoxicilina/ácido clavulánico (2g) o ampicilina (3g) en el implante de prótesis con catéter.
El diagnóstico de EI se basa en la sospecha clínica y se confirma con datos microbiológicos y técnicas de diagnóstico por la imagen. La ecocardiografía transtorácica (ETT) y la ecocardiografía transesofágica (ETE) constituyen las técnicas de diagnóstico por la imagen principales, pero en la actualidad se recomienda claramente un enfoque de diagnóstico multimodal. La ETE presenta una recomendación de clase I, incluso en casos con ETT positiva, excepto en la EI aislada de la válvula nativa derecha con una exploración con ETT de buena calidad y resultados inequívocos. Debería contemplarse la realización de una ecocardiografía no solo en pacientes con S. aureus sino también en aquellos con E. faecalis y en alguna bacteriemia causada por Streptoccocus spp (clase IIa). En relación con el seguimiento, actualmente se recomienda la ETE cuando el paciente se encuentra estable y antes de pasar de un tratamiento intravenoso a uno con antibióticos orales (clase I). Las recomendaciones sobre la importancia de otras pruebas diagnósticas, como la tomografía computarizada (TC), la resonancia magnética (RM) y las pruebas diagnósticas de medicina nuclear, se han descrito y actualizado con mayor claridad en presencia de prótesis valvulares o dispositivos de electroestimulación cardiaca (DEC). La guía destaca su importancia en el diagnóstico de la EI y la detección de complicaciones cardiacas, lesiones a distancia y fuentes de bacteriemia. Concretamente, se recomienda la angiografía por TC en los pacientes con endocarditis «posible» de la válvula nativa para detectar lesiones valvulares y confirmar el diagnóstico, y la [18F]FDG-PET/TC o angiografía por TC en los casos de endocarditis «posible» de la prótesis valvular (EPV) para detectar lesiones valvulares y confirmar el diagnóstico3. También se recomiendan técnicas de neuroimagen y de todo el cuerpo (TC, [18F]FDG-PET/TC o RM) en pacientes con síntomas que indiquen complicaciones embólicas para detectar lesiones periféricas o añadir criterios diagnósticos menores (clase IB) y pueden realizarse en pacientes asintomáticos para el cribado de lesiones periféricas (clase IIb). Se incluyen nuevos algoritmos para el diagnóstico de la EI relacionada con la válvula nativa, con la prótesis valvular y con los DEC.
Se han introducido modificaciones en los criterios diagnósticos. Respecto a los principales criterios, se ha simplificado la presencia de imágenes positivas en la EI, incluida cualquier lesión anatómica y metabólica valvular, perivalvular/periprotésica y de material extraño característica de la EI detectada mediante ecocardiografía, TC, [18F]FDG-PET/TC/angiografía por TC o SPECT/TC de leucocitos. La captación protésica o periprotésica anómala detectada mediante [18F]FDG-PET/TC o SPECT/TC de leucocitos debería considerarse un criterio principal de EPV, independientemente del tiempo transcurrido desde la intervención quirúrgica. E. faecalis se ha incluido entre los organismos característicos. Entre los criterios secundarios se incluyen la diseminación vascular embólica e, incluso, lesiones asintomáticas detectadas solo mediante técnicas de diagnóstico por la imagen.
Tratamiento antibióticoEl comité de expertos reconoce que los datos son insuficientes para establecer que, en la EI, cualquier tratamiento con antibióticos sea superior a otro4. Aunque hay consenso sobre el tratamiento antibiótico de la EI protésica causada por estreptococos y Enterococcus faecalis, se desconoce cuál es el mejor tratamiento de la EI protésica causada por estafilococos, sobre todo si está causada por cepas resistentes a meticilina. Se hace una advertencia sobre las posibles interacciones y efectos secundarios relacionados con los fármacos utilizados habitualmente (rifampicina, gentamicina), así como los «nuevos» fármacos (daptomicina, fosfomicina). No solo la cloxacilina, como en la guía anterior, sino también la cefazolina se consideran fármacos de primera elección en el tratamiento de la endocarditis estafilocócica causada por cepas sensibles a meticilina. La inocuidad y eficacia del tratamiento con antibióticos orales o parenteral ambulatorio han cambiado el paradigma del tratamiento antibiótico en los pacientes con EI estables5. Así pues, el tratamiento se divide en dos periodos: una fase inicial (fase preliminar crucial), en la cual hay que garantizar el control de la infección y la estabilización del paciente, y una segunda fase (fase de continuación), en la cual el objetivo es finalizar la toma de antibióticos, si es posible, por vía oral y a domicilio.
CirugíaComo en la guía anterior, la nueva guía centra la atención en los tres motivos principales que justifican la indicación de una intervención quirúrgica inmediata en el contexto de una EI: insuficiencia cardiaca, infección no controlada y prevención de la embolia séptica. Se propone una nueva clasificación de las definiciones de momento adecuado de la intervención quirúrgica. El grupo de trabajo ha definido intervención quirúrgica emergente (en cuestión de horas; <24horas independientemente de la duración preoperatoria del tratamiento antibiótico), intervención quirúrgica urgente (en cuestión de días; de 3-5 días) e intervención quirúrgica no urgente (durante el ingreso hospitalario). El número de días de espera para una intervención quirúrgica urgente se ha reducido (pasa de menos de 7 días a 3-5 días) y se destaca que debería evitarse el retraso innecesario una vez que se establece la indicación de intervención quirúrgica urgente, con una implicación clínica importante, en particular en los centros no especializados.
No hay diferencias en las indicaciones de intervención quirúrgica en pacientes con insuficiencia cardiaca, la principal indicación para una intervención quirúrgica urgente (en días u horas) en la EI. En el apartado sobre infección no controlada, se han introducido pocos cambios. La tabla de recomendaciones indica de manera específica que la dehiscencia protésica y el nuevo bloqueo auriculoventricular son indicaciones para una intervención quirúrgica urgente (en cuestión de días u horas). Además, debería contemplarse una intervención quirúrgica urgente en la EI con hemocultivos positivos >1 semana y control adecuado de los focos metastásicos. En este sentido, es suficiente demostrar hemocultivos positivos 2 o 3 días después de iniciar el tratamiento antibiótico correcto para esta recomendación6.
La guía propone un uso más libre de la intervención quirúrgica para prevenir las embolias. Se ha actualizado una recomendación de intervención quirúrgica urgente en la EI con vegetación ≥10mm y otras indicaciones de intervención quirúrgica a clase I. Además, puede contemplarse la intervención quirúrgica urgente en la EI aórtica o mitral con vegetación ≥10mm y sin disfunción valvular grave, o sin datos clínicos de embolia y bajo riesgo quirúrgico (clase IIb). El análisis de las vegetaciones y las características clínicas por parte del equipo de endocarditis es esencial para el tratamiento clínico y la decisión temprana y óptima de la intervención quirúrgica: una caracterización más profunda de los rasgos distintivos de las imágenes de las vegetaciones (tamaño, forma, patrones de movimiento, etc.) ayudaría a discriminar entre las lesiones peligrosas que podrían terminar en un episodio de embolia y las vegetaciones de bajo riesgo7. Por último, la guía indica la necesidad de una evaluación adecuada del riesgo quirúrgico con diferentes escalas de riesgo diseñadas específicamente para el contexto de la EI.
Después de un ictus, en pacientes con indicación quirúrgica bien fundamentada, se recomienda el tratamiento quirúrgico (clase IB) sin demora (siempre que no exista lesión neurológica grave, coma o hemorragia intracraneal). En los pacientes estables con hemorragia intracraneal continúa recomendándose la demora de la intervención (>1 mes) con repetición de la evaluación de la estabilidad clínica y de las imágenes. En pacientes con rasgos inestables que llevarían a la necesidad de realizar la intervención antes para permitir la supervivencia, la guía incluye la posibilidad de proceder con la intervención siempre que el pronóstico neurológico característico sea favorable (IIaC). En cuanto a la EI derecha, la guía actualiza las indicaciones para la intervención quirúrgica (reparación antes que sustitución de la prótesis): disfunción derecha debida a insuficiencia tricuspídea grave sin refractariedad diurética (clase IB), vegetaciones residuales >20mm tras embolia pulmonar (clase IC), afectación simultánea del lado izquierdo (clase IC) y vegetaciones persistentes con insuficiencia respiratoria grave tras embolia pulmonar (clase IB). Por último, la guía proporciona información sobre la elección de la prótesis valvular en la sustitución de la válvula aórtica o mitral, con un uso libre del material bioprotésico de sustitución a medida que aumenta la complejidad de la enfermedad.
Complicaciones y situaciones específicasEn la guía se describen otras complicaciones de la EI y su tratamiento clínico. Las complicaciones neurológicas de la EI se relacionan con un exceso de morbilidad y con mortalidad, y el diagnóstico rápido de EI y el inicio inmediato del tratamiento antibiótico son fundamentales para la prevención. En los aneurismas cerebrales infecciosos con una indicación de tratamiento intervencionista, debería proponerse el tratamiento endovascular. Debería contemplarse el implante de un marcapasos epicárdico en pacientes a quienes hay que intervenir quirúrgicamente a causa de una EI en presencia de uno de los siguientes factores pronóstico de bloqueo auriculoventricular persistente: alteraciones en la conducción previas a la intervención (prolongación de los intervalos PR y QRS), infección causada por S. aureus, absceso de la raíz aórtica, afectación de la válvula tricúspide o intervención quirúrgica valvular previa. La guía proporciona criterios precisos para diagnosticar y tratar la EI relacionada con los DEC, en cuyo caso puede contemplarse la realización de una [18F]FDG-PET/TC/angiografía por TC para confirmar el diagnóstico. Se recomienda la extracción completa del dispositivo sin demora en pacientes con EI relacionada con DEC confirmada en tratamiento antibiótico empírico inicial. En todos los casos, deben seguirse las medidas de prevención general en los pacientes que llevan DEC. Por último, si hay manifestaciones osteomusculares, se recomienda utilizar técnicas de diagnóstico por la imagen (RM o PET/TC) en los pacientes en quienes se sospecha espondilodiscitis y osteomielitis vertebral que compliquen la EI.
Alta y seguimientoTras el alta hospitalaria, para detectar la aparición de posibles complicaciones, se diferencian dos periodos de seguimiento: el primer año después de la EI y el pronóstico a largo plazo. El riesgo de recidiva (que incluye recaídas y reinfecciones) ha aumentado y oscila entre el 2 y el 9%. La misma descripción y tratamiento se mantienen para el término «recaída» y «reinfección», y, como novedad, un algoritmo diferencia estas dos situaciones clínicas. Entre las nuevas recomendaciones para el seguimiento se incluyen el apoyo psicosocial al paciente y a la familia, la detección de ansiedad y depresión, la remisión a tratamiento psicológico, si es necesario, el tratamiento a la adicción en las personas adictas a fármacos intravenosos y la rehabilitación cardiaca en los pacientes estables por lo menos dos semanas después de la intervención quirúrgica de una EI izquierda. La educación sanitaria para pacientes y cuidadores continúa siendo esencial durante este periodo.
CONSECUENCIAS DE LA APLICACIÓN DE LA GUÍA EN NUESTRO ÁMBITOEn relación con la prevención de la EI, la principal consecuencia de su aplicación será un aumento de la profilaxis antibiótica y su extensión a las situaciones de riesgo intermedio y a intervenciones distintas a las bucodentales. En los pocos estudios llevados a cabo en España sobre el seguimiento de la guía previa ya se indicó una «sobreindicación» de la profilaxis en estos nuevos casos aceptados8,9, por lo que la nueva guía se acercaría más a la realidad de nuestro ámbito.
La ecocardiografía es ampliamente accesible; no obstante, se prevé un uso más amplio de la ETE ya que ahora es una modalidad diagnóstica clave no solo para el diagnóstico sino también antes de pasar al tratamiento oral. Esto es aún más complicado en el contexto de las modalidades de diagnóstico por la imagen más nuevas que ahora se recomiendan de forma convincente, aunque quizá no son accesibles en todos los centros, lo cual puede traducirse en la necesidad de un diagnóstico/tratamiento en centros específicos. El número de estudios y, por tanto, su coste asociado aumentarán por las nuevas recomendaciones.
La diversidad de opciones en el tratamiento antibiótico de la EI protésica causada por estafilococos puede llevar a cierta confusión. Sin embargo, esta diversidad permite a cada centro adaptar el protocolo a su contexto y disponibilidad de fármacos. Se espera que la administración preferente de cefazolina reduzca el riesgo de nefritis y flebitis intersticial asociadas a la administración de cloxacilina. Facilitar el alta inmediata una vez resuelta la infección tiene ventajas notables para el paciente en cuanto a calidad de vida y menor riesgo de complicaciones. No obstante, esto requiere un procedimiento diagnóstico y terapéutico ágil en el centro especializado, una infraestructura adecuada para el seguimiento en casa y mucha coordinación entre los distintos departamentos del hospital y atención primaria.
Teniendo en cuenta que la mayoría de los pacientes que requieren una intervención quirúrgica durante la fase activa encajan en la categoría de intervención quirúrgica urgente (en cuestión de días), el cambio en la definición de momento adecuado llevará de inmediato a realizar la intervención antes. La mayor parte de los departamentos de cirugía cardiovascular han impuesto limitaciones a las plazas quirúrgicas diarias y a las camas de las unidades de cuidados intensivos. Es necesario evaluar si la adopción de la recomendación de esta nueva guía será posible mediante una mayor flexibilidad en la programación quirúrgica y una mayor financiación de los recursos locales. La necesidad de que los hospitales especializados puedan responder de manera oportuna a los casos de EI recuerda, en cierto modo, a las dificultades previas a las cuales había que hacer frente a la hora de mejorar el tiempo transcurrido entre el momento en que una persona que hubiera sufrido un infarto de miocardio llegaba al servicio de urgencias de un hospital y la realización de la intervención coronaria percutánea en la arteria responsable para el tratamiento del infarto agudo de miocardio. La indicación más libre para una intervención quirúrgica para prevenir embolias se basa en unos pocos estudios no aleatorizados y en datos poco fundamentados, por lo que debería evaluarse formalmente antes de incluirla en la práctica diaria.
En pacientes que han sufrido un ictus recientemente, hay que sopesar el riesgo de empeoramiento neurológico perioperatorio con el de retrasar la intervención quirúrgica cardiaca. Aunque hay pocas pruebas, las nuevas recomendaciones son el reflejo de una mayor libertad para realizar antes la intervención quirúrgica tras un ictus isquémico. El tratamiento perioperatorio de los pacientes que han sufrido un ictus es un esfuerzo complicado que requiere un equipo quirúrgico de expertos. El tratamiento preoperatorio y posoperatorio personalizado de estos pacientes influirá mucho en la posibilidad de implementar la realización de una intervención quirúrgica precoz. Los resultados satisfactorios que corroboran las ambiciosas recomendaciones actuales habitualmente proceden de centros excelentes10. La decisión de implementar un tratamiento quirúrgico de inmediato tras un ictus en entornos con menos experiencia tiene que adaptarse a nivel local ya que la evidencia en este contexto continúa siendo escasa.
Se recomienda la extracción completa del dispositivo sin demora en pacientes con EI relacionada con DEC confirmada en tratamiento antibiótico empírico inicial. Se prefiere la extracción percutánea a la quirúrgica, aunque requiere herramientas especializadas y debería hacerse en centros con experiencia en esta técnica y con soporte quirúrgico in situ, por el riesgo de taponamiento y desgarro venoso potencialmente mortales. Para cumplir estas recomendaciones, se recomiendan centros especializados.
En nuestro ámbito, es difícil implementar la recomendación de programas de rehabilitación cardiaca por la disponibilidad insuficiente de estas unidades y por la variabilidad territorial.
LAGUNAS EXISTENTESLa guía aborda casi todas las situaciones y casi todos los pacientes con riesgo de EI, por lo que ofrece recomendaciones muy completas. En general, la principal laguna es la falta de datos bien fundamentados en casi todas las situaciones, lo cual se refleja en una mayoría de nivel de evidencia C. No está claro si la ecocardiografía debería realizarse de manera sistemática en pacientes con septicemia o si hay estrategias que permitan identificar a los pacientes con un mayor riesgo de EI. ¿Las escalas de puntuación intentan superar estas dudas? La ausencia de la necesidad de un intervalo de tiempo después de la intervención quirúrgica para realizar la PET/TC será probablemente objeto de más estudios en los próximos años. En la guía actual, continúa habiendo falta de datos para recomendar el mejor tratamiento (el más eficaz y menos tóxico) de la EI protésica causada por estafilococos. Se requieren más datos reales sobre el tratamiento oral para corroborar las recomendaciones actuales. Los datos que corroboran la realización de una intervención quirúrgica inmediata tras el ictus se limitan a los estudios observacionales. Así pues, a pesar de la recomendación actualizada de intervención quirúrgica inmediata tras el ictus, es necesario analizar el impacto de esta implementación. No hay recomendaciones para los nuevos dispositivos, ni comentarios sobre cómo tratar los casos de sospecha de EI en los marcapasos sin cables o si los pacientes que llevan un desfibrilador subcutáneo requieren un tratamiento especial. La mortalidad hospitalaria de los pacientes con EI se ha mantenido elevada y sin cambios a lo largo de las dos últimas décadas, aunque la identificación de nuevos marcadores de alto riesgo puede ofrecer la oportunidad de cambiar el curso de la enfermedad. Se han creado varias escalas de puntuación del riesgo quirúrgico, pero en la práctica clínica sistemática no se utiliza ninguna. Es necesario crear escalas de puntuación quirúrgica prospectivas con mejor precisión, en particular para ayudar a determinar la futilidad del tratamiento quirúrgico en los pacientes de alto riesgo.
CONCLUSIONESEn la nueva guía sobre el tratamiento de la endocarditis se actualizan nuevos datos sobre la profilaxis, el diagnóstico, el tratamiento clínico y el quirúrgico. Se ofrecen recomendaciones prácticas y algoritmos que ayudan a los médicos a tomar decisiones simples en la práctica clínica diaria. La guía también destaca la necesidad de un enfoque multidisciplinario y la función clave del equipo de endocarditis en la evaluación de los pacientes de alto riesgo y la toma de decisiones.
FINANCIACIÓNNinguna.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizaron herramientas de inteligencia artificial para la preparación de este artículo.
CONFLICTO DE INTERESESLos documentos de declaración de conflicto de intereses de todos los autores se pueden consultar en el material adicional.
Grupo de Trabajo de la SEC para la guía ESC 2023 sobre el tratamiento de la endocarditis: David Vivas (coordinador), Alberto San Román (coordinador), Manuel Anguita, Nuria Fernández-Hidalgo, Ignacio Fernández-Lozano, Carlos González-Juanatey, Ariana González, Marta Parellada, Eduard Quintana.
Comité de Guías de la SEC: José Luis Ferreiro (presidente), Pablo Avanzas (secretario), Rut Andrea, Araceli Boraita, David Calvo, Raquel Campuzano, Victoria Delgado, Laura Dos Subirá, Juan José Gómez Doblas, María Antonia Martínez Momblan, Pilar Mazón, Domingo Pascual Figal, Juan Sanchis, José María de la Torre Hernández, David Vivas.
Véase artículo relacionado: https://secardiologia.es/cientifico/guias-clinicas/miscelanea/14533-2023-esc-guidelines-for-the-management-of-endocarditis
Los nombres de todos los autores del artículo figuran por orden alfabético en el Anexo A.
* Autor para correspondencia.
Correo electrónico:dvivas@secardiologia.es.