A pesar de la eficacia de los anticoagulantes orales (ACO), algunos pacientes mantienen una alto riesgo residual y presentan ictus aun estando en tratamiento con ACO, y falta evidencia sobre el tratamiento de estos pacientes. El objetivo del estudio es analizar la seguridad y la eficacia del cierre percutáneo de la orejuela izquierda (OI) como prevención secundaria para pacientes con fibrilación auricular no valvular que han experimentado un ictus/accidente isquémico transitorio a pesar de los ACO (ictus resistente [IR]).
MétodosSe estudió a 1.047 pacientes consecutivos con fibrilación auricular no valvular sometidos a cierre percutáneo de la OI incluidos en el registro multicéntrico Amplatzer Cardiac Plug. Se seleccionó a los pacientes con IR como indicación para el cierre de la OI, y se los comparó con pacientes con otras indicaciones.
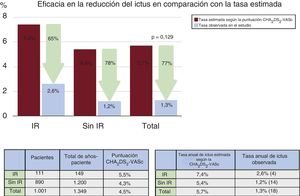
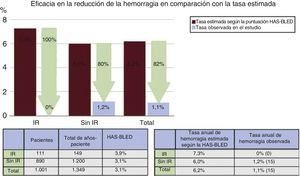
ResultadosEn un total de 115 pacientes (11%) se produjo un IR. Las escalas CHA2DS2-VASc y HAS-BLED eran significativamente más altas en el grupo de IR (5,5±1,5 frente a 4,3±1,6; p <0,001 y 3,9±1,3 frente a 3,1±1,2; p <0,001). No hubo diferencias significativas en los eventos mayores de seguridad periprocedimiento (el 7,8 frente al 4,5%; p=0,1). Tras 16,2±12,2 meses de seguimiento medio, la tasa anual de ictus/accidente isquémico transitorio observada fue del 2,6% (el 65% de reducción del riesgo) y la tasa anual de hemorragia mayor observada fue del 0% (el 100% de reducción del riesgo) en los pacientes con IR.
ConclusionesLos pacientes con IR sometidos a cierre percutáneo de la OI presentaron resultados de seguridad similares que los pacientes sin IR, con una reducción significativa de los eventos de ictus/accidente isquémico transitorio y hemorragia mayor durante el seguimiento.
Palabras clave
El cierre de la orejuela izquierda (COI) mediante una técnica percutánea es una alternativa de tratamiento para la prevención del ictus en los pacientes con fibrilación auricular no valvular1–3. La tasa anual de ictus isquémico es de aproximadamente un 5% en los pacientes con fibrilación auricular no valvular no tratados4. Este riesgo se reduce de manera significativa usando antagonistas de la vitamina K (AVK), en hasta un 64% en comparación con placebo5, y el tratamiento de anticoagulantes orales no antagonistas de la vitamina K (NACO) se asocia con menores riesgos de ictus y de embolia sistémica (19%), en comparación con el uso de AVK6. A pesar de la eficacia del tratamiento de anticoagulación oral (ACO), algunos pacientes siguen presentando un riesgo residual elevado y sufren un ictus durante el tratamiento con ACO (a lo que denominaremos en adelante «ictus resistente» [IR]). Para los pacientes con IR a pesar de un tratamiento adecuado con AVK, una vez descartadas otras posibles causas, la guía vigente propone aumentar el valor de la razón internacional normalizada (INR) establecido como objetivo a 2,5-3,5 en los pacientes tratados con AVK o cambiar el tratamiento de AVK a NACO2. Sin embargo, la evidencia existente no basta para decidir el tratamiento de los pacientes que han sufrido un ictus durante el tratamiento con NACO. Así pues, los pacientes que sufren un ictus durante el tratamiento con un AVK y tienen el INR entre 2,5 y 3,5 podrían ser candidatos adecuados para un COI percutáneo; los que tengan una contraindicación para el cambio de tratamiento a un NACO (p. ej., a causa de una insuficiencia renal avanzada) o los que sufren un ictus a pesar del tratamiento con un NACO. Sin embargo, hasta el momento no se ha analizado el COI en este grupo específico de pacientes.
El objetivo del presente estudio es investigar la seguridad y los resultados a largo plazo de la intervención en pacientes con fibrilación auricular no valvular a los que se realizó un COI percutáneo por haber sufrido un ictus a pesar del tratamiento con ACO.
MÉTODOSEstudio retrospectivo, realizado en 22 centros entre diciembre de 2008 y noviembre de 2013, que incluyó a 1.047 pacientes consecutivos con fibrilación auricular no valvular a los que se practicó un COI con un Amplatzer Cardiac Plug (ACP, Abbott; Plymouth, Minnesota, Estados Unidos) y que fueron incluidos en el registro multicéntrico de Amplatzer Cardiac Plug1. Para los fines de este estudio, se identificó a los pacientes con un ictus previo durante el tratamiento como indicación para el COI, y se los comparó con los tratados por otras indicaciones. El éxito de la intervención se definió como el implante satisfactorio del Amplatzer Cardiac Plug en la orejuela izquierda. Los eventos adversos periintervención (aparecidos entre 0 y 7 días después de la intervención o antes del alta hospitalaria, lo que sucediera más tarde) se basaron en los criterios VARC7: muerte, infarto de miocardio, ictus, accidente isquémico transitorio (AIT), embolia sistémica, embolia gaseosa, embolización del dispositivo, taponamiento cardiaco y hemorragia mayor. Los eventos adversos aparecidos durante el seguimiento (excluidos los eventos adversos periintervención) fueron muerte (por cualquier causa, cardiovascular o no), ictus, AIT, embolia sistémica y hemorragia mayor. Se registró la medicación antitrombótica utilizada en la fecha de ingreso y en la última visita de seguimiento. Se individualizó el tipo de tratamiento antitrombótico y su duración según los antecedentes del paciente, la indicación para el COI y la preferencia del médico. Se evaluó la eficacia del dispositivo para prevenir el ictus, el AIT y la embolia sistémica comparando la tasa de eventos real en el seguimiento con la tasa de eventos predicha según la puntuación CHA2DS2-VASc8,9. De igual modo, la reducción de la hemorragia se evaluó comparando los eventos de hemorragia mayor reales con la tasa predicha según la puntuación HAS-BLED10.
Análisis estadísticoLas variables continuas se presentan en forma de media ± desviación estándar y las variables discretas, mediante frecuencia y porcentaje. Las variables continuas se evaluaron con la prueba de la t de Student para muestras independientes y las variables discretas, con la prueba de la χ2. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. Todos los análisis estadísticos se realizaron con el programa SPSS 22.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
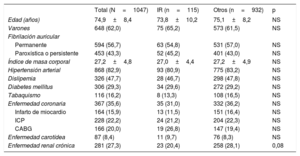
RESULTADOSSe identificó a un total de 115 pacientes (11%) con ictus durante el tratamiento con ACO (grupo de IR). Las características de los pacientes en situación basal y las características de la intervención se muestran en la tabla 1 y la tabla 2. Los pacientes con un IR no presentaban diferencias estadísticamente significativas respecto a los del grupo de otras indicaciones por lo que respecta a las características iniciales o de la intervención.
Características basales de los pacientes
| Total (N=1047) | IR (n=115) | Otros (n=932) | p | |
|---|---|---|---|---|
| Edad (años) | 74,9±8,4 | 73,8±10,2 | 75,1±8,2 | NS |
| Varones | 648 (62,0) | 75 (65,2) | 573 (61,5) | NS |
| Fibrilación auricular | ||||
| Permanente | 594 (56,7) | 63 (54,8) | 531 (57,0) | NS |
| Paroxística o persistente | 453 (43,3) | 52 (45,2) | 401 (43,0) | NS |
| Índice de masa corporal | 27,2±4,8 | 27,0±4,4 | 27,2±4,9 | NS |
| Hipertensión arterial | 868 (82,9) | 93 (80,9) | 775 (83,2) | NS |
| Dislipemia | 326 (47,7) | 28 (46,7) | 298 (47,8) | NS |
| Diabetes mellitus | 306 (29,3) | 34 (29,6) | 272 (29,2) | NS |
| Tabaquismo | 116 (16,2) | 8 (13,3) | 108 (16,5) | NS |
| Enfermedad coronaria | 367 (35,6) | 35 (31,0) | 332 (36,2) | NS |
| Infarto de miocardio | 164 (15,9) | 13 (11,5) | 151 (16,4) | NS |
| ICP | 228 (22,2) | 24 (21,2) | 204 (22,3) | NS |
| CABG | 166 (20,0) | 19 (26,8) | 147 (19,4) | NS |
| Enfermedad carotídea | 87 (8,4) | 11 (9,7) | 76 (8,3) | NS |
| Enfermedad renal crónica | 281 (27,3) | 23 (20,4) | 258 (28,1) | 0,08 |
CABG: cirugía de revascularización aortocoronaria; ICP: intervención coronaria percutánea; IR: ictus resistente.
Los valores expresan media ± desviación estándar o n (%).
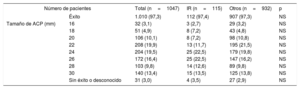
Características de la intervención
| Número de pacientes | Total (n=1047) | IR (n=115) | Otros (n=932) | p | |
|---|---|---|---|---|---|
| Éxito | 1.010 (97,3) | 112 (97,4) | 907 (97,3) | NS | |
| Tamaño de ACP (mm) | 16 | 32 (3,1) | 3 (2,7) | 29 (3,2) | NS |
| 18 | 51 (4,9) | 8 (7,2) | 43 (4,8) | NS | |
| 20 | 106 (10,1) | 8 (7,2) | 98 (10,8) | NS | |
| 22 | 208 (19,9) | 13 (11,7) | 195 (21,5) | NS | |
| 24 | 204 (19,5) | 25 (22,5) | 179 (19,8) | NS | |
| 26 | 172 (16,4) | 25 (22,5) | 147 (16,2) | NS | |
| 28 | 103 (9,8) | 14 (12,6) | 89 (9,8) | NS | |
| 30 | 140 (13,4) | 15 (13,5) | 125 (13,8) | NS | |
| Sin éxito o desconocido | 31 (3,0) | 4 (3,5) | 27 (2,9) | NS | |
ACP: Amplatzer Cardiac Plug; IR: ictus resistente.
Las variables se presentan como n (%).
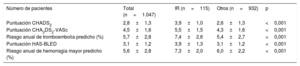
La media de la puntuación CHA2DS2-VASc fue significativamente superior en los pacientes con IR (5,5±1,5 frente a 4,3±1,6; p <0,001), la media de la puntuación HAS-BLED fue también mayor en el grupo de IR (3,9±1,3 frente a 3,1±1,2; p <0,001). El riesgo anual de tromboembolia estimado según la puntuación CHA2DS2-VASc fue mayor en el grupo de IR (7,4±2,6 frente a 5,4±2,7; p < 0,001), y el riesgo anual de hemorragia mayor estimado según la puntuación HAS-BLED fue asimismo superior en los pacientes con IR (7,3±2,0 frente a 6,0±2,2; p < 0,001) (tabla 3).
Puntuaciones de riesgo y riesgo anual predicho de tromboembolia y hemorragia mayor
| Número de pacientes | Total (n=1.047) | IR (n=115) | Otros (n=932) | p |
|---|---|---|---|---|
| Puntuación CHADS2 | 2,8±1,3 | 3,9±1,0 | 2,6±1,3 | <0,001 |
| Puntuación CHA2DS2-VASc | 4,5±1,6 | 5,5±1,5 | 4,3±1,6 | <0,001 |
| Riesgo anual de tromboembolia predicho (%) | 5,7±2,8 | 7,4±2,6 | 5,4±2,7 | <0,001 |
| Puntuación HAS-BLED | 3,1±1,2 | 3,9±1,3 | 3,1±1,2 | <0,001 |
| Riesgo anual de hemorragia mayor predicho (%) | 5,6±2,8 | 7,3±2,0 | 6,0±2,2 | <0,001 |
IR: ictus resistente.
Los valores expresan media ± desviación estándar.
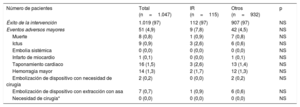
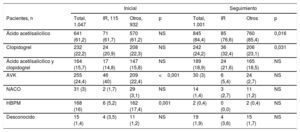
La intervención tuvo éxito en 1.019 pacientes (97,3%) de la cohorte total, sin que hubiera diferencias significativas entre los 2 grupos (tabla 4). No se observaron diferencias significativas en cuanto a los eventos mayores de la seguridad periintervención entre los 2 grupos (el 7,8 frente al 4,5%; p = 0,1). Se observaron diferencias no significativas entre los 2 grupos en la medicación antitrombótica en la situación basal y en el último seguimiento (tabla 5).
Éxito de la intervención y eventos adversos mayores
| Número de pacientes | Total (n=1.047) | IR (n=115) | Otros (n=932) | p |
|---|---|---|---|---|
| Éxito de la intervención | 1.019 (97) | 112 (97) | 907 (97) | NS |
| Eventos adversos mayores | 51 (4,9) | 9 (7,8) | 42 (4,5) | NS |
| Muerte | 8 (0,8) | 1 (0,9) | 7 (0,8) | NS |
| Ictus | 9 (0,9) | 3 (2,6) | 6 (0,6) | NS |
| Embolia sistémica | 0 (0,0) | 0 (0,0) | 0 (0,0) | NS |
| Infarto de miocardio | 1 (0,1) | 0 (0,0) | 1 (0,1) | NS |
| Taponamiento cardiaco | 16 (1,5) | 3 (2,6) | 13 (1,4) | NS |
| Hemorragia mayor | 14 (1,3) | 2 (1,7) | 12 (1,3) | NS |
| Embolización de dispositivo con necesidad de cirugía | 2 (0,2) | 0 (0,0) | 2 (0,2) | NS |
| Embolización de dispositivo con extracción con asa | 7 (0,7) | 1 (0,9) | 6 (0,6) | NS |
| Necesidad de cirugía* | 0 (0,0) | 0 (0,0) | 0 (0,0) | NS |
IR, ictus resistente.
Los valores expresan n (%).
Medicación antitrombótica en la situación inicial y en el seguimiento
| Inicial | Seguimiento | |||||||
|---|---|---|---|---|---|---|---|---|
| Pacientes, n | Total, 1.047 | IR, 115 | Otros, 932 | p | Total, 1.001 | IR | Otros | p |
| Ácido acetilsalicílico | 641 (61,2) | 71 (61,7) | 570 (61,2) | NS | 845 (84,4) | 85 (76,6) | 760 (85,4) | 0,016 |
| Clopidogrel | 232 (22,2) | 24 (20,9) | 208 (22,3) | NS | 242 (24,2) | 36 (32,4) | 206 (23,1) | 0,031 |
| Ácido acetilsalicílico y clopidogrel | 164 (15,7) | 17 (14,8) | 147 (15,8) | NS | 189 (18,9) | 24 (21,6) | 165 (18,5) | NS |
| AVK | 255 (24,4) | 46 (40) | 209 (22,4) | <0,001 | 30 (3) | 6 (5,4) | 24 (2,7) | NS |
| NACO | 31 (3) | 2 (1,7) | 29 (3,1) | NS | 14 (1,4) | 3 (2,7) | 11 (1,2) | NS |
| HBPM | 168 (16) | 6 (5,2) | 162 (17,4) | 0,001 | 2 (0,4) | 0 (0,0) | 2 (0,4) | NS |
| Desconocido | 15 (1,4) | 4 (3,5) | 11 (1,2) | NS | 19 (1,9) | 4 (3,6) | 15 (1,7) | NS |
AVK: antagonistas de la vitamina K; HBPM: heparina de bajo peso molecular; IR: ictus resistente; NACO: anticoagulantes orales no antagonistas de la vitamina K.
Los valores se presentan como n (%).
La media de duración del seguimiento clínico fue de 16,2±12,2 meses, con un total de 1.349 años-paciente, y se completó en 1.001 de los 1.019 pacientes con éxito del implante (98,2%). En total, 561 pacientes completaron como mínimo 1 año de seguimiento. La tasa anual observada de ictus o AIT en el seguimiento del grupo de IR fue del 2,6% (reducción relativa de la tromboembolia del 65% según la puntuación CHA2DS2-VASc) mientras que fue del 1,2% en los pacientes sin IR (reducción relativa del 78% según la puntuación CHA2DS2-VASc) (figura 1). La tasa anual observada de hemorragia mayor en el seguimiento del grupo de IR fue del 0% (reducción relativa del 100% según la puntuación HAS-BLED), mientras que en los pacientes sin IR fue del 1,2% (reducción relativa del 79%) (figura 2). Se dispuso de una ecocardiografía transesofágica en el seguimiento de 632 de los 1.001 pacientes (63%) con éxito del implante (grupo de IR, 78 de 111 pacientes [70%], y grupo control, 554 de 890 pacientes [62%]; p = 0,099). La exploración se realizó tras una mediana de 7 [intervalo intercuartílico, 3-11] meses después de realizado el COI. No hubo diferencias significativas entre grupos en las tasas de trombosis del dispositivo y de fugas peridispositivo (trombosis del dispositivo en los pacientes con IR frente a los del grupo de control, el 5,2 frente al 4,4%; p = 0,754; y fugas peridispositivo en los pacientes con IR frente a los del grupo de control, el 12,8 frente al 11,4%; p = 0,708).
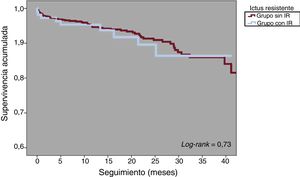
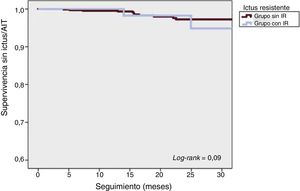
La mortalidad por cualquier causa a 1 año fue del 4,3% en la población total (figura 3). Se registró un total de 63 muertes durante el seguimiento, 8 (7,2%) en el grupo de IR y 55 (6,2%) en el grupo sin IR (p = 0,67). Hubo 8 muertes periintervención (1 en el grupo de IR [0,9%] y 7 [0,8] en el grupo sin IR; p = 0,89) y no se registró ninguna relacionada con el dispositivo. Hubo 18 ictus o AIT durante el seguimiento, 4 (3,6%) en el grupo de IR y 14 (1,6%) en el grupo sin IR (p = 0,12). En la figura 4 se muestran las curvas de Kaplan-Meier de la supervivencia acumulada sin ictus ni AIT.
En este estudio se evalúa el papel del COI en los pacientes con fibrilación auricular no valvular que habían sufrido un ictus a pesar del tratamiento de ACO. Los resultados más importantes del estudio pueden resumirse así: a) la tasa de éxito del COI percutáneo fue elevada, superior al 97%, y el COI fue seguro en los pacientes con IR. La tasa de complicaciones fue similar a la descrita en otros estudios y a la del grupo sin IR; b) el COI percutáneo fue eficaz para reducir los ictus en los 2 grupos de pacientes (con IR y sin IR); c) aunque los pacientes con IR presentaron también un mayor riesgo de hemorragia, no hubo episodios hemorrágicos significativos en el seguimiento, lo cual es de destacar en esta cohorte de pacientes, y d) la supervivencia total y la supervivencia sin ictus fueron similares en ambos grupos, con IR y sin IR.
Los AVK tienen importantes limitaciones respecto a su uso en la práctica clínica11. Son necesarias visitas de seguimiento regulares para mantener el INR dentro del margen terapéutico estricto, aunque se consigue solo en un 60-70% de los casos según lo indicado por estudios previos12, con lo que lleva a un elevado número de pacientes en niveles subterapéuticos y, por consiguiente, con un aumento del riesgo de ictus13. Además, los AVK pueden causar complicaciones, principalmente de tipo hemorrágico. A este respecto, los NACO aportan algunas ventajas no solo porque mejoran la prevención del ictus cardioembólico, sino también porque reducen los eventos hemorrágicos. En varios estudios del tratamiento con NACO se ha observado una reducción de los eventos tromboembólicos de alrededor de un 20% respecto a lo observado con el tratamiento con warfarina6. En estos estudios, alrededor de un 20% de los pacientes ya habían tenido un ictus o un AIT, lo cual está correlacionado con la mayor edad, que es el más importante factor de riesgo de ictus en los pacientes con fibrilación auricular. Se ha observado que el tratamiento con NACO como prevención secundaria es no inferior al de warfarina en el subgrupo de pacientes con un ictus o un AIT previos. A pesar del tratamiento con NACO, estos pacientes presentan una tasa residual de ictus o embolia sistémica de entre 2,0 y 2,8 cada 100 años-paciente de seguimiento, lo cual es superior a lo observado en los pacientes sin antecedentes de ictus o AIT14–16. En consecuencia, en este grupo de pacientes con un riesgo residual de ictus elevado a pesar del tratamiento con ACO, el COI puede desempeñar un papel prometedor para reducir el riesgo de eventos tromboembólicos2.
El tratamiento de los pacientes con IR constituye un verdadero reto, ya que, como se ha evidenciado en este estudio, se caracterizan por un riesgo tromboembólico elevado según la puntuación CHA2DS2-VASc, así como por un riesgo hemorrágico según la puntuación HAS-BLED. En este estudio, el COI se asoció con una reducción de la tasa de ictus al comparar la tasa observada con la esperada según la puntuación CHA2DS2-VASc y a una reducción de los eventos hemorrágicos en el seguimiento. La reducción del ictus o el AIT en el seguimiento en comparación con la incidencia esperada según la puntuación CHA2DS2-VASc (65%) fue coherente con lo indicado por estudios previos1,17–20. La reducción de los episodios hemorrágicos tras el COI fue notable, puesto que no hubo ningún episodio de hemorragia mayor durante el seguimiento en el grupo de IR. Dado el bajo número de eventos, esto podría corresponder a un sesgo estadístico, si bien, tal como se ha observado en estudios previos, el COI redujo las hemorragias más allá del periodo periintervención inmediato, y sobre todo tras la suspensión del tratamiento antiagregante plaquetario o anticoagulante adyuvante utilizado21. Cabe especular con la posibilidad de que, cuando la indicación para el COI no es una contraindicación para el tratamiento con ACO, como ocurre en el grupo de IR, los eventos hemorrágicos tras el COI sean realmente bajos. En cambio, en el grupo sin IR la indicación para el COI en muchos pacientes era la contraindicación del uso de ACO (a causa de una hemorragia previa), por lo que las tasas de hemorragia son superiores, con independencia de la pauta de tratamiento farmacológico empleada tras el COI. Al decidir la estrategia para la prevención del ictus, es necesario tener en cuenta el efecto favorable del COI en la reducción de los eventos hemorrágicos a largo plazo, sobre todo si la indicación para el COI no es la presencia de una contraindicación para la ACO ni una hemorragia previa. Por otra parte, la puntuación HAS-BLED se elaboró para predecir el riesgo de hemorragia en los pacientes tratados con ACO. Sería razonable considerar que esta puntuación es adecuada para predecir los episodios hemorrágicos en los pacientes que presentan alguna resistencia a los anticoagulantes orales, como son los pacientes con un IR.
En los pacientes que sufrieron un ictus a pesar del tratamiento de ACO, es necesario investigar la causa del ictus. La causa más frecuente es una INR inferior al rango terapéutico, pero tal como se ha descrito en estudios previos, es frecuente que los pacientes tengan otras posibles etiologías adicionales para el ictus22–24. En nuestro estudio, resaltamos la heterogeneidad del tratamiento inicial de los pacientes con IR y el bajo uso de NACO (relacionado probablemente con la inclusión en el estudio entre los años 2008 y 2013).
Teniendo en cuenta la eficacia del COI para reducir el ictus y la hemorragia, así como el bajo riesgo de eventos adversos periintervención, creemos que el COI debe tenerse en cuenta en la prevención secundaria del ictus en los pacientes con IR.
LimitacionesEl presente estudio tiene varias limitaciones que es preciso reconocer. Se trata de un subanálisis del registro Amplatzer Cardiac Plug, que fue un estudio observacional, retrospectivo, no aleatorizado y sin un grupo de comparación. El carácter retrospectivo del estudio es una limitación importante que puede conducir a una subestimación de las tasas de eventos, sobre todo durante el seguimiento. Es importante señalar que, si se dispusiese de un grupo de control tratado con ACO tras el IR, este proporcionaría una referencia mejor respecto a las tasas de eventos isquémicos y hemorrágicos que las estimadas con las puntuaciones CHA2DS2-VASc y HAS-BLED. Otra limitación importante del estudio es que, a pesar de la reducción significativa del RR de ictus en los pacientes con IR, estos pacientes presentan un riesgo absoluto de ictus superior al de los pacientes sin IR. Aunque el estudio no se diseñó para este fin, después del COI, la reducción del RR de ictus parece ser más importante en los pacientes sin IR que en los que tienen un IR.
No se dispone de datos sobre las posibles causas del ictus a pesar de la anticoagulación (p. ej., INR fuera del intervalo pretendido, trombo auricular izquierdo a pesar de la anticoagulación, trombos sobre una válvula cardiaca artificial, cortocircuito derecha-izquierda) ni sobre los valores de la INR si el paciente había sido tratado con AVK. Por lo que respecta al tratamiento antitrombótico en la situación inicial, no se dispone de datos sobre el tipo de anticoagulante, sino tan solo de si se trataba de AVK, NACO o heparina de bajo peso molecular. No se dispone de datos de ecocardiografía transesofágica previos a la intervención ni de un seguimiento con esta exploración en todos los pacientes.
CONCLUSIONESLos pacientes con un IR previo y una indicación para el COI percutáneo presentaron unos resultados de la intervención similares a los de los pacientes sin IR. Según los resultados de este estudio, el COI podría utilizarse de manera segura en este grupo de pacientes que tienen un riesgo elevado de sufrir eventos tromboembólicos y hemorrágicos. En este estudio, los pacientes con IR presentaron una reducción significativa del ictus y el AIT, sin que hubiera eventos hemorrágicos graves durante el periodo de seguimiento, a pesar del elevado riesgo hemorrágico general. Son necesarios ensayos controlados con una potencia estadística suficiente para investigar con mayor detalle el uso del COI en pacientes que sufren un ictus a pesar del tratamiento con ACO. A este respecto, sería fundamental disponer de datos sobre la eficacia comparada del COI frente a los NACO.
CONFLICTO DE INTERESESI. Cruz-González, X. Freixa, S. Gaafoor, H. Omran, S. Berti, G. Santoro, J. Nielsen-Kudsk, U. Landmesser, A. Aminian, M. Costa y R. Ibrahim son consultores y proctors de Abbott. A. Tzikas, H. Sievert, P. Kanagaratnam, W. Schillinger, B. Meier y J.W. Park son consultores, proctors y han recibido subvenciones de investigación de Abbott. I. Cruz-González y M. Costa son proctors y consultores de Boston Scientific. I. Cruz-González es proctor de Lifetech. S. Berti es proctor de Edwards Lifesciences. F. Nietlispach es consultor de Abbott, Edwards Lifesciences y Medtronic. Los demás autores no tienen conflictos de intereses que declarar.
- –
El COI es una alternativa al tratamiento con ACO para la prevención del ictus en los pacientes con fibrilación auricular no valvular.
- –
No ha habido análisis previos del papel del COI como prevención secundaria en los pacientes que han sufrido un ictus a pesar del tratamiento con ACO (IR).
- –
En este estudio, el COI de los pacientes con IR tuvo una tasa de éxito de la intervención del 97,0% y una tasa de eventos adversos mayores periintervención del 4,5%, sin que se observaran diferencias significativas respecto al grupo sin IR.
- –
En los pacientes con IR, el COI proporcionó un resultado favorable con una reducción del riesgo anual de ictus o AIT del 65% y una reducción del riesgo anual de eventos hemorrágicos mayores del 100% durante el seguimiento.
- –
Son necesarios ensayos controlados con una potencia estadística suficiente para investigar con mayor detalle el uso del COI en pacientes que sufren un ictus, con una comparación apropiada de la estrategia de tratamiento clásica frente a una estrategia que agregase el COI.