Palabras clave
El tratamiento antitrombótico durante el embarazo es indispensable para la prevención de complicaciones tromboembólicas en pacientes con ciertas cardiopatías. Las prótesis valvulares cardíacas constituyen la indicación más frecuente. El tratamiento es también necesario en pacientes con lesiones valvulares y fibrilación auricular. El riesgo de fenómenos tromboembólicos es mayor debido al estado de hipercoagulabilidad presente durante el embarazo, que se caracteriza por la elevación de las concentraciones de ciertos factores de coagulación, de fibrinógeno y por un aumento de la adhesividad plaquetaria1.
EMBARAZO EN PACIENTES CON PRÓTESIS VALVULARES
Existe consenso general en que, cuando esto sea posible, las lesiones valvulares deben ser tratadas con un procedimiento reconstructivo en vez de recurrir al reemplazo valvular en sujetos jóvenes, especialmente en mujeres que deseen quedar embarazadas en el futuro. Sin embargo, el reemplazo valvular es con frecuencia necesario en la enfermedad grave de la válvula mitral o de la aórtica. La selección de prótesis es difícil porque el embarazo en estas mujeres representa serios problemas que dependen del tipo de válvula empleada.
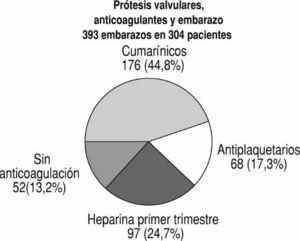
En el Instituto Nacional de Cardiología Ignacio Chávez hemos tenido la oportunidad de estudiar 393 casos de embarazos en 304 pacientes portadoras de prótesis valvulares2-5 (fig. 1). Puesto que estas enfermas han sido estudiadas a lo largo de las últimas 3 décadas, el tipo de prótesis que se implantó, así como el tratamiento empleado, han variado considerablemente. La prótesis que se utilizó en cada caso corresponde a la que estaba en uso en el momento de la intervención quirúrgica. Las pacientes no fueron asignadas a protocolos específicos de tratamiento anticoagulante, sino que fueron tratadas como se consideró que era lo más adecuado en su tiempo. A medida que se reunió la información, el tratamiento fue cambiando. Así, cada grupo representa a pacientes tratadas de modo concurrente, que fueron estudiadas prospectivamente. Se observaron 281 embarazos en pacientes con prótesis mecánicas (236 mitrales, 46 aórticas, 3 tricuspídeas) y 112 en mujeres con prótesis biológicas (104 mitrales, 9 aórticas, una tricuspídea). Seis de las pacientes tenían 2 prótesis (tabla 1).
Fig. 1. Tratamiento antitrombótico empleado en 393 embarazos en 304 pacientes. Un total de 52 embarazos ocurrieron en pacientes con prótesis biológicas que estaban en ritmo sinusal y no requirieron anticoagulación (sin anticoag.). Hep. 1er trim.: heparina durante el primer trimestre.
Bajo estricta vigilancia y tratamiento médico adecuado, la gran mayoría de las mujeres con válvulas artificiales pueden tolerar con normalidad la sobrecarga hemodinámica del embarazo. Si se excluyen las situaciones catastróficas originadas por disfunción protésica aguda, sólo 7 de 393 (1,9%) pacientes presentaron insuficiencia cardíaca. Las 7 pacientes respondieron de manera adecuada al tratamiento y pudieron llevar su embarazo a término.
El embarazo en pacientes portadoras de prótesis valvulares representa un serio problema. Las pacientes con prótesis mecánicas requieren tratamiento anticoagulante a largo plazo para prevenir complicaciones tromboembólicas. La omisión del tratamiento anticoagulante durante el embarazo aumenta de manera considerable el riesgo de trombosis protésica y de embolia sistémica. En un intento de prevenir las serias complicaciones que el tratamiento con cumarínicos representa para el feto, en los primeros años del estudio, 68 pacientes con prótesis mecánicas fueron tratadas con dipiridamol y aspirina2. Hubo 3 casos de trombosis masiva fatal que ocurrió en una prótesis de bola mitral o aórtica y una incidencia de un 25% de embolias cerebrales. La valoración inicial de estos datos demostró que los agentes antiplaquetarios no proporcionan protección contra los fenómenos tromboembólicos en pacientes embarazadas con prótesis mecánicas, por lo que este modo de tratamiento practicado en el Instituto fue abandonado desde 1975.
COMPLICACIONES FETALES DEL TRATAMIENTO ANTICOAGULANTE
En pacientes con prótesis mecánicas, los derivados cumarínicos proporcionan protección adecuada contra los fenómenos tromboembólicos. Sin embargo, estos agentes cruzan la barrera placentaria y su uso por la madre resulta en un aumento en la mortalidad y morbilidad fetal. La heparina puede ser un método alternativo de anticoagulación puesto que tiene un alto peso molecular y no cruza la barrera placentaria. En un trabajo pionero, Hall et al6 revisaron los casos publicados hasta 1978, en los cuales se había administrado tratamiento con derivados cumarínicos o con heparina durante el embarazo. En aproximadamente la tercera parte de los casos revisados se observó un resultado fetal adverso. Concluyeron que el uso de cualquier tipo de anticoagulante se asocia con riesgos fetales importantes.
El tratamiento con derivados cumarínicos durante el embarazo induce una frecuencia elevada de aborto espontáneo de aproximadamente 24,3%7. En mujeres tratadas de esta forma en nuestra serie, la frecuencia de aborto espontáneo fue de 26,7% (47 de 176). En la segunda parte del embarazo, el tratamiento con cumarínicos se asocia también con un aumento en la incidencia de pérdidas fetales. En nuestros estudios, la frecuencia de mortinatos fue del 5,1% (9 de 176).
La exposición del feto a los agentes cumarínicos durante el primer trimestre puede inducir una embriopatía cuyas características son telecantus, hipoplasia de la nariz, atrofia de los huesos nasales, depresión del puente de la nariz, alas nasales hipoplásicas, estenosis de las coanas con obstrucción de las vías aéreas superiores y displasia punctata de las epífisis de los huesos largos. En estudios previos de este Instituto2,3 se buscaron los efectos teratogénicos en los productos de las madres que habían recibido tratamiento anticoagulante. Un total de 108 niños fueron estudiados por el genetista. Se encontró que los efectos teratogénicos de los agentes cumarínicos se pueden prevenir si estos fármacos se discontinúan desde antes de la sexta semana hasta el fin de la duodécima semana de la gestación3. De este modo, no hubo casos de embriopatía en los 35 embarazos en los cuales las madre había sido tratada con heparina durante este período. La forma típica de embriopatía se encontró en 3 de 73 (4,1%) niños que habían estado expuestos a los cumarínicos intraútero entre la sexta y la decimosegunda semanas del embarazo. Un grupo adicional de niños (10 de 73; 13,7%) tuvo discretas anormalidades, como ligera hipoplasia de los huesos nasales, lo que probablemente representa ejemplos menos pronunciados del síndrome. Sareli et al8 y de Born et al9 han encontraron una incidencia de embriopatía de 5,9% (2 de 34) y 10,0% (3 de 30), respectivamente, en los niños nacidos de madres que habían sido tratadas con cumarínicos durante todo el embarazo. En la tabla 2 se expone la frecuencia de complicaciones fetales en mujeres tratadas con cumarínicos durante el embarazo que se han descrito en algunos estudios recientes.
Algunos estudios indican que pueden ocurrir anormalidades del sistema nervioso central en los niños nacidos de madres tratadas con cumarínicos durante cualquiera de los trimestres6,14. En la revisión de Hall et al6,11 de los 418 niños (2,6%) que estuvieron expuestos a los derivados cumarínicos durante el embarazo, presentaron anormalidades del sistema nervioso central o de los ojos como microcefalia, hidrocefalia, displasía de la línea media dorsal caracterizada por agenesia del cuerpo calloso, malformación de Dandy-Walker, atrofia cerebelosa en la línea media, atrofia óptica y retraso mental de moderado a importante. Sin embargo, en nuestros estudios, estas complicaciones parecerían ser poco comunes y ninguno de los 73 niños expuestos intraútero a cumarínicos presentó estas anomalías neurológicas2-4. Del mismo modo, en los estudios de Chen et al15 y Chong et al16 no hubo casos de atrofia óptica, microcefalia o retardo mental en los niños nacidos de madres que recibieron cumarínicos durante el embarazo.
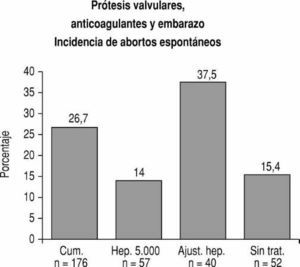
Para evitar la alta frecuencia de abortos espontáneos y el riesgo de efectos teratogénicos cuando el feto es expuesto a los cumarínicos se ha propuesto sustituir estos agentes por heparina durante el embarazo en vez de los anticoagulantes orales en pacientes con prótesis mecánicas17-24. La heparina tiene un alto peso molecular y no cruza la barrera placentaria. Algunos investigadores administran la heparina durante todo el embarazo15,17,24,25, mientras que otros indican su uso en el primer trimestre y las últimas 2 semanas de la gestación20,21,23,24. Ginsberg et al17 describieron una incidencia baja de abortos espontáneos (3 de 34 o 8,8%) en pacientes a los que se administró heparina subcutánea para la prevención o para el tratamiento de tromboembolia venosa durante las primeras 20 semanas del embarazo. En una revisión de la bibliografía, Ginsberg y Hirsh14 concluyeron que cuando se excluyen los embarazos asociados con situaciones maternas de comorbidad que pueden afectar de modo independiente al producto, la frecuencia de aborto en las madres tratadas con heparina fue similar a la que se encuentra en una población normal. En nuestro estudio3, cuando se usó una dosis pequeña de heparina no fraccionada subcutánea (5.000 U cada 12 h) en el primer trimestre, la incidencia de abortos espontáneos fue de 8,7% (2 de 23), que es la frecuencia habitual de abortos para una población de mujeres normales. En un estudio posterior, la dosis de heparina no fraccionada, administrada durante el primer trimestre por vía subcutánea, se ajustó para llevar el tiempo de tromboplastina parcial activado (TTPA) de 1,5 a 2,5 veces el control4. La frecuencia de abortos espontáneos fue 37,5% (15 de 40), que es comparable a la que se observa en madres tratadas con cumarínicos en el mismo período (fig. 2). Debe señalarse que todas las pacientes habían concebido cuando recibían cumarínicos y habían sido tratadas con estos agentes durante las 6 semanas anteriores a la iniciación de la terapia con heparina. Es probable que esta elevada frecuencia de abortos también pudiera explicarse por la hemorragia placentaria que puede ocurrir durante el tratamiento anticoagulante efectivo, ya sea con cumarínicos o con heparina. Meschengieser et al11 estudiaron 92 embarazos en 59 pacientes. La frecuencia de pérdidas fetales fue similar en las mujeres expuestas a anticoagulantes orales en el primer trimestre (13 de 61; 21,3%) en comparación con aquellas que recibieron heparina subcutánea ajustada para prolongar el TTPA ajustado al doble del control (6 de 31; 19%). No hubo casos de embriopatía en los 45 niños cuyas madres habían recibido acenocumarina en el primer trimestre. En una revisión de la bibliografía, Chan et al7 encontraron 1.234 embarazos en 976 mujeres con prótesis valvulares publicados hasta 1997. La frecuencia de abortos espontáneos fue de 24,7% (196 de 792) cuando se usaron cumarínicos durante todo el embarazo y prácticamente idéntica (24,8%; 57 de 230) cuando se utilizó heparina en el primer trimestre. En este estudio, la frecuencia de anomalías fetales congénitas en los niños expuestos a cumarínicos durante todo el embarazo fue 6,4% (35 de 549). No hubo casos de embriopatía cuando se empleó heparina desde antes de la sexta hasta después de la duodécima semana (0 de 108) en comparación con el 11,1% (4 de 36) si la heparina empezó a usarse después de la sexta semana.
Fig. 2. Las pacientes que no requirieron tratamiento anticoagulante durante el embarazo (Sin Trat.) o que recibieron minidosis de heparina no fraccionada subcutánea en el primer trimestre (Hep. 5.000 U cada 12 horas) tuvieron una incidencia baja de abortos espontáneos. En cambio, en las que recibieron cumarínicos durante todo el embarazo (Cum.) y en aquellas que fueron tratadas con dosis ajustadas de heparina subcutánea en el primer trimestre (Ajust. Hep) la frecuencia de abortos se elevó considerablemente.
Cotrufo et al26 y Vitale et al12 han sugerido que hay una dependencia estrecha entre las dosis de warfarina empleada y las complicaciones fetales (tabla 2). En 58 embarazos en pacientes con diferentes modelos de prótesis mecánicas, el tratamiento consistió en warfarina durante todo el embarazo en dosis suficientes para mantener un INR de 2,5 a 3,5. En las 33 pacientes que recibieron una dosis diaria de 5 mg o menos no se observaron casos de embriopatía, y hubo sólo un 12,1% (4 de 33) de abortos espontáneos. En contraste, se encontró una frecuencia del 8% de embriopatía cumarínica (2 de 25) y del 72% (18 de 25) de abortos en las enfermas que requerían una dosis diaria de warfarina de más de 5 mg. Estos investigadores sugieren que el feto expuesto a la warfarina reacciona de modo independiente a la madre y la reducción en morbimortalidad fetal se debe a que las dosis bajas de estos fármacos no producen hemorragias fetales. Estos datos parecen indicar que el riesgo fetal del uso de cumarínicos durante el embarazo puede ser menor en las pacientes con prótesis mecánicas que consiguen una anticoagulación adecuada con dosis de warfarina de 5 mg o menos. Se requieren más estudios para confirmar estos hallazgos. En efecto, Sadler et al25 encontraron recientemente que la dosis diaria baja de warfarina no condujo a un mejor resultado fetal. La frecuencia de pérdidas fetales fue exactamente igual en las pacientes que recibieron menos de 5 mg/día de warfarina (7 de 11) que en aquellas que recibieron una dosis mayor (7 de 11). No parece haber diferencia en los efectos fetales producidos por el uso de acenocumarina o de warfarina27, aun cuando la magnitud de las dosis terapéuticas no es necesariamente equiparable. En el estudio de Meschengieser et al11 la frecuencia de pérdidas fetales en las 10 mujeres expuestas a dosis de acenocumarina de 5 mg/día o más no fue estadísticamente diferente a la encontrada en las 35 pacientes que recibieron menos de 5 mg/día (30 frente a 23%).
Se han comunicado algunos casos de muerte neonatal por hemorragia intracraneana en niños cuyas madres recibieron cumarínicos hasta el término del embarazo2,8,9. El traumatismo del parto vaginal pude ser un factor principal en la producción de hemorragia intracraneana perinatal si el parto se presenta cuando la madre esta todavía bajo este tratamiento. La inmadurez relativa del sistema de coagulación del feto lo hace más sensible a las dosis habituales de cumarínicos28. Así, el feto puede permanecer anticoagulado durante 7-10 días después de la suspensión del tratamiento. Para disminuir el riesgo de hemorragia cerebral en el neonato, las pacientes deberían suspender el tratamiento con anticoagulantes orales y reemplazarlo con heparina intravenosa en las últimas 2 semanas de la gestación. La operación cesárea puede estar indicada para proteger al feto contra el peligro de la hemorragia cerebral asociada con el traumatismo del parto vaginal si el trabajo de parto comienza prematuramente mientras la madre se encuentra recibiendo cumarínicos.
COMPLICACIONES MATERNAS DEL TRATAMIENTO ANTICOAGULANTE
Para evitar los riesgos fetales derivados del uso de agentes cumarínicos se ha propuesto emplear heparina durante el embarazo. El uso prolongado de heparina puede inducir osteoporosis, que es generalmente asintomática, y trombocitopenia grave que, por fortuna, es rara28. En un estudio previo de nuestro Instituto3 el uso de dosis fijas de heparina no fraccionada, 5.000 unidades por vía subcutánea cada 12 h, administradas de la sexta a la decimosegunda semanas y en las últimas 2 semanas de la gestación, no fueron efectivas para evitar la trombosis protésica. Hubo 2 casos de trombosis masiva de una prótesis de disco en un grupo de 23 pacientes (8,7%) tratadas en esta forma. Otra enferma de este estudio, que fue tratada con acenocumarol las primeras 38 semanas de la gestación, también presentó trombosis de una prótesis de disco mientras estaba siendo tratada con estas dosis de heparina subcutánea en las últimas 2 semanas del embarazo. Del mismo modo, Wang et al21 y Thomas et al29 encontraron que este régimen no era eficaz para prevenir los fenómenos tromboembólicos en sus pacientes.
Se ha sugerido la posibilidad de que dosis ajustadas de heparina no fraccionada con control del TTPA pudiera ser más efectivo14,18,23,30. Lee et al18 ajustaron la dosis de heparina subcutánea, administrada cada 8 h, para prolongar el TTPA a 1,5 veces el valor control, durante el primer trimestre y las últimas semanas de la gestación en 18 embarazos observados en 16 pacientes. No hubo complicaciones tromboembólicas en los 9 embarazos que llegaron a término. En un estudio previo4 de nuestro Instituto se administraron dosis ajustadas de heparina no fraccionada a 40 pacientes desde antes de la sexta hasta el final de la duodécima segunda y en las últimas 2 semanas de la gestación. En los primeros 36 casos, la dosis fue aplicada cada 8 h y se ajustó para mantener el TTPA en 1,5-2,5 veces el control (8.000 U cada 8 h en promedio). En este régimen, una paciente presentó trombosis masiva fatal de una prótesis aórtica de Björk-Shiley. En un intento por evitar períodos sin efecto anticoagulante se acortó el intervalo entre las dosis de heparina subcutánea a 6 h y de nuevo se ajustó para mantener un TTPA de 1,5 a 2,5 veces el control (5.000 U cada 6 h en promedio). Desafortunadamente, otra paciente presentó también trombosis masiva de una prótesis mitral de Björk-Shiley. Se concluyó que las dosis empleadas no proporcionan protección adecuada contra los fenómenos tromboembólicos en mujeres embarazadas con prótesis mecánicas y su uso en el Instituto fue abandonado.
Se han comunicado varios casos de trombosis de válvulas mecánicas en pacientes embarazadas mientras recibían tratamiento anticoagulante con heparina10,13,21,25,29,31-34. Sbarouni y Oakley33 informaron el resultado de una encuesta retrospectiva de varios Centros Cardiológicos Europeos llevada a cabo por el Grupo de Trabajo de la Sociedad Europea de Cardiología. La información se obtuvo mediante cuestionarios. Hubo 13 casos de trombosis de una válvula protésica y 8 episodios embólicos mayores en 151 embarazos observados en 133 mujeres con válvulas mecánicas. Diez de las 13 mujeres que presentaron trombosis protésica y cinco de las 8 con embolias arteriales recibían heparina. En la revisión de Chan et al7 se encontró una incidencia de complicaciones tromboembólicas de 3,9% (31 de 778) en las pacientes que recibieron heparina en el primer trimestre. En varios estudios, el tratamiento con heparina no fraccionada ajustada aplicada por vía subcutánea durante todo el embarazo ha resultado en una incidencia catastrófica de complicaciones tromboembólicas maternas. De las 34 pacientes con válvulas mecánicas reunidas por Sbarouni y Oakley33 tratadas de esta manera, el 24% se complicaron con trombosis protésica y 12% con acontecimientos embólicos periféricos. En el estudio de Sadler et al13, la frecuencia de accidentes trombóticos en mujeres que recibieron durante todo el embarazo heparina subcutánea ajustada para llevar el TTPA a 2 veces el control fue del 29% (4 de 14). Finalmente, en su revisión de la bibliografía, Chan et al7 encontraron que las pacientes tratadas de este modo tuvieron una incidencia de trombosis protésica de 33,3% (7 de 21) y de muerte de 15% (3 de 20). Nuestros resultados, así como los de otros investigadores7,13,33, confirman que el uso prolongado de heparina subcutánea durante el embarazo en pacientes con prótesis mecánicas incrementa de manera considerable el riesgo de fenómenos tromboembólicos.
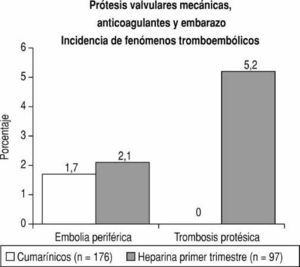
Fig. 3. En las 176 pacientes tratadas con cumarínicos durante todo el embarazo no hubo casos de trombosis protésica. En las pacientes que recibieron heparina no fraccionada subcutánea hubo 5 casos de trombosis aguda de la válvula (5,2%). La incidencia de embolias periféricas fue similar en ambos grupos.
Se ha sugerido que tanto las dosis de heparina como las concentraciones logradas de TTPA han sido insuficientes y que esto puede explicar la alta frecuencia de tromboembolia. Ginsberg y Barron30 han recomendado el uso de dosis más elevadas de heparina no fraccionada subcutánea, iniciando con 17.500 a 20.000 unidades cada 12 h, con ajuste de la dosis para obtener un TTPA por lo menos al doble del control. Este régimen se aplica entre la sexta y decimosegunda semanas y cerca del término, con administración de cumarínicos en los otros momentos. Sin embargo, estos regímenes con dosis mayores de heparina no han sido probados y, por consiguiente, no se dispone de datos para determinar si podrían reducir la frecuencia de complicaciones trombóticas durante el embarazo en pacientes con prótesis mecánicas.
En nuestros casos tratados con heparina, la trombosis protésica se presentó en válvulas de primera generación (Starr-Edwards, Björk-Shiley, etc.). Las nuevas generaciones de prótesis mecánicas parecen tener una probabilidad relativamente menor de tromboembolia35,36. La frecuencia de estas complicaciones durante el embarazo puede reducirse con el uso de estas válvulas, pero la información disponible a este respecto es escasa. En un estudio retrospectivo de varios centros en Francia, Hanania et al32 comunicaron recientemente 2 casos de trombosis protésica durante el embarazo en un grupo de 22 mujeres con prótesis de St. Jude Medical mientras eran tratadas con calciheparina. González-Santos et al31 también informaron de un caso de trombosis de una válvula de Medtrónic-Hall en una gestante que también recibía calciheparina. En el estudio de Lecuru et al34 hubo un caso (uno de 11) de trombosis de una prótesis de St. Jude Medical mientras la paciente recibía 15.000 U/día de heparina en el primer trimestre.
Las heparinas de bajo peso molecular tienen una vida media plasmática más prolongada, una mayor biodisponibilidad y el efecto anticoagulante es más confiable. Estos fármacos se han usado con excelente resultado para el tratamiento y la profilaxis de la trombosis venosa profunda durante el embarazo. Del mismo modo que la heparina no fraccionada, no cruzan la placenta y, al mismo tiempo, tienen una incidencia menor de osteosporosis, trombocitopenia y complicaciones hemorrágicas. Existe un gran interés en el uso de estos fármacos durante el embarazo en pacientes con prótesis mecánicas, pero la información es todavía demasiado escasa para permitir la recomendación de su uso en pacientes con prótesis valvulares28.
Las complicaciones tromboembólicas en el embarazo se previenen adecuadamente con el tratamiento con cumarínicos8,33,37. En nuestros estudios2,3,5, 176 pacientes recibieron acenocumarina desde el inicio hasta la trigésima octava semana del embarazo, porque éste se detectó después del primer trimestre o porque las pacientes no aceptaron el tratamiento con heparina. No hubo trombosis protésica y se presentaron sólo 3 casos (3 de 176; 1,7%) de embolia cerebral (fig. 3). Tampoco hubo accidentes tromboembólicos en 97 embarazos mientras las madres recibían cumarínicos en el segundo y tercer trimestre. Del mismo modo, no hubo fenómenos tromboembólicos en 20 pacientes tratadas con cumarínicos durante toda la gestación por Cotrufo et al26, ni en las 43 mujeres tratadas del mismo modo por Lecuru et al34 ni en las 33 pacientes con prótesis mitrales estudiadas por Sadler et al13. La mayor parte de estas pacientes llevaban prótesis mecánicas de primera generación. Sareli et al8 no encontraron estas complicaciones en 46 mujeres (39 con prótesis de St. Jude Medical y 7 con Medtronic-Hall) tratadas con cumarínicos durante todo el embarazo. Born et al9 informaron un 7,5% (3 de 40) de trombosis de válvulas mecánicas en gestantes tratadas con cumarínicos, pero dos de estos accidentes ocurrieron en pacientes en las que la anticoagulación no era adecuada. De la misma manera, dos de las 3 pacientes de Lee et al38 (3 de 47) que sufrieron accidentes tromboembólicos habían suspendido el tratamiento con warfarina. Con vigilancia rigurosa, por tanto, el riesgo de complicaciones tromboembólicas en pacientes con prótesis mecánicas que reciben tratamiento con cumarínicos durante el embarazo es probablemente igual al de la población general de mujeres con estas válvulas. Sin embargo, dos de las pacientes de Vitale et al12 tratadas con cumarínicos durante todo el embarazo tuvieron trombosis de una prótesis mecánica de disco en el segundo trimestre (2 de 58; 3,4%). Finalmente, en su revisión de la bibliografía, Chan et al7 encontraron un 3,9% (31 de 788) de complicaciones tromboembólicas en pacientes que recibieron cumarínicos durante todo el embarazo. En la tabla 3 se exponen las complicaciones tromboembólicas observadas durante el embarazo en pacientes con prótesis mecánicas en algunos estudios recientes.
PRÓTESIS BIOLÓGICAS Y EMBARAZO
Las prótesis biológicas son menos trombogénicas que las mecánicas y cuando el ritmo es sinusal, las pacientes podrían no requerir anticoagulantes. Se ha sugerido, por tanto, que a las mujeres en edad fértil que necesiten remplazo valvular se les debería ofrecer
una prótesis biológica en vez de las válvulas mecánicas39,40. Varios informes han indicado que cuando los cumarínicos o la heparina no son necesarios, no hay diferencia en la mortalidad fetal o materna en mujeres con prótesis biológicas cuando se compara con la de la población general33,39. En un estudio de nuestro Instituto, el 72,4% (42 de 58) de los embarazos terminaron en partos normales. En la encuesta publicada por Sbarouni y Oakley33, la mayor parte de las mujeres con bioprótesis no recibieron anticoagulantes y tuvieron embarazos normales. El resultado, en cuanto a los productos, fue excelente y los datos para el grupo no fueron diferentes de los que se observan en la población normal. En el estudio comunicado por Jamieson et al39 hubo un 74,5% (70 de 94) de partos normales con xenoprótesis porcinas. Se concluyó que hay un claro beneficio al no requerir anticoagulantes durante el embarazo. Sin embargo, esta ventaja con alguna frecuencia no existe, porque las pacientes con prótesis mitrales tienen una prevalencia alta de fibrilación auricular, lo que constituye una indicación para el tratamiento anticoagulante a largo plazo41. En las pacientes de nuestro estudio5 el 36,2% (21 de 58) presentaban este trastorno de ritmo y recibieron tratamiento anticoagulante. Como el riesgo trombogénico de las prótesis es menor que el de las prótesis mecánicas, es posible que la heparina no fraccionada a dosis ajustadas al TTPA administrada entre la sexta y la decimosegunda semanas del embarazo y 2 semanas antes del parto sea más segura que en los casos de pacientes con prótesis mecánicas.
Ha habido cierta preocupación de que las bioprótesis se deterioren más rápidamente durante el embarazo22,24,33,42. En el estudio de Jamieson et al39 se valoró la duración de las bioprótesis porcinas en 52 pacientes, que habían tenido 94 embarazos, estudiadas en cuatro distintas instituciones médicas. Cuando se comparó con un grupo control, el embarazo no influyó de modo significativo en la incidencia de disfunción estructural de las válvulas. En nuestro Instituto5 se investigó la incidencia de disfunción de las prótesis de pericardio bovino en 48 mujeres que tuvieron 58 embarazos y en un grupo control de 167 pacientes de la misma edad que no habían estado embarazadas desde la inserción de la prótesis. Se encontró que el embarazo no acelera el deterioro de estas bioprótesis. Sin embargo, sí hubo una correlación directa entre la ausencia de la disfunción protésica y la edad de la paciente en el momento de la intervención quirúrgica. La corta duración de las prótesis biológicas es una seria desventaja para las mujeres con valvulopatías que deseen quedar embarazadas. Las bioprótesis tienen todavía una duración más limitada en estas pacientes por su edad juvenil. El problema de qué prótesis colocar en estas mujeres jóvenes no está resuelto todavía y la controversia continúa sobre si deben ser prótesis mecánicas o biológicas. Una mayor duración de los nuevos modelos de prótesis biológicas posiblemente permita redefinir su indicación para las mujeres jóvenes con valvulopatías graves que deseen quedar embarazadas.
CONCLUSIONES
Por el momento no existe un tratamiento anticoagulante que esté libre de riesgo durante el embarazo y la conducta terapéutica debería basarse en una estimación de riesgo-beneficio para el binomio madre-producto43. Las pacientes deben ser informadas de los riesgos de los tratamientos a emplear44.
1. El riesgo de tromboembolia permanece alto aun con las prótesis de nueva generación. Los cumarínicos proporcionan protección adecuada contra esta complicación durante el embarazo y deben ser usadas en pacientes con prótesis mecánica hasta la trigésima octava semana de la gestación. Hay un riesgo de 4,1% de embriopatía cuando la gestante recibe un agente cumarínico desde la sexta hasta el final de la decimosegunda semana de embarazo.
2. El uso de heparina en el primer trimestre evita la embriopatía fetal pero expone a la paciente a un período de mayor riesgo de trombosis. Sin embargo, no parecería que hubiese ninguna ventaja en el uso de heparina a dosis ajustadas durante el primer trimestre para prevenir pérdidas fetales, ya que la incidencia de aborto espontáneo es similar a la observada cuando las madres son tratadas con cumarínicos. Por tanto, los riesgos maternos y la morbilidad neonatal deben ser las preocupaciones principales en estas pacientes. Las dosis de heparina subcutánea que se han empleado no constituyen una profilaxis eficaz contra la tromboembolia en estos casos. En pacientes que elijan evitar los posibles efectos fetales de los cumarínicos se ha propuesto el uso de heparina no fraccionada subcutánea en dosis altas (15.000-20.000 U cada 12 h), desde antes de la sexta hasta después de la décimasegunda semanas23,45, y ajustarla para prolongar el TTPA a más de 2 veces el control. Los cumarínicos se usan durante el segundo y el tercer trimestre. Sin embargo, estos regímenes no han sido probados.
3. Para evitar el parto de un producto anticoagulado se recomienda que la madre sea hospitalizada y se sustituya el cumarínico por heparina intravenosa en dosis completa, en las últimas 2 semanas del embarazo4,46,47. El uso de heparina puede evitarse practicando una cesárea electiva en la semana 3812,26. Debido al riesgo de hemorragia intracraneana perinatal en el neonato, la operación cesárea esta indicada si el trabajo de parto se desencadena mientras la madre todavía recibe cumarínicos. En estos casos, la anticoagulación se revierte rápidamente con vitamina K y con plasma fresco.
4. Cuando el tratamiento con anticoagulantes no es necesario, el embarazo en mujeres con bioprótesis cursa de modo similar a los que ocurren en la población general. Sin embargo, en pacientes con cardiopatía reumática la frecuencia de fibrilación auricular es elevada. Debido a la necesidad de tratamiento anticoagulante, las pacientes con este trastorno de ritmo presentan riesgos similares a los de las pacientes con prótesis mecánicas. Por otra parte, la corta duración de las prótesis biológicas es una importante desventaja para estas pacientes y su uso implica la necesidad de reoperación.