Palabras clave
INTRODUCCIÓN
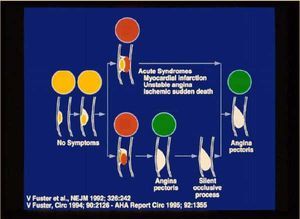
La resonancia magnética se está convirtiendo en una herramienta potente y versátil, no sólo para el diagnóstico de la aterosclerosis, sino también para el estudio de la evolución de la placa de ateroma y la identificación de la fase en la que se encuentra la lesión. Desde que en el año 1986 empezamos a observar la aparición de infartos de miocardio en pacientes con arterias que no estaban muy estenosadas, el concepto de la enfermedad aterosclerótica tuvo que ser revisado. En nuestra opinión, esta enfermedad debe ser enfocada como si se tratara de un tumor en crecimiento. En este sentido, es más importante hacer una biopsia para saber si es benigna o maligna que limitarnos a comprobar el grado de estenosis. Esta visión, que fue desarrollada en nuestro grupo a partir de numerosas observaciones clínicas que han dado lugar a diversas publicaciones, es la que dio origen a la clasificación de las lesiones ateroscleróticas por la American Heart Association. La aplicación de la resonancia magnética para el estudio del crecimiento de la placa de ateroma nos ha proporcionado una información muy valiosa sobre los mecanismos biológicos de las 4 lesiones fundamentales de las arterias coronarias: el inicio de la lesión, el desarrollo de la placa vulnerable, la formación de un trombo y la organización del trombo por tejido conectivo (fig. 1).
Fig. 1. Esquema de la progresión del daño aterosclerótico con los cuadros clínicos asociados a las distintas fases del desarrollo. Las fases 1 y 2 de la enfermedad aterosclerótica se corresponden con el inicio de la lesión ateromatosa y la formación de la placa vulnerable, y no producen síntomas clínicos. La evolución de la placa puede conducir a la formación de un trombo y su posterior ruptura, con la aparición de un síndrome coronario agudo (infarto de miocardio, angina inestable, muerte súbita) o a la organización del trombo por tejido conectivo y al desarrollo de angina de pecho, que puede desembocar en un proceso oclusivo silente (tomada de V. Fuster et al. N Engl J Med 1992; 326: 242 y V. Fuster.
LESIONES DE COMIENZO O DE REMODELAMIENTO (FASE 1)
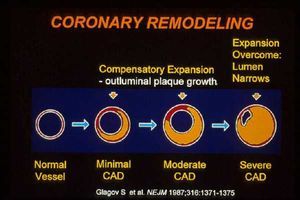
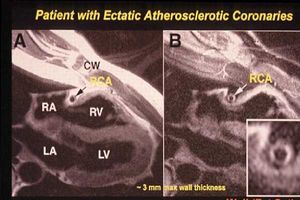
Como se había propuesto en el trabajo de Glagov et al en el año 1987, cuando comienza la enfermedad aterosclerótica se produce un crecimiento que avanza externamente dando lugar a un fenómeno de remodelado1. La acumulación de líquido que acompaña a este fenómeno es lo que determina el inicio de la estenosis, aunque puede no haber un grado importante de estenosis en el momento que existe una placa vulnerable (fig. 2). La resonancia magnética ha aportado evidencias al respecto, tanto en modelos experimentales como en humanos. En conejos con hiperlipidemia se ha podido documentar el desarrollo de la enfermedad aterosclerótica a partir de una dilatación de la arteria femoral2. En ratones transgénicos que sobreexpresan LDL también se ha comprobado el avance externo de la enfermedad sin que se modifique la luz del vaso, es decir, se produce un aumento del área patológica que no se acompaña de una disminución del área vascular3. También en humanos, el uso de la resonancia magnética en un gran número de pacientes con enfermedad coronaria ha permitido confirmar que la enfermedad comienza por un proceso de remodelado y no de estenosis, como habíamos descrito en los modelos experimentales4. En la figura 3 se observa una imagen que corresponde a un paciente con infarto de miocardio que presenta unas arterias completamente dilatadas. La resonancia magnética reveló que, contrariamente a lo que cabría esperar, no se produjo un trombo sobre una estenosis, sino por la aterosclerosis externa, que se encontraba en un estado muy avanzado. El remodelado de la arteria puede, por tanto, tener consecuencias clínicas importantes.
Fig. 2. El fenómeno de remodelado vascular se produce en las etapas más tempranas del desarrollo de la lesión aterosclerótica y se caracteriza por un aumento del grosor de la pared vascular que no se acompaña de una disminución de la luz del vaso. En las etapas más avanzadas, el enorme engrosamiento de la pared acaba por producir un estrechamiento de la luz vascular. Este fenómeno ha sido ampliamente documentado en modelos experimentales y en humanos (tomada de Glagov S et al. N Engl J Med 1987; 316: 1371-1375).
Fig. 3. Imagen obtenida por resonancia magnética del corazón de un paciente hospitalizado por un infarto agudo de miocardio en el que se aprecia una arteria dilatada con enfermedad aterosclerosa. En este paciente, las arterias habían comenzado el proceso aterosclerótico con un importante remodelado (luz vascular dilatada). El trombo, en este caso, no se produjo por estasia sino por el proceso ateromatoso que había progresado externamente. RA: aurícula derecha; LA: aurícula izquierda; RV: ventrículo derecho; LV: ventrículo izquierdo (tomada de Fayad ZA et al. Circulation 2000; 102: 506-510).
LESIONES VULNERABLES O DE ALTO RIESGO (FASE 2)
En el año 1995, trabajando en colaboración con el Dr. Toussaint y después de analizar numerosas autopsias de pacientes con enfermedad aterosclerótica, observamos la presencia de un tipo de placa vulnerable con un gran contenido de grasa. En estas placas existía una separación considerable entre la grasa y la luz vascular, y también entre la grasa y la parte externa de la arteria. En aquel momento conjeturamos que se podía tratar de placas de estabilización en pacientes que habían seguido un tratamiento con estatinas. Las imágenes obtenidas con resonancia magnética permitieron observar que la grasa estaba rodeada a ambos lados por tejido conectivo, lo que demostraba que el tejido conectivo se había formado con posterioridad, porque si no la grasa no hubiera podido atravesar esa barrera5,6.
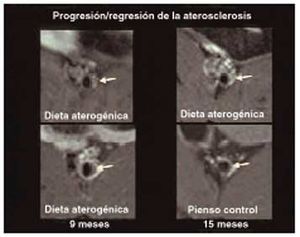
Fig. 4. Arteria femoral en un modelo experimental de conejos hiperlipidémicos, según imágenes obtenidas por resonancia magnética. En la parte izquierda se observa la progresión de la lesión ateromatosa desde que se inició la dieta rica en colesterol (panel superior) hasta los 9 meses de desarrollo de la enfermedad (panel inferior). Se puede apreciar claramente el incremento en el grosor de la pared arterial. En la parte derecha se aprecia la regresión de la enfermedad aterosclerótica desde que se inició una dieta baja en colesterol (panel superior) hasta los 15 meses de seguimiento. La dieta pobre en grasas produjo una normalización de las concentraciones sanguíneas de colesterol y, como se aprecia en la imagen, inició un importante proceso de regresión de la placa en estos animales (tomada de Worthley et al. J Am Coll Cardiol 2000; 35: 432A).
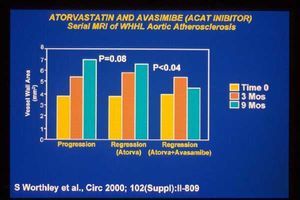
A partir de estas observaciones formulamos la hipótesis de la estabilización de una placa de ateroma por tejido conectivo. Hay evidencias experimentales de que existe un fenómeno de regresión de la placa ateromatosa en conejos hiperlipidémicos sometidos a una dieta baja en colesterol o a un tratamiento con estatinas. En el primer caso se ha descrito la estabilización de la placa de ateroma en conejos hiperlipidémicos que recibieron una dieta pobre en grasas, por un mecanismo asociado a la reducción de la actividad metaloproteinasa y a un aumento del contenido de colágeno7,8. Nosotros hemos observado también en conejos hiperlipidémicos con lesión en la arteria femoral que la sustitución de la dieta hipercolesterolémica por otra baja en colesterol después de 9 meses de progresión de la enfermedad es capaz de producir una regresión de la placa ateromatosa (fig. 4). Por otra parte, la combinación de una estatina (atorvastatina) y un inhibidor del ACAT (avasimibe) en un modelo experimental similar, no sólo detuvo la progresión de la enfermedad, sino que inició un proceso de regresión de la placa9. En la figura 5 se expone una secuencia de imágenes que permiten apreciar el fenómeno de regresión de la placa.
Fig. 5. Efecto del tratamiento combinado entre una estatina (atorvastatina) y un inhibidor del ACAT (avasimibe) sobre la progresión de la aterosclerosis aórtica en conejos hiperlipidémicos. La cuantificación del área de la pared vascular se hizo a partir de imágenes obtenidas por resonancia magnética. Se puede apreciar cómo a los 9 meses el tratamiento con atorvastatina disminuyó la progresión de la enfermedad, mientras que la combinación de atorvastatina con avasimibe no sólo detuvo la progresión, sino que produjo una disminución del área de la pared de la arteria estudiada (tomada de Worthley et al. Circ 2000; 102 [Supl]: 809).
Las lesiones de la arteria carótida en humanos presentan unas características específicas. La grasa se encuentra dispersa formando islas y las lesiones son muy fibrosas. No aparece una acumulación localizada como se observa en las arterias coronarias. Después de tratar con estatinas a pacientes a los que habíamos diagnosticado este tipo de lesiones, los resultados que hemos obtenido son muy prometedores. Se realizó una resonancia magnética de la arteria carótida afectada antes del tratamiento, a los 6 y a los 12 meses de tratamiento con estatinas. A los 6 meses no se modificó la placa, pero entre los 6 y los 12 meses de tratamiento se produjo una disminución de la estenosis de la arteria carótida y, lo que es más importante, una sustitución de la grasa por tejido conectivo10. Ésta es la primera vez que se documenta por un estudio progresivo de imagen la utilización de un fármaco capaz de modificar la composición de la placa ateromatosa.
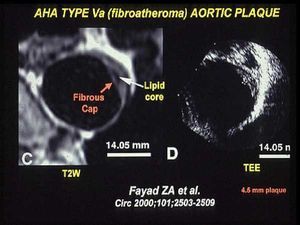
Sabemos que la aparición de lesiones en la aorta puede dar lugar a accidentes cerebrovasculares. Como se aprecia en la figura 6, las imágenes de la aorta que estamos obteniendo por resonancia magnética en pacientes permiten no sólo cuantificar el grado de lesión, sino también distinguir los componentes que constituyen la placa. ¿Qué ocurre si damos estatinas a pacientes con placas vulnerables identificadas en la aorta? Disponemos ya de los primeros resultados que se han obtenido en series reducidas de pacientes y que demuestran que a los 6 meses de tratamiento las estatinas comienzan a hacer su efecto en la pared vascular. La grasa disminuye progresivamente porque sale de la arteria y es sustituida por tejido conectivo, que la va rodeando10. El uso de la resonancia magnética ha permitido confirmar la hipótesis que formulamos en el año 1995 a partir de autopsias de pacientes en los que describimos la existencia de placas que se habían estabilizado por el tratamiento con estatinas.
Fig. 6. Placa ateromatosa de la aorta torácica, como se observa en una imagen obtenida por resonancia magnética, con una lesión de tipo Va según la clasificación de la American Heart Association. Este tipo de imágenes proporciona la suficiente resolución como para permitir la diferenciación de los distintos componentes de la placa. En este ejemplo concreto se aprecia el corazón lipídico del ateroma rodeado por una cápsula fibrosa (tomada de Fayad ZA et al. Circulation 2000; 101: 2503-2509).
El mecanismo por el que la placa vulnerable se rompe y se produce la formación de un trombo fue descrito por nosotros en los años 1995-199711-13. Las placas vulnerables contienen una gran cantidad de factor tisular generado por los macrófagos. Cuando una placa se rompe, el factor tisular entra en contacto con la sangre y promueve la formación de un trombo coronario. Nuestra hipótesis fue que las metaloproteinasas de los macrófagos de la arteria intervienen en la rotura de la placa y el factor tisular que liberan es responsable de la formación del trombo. Los últimos datos que hemos obtenido a partir de biopsias de placas de pacientes con síndrome coronario agudo demuestran que los macrófagos que se acumulan en la lesión aterosclerótica presentan una tasa muy alta de suicidio celular o apoptosis. La presencia de muerte celular apoptótica en macrófagos y células musculares lisas ha sido documentada por varios grupos y sus consecuencias en la rotura de la placa son objeto de estudio en diversos modelos experimentales14. La apoptosis se desarrolla como respuesta a una situación metabólica anómala de los macrófagos que se encuentran en la placa que, al tener el citoplasma lleno de grasa, no pueden desarrollar una función normal, lo que pone en marcha la maquinaria del suicidio celular. Al morir, los macrófagos liberan al espacio extracelular gran cantidad de factor tisular y metaloproteinasas. El control de la muerte celular en la placa puede modular la progresión del daño. Estamos entrando en un campo nuevo de la farmacología en el que se va a prevenir o revertir el proceso apoptótico como una estrategia terapéutica capaz de disminuir el avance de las lesiones ateromatosas. Los resultados más recientes de que disponemos han sido obtenidos en modelos experimentales transgénicos y sugieren que el mecanismo de apoptosis puede estar regulado por las HDL, de manera que el trasplante de arterias con una elevada tasa de apoptosis macrofágica a animales que tienen unas concentraciones elevadas de HDL es capaz de revertir el fenómeno de muerte celular15. Una vez más, el uso de la resonancia magnética nos ha permitido identificar el desarrollo de la muerte celular macrofágica como mecanismo de daño en la progresión de la placa.
La principal limitación con la que nos encontramos hoy día es la falta de disponibilidad de métodos que sean suficientemente sensibles y específicos para estudiar la evolución de la grasa de las arterias coronarias, ya sea en respuesta al tratamiento con estatinas o a la elevación de HDL. La información que tenemos procede de datos obtenidos por resonancia magnética de placas localizadas en las arterias carótidas y la aorta16. Los resultados en estos casos confirman que la elevación de las concentraciones de HDL es capaz de revertir el desarrollo de la enfermedad, como se había descrito para el tratamiento reductor de los valores de LDL.
ORGANIZACION DEL TROMBO (FASES 5 Y 6)
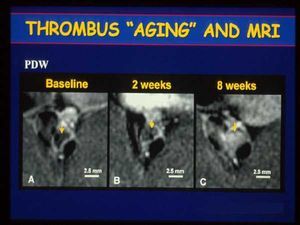
La última fase en la evolución de la lesión aterosclerótica consiste en la organización del trombo por tejido conectivo. Nuestro grupo está desarrollando el uso de la resonancia magnética para poder conocer la edad del trombo. Hemos obtenido resultados positivos utilizando dos modelos experimentales (conejo y porcino), que nos ha permitido hacer un seguimiento detallado de la formación de un trombo y su organización con tejido conectivo después de una angioplastia (fig. 7)17.
Fig. 7. Uno de los retos que se plantean con el uso de la resonancia magnética es la posibilidad de predecir la edad del trombo. Estas imágenes corresponden a la organización de un trombo que se ha inducido experimentalmente después de una angioplastia coronaria en un modelo porcino. La imagen negra de la izquierda, que corresponde al trombo coronario, se transforma en una imagen mucho más opaca a lo largo del tiempo. A las 8 semanas el trombo se encuentra completamente organizado por tejido conectivo. Por primera vez, la resonancia magnética nos proporciona información sobre el grado de evolución del trombo (tomada de Corti R et al. Circulation 2001. En prensa).
La pregunta que nos planteamos ahora es: ¿podremos, en un futuro próximo, determinar si un trombo ha ocurrido hace 2 o 6 semanas y saber si se encuentra en proceso de organización en pacientes que se presentan en etapas subagudas de la enfermedad? La respuesta a esta pregunta tiene que ver con el enfoque que debemos dar a la enfermedad aterosclerótica. Como nos habíamos planteado unos años atrás, la evolución de la placa en una arteria debe considerarse como una enfermedad tumoral, en la que es más importante determinar el grado de malignidad que la estenosis. En este caso, la biopsia corresponde a las imágenes que podemos obtener utilizando técnicas que, como la resonancia magnética, nos aportan una información relevante sobre la biología de las lesiones fundamentales que constituyen el proceso aterosclerótico. Nuestro objetivo es utilizar técnicas de imagen no invasivas para hacer estudios longitudinales en los que se pueda visualizar, después de administrar un contraste, la luz vascular y la pared, el calcio, o la fase de crecimiento de la placa, por ejemplo. Es importante conocer la progresión en el tiempo de las lesiones vasculares y no sólo disponer de información puntual sobre su estructura o localización. Por todo ello, las nuevas tecnologías de imagen se presentan como un campo fascinante en continuo desarrollo para el estudio y caracterización de los mecanismos celulares implicados en la patogenia de la aterosclerosis.