La insuficiencia pulmonar (IP) es una complicación frecuente tras la intervención de cardiopatías congénitas. La expresión en leucocitos mononucleares circulantes (LMC) de los adrenoceptores (β1 y β2) y de las cinasas (GRK2, GRK3 y GRK5) refleja los cambios neurohumorales que se producen en la insuficiencia cardiaca (IC). El objetivo principal es describir la expresión génica de dichas moléculas en LMC de pacientes con IP grave.
MétodosEstudio prospectivo que analizó la expresión de las moléculas descritas en LMC de pacientes con IP grave en comparación con controles sanos y pacientes con IC avanzada.
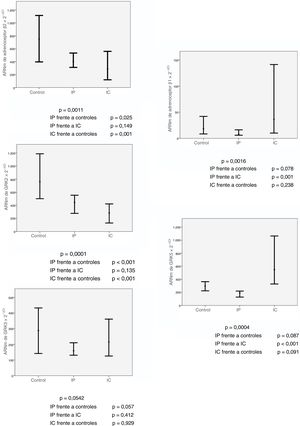
ResultadosSe estudió a 35 pacientes con IP grave, 22 controles y 13 pacientes con IC. El análisis de comparaciones múltiples mostró que en los controles la cantidad de ARN mensajero de adrenoceptor β2 era mayor que el que presentaban los pacientes con IP y con IC, con similar expresión en estos 2 grupos: 748,49 (intervalo, 1.703,87) frente a 402,80 (1.210,81) frente a 287,46 (685,69) (p = 0,001). Estos mismos hallazgos se obtuvieron en la expresión génica de GRK2: 760,89 (1.169,46) frente a 445,17 (1.190,69) frente a 284,09 (585,27) (p < 0,001). No hubo diferencias en la expresión de estas moléculas según las variables clínicas de los pacientes con IP.
ConclusionesEl patrón de expresión génica de GRK2 y del adrenoceptor β2 de los pacientes con IP grave, como marcadores moleculares de disfunción cardiaca, se encuentra alterado respecto a los controles y es similar al de los pacientes con IC avanzada.
Palabras clave
La insuficiencia valvular pulmonar (IP) crónica es una complicación frecuente en los pacientes intervenidos de cardiopatías congénitas. En la evolución, causa sobrecarga de volumen y disfunción progresiva del ventrículo derecho (VD)1 que se asocia con reducción de la capacidad de ejercicio, aumento del riesgo de arritmias y muerte súbita cardiaca2.
El recambio de válvula pulmonar (RVP) es una intervención con bajo riesgo3, pero son necesarias múltiples reintervenciones por la degeneración de la bióprotesis o el homoinjerto implantado4. Las guías de práctica clínica5,6 recomiendan cirugía de la IP grave para los pacientes sintomáticos o con dilatación/disfunción del VD moderada-grave7,8. Sin embargo, en la mayoría de las series analizadas, tras la cirugía no se evidencia una mejoría de la capacidad de ejercicio o la función sistólica del VD ni una mejoría pronóstica9, por lo que muchos autores recomiendan realizar el RVP más precozmente10.
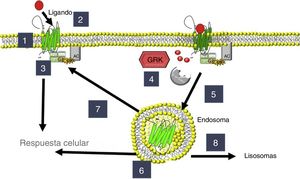
La regulación homeostática del aparato cardiovascular se controla por el sistema nervioso autónomo, y la interacción entre ambos sistemas es permanente. En la insuficiencia cardiaca (IC), la concentración de catecolaminas circulantes aumenta y esto determina una adaptación en la expresión y la actividad de los adrenoceptores, así como de las cinasas de estos receptores acoplados a proteínas G (GRK), que los fosforilan cuando son ocupados por agonistas. Hay distintas isoformas (GRK2, GRK3 y GRK5) presentes en el corazón y también en leucocitos mononucleares circulantes (LMC) que, al fosforilar los adrenoceptores β, favorecen su internalización en la célula y, por lo tanto, el cese de su función en la membrana celular11,12 (figura 1). La expresión de los adrenoceptores β y las GRK (especialmente GRK2 y GRK5) cambia como consecuencia de los cambios hemodinámicos que se producen en la IC13–16, y de esta forma se pueden convertir en un parámetro útil para el seguimiento de esta enfermedad. Inicialmente, estos cambios en la expresión de adrenoceptores β y GRK se determinaron en material de origen cardiaco (biopsias endomiocárdicas, explante cardiaco), pero también es posible estudiar su expresión en LMC15,17,18, lo que simplifica su uso como biomarcadores a partir de una muestra de sangre periférica. De hecho, en el estudio de la IC se ha utilizado como marcador molecular la expresión de la GRK2 en LMC19, por lo que una aproximación semejante podría ser útil en la IP.
Regulación de adrenoceptores y cinasas de los receptores acoplados a proteína G (GRK). 1: localización del adrenoceptor β; 2: activación; 3: señalización a través de proteínas G con activación de la adenilato ciclasa (AC); 4: fosforilación por GRK; 5: endocitosis; 6: localización de endosomas; 7: reciclado a la membrana; 8: degradación en lisosomas.
En el presente trabajo se propone un enfoque molecular que permita mejorar el conocimiento fisiopatológico del proceso y ayudar a establecer el momento del RVP. El objetivo principal es describir la expresión génica de adrenoceptores y GRK en LMC de los pacientes con IP grave como secuela tras cirugía de cardiopatías congénitas y compararla con la expresión que presentan los controles y los pacientes con IC. Los objetivos secundarios son comparar la expresión de adrenoceptores y GRK entre pacientes con IP grave según la presencia de síntomas y de dilatación significativa o disfunción del VD, puesto que son los criterios considerados para la indicación quirúrgica.
MÉTODOSSe seleccionó prospectivamente a los pacientes diagnosticados de IP grave seguidos en la Unidad de Cardiopatías Congénitas del Adulto desde diciembre de 2011 a julio de 2015. El diagnóstico de IP grave se realizó siguiendo criterios ecocardiográficos20 y se confirmó mediante cardiorresonancia magnética. Se excluyó a los pacientes con disfunción del ventrículo izquierdo u otra valvulopatía grave además de la IP.
Tras firmar el consentimiento informado, se les extrajo una muestra sanguínea para análisis de la expresión génica de adrenoceptores y GRK en LMC de sangre periférica. Se recogieron también datos clínicos (clase funcional de la New York Heart Association [NYHA]), electrocardiográficos (ritmo y anchura de QRS) y de valoración del VD por cardiorresonancia magnética (volúmenes y fracción de eyección ventriculares).
Se incluyó en el estudio a 22 controles sanos voluntarios, emparejados por edad y sexo con los pacientes incluidos y 13 pacientes con IC avanzada de origen no isquémico para realizar una única extracción sanguínea para el análisis de la expresión génica de adrenoceptores y GRK. Se excluyó a los pacientes con procesos inflamatorios que pudieran alterar la expresión de estas moléculas.
El estudio se realizó de acuerdo con la Declaración de Helsinki y el Comité Ético del Hospital Universitario y Politécnico La Fe lo aprobó.
Análisis de la expresión génica de adrenoceptores y GRK en leucocitos mononucleares circulantes de sangre periféricaEl material biológico de estudio fue una muestra de sangre fresca (10 ml) obtenida por venopunción y conservada en un tubo con anticoagulante (EDTA). Inmediatamente tras la extracción, se realizó el aislamiento de LMC mediante gradiente de Ficoll21. La muestra obtenida se conservó a –80°C hasta su procesado. En una primera fase se efectuó la extracción de ARN por centrifugación siguiendo el protocolo Tripure Isolation Reagent (Roche). Una vez aislado el ARN, se realizó un control de calidad con el sistema StdSens RNA Experion (Biorad) que valora la calidad, la pureza y la integridad de la muestra fijando como requisito un indicador de calidad de ARN (RQI) > 0,75. En una segunda fase se llevó a cabo el estudio mediante transcripción inversa-reacción en cadena de la polimerasa cuantitativa en tiempo real con el sistema Taqman Gene en un termociclador GeneAmp 7500 Fast System (Applied Biosystem) siguiendo el protocolo experimental previamente descrito21. Así se cuantificó el ARN mensajero codificante de adrenoceptores, GRK y gliceraldehído 3-fosfato deshidrogenasa como control interno, con sondas Taqman:β1-AR, Hs00265096_s1; β2-AR, Hs00240532_s1; GRK2, Hs00176395_m1; GRK3, Hs00178266_m1; GRK5, Hs00178389_m1 y gliceraldehído 3-fosfato deshidrogenasa, Hs99999905_m1 (Applied Biosystems).
Análisis estadísticoLas variables cualitativas se expresan en porcentaje y las cuantitativas, en media ± desviación típica. Los valores de adrenoceptores y GRK se expresan en mediana (intervalo), pues no cumplen los parámetros de normalidad. Se analizaron 3 grupos: controles, pacientes con IP grave y pacientes con IC avanzada. Se realizó un análisis descriptivo y se comparó la expresión de adrenoceptores y GRK en los 3 grupos mediante test de Kruskal-Wallis, dados el tamaño muestral y la distribución de las variables de expresión génica, con comparaciones múltiples por grupos.
Posteriormente se comparó la expresión de adrenoceptores y GRK dentro del grupo de pacientes con IP según su situación clínica y los datos de valoración del VD mediante el test no parámetrico W de Wilcoxon.
Se consideró significación estadística un valor de p < 0,05. Se utilizaron los paquetes estadísticos SPSS 15 y STATA 13.1.
RESULTADOSPoblación de estudioSe incluyó a 35 pacientes con IP grave (el 54,3% varones; media de edad, 32,2 años). Respecto a la cardiopatía de base, el 65,7% tenía tetralogía de Fallot; el 25,7%, estenosis pulmonar valvular; 1 paciente, agenesia valvular y 2, otras cardiopatías intervenidas que en el seguimiento habían ocasionado IP. La intervención correctora sobre la válvula pulmonar se efectuó en el 94,3% de los pacientes. En un 8,6% se realizó una miectomía/valvulotomía sola y en el 82,9% se colocó un parche transanular o de ampliación del tracto de salida del VD.
En la inclusión, el 77,1% se encontraba en clase funcional I de la NYHA. El 91,4% estaba en ritmo sinusal, con una duración media del QRS de 142,4 ± 29,3ms. El 37,1% presentaba disfunción del VD según los criterios de cardiorresonancia magnética (fracción de eyección del VD < 45%) y el 65,7%, dilatación significativa del VD (volumen telediastólico del VD indexado por cardiorresonancia magnética ≥ 150 ml/m2).
Las comparaciones se realizaron con 22 controles (el 62% varones; media de edad, 36,7 años) y 13 pacientes con IC avanzada (el 76,9% varones; media de edad, 47,5 años). Los pacientes con IC presentaban miocardiopatías de causa no isquémica (media del diámetro telediastólico del ventrículo izquierdo, 67,6 ± 13,7 mm; media del diámetro telesistólico del ventrículo izquierdo, 57,5 ± 15 mm), con una media de fracción de eyección del ventrículo izquierdo del 22,5% ± 16,6%.
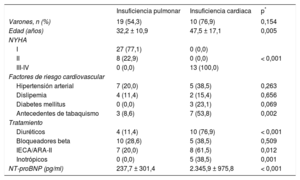
En la tabla 1 se comparan las características clínicas de los pacientes con IP e IC. Los pacientes con IP presentaban mejor situación clínica y menores cifras de fracción aminoterminal del propéptido natriurético cerebral. La tasa de tratamiento con bloqueadores beta en el grupo de IC era baja por encontrarse en un estadio avanzado de su enfermedad, con mala tolerancia hemodinámica.
Características basales de los pacientes con insuficiencia pulmonar grave e insuficiencia cardiaca
| Insuficiencia pulmonar | Insuficiencia cardiaca | p* | |
|---|---|---|---|
| Varones, n (%) | 19 (54,3) | 10 (76,9) | 0,154 |
| Edad (años) | 32,2 ± 10,9 | 47,5 ± 17,1 | 0,005 |
| NYHA | |||
| I | 27 (77,1) | 0 (0,0) | |
| II | 8 (22,9) | 0 (0,0) | < 0,001 |
| III-IV | 0 (0,0) | 13 (100,0) | |
| Factores de riesgo cardiovascular | |||
| Hipertensión arterial | 7 (20,0) | 5 (38,5) | 0,263 |
| Dislipemia | 4 (11,4) | 2 (15,4) | 0,656 |
| Diabetes mellitus | 0 (0,0) | 3 (23,1) | 0,069 |
| Antecedentes de tabaquismo | 3 (8,6) | 7 (53,8) | 0,002 |
| Tratamiento | |||
| Diuréticos | 4 (11,4) | 10 (76,9) | < 0,001 |
| Bloqueadores beta | 10 (28,6) | 5 (38,5) | 0,509 |
| IECA/ARA-II | 7 (20,0) | 8 (61,5) | 0,012 |
| Inotrópicos | 0 (0,0) | 5 (38,5) | 0,001 |
| NT-proBNP (pg/ml) | 237,7 ± 301,4 | 2.345,9 ± 975,8 | < 0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association.
Los valores expresan n (%) o media ± desviación estándar.
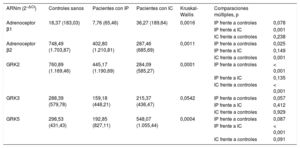
Se comparó la expresión de los adrenoceptores y GRK en LMC obtenidos de muestras sanguíneas de los 3 grupos de estudio: controles, pacientes con IP grave y pacientes con IC. En la tabla 2 se muestran los valores de ARN mensajero de los adrenoceptores β y las GRK según el grupo de estudio expresados en mediana (intervalo).
Expresión de adrenoceptores y GRK según los grupos de estudio
| ARNm (2–ΔCt) | Controles sanos | Pacientes con IP | Pacientes con IC | Kruskal-Wallis | Comparaciones múltiples, p | |
|---|---|---|---|---|---|---|
| Adrenoceptor β1 | 18,37 (183,03) | 7,76 (65,46) | 36,27 (189,64) | 0,0016 | IP frente a controles | 0,078 |
| IP frente a IC | 0,001 | |||||
| IC frente a controles | 0,238 | |||||
| Adrenoceptor β2 | 748,49 (1.703,87) | 402,80 (1.210,81) | 287,46 (685,69) | 0,0011 | IP frente a controles | 0,025 |
| IP frente a IC | 0,149 | |||||
| IC frente a controles | 0,001 | |||||
| GRK2 | 760,89 (1.169,46) | 445,17 (1.190,69) | 284,09 (585,27) | 0,0001 | IP frente a controles | < 0,001 |
| IP frente a IC | 0,135 | |||||
| IC frente a controles | < 0,001 | |||||
| GRK3 | 288,39 (579,78) | 159,18 (448,21) | 215,37 (436,47) | 0,0542 | IP frente a controles | 0,057 |
| IP frente a IC | 0,412 | |||||
| IC frente a controles | 0,929 | |||||
| GRK5 | 298,53 (431,43) | 192,85 (827,11) | 548,07 (1.055,44) | 0,0004 | IP frente a controles | 0,087 |
| IP frente a IC | < 0,001 | |||||
| IC frente a controles | 0,091 |
ARNm: ácido ribonucleico mensajero; GRK: cinasas de los receptores acoplados a proteína G; IC: insuficiencia cardiaca; IP: insuficiencia pulmonar.
Como se observa en la figura 2, y según los resultados del análisis de comparaciones múltiples, se encontraron diferencias significativas en la expresión del adrenoceptor β2 en el grupo control frente a los grupos de pacientes con IP e IC: 748,49 (1.703,87) frente a 402,80 (1.210,81) frente a 287,46 (685,69) (p = 0,001). En los últimos 2 grupos la expresión de adrenoceptores β2 estaba significativamente disminuida respecto al grupo control (IP frente a controles, p = 0,025; IC frente a controles, p = 0,001). Estos mismos resultados se obtienen cuando se analiza la expresión génica de GRK2. Los valores de ARN mensajero en el grupo control son significativamente mayores que en los grupos de IP e IC: 760,89 (1.169,46) frente a 445,17 (1.190,69) frente a 284,09 (585,27) (p < 0,001), y esto se confirma en los resultados del análisis por grupos (IP frente a controles, p < 0,001; IC frente a controles, p < 0,001).
Por otro lado, no se observaron diferencias entre los grupos en la expresión génica de GRK3, y aunque en el análisis estadístico se muestran diferencias significativas en la expresión del adrenoceptor β1 y GRK5, en el análisis por comparaciones múltiples no había diferencias en la expresión del grupo IP frente a los controles.
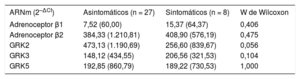
Subgrupos de pacientes con insuficiencia pulmonarComo objetivo secundario se comparó la expresión génica de adrenoceptores y GRK en los pacientes con IP grave que presentaban síntomas (clase funcional de la NYHA ≥ 2) frente a los asintomáticos, y no se evidenciaron diferencias estadísticamente significativas entre ambos grupos (tabla 3), aunque los pacientes sintomáticos sí mostraban menor expresión de GRK2, pero sin alcanzar una diferencia con significación estadística.
Expresión de adrenoceptores y GRK según la presencia de síntomas
| ARNm (2–ΔCt) | Asintomáticos (n = 27) | Sintomáticos (n = 8) | W de Wilcoxon |
|---|---|---|---|
| Adrenoceptor β1 | 7,52 (60,00) | 15,37 (64,37) | 0,406 |
| Adrenoceptor β2 | 384,33 (1.210,81) | 408,90 (576,19) | 0,475 |
| GRK2 | 473,13 (1.190,69) | 256,60 (839,67) | 0,056 |
| GRK3 | 148,12 (434,55) | 206,56 (321,53) | 0,104 |
| GRK5 | 192,85 (860,79) | 189,22 (730,53) | 1,000 |
ARNm: ácido ribonucleico mensajero; GRK: cinasas de los receptores acoplados a proteína G.
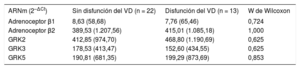
También se analizó la expresión génica según la presencia de dilatación y disfunción de VD, sin diferencias significativas en los niveles de expresión de adrenoceptores y GRK según estos parámetros (tabla 4 y tabla 5).
Expresión de adrenoceptores y GRK según la dilatación del VD (VTDVDi > 150 ml/m2)
| ARNm (2–ΔCt) | Sin dilatación significativa (n = 12) | Dilatación significativa (n = 23) | W de Wilcoxon |
|---|---|---|---|
| Adrenoceptor β1 | 8,63 (64,69) | 7,76 (60,00) | 1,000 |
| Adenoceptor β2 | 328,82 (1.210,81) | 415,01 (1.079,25) | 0,195 |
| GRK2 | 298,75 (834,00) | 468,80 (1.190,69) | 0,526 |
| GRK3 | 181,79 (382,39) | 152,60 (303,93) | 0,327 |
| GRK5 | 200,90 (821,51) | 189,91 (730,53) | 0,381 |
ARNm: ácido ribonucleico mensajero; GRK: cinasas de los receptores acoplados a proteína G; VD: ventrículo derecho; VTDVDi: volumen telediastólico del ventrículo derecho indexado.
Expresión de adrenoceptores y GRK según la disfunción del VD (FEVD < 45%)
| ARNm (2–ΔCt) | Sin disfunción del VD (n = 22) | Disfunción del VD (n = 13) | W de Wilcoxon |
|---|---|---|---|
| Adrenoceptor β1 | 8,63 (58,68) | 7,76 (65,46) | 0,724 |
| Adrenoceptor β2 | 389,53 (1.207,56) | 415,01 (1.085,18) | 1,000 |
| GRK2 | 412,85 (974,70) | 468,80 (1.190,69) | 0,625 |
| GRK3 | 178,53 (413,47) | 152,60 (434,55) | 0,625 |
| GRK5 | 190,81 (681,35) | 199,29 (873,69) | 0,853 |
ARNm: ácido ribonucleico mensajero; FEVD: fracción de eyección del ventrículo derecho; GRK: cinasas de los receptores acoplados a proteína G; VD: ventrículo derecho.
En este trabajo se ha estudiado a los pacientes con IP desde un punto de vista fisiopatológico, y se han analizado los cambios moleculares que permitan conocer más sobre la evolución de esta enfermedad y ayudar a su tratamiento clínico. De los 5 genes estudiados, se encontró una disminución significativa en la expresión de GRK2 y del adrenoceptor β2 en los LMC de pacientes con IP y con IC, en comparación con los controles; por lo tanto, se demuestra que en estos pacientes aparecen datos bioquímicos de daño cardiaco similares a los que muestran los pacientes con IC avanzada.
La IP sigue siendo una secuela muy importante de los pacientes intervenidos de tetralogía de Fallot y estenosis pulmonar, y una muy frecuente causa de reintervención. La sobrecarga de volumen crónica a la que se somete el VD por la presencia de IP causa cambios fisiopatológicos que llevan a su dilatación y disfunción, que conlleva arritmias, intolerancia al ejercicio, IC y muerte. Las indicaciones para RVP en pacientes asintomáticos no están claramente establecidas, y se recomienda la cirugía en determinadas situaciones como dilatación/disfunción progresiva del VD5, pero no hay consenso sobre en qué momento concreto llevarla a cabo. Entre las herramientas que se podría utilizar en la toma de decisiones, el análisis de parámetros moleculares que indiquen disfunción ventricular podría ayudar al tratamiento de estos pacientes.
Se ha demostrado que hay alteraciones en la expresión de adrenoceptores β y GRK en LMC de pacientes con enfermedades cardiovasculares como hipertensión o IC14–18,21,22, por lo que se ha propuesto, especialmente en el caso de la IC, su uso como biomarcadores en la evolución de la enfermedad. Por este motivo, se propone el estudio de la expresión génica de los 2 subtipos de adrenoceptores β (β1 y β2), y las 3 GRK (GRK2, GRK3 y GRK5) presentes en los LMC para determinar si dicha expresión también sufre cambios en los pacientes con IP.
En la IC, se han descrito cambios en la expresión (génica o proteica) de los adrenoceptores β1, GRK2 y GRK5 en el corazón13,16,23, que varían según el origen24 o el estadio de la enfermedad25,26. Hay evidencias previas de que los cambios en el corazón se reproducen en los LMC15,27–30, lo que permitiría utilizar los LMC como un espejo de los cambios cardiacos. Este paralelismo entre los LMC y el corazón se explica si se considera el papel que las catecolaminas circulantes o el tratamiento con bloqueadores beta puedan tener en la expresión de adrenoceptores y GRK. De hecho, un aumento sostenido de catecolaminas circulantes induce una disminución de la expresión de los adrenoceptores β acompañada de un aumento en la expresión de las GRK, mientras que la administración de bloqueadores beta produce los efectos contrarios29,31. Sin embargo, no siempre hay una concordancia en los cambios producidos en el corazón y los LMC. Así, se han descrito altas concentraciones de GRK216,21 y adrenoceptor β221 en el miocardio de pacientes con miocardiopatía dilatada, pero resultados previos indican que la expresión de GRK2 y adrenoceptores β2 disminuye en LMC de esos mismos pacientes y esta disminución se revierte tras el trasplante cardiaco21.
Aunque no se conocen bien los mecanismos que conducen a los cambios de expresión de los adrenoceptores y las GRK en los LMC ni su trascendencia fisiopatológica32, es interesante señalar que en distintos modelos animales y humanos de enfermedad cardiovascular, hay un patrón común de cambios entre el adrenoceptor β2 y la GRK2 en un determinado territorio21, patrón que se encuentra también en los LMC de los pacientes con IP, donde ambos genes disminuyen. Es importante señalar que una disminución semejante se observa en los LMC de pacientes con IC y que esta disminución se revierte tras el trasplante21, lo que corrobora su interrelación con la evolución de la afección. Por ello, el interés en analizar la expresión de adrenoceptores β2 y GRK2 en los LMC no tiene por qué centrarse en buscar un mimetismo con los cambios cardiacos, sino que se puede considerar como un biomarcador a los LMC en sí mismos, tal como proponen otros autores en el caso de los pacientes con IC19.
Centrándonos en el grupo de pacientes con IP grave, se encontró un patrón de expresión de GRK2 y del adrenoceptor β2 en los LMC similar al que presenta el grupo con IC y que difiere de manera significativa del presentado por el grupo control. Independientemente de cuál sea el origen de dicho cambio, esto indica que el grado de disfunción ventricular y los correspondientes cambios moleculares en los LMC de los pacientes con IP son similares a los de los pacientes con IC avanzada, pese a que los pacientes con IP son una población asintomática en su mayoría. Si la reducción de adrenoceptores β en los LMC que se observa en distintas enfermedades cardiacas se relaciona con una respuesta inflamatoria crónica de baja intensidad32, estos datos podrían indicar que en IP asintomática ya hay un daño del VD muy evolucionado que da lugar a esta respuesta inflamatoria. Y podría explicar de algún modo la ausencia de mejoría significativa en los parámetros funcionales del VD tras el RVP y que este debería llevarse a cabo antes. De hecho, Hallbergson et al.33, analizando datos de remodelado del VD a largo plazo, observaron que en los primeros 2 años tras el RVP había una disminución de volúmenes del VD con ligera disminución de la fracción de eyección del VD, pero a los 10 años el volumen del VD volvía a aumentar a los valores previos al RVP, con menor fracción de eyección del VD. Aunque relacionaban estos hallazgos con sobrecarga de presión y de volumen del VD por disfunción de la bioprótesis implantada, destacaban que estos cambios también se observaban cuando la disfunción del injerto no era tan significativa, lo que indicaba que el VD de estos pacientes era muy vulnerable a modificaciones hemodinámicas ligeras y que se podía deber a que el remodelado ventricular ya estuviera evolucionado previamente al RVP. En este sentido se ha publicado recientemente un estudio10 donde la mejora de los parámetros de valoración del VD y de los datos de consumo de oxígeno era mayor en los pacientes intervenidos a edades más tempranas, probablemente porque había un menor remodelado del VD. Con todo ello, probablemente en pacientes asintomáticos los datos de volumen y función del VD por cardiorresonancia magnética no son suficientes para decidir el momento óptimo para el RVP y sean necesarios biomarcadores que respalden la indicación quirúrgica más precozmente. En vista de los resultados publicados, la concentración de GRK2 sí muestra valor pronóstico en pacientes con IC19 y, según nuestros resultados, podrían ser útiles también en pacientes con IP. Pero para ello, es necesario demostrar que hay una mejoría pronóstica si se interviene antes a los pacientes y mejorar las técnicas quirúrgicas que permitan disminuir el número de reintervenciones.
Hasta el momento, no hay estudios que analicen estos biomarcadores en cardiopatía derecha. Recientemente, se ha publicado un trabajo que muestra la alteración en la expresión de GRK2 y adrenoceptores en miocitos auriculares de pacientes con cardiopatías congénitas intervenidos con bypass cardiopulmonar34, y relacionando estos hallazgos con la vulnerabilidad que presenta el miocardio a las concentraciones de catecolaminas en este contexto y el daño miocárdico que esto puede producir. Estos hallazgos, aunque interesantes, no son comparables con los que se muestran en este trabajo, puesto que nuestros pacientes estaban en situación estable.
Estudiando el grupo de pacientes con IP según el estado sintomático y de parámetros de valoración del VD, se observa que hay una tendencia, aunque no significativa, a una expresión génica de GRK2 menor en los pacientes sintomáticos que en los asintomáticos. La ausencia de significación estadística en esta diferencia se puede relacionar con el reducido tamaño muestral. Esto indica que los pacientes sintomáticos deben tener un grado de daño cardiaco mayor y que puede existir una relación inversa entre la concentración de GRK2 y el grado de daño cardiaco. Aunque estas diferencias no están presentes al comparar a los pacientes según el daño del VD en términos de dilatación o disfunción sistólica. Esto podría significar que, aunque entre los parámetros que se usan para la indicación quirúrgica estén los valores de volumen y función del VD por cardiorresonancia magnética, los puntos que se marcan para indicar la cirugía pueden ser tardíos y el daño miocárdico podría haberse establecido ya.
LimitacionesEl tamaño muestral del estudio es pequeño, aunque similar al presentado en trabajos previos sobre pacientes con IP9 en estudios unicéntricos, y esto hace que la potencia estadística del estudio sea escasa.
Se considera que los pacientes con IC avanzada pueden no ser comparables con los pacientes con IP grave, pero representan una población con importante daño cardiaco y, a la luz de los resultados, de fisiopatología similar a la de los pacientes con IP.
Se conoce, a través de diferentes estudios, los cambios de expresión génica en los adrenoceptores y sus GRK reguladoras en diferentes enfermedades cardiovasculares. En el presente estudio se expone por primera vez una expresión génica del adrenoceptor β2 y GRK2 similar en pacientes con IP e IC avanzada, aunque sería necesario realizar estudios multicéntricos para conseguir un tamaño muestral mayor e información pronóstica de estos hallazgos.
CONCLUSIONESEste trabajo propone el estudio de la IP desde un enfoque molecular que no se había realizado hasta el momento y puede ayudar a la toma de decisiones terapéuticas en estos pacientes.
El hallazgo principal del estudio es que la expresión génica de GRK2 y del adrenoceptor β2, como marcadores moleculares de disfunción cardiaca, se encuentra alterada en pacientes con IP grave respecto a los controles, y es similar a la de los pacientes con IC avanzada. Estos hallazgos invitan a realizar estudios con estos marcadores moleculares en esta población y analizar su valor pronóstico y la utilidad en el tratamiento clínico de estos pacientes.
FINANCIACIÓNAyudas provenientes del Instituto de Salud Carlos III, Fondo de Investigaciones Sanitarias (FIS PI070509), Ministerio de Economía y Competitividad (SAF2013-45362-R) y de la Generalitat Valenciana (GVACOMP07-182 y GVACOMP2009/261).
E. Oliver es beneficiario de una beca de investigación de las acciones Marie Sklodowska-Curie COFUND del FP7. El CNIC (Centro Nacional de Investigaciones Cardiovasculares) cuenta con el apoyo del Ministerio de Economía, Industria y Competitividad y la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (SEV-2015-0505).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Las alteraciones de la expresión génica de adrenoceptores y GRK en LMC se han estudiado en otras enfermedades cardiovasculares y, según indican algunos autores, pueden tener valor pronóstico en enfermedades como la IC. Sabemos poco sobre las alteraciones moleculares que se producen a este nivel en pacientes con cardiopatías congénitas, concretamente en pacientes con IP. Su conocimiento podría aportar información sobre el daño molecular de estos pacientes y ayudar a decidir el momento idóneo para indicar el RVP con el fin de preservar la función del VD y mejorar el pronóstico.
- –
Este trabajo apuesta por incluir una valoración molecular para los pacientes con IP. De hecho, en el trabajo se muestra que hay una alteración en la expresión génica del adrenoceptor β2 y de la GRK2 similar a la de los pacientes con IC, por lo que estos biomarcadores podrían ser útiles para la valoración integral de los pacientes con IP junto con las herramientas que se utilizan actualmente (valoración clínica y pruebas de imagen). Aunque es necesario realizar más estudios que confirmen estos hallazgos y analicen el valor pronóstico de estos biomarcadores, con este trabajo se propone una nueva aproximación para el tratamiento clínico de los pacientes con IP.