Full English text available from: www.revespcardiol.org/en
La trombosis del stent/armazón (TS) es una de las consecuencias más catastróficas tras una intervención coronaria percutánea (ICP). El conocimiento de sus causas podría ser útil no solo para su prevención y tratamiento, sino también para el diseño de nuevas generaciones de dispositivos intravasculares. La TS se clasifica como TS aguda (TSA), que se produce hasta 1 día después de la ICP), TS subaguda (TSSA), entre 1 día y 1 mes después de la ICP, TS tardía (TST), entre 1 mes y 1 año después de la ICP) y TS muy tardía (TSMT), más de 1 año después de la ICP)1. La mortalidad hospitalaria no es baja, sea cual sea el tiempo transcurrido hasta su aparición (el 7,9% en la TSA+TSSA, el 3,8% en la TST y el 3,6% en la TSMT)2. La tomografía de coherencia óptica (OCT) y las imágenes de dominio de frecuencia óptica son las técnicas de imagen intracoronaria de mayor resolución disponibles para visualizar la pared arterial con un grado de resolución micrométrico, aproximadamente 10 veces superior al de la ecografía intravascular. La OCT o las imágenes de dominio de frecuencia óptica probablemente sean las mejores técnicas disponibles para determinar las causas de la TS.
En un reciente artículo publicado en Revista Española de Cardiología, Cuesta et al.3 han presentado los resultados de la OCT en 40 pacientes consecutivos con TSA+TSSA (n = 16) o con TST o TST+TSMT (n = 24) de un solo centro. Se utilizaron diversos tipos de stent (17 stents metálicos [SM], 4 stents farmacoactivos [SFA] de primera generación, 12 SFA de segunda generación, 4 armazones totalmente bioabsorbibles y 3 de tipo desconocido). Como consecuencia de la falta de imágenes basales o por insuficiente resolución de imagen, se excluyeron del análisis 6 imágenes de OCT y se evaluaron 13 TSA+TSSA y 21 TST+TSMT. En los casos de TSA+TSSA, que incluían 5 SM y 11 SFA, la causa más frecuente de TS fue la mala aposición (39%, 5/13) seguida de la expansión insuficiente (23%, 3/13) y la disección del borde (23%, 3/13), y en 2 casos no hubo ningún hallazgo específico. En los casos de TST+TSMT, que incluían 12 SM y 12 SFA, la mayoría de los SFA (67%) presentaban signos de algún strut no cubierto, lo que fue mucho menos frecuente con los SM (25%). Alrededor de una tercera parte de los SFA presentaba algún signo de mala aposición, que no se observó en ninguno de los SM. La neoateroesclerosis, definida como la presencia de lípidos en la neoíntima, la calcificación o ambas cosas, tuvo una prevalencia del 67% en las lesiones de TS tardía, sin que se apreciaran diferencias entre los SM y los SFA. Es interesante la observación de que la neoateroesclerosis se asociaba con la región con la mayor carga de trombo, y en la mayoría de los casos de neoateroesclerosis (9/14); el tiempo transcurrido tras el implante era > 5 años.
En los últimos años se han realizado estudios similares en los que se han examinado los resultados de la OCT en pacientes con TS4-8. Souteyrand et al.4 presentaron los resultados de la OCT en 120 casos de TS del registro francés PESTO. El principal mecanismo de TSA+TSSA fue la mala aposición (48%) seguida de la expansión insuficiente de carácter grave (26%). Los mecanismos de la TST+TSMT fueron más variados (mala aposición [32%], rotura por neoateroesclerosis [28%], evaginación coronaria [10%], strut no cubierto [10%]). Taniwaki et al.5 estudiaron los resultados de la OCT en la TSMT (mediana de duración, 4,7 años) en SFA de primera generación (n = 38) y SFA de segunda generación (n = 20) de un registro europeo. Asimismo los hallazgos más frecuentes fueron la mala aposición del stent (34,5%), la neoateroesclerosis (27,6%), los struts no cubiertos (12,1%) y la expansión insuficiente del stent (6,9%). Más recientemente, Lee et al.8 han presentado un estudio de OCT en la TSMT (mediana de duración, 4,6 años) en SFA de primera generación (n = 71) y SFA de segunda generación (n = 27) de 10 registros de hospitales de Corea del Sur8. Los principales mecanismos de TSMT fueron la neoateroesclerosis (34,7%), la mala aposición del stent (33,7%) y los struts no cubiertos sin mala aposición del stent o evaginaciones (24,5%).
En conjunto, estos datos aportan información obtenida de pacientes vivos sobre las causas de la TS. En los casos de TSA, el estudio de Cuesta et al. indica, al igual que los de otros autores, que en la mayoría de los casos de TSA+TSSA hay signos de alguna complicación relacionada con el stent (expansión insuficiente) o con la intervención (mala aposición o disección). En nuestro estudio anatomopatológico, se evaluaron 37 lesiones en 34 pacientes con TS tempranas, en comparación con 25 pacientes/lesiones con stents permeables; todos los pacientes fallecieron en los 30 días siguientes al implante del stent9. Entre los factores predictivos independientes de una TS temprana, se identificó el prolapso del núcleo necrótico, el desgarro de la media y la aposición incompleta del stent. En esta serie, el 34% de los cortes mostró mala aposición, frente al 18% de los casos de stent permeable. La distancia de la mala aposición también fue mayor en los pacientes con trombo (204 μm) en comparación con los pacientes sin trombo (51 μm), lo que indica que el grado de mala aposición es un importante factor determinante del riesgo de trombosis. El estudio de Cuesta et al. no proporciona un grupo de control (pacientes sin TS) para la comparación, lo que habría aportado datos interesantes respecto a las diferencias relativas en el grado de mala aposición. Probablemente se puede asumir que el grado de mala aposición fue grande, dado que estos casos evolucionaron a trombosis. Otros estudios han confirmado que la mala aposición del stent tiende a tener una prevalencia considerable en los casos de tratamiento con SM o con SFA de un infarto agudo de miocardio con elevación del segmento ST, probablemente porque el trombo superpuesto oculta las dimensiones de la pared arterial10. Aunque no se aportan datos al respecto, habría sido interesante conocer las indicaciones clínicas para implantar los stents en estos pacientes.
El presente estudio tiene también implicaciones importantes respecto al tratamiento de la TS temprana. La mayor parte de los mecanismos descritos no se habrían resuelto con la colocación de otros stents adicionales, excepto las disecciones limitantes del flujo residual. En los casos de mala aposición, la estrategia de tratamiento de la TS debiera ser relativamente sencilla, ya que es probable que con una mejor aposición mejoren los resultados. Igualmente, por lo que respecta a la expansión insuficiente, se necesita una posdilatación más completa que verifique una mejor expansión del stent. Aunque cabría esperar que las exploraciones de imagen utilizadas en el implante del stent puedan mejorar los resultados en cuanto a la TS temprana, en el ensayo multicéntrico, controlado y aleatorizado ILLUMIEN III, con implantes de stents guiados por OCT, ecografía intravascular o angiografía, no hubo diferencias significativas entre los grupos respecto a los eventos cardiacos adversos mayores a los 30 días11.
Cuesta et al. aportan también datos interesantes sobre las causas de la TST. La observación relativamente frecuente de struts no cubiertos, en especial en el grupo de SFA, probablemente no resulta extraña, dados el conocido efecto de los SFA de la cicatrización retrasada y nuestras observaciones previas en estudios anatomopatológicos de que los struts no cubiertos son un importante factor de riesgo de TS. Tal como se preveía, la frecuencia de los struts no cubiertos fue significativamente menor en los pacientes tratados con SM. Tampoco se informa si los struts no cubiertos fueron más frecuentes en los SFA de primera generación que en los de segunda, aunque la mayoría de los SFA de este estudio eran de segunda generación. En otra serie anatomopatológica, demostramos que el número de struts no cubiertos era significativamente inferior con los SLE de cobalto-cromo de segunda generación que con los SFA de primera generación. Así pues, cabría prever que se observen con menor frecuencia struts no cubiertos en los SFA de segunda generación12.
También tiene interés el papel de la mala aposición en la TST. Cuesta et al. no describen ningún caso de mala aposición en los SM, en comparación con un 33% en los casos de SFA. No se indica si los casos de mala aposición del SFA fueron agudos y persistentes o de aparición tardía, pero cabría suponer que esta información está disponible teniendo en cuenta que en estos pacientes se dispuso de exploraciones de imagen basales. Además, habría sido interesante saber cuántos casos de SFA de segunda generación presentaban tanto mala aposición como struts no cubiertos. Foin et al.13 examinaron con un estudio retrospectivo de OCT la relación entre el grado de mala aposición, las alteraciones del flujo y la cobertura de neoíntima de los struts del stent. Los struts con una distancia de mala aposición < 100 μm presentaron alteraciones mínimas del flujo sanguíneo, en comparación con los struts flotantes con una distancia de mala aposición más significativa. Los segmentos con una mala aposición < 100 μm tuvieron una repercusión mínima en la cobertura de los struts, mientras que las distancias de 100 a 300 y > 300 μm mostraron struts no cubiertos en un grado significativamente superior. Dada la cicatrización significativamente mejor de los SFA de segunda generación, cabría esperar que algunos factores adicionales, como la mala aposición, contribuyan al retraso de la cicatrización observado en estos casos.
Por último, Cuesta et al. aportan también una perspectiva importante respecto al papel de la neoateroesclerosis en la TST (figura). Los datos anatomopatológicos y clínicos indican que la neoateroesclerosis progresa en los SFA con mayores rapidez y frecuencia que en los SM15. Nuestro propio análisis de autopsias de pacientes con SM de hasta 2 años de duración tras el implante no mostró ningún signo de neoateroesclerosis, mientras que hubo un aumento progresivo de su incidencia en los stents con una duración del implante > 2 años pero ≤ 6 (22%), así como en los casos de duración del implante > 6 años (42%). Los datos presentados por Cuesta et al. no concuerdan con los nuestros por cuanto estos autores observaron similares frecuencias de TST por neoateroesclerosis en los SM y los SFA, con 9 de 14 stents con duración del implante > 5 años. Los clínicos deben tener presente que la neoateroesclerosis como causa de TST en los SM y los SFA es realmente muy probable. Los resultados de Cuesta et al. difieren radicalmente de nuestros estudios sobre neoateroesclerosis, por cuanto los SFA con duración < 2 años mostraron una incidencia del 29%, que aumentó a un 44% en los SFA de duración > 2 pero < 6 años. Esto tiene sentido, dado que la disfunción endotelial es mayor en los SFA que en los SM y porque se observa una formación de placa con menor rapidez en los vasos nativos, mientras que es significativamente más rápida en los SFA. En última instancia, la formación de neoateroesclerosis limita la durabilidad y la seguridad de los SFA de la generación actual, y serán necesarios nuevos estudios para conocer sus causas exactas.
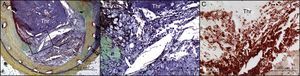
Trombosis de stent muy tardía debida a neoateroesclerosis con rotura de placa en el stent. A: rotura de placa en el stent con trombo luminal oclusivo (Thr) en el interior de un stent metálico, sin reestenosis. B: se identificó un alto número de macrófagos en la cubierta que había sufrido la rotura. C: inmunotinción con anticuerpo anti-CD68. Reproducido con permiso de Nakazawa et al.14. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En conclusión, el estudio de Cuesta et al. aporta nueva luz sobre un tema importante en la cardiología intervencionista. Los resultados clínicos en los pacientes con TS siguen siendo malos, de tal manera que un 15% de los pacientes del presente estudio fallecieron como consecuencia del episodio de TS. El conocimiento de las causas de la TS a lo largo del tiempo será útil para tratar adecuadamente este evento de consecuencias devastadoras. Todos los intervencionistas deben ser conscientes de la importancia de reducir al mínimo la mala aposición, sobre todo cuando es grande, así como de asegurar la suficiente expansión del stent, para prevenir los eventos de TS temprana16. Las causas de la TSMT son más complejas y es probable que no puedan resolverse simplemente con las técnicas de implante de stents. Entre las causas de la TSMT destaca la neoateroesclerosis, que se observó en un elevado número de los casos presentados por Cuesta et al. Deberán hacerse nuevos estudios para esclarecer sus mecanismos si se quiere mejorar los resultados a largo plazo en los pacientes a los que se implantan stents para el tratamiento de la enfermedad coronaria.
CONFLICTO DE INTERESESCVPath ha recibido apoyo de investigación para el centro por parte de 480 Biomedical, Abbott Vascular, ART, BioSensors International, Biotronik, Boston Scientific, Celonova, Claret Medical, Cook Medical, Cordis, Edwards Lifescience, Medtronic, MicroPort, MicroVention, Celonova, OrbusNeich, ReCore, SINO Medical Technology, Spectranetics, Surmodics, Terumo Corporation, W.L. Gore y Xeltis. H. Mori ha recibido honorarios de Abbott Vascular Japan, Goodman y Terumo Corporation. A.V. Finn tiene acuerdos de patrocinio de investigación con Boston Scientific y Medtronic CardioVascular y forma parte del consejo asesor de Medtronic CardioVascular.