Palabras clave
INTRODUCCION
En la atresia pulmonar con septo íntegro (APSI) se observa una obstrucción completa del tracto de salida del ventrículo derecho por una válvula pulmonar atrésica no asociada al defecto septal interventricular. Debe existir un conducto arterioso permeable responsable del flujo sanguíneo pulmonar1. La asociación con estenosis aórtica es muy infrecuente y los casos descritos en la bibliografía son excepcionales.
Presentamos el caso de una primípara de 19 años en la que se observó APSI en un ecocardiograma fetal a las 24 semanas de gestación. La recién nacida presentó desaturación y soplo sistólico eyectivo en el foco aórtico. Un ecocardiograma reveló una APSI y una válvula aórtica bicúspide engrosada y estenótica. La paciente evolucionó hacia el bajo gasto sistémico incontrolable y falleció.
CASO CLINICO
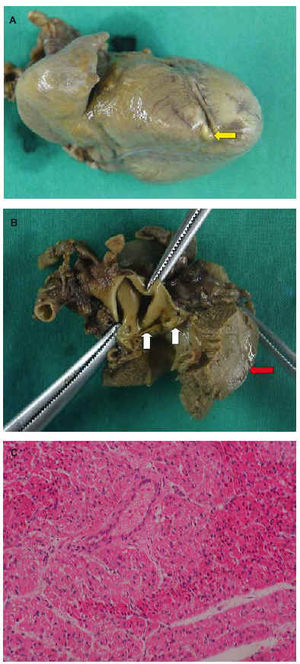
Primípara de 19 años, sin antecedentes patológicos de interés, a la que se realizó un ecocardiograma fetal que reveló una APSI, un ventrículo derecho hipoplásico e imágenes sugerentes de sinusoides coronarios en el Doppler color. El parto fue a término y se instauró tratamiento con prostaglandina-E1 en dosis de 0,03 μg/kg/min. Al nacimiento se objetivó desaturación leve, latido hiperdinámico, titilación y soplo sistólico eyectivo III/VI en el foco aórtico. La presión arterial era de 50/32 mmHg y la frecuencia cardíaca de 148 lat/min. La radiografía de tórax mostró una cardiomegalia moderada y en el electrocardiograma (ECG) se observó taquicardia sinusal, eje a 60o, P. pulmonale, disminución de fuerzas del ventrículo derecho y signos de sobrecarga sistólica de ventrículo izquierdo (fig. 1). A las 2 h de vida se realizó un ecocardiograma (fig. 2) que mostró APSI, hipoplasia de la válvula tricúspide, del cuerpo y del infundíbulo del ventrículo derecho, sinusoides, un conducto arterioso permeable, una válvula aórtica bicúspide engrosada y estenótica (con gradiente máximo de 45-50 mmHg) y un ventrículo izquierdo dilatado con paredes hipertróficas. Se planteó la realización de una valvulotomía pulmonar con catéter de radiofrecuencia, una fístula sistemicopulmonar y, según la evolución, una valvulotomía aórtica. Sin embargo, la paciente presentó un empeoramiento progresivo, con bajo gasto cardíaco incontrolable, y falleció a los 4 días de vida. El estudio necroscópico (fig. 3) confirmó los hallazgos ecocardiográficos descritos.
Fig. 1. Exploraciones complementarias iniciales. A: electrocardiograma de la paciente a las 2 h de vida: se observa taquicardia sinusal, eje eléctrico a 60o, P. pulmonale, disminución de fuerzas del ventrículo derecho y signos de sobrecarga sistólica del ventrículo izquierdo. B: radiografía de tórax a las 2 h 30 min de vida, en la que se observa cardiomegalia moderada.
Fig. 2. Ecocardiograma a las 2 h de vida. A: plano subcostal: se observa una válvula aórtica engrosada (flecha). B: eje corto paraesternal: se observa atresia de la válvula pulmonar (flecha) con dilatación del tronco de la arteria pulmonar (TP). AI: aurícula izquierda; Ao: válvula aórtica; VD: ventrículo derecho; VI: ventrículo izquierdo.
Fig. 3. Anatomía patológica. A: imagen macroscópica del corazón de la paciente que muestra un sinusoide (flecha) en el ápex ventricular derecho, junto al septo interventricular. B: imagen macroscópica que muestra engrosamiento de las 2 valvas de la válvula aórtica (flechas amarillas) e hipertrofia ventricular izquierda significativa (flecha roja). C: imagen microscópica de músculo papilar de ventrículo izquierdo. Tinción hematoxilina-eosina: se observan signos de isquemia parcheada (margen superior izquierdo y derecho), con citoplasma más eosinófilo, núcleos hipercromáticos y picnóticos.
DISCUSION
La APSI es una cardiopatía congénita infrecuente (0,7% del total) que se caracteriza por una obstrucción completa en el tracto de salida del ventrículo derecho debida a una válvula pulmonar atrésica (con la característica fusión de sus 3 comisuras) no asociada a defecto del tabique interventricular. Debe existir un conducto arterioso permeable responsable del flujo sanguíneo pulmonar1. Se acompaña de varias anomalías morfológicas. El ventrículo derecho puede ser pequeño, de tamaño normal o dilatado (con paredes adelgazadas y asociado a insuficiencia tricuspídea). Los casos en los que el ventrículo derecho es pequeño constituyen el denominado síndrome del ventrículo derecho hipoplásico (SVDH), caracterizado por APSI y válvula tricúspide hipoplásica, con un anillo y unos músculos papilares poco desarrollados. Cuando el ventrículo derecho es de tamaño normal o está dilatado, la válvula tricúspide tiene un tamaño prácticamente normal y puede ser severamente insuficiente2,3. La aurícula derecha está dilatada y puede tener un aspecto aneurismático en el ecocardiograma si existe insuficiencia tricuspídea. La sangre procedente de la circulación sistémica sale del corazón derecho a través de un foramen oval permeable (o comunicación interauricular). El tronco y las ramas pulmonares están bien formados. La aurícula izquierda está ligera o moderadamente dilatada debido a que recibe el retorno venoso sistémico y pulmonar. El ventrículo izquierdo está agrandado y se altera la distensibilidad y la contractilidad. Como resultado de la presión elevada en el ventrículo derecho, las conexiones embrionarias de la cavidad ventricular con la circulación coronaria persisten, constituyendo los denominados sinusoides, que están conectados con el lecho capilar miocárdico y, a través de éste, con las arterias coronarias epicárdicas4. Los sinusoides llevan sangre poco oxigenada al miocardio y pueden terminar en una forma ciega5, expuestos a altas presiones sistólicas que llevan a la hipertrofia de la capa media de las arterias intramurales6 y al agrandamiento progresivo de los sinusoides, que puede culminar en rotura miocárdica2. Otra consecuencia de la existencia de sinusoides que se comunican con una o ambas arterias coronarias es un fenómeno de «robo» isquémico del lecho capilar coronario durante el flujo diastólico, en el que se produce paso de sangre desde las coronarias a los sinusoides y, finalmente, al ventrículo derecho, e incluso se puede producir un infarto7. En ocasiones pueden existir estenosis en los sinusoides y, al depender la circulación coronaria del ventrículo derecho, aumentar el riesgo de isquemia y muerte. Se han descrito otras anomalías en la circulación coronaria, como fístulas1, estenosis o atrofia coronarias8. En este último caso, característico de corazones con hipoplasia del cuerpo del ventrículo derecho, los vasos coronarios distales son suplidos por comunicaciones con el ventrículo derecho, por lo que la circulación coronaria depende de éste. A no ser que el feto desarrolle una insuficiencia tricuspídea severa, no se produce insuficiencia cardíaca congestiva (con derrame pleural y pericárdico y ascitis) y la incidencia de muerte fetal es baja9,10. Las manifestaciones clínicas en el recién nacido son cianosis, hipoxemia, acidosis metabólica e insuficiencia cardíaca derecha e izquierda. Los excepcionales casos de supervivencia sin intervención después del período neonatal presentan subdesarrollo físico2. En el ECG se observan fuerzas ventriculares derechas normales (en algunos casos de SDVH) o aumentadas y crecimiento auricular derecho. La radiografía de tórax muestra una silueta cardíaca normal en el SVDH, mientras que si el ventrículo derecho es de tamaño normal o está dilatado se observa una dilatación de cavidades derechas3. El pronóstico es habitualmente malo sin tratamiento11, con más de un 50% de mortalidad al mes2. La supervivencia posnatal depende de la permeabilidad del conducto arterioso; de ahí que sea necesaria una infusión continua de prostaglandina-E1, ya que el cierre del conducto conllevaría la muerte5. Puede haber casos con atresia infundibular importante que limitan el éxito de una valvuloplastia pulmonar. Con tratamiento quirúrgico12 se puede conseguir una supervivencia elevada.
La asociación de APSI a estenosis aórtica es muy infrecuente y su descripción en la bibliografía es excepcional, ya sea de forma aislada13 o formando parte del síndrome de ventrículo derecho hipoplásico14. La evolución suele ser mala, como en nuestra paciente, posiblemente por fallo ventricular izquierdo de origen multifactorial. Las alteraciones que pueden llevar a dicha situación son isquemia miocárdica y dilatación ventricular izquierda. La primera puede producirse por robo de sangre del lecho coronario y aporte de sangre poco oxigenada (procedente del ventrículo derecho) por los sinusoides, hipoperfusión coronaria debida a hipoperfusión sistémica por la estenosis aórtica y reducción de la presión arterial diastólica aórtica por efecto de la prostaglandina-E1. La segunda puede deberse a una sobrecarga de presión causada por la estenosis aórtica.
Correspondencia: Dr. J.R. Peraira.
San Marcial, 28, 1.o C. 28931 Móstoles. Madrid. España.
Correo electrónico: robertoperaira@hotmail.com