Palabras clave
INTRODUCCIÓN
El síndrome de la cimitarra se caracteriza por la conexión anómala de las venas pulmonares derechas a la porción suprahepática de la vena cava inferior o a la aurícula derecha por encima de la desembocadura de esta vena. Este síndrome incluye dextroposición del corazón debido a dextrorrotación, hipoplasia del pulmón derecho, hipoplasia de la arteria pulmonar derecha, anomalías sistémicas de la irrigación arterial al pulmón derecho (arterias colaterales aortopulmonares que pueden provocar un cortocircuito de izquierda a derecha), secuestro broncopulmonar con agenesia de bronquio derecho superior o medio, y otras anomalías extracardiacas y cardiacas. El 25% de los pacientes presenta malformaciones cardiacas y, entre ellas, la más frecuente es la comunicación interauricular1-4.
El diagnóstico de primera intención se hace por la imagen radiográfica. La ecocardiografía permite identificar el trayecto del drenaje anómalo de las venas pulmonares derechas hacia el colector curvo, la presencia de obstrucciones y el sitio de conexión en la porción suprahepática de la vena cava inferior. La técnica transtorácica tiene limitaciones diagnósticas hasta en el 33% de los casos; de ahí la importancia de complementarla con un estudio transesofágico5,6. La peculiaridad de este trabajo reside en la rareza de los casos extraídos de la población adulta.
El objetivo de esta publicación es comunicar el comportamiento clínico y ecocardiográfico de 7 pacientes adultos con este síndrome estudiados en el Instituto Nacional de Cardiología Ignacio Chávez de 1985 a junio de 2004.
PACIENTES Y MÉTODO
Es un estudio retrospectivo de 7 mujeres con diagnóstico de síndrome de la cimitarra estudiadas en la clínica de cardiopatías congénitas del adulto.
A todos los pacientes se les realizaron una historia clínica completa, una radiografía de tórax, un ecocardiograma transtorácico y transesofágico, y un cateterismo cardiaco izquierdo y derecho. A 2 se les practicó una tomografía computarizada para determinar el sitio de la conexión de las venas pulmonares derechas y para excluir la posibilidad de bronquiectasias o hipoplasia pulmonar, y a 3 resonancia magnética para definir el tipo de conexión en 2 y para determinar el sitio de la obstrucción del tubo colocado durante la cirugía en 1.
El estudio ecocardiográfico se realizó con equipos Philips sonos 1000 y 5500 con sonda transtorácica de 2,5 mHz y transesofágica biplanar y multiplanar. Para el análisis ecocardiográfico se utilizaron las guías específicas y no específicas descritas previamente4,6. En el corte paraesternal en ambas arterias se determinó el diámetro de la arteria pulmonar y de las ramas. Se utilizaron cortes transtorácicos apical y subcostal de cuatro cámaras para valorar con modo bidimensional las características del defecto septal interauricular, la conexión de las venas pulmonares, el drenaje la vena cava inferior, la presencia de obstrucción en el colector venoso, la dilatación de las cavidades derechas y la detección de colaterales aortopulmonares. Con Doppler color y continuo en un corte apical de cuatro cámaras, se colocó la muestra de volumen a la altura de las valvas tricúspides, se determinó el gradiente de presión entre la aurícula y el ventrículo derechos por método de Bernoulli y se multiplicó por el factor de corrección de 1,23 para obtener la presión sistólica de la arteria pulmonar.
Mediante la técnica transesofágica de cuatro cámaras se valoraron el tamaño y la localización del defecto septal interatrial, la forma de conexión de las venas pulmonares y la repercusión en las cavidades derechas; en el corte longitudinal a 70° se midió el diámetro de la arteria pulmonar y en el de 0°, el de las ramas pulmonares. Se consideró que la arteria pulmonar era hipoplásica cuando el diámetro de ésta fue < 18 mm y de las ramas cuando su diámetro fue < 10 mm6.
RESULTADOS
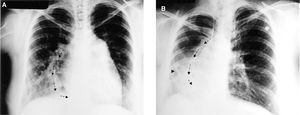
Los datos demográficos de los pacientes se muestran en la tabla 1. La sintomatología más frecuente fue la respiratoria (tos crónica, disminución de tolerancia al ejercicio e infección recurrente de las vías respiratorias) y progresión de disnea de grandes a medianos esfuerzos en el 90% de los casos. La radiografía de tórax mostró signo de la cimitarra en 4 de ellos (57%), (fig. 1 A y B).
Fig. 1. A: radiografía de tórax en posición anteroposterior que muestra el trayecto curvo del colector (flechas), cardiomegalia de grado II con abombamiento de la rama izquierda de la arteria pulmonar y ligera hipoplasia del lóbulo inferior del pulmón derecho. B: radiografía de tórax con dextrorrotación del corazón e hipoplasia de los lóbulos inferior y medio del pulmón derecho. Las flechas señalan el trayecto curvo del colector. La cabeza de flecha muestra una colateral aortopulmonar.
Los estudios ecocardiográficos transtorácicos y transesofágicos permitieron establecer el diagnóstico en el 86% de los casos; las anomalías cardiacas encontradas se muestran en la tabla 2.
Se encontró dextrocardia en 5 pacientes, dilatación de cavidades derechas e hipoplasia de la arteria pulmonar y sus ramas en 5, y presencia de borde romo (ausencia de venas pulmonares derechas drenando a la aurícula izquierda) en 5 pacientes.
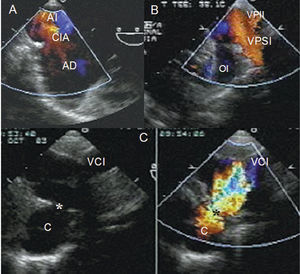
Con utilización de Doppler color se determinó el sitio de la conexión venosa pulmonar: en 2 se hallaba en la porción baja de la aurícula derecha, en 2 en la vena cava inferior a través de un colector, y en 3 en la unión de la aurícula derecha con la vena cava inferior. Tres pacientes tuvieron estrechamiento del colector en el sitio de la conexión a la vena cava inferior (fig. 2 A-D) (tabla 3).
Fig. 2. A: ecocardiograma transesofágico con Doppler color donde se observa el cortocircuito interauricular. B: ecocardiograma transesofágico con Doppler color que muestra las venas pulmonares izquierdas drenando a la aurícula izquierda por encima de la orejuela izquierda. C: imágenes bidimensional y con Doppler color que muestran el flujo turbulento del colector, el cual drena en el sitio de la unión de la vena cava inferior a la aurícula derecha. AD: aurícula derecha; AI: aurícula izquierda; C: colector; CIA: comunicación interauricular; VD: ventrículo derecho; VI: ventrículo izquierdo; OI: orejuela izquierda; VCI: vena cava inferior; VP: vena pulmonar; VPII: vena pulmonar inferior izquierda; VPSI: vena pulmonar superior izquierda. *Sitio de obstrucción del colector.
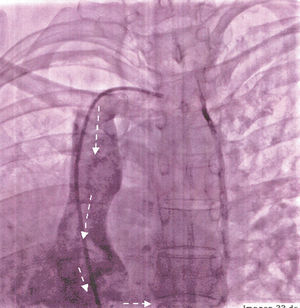
El diagnóstico ecocardiográfico tuvo alta concordancia con los hallazgos obtenidos por cateterismo cardiaco (fig. 3); este último permitió valorar la circulación colateral aortopulmonar observada en 1 caso.
Fig. 3. Estudio angiográfico que muestra el trayecto curvo del colector (flechas).
Seis pacientes fueron intervenidos quirúrgicamente para la corrección de la anomalía cardiaca asociada y la colocación de un conducto de derivación de las venas pulmonares derechas a la aurícula izquierda; sólo en 1 de éstos el reimplante de las venas pulmonares derechas a la aurícula izquierda se efectuó en un segundo tiempo. Un paciente fue reintervenido por obstrucción importante del tubo colocado para el reimplante.
El paciente restante con comunicación interauricular pequeña y sin hipertensión arterial pulmonar no fue operado, ya que se encontró en clase funcional I (tabla 2).
Los pacientes que fueron operados están en clase funcional I.
DISCUSIÓN
El síndrome de la cimitarra se clasifica en 3 grupos, de acuerdo con la edad de los pacientes, como se ha referido en un estudio multicéntrico de 122 pacientes con edades entre los 1 y los 58 años. El grupo I constituye la forma adulta sin hipertensión arterial pulmonar (HAP) y con comunicación interauricular pequeña, y es el mejor tolerado, como observamos en uno de nuestros pacientes; el grupo II se caracteriza por su asociación con anormalidades congénitas complejas que modifican la sintomatología y la historia natural de este síndrome; en este grupo se encuentran los 6 pacientes restantes. El grupo III es el infantil y está caracterizado por HAP severa y mal pronóstico2,4,5,7.
Los síntomas más comunes presentes en todos nuestros pacientes fueron los respiratorios y la disnea progresiva4,5,8.
En algunos casos, el signo radiográfico de la cimitarra no se observa por la dextrorrotación cardiaca o porque el colector venoso no es curvo ni ancho, sino más bien recto, delgado o múltiple. Este signo se presenta en un 70%, debido a que generalmente la hipoplasia del pulmón derecho está ausente en los adultos1,2.
El diagnóstico ecocardiográfico tuvo una buena correlación con el cateterismo cardiaco. La ecocardiografía transtorácica tiene más valor en niños con síndrome de la cimitarra, mientras que en los adultos se debe complementar el diagnóstico con ecocardiograma transesofágico para valorar las estructuras posteriores, como el septo interauricular, el tamaño, el número, la morfología y localización de los defectos, así como la conexión de las venas pulmonares que no pueden ser bien valoradas por la técnica transtorácica. La ecocardiografía transesofágica también es útil para detectar las obstrucciones de los tubos colocados para el reimplante, como sucedió en uno de los casos estudiados, que fue corroborado mediante resonancia magnética2,4,6,7.
Es muy importante determinar las zonas de la conexión supradiafragmática para un mejor tratamiento quirúrgico. Una alternativa quirúrgica podría ser el reimplante del colector a la pared posterior de la aurícula izquierda sin circulación extracorpórea5,8-10.
Sobre la base de nuestro estudio, concluimos que el síndrome de la cimitarra es raro y su diagnóstico se realiza en la mayoría de los casos mediante ecocardiografía. Con el desarrollo de técnicas no invasivas11,12, sólo en algunos casos el diagnóstico se complementa con cateterismo cardiaco.
Correspondencia: Dra. N. Espinola Zavaleta.
Departamento de Ecocardiografía. Instituto Nacional de Cardiología Ignacio Chávez.
Juan Badiano, 1. Colonia Sección XVI. Tlalpan 14080. México, DF.
Correo electrónico: niesza2001@hotmail.com
Recibido el 16 de septiembre de 2004.
Aceptado para su publicación el 10 de junio de 2005.