El control intensivo de la presión arterial sistólica (PAS) mejora los resultados de la estrategia de control de la presión arterial en el ensayo STEP con pacientes ancianos hipertensos. Sin embargo, se desconoce si los niveles de ácido úrico pueden afectar los beneficios del control intensivo de la PAS.
MétodosEl ensayo STEP fue un estudio controlado y aleatorizado que comparó el efecto del control intensivo (PAS objetivo de 110 o <130mm Hg) frente al tratamiento estándar (PAS objetivo de 130 o <150mm Hg) de la PAS en pacientes chinos hipertensos de entre 60 y 80 años. El objetivo primario incluyó un conjunto de eventos asociados a la enfermedad cardiovascular. Se utilizaron los modelos de curvas spline cúbicas restringidas y análisis de subgrupos para estudiar si los efectos del control intensivo de la PAS difieren en función las concentraciones basales de ácido úrico. Ambos modelos se basaron en la subdistribución de riesgos de Fine-Gray para el análisis del objetivo primario y los objetivos secundarios. El modelo de regresión de Cox se utilizó para el análisis de muerte por cualquier causa. También se analizaron las concentraciones de ácido úrico durante el seguimiento.
ResultadosEl riesgo del objetivo primario se incrementó con el incremento de la concentración de ácido úrico tanto en el grupo de tratamiento intensivo como en el de tratamiento estándar. Los pacientes bajo tratamiento intensivo mostraron menor subdistribución (ajustada de forma multivariable) del cociente de riesgo para el objetivo primario, aunque con un amplio solapamiento del IC 95%. La estratificación de pacientes por terciles de concentración de ácido úrico mostró un CR de 0,55 (IC95%, 0,36-0,86; p=0,008) para el tercil 1 (ácido úrico <303,0μmol/l), de 0,80 (IC95%, 0.56-1.14; p=0,22) para el tercil 2 (AcU 303,0 a <375,8μmol/l) y de 0,86 (IC95%, 0,60–1,21; p=0,39) para el tercil 3 (AcU ≥ 375,8μmol/l); p=0,29 para la interacción. Las tendencias fueron similares para la mayoría de las variables secundarias.
ConclusionesEl beneficio del control intensivo de la PAS no difiere en función de las concentraciones basales de ácido úrico. Registrado en ClinicalTrial.gov (Identificador: NCT03015311).
Palabras clave
La hipertensión es el principal factor que contribuye a la discapacidad y la mortalidad prematura en todo el mundo1. Cannon et al.2 informaron de que el 25% de los pacientes con hipertensión arterial no tratada presentaban hiperuricemia, definida como cifras de ácido úrico > 7,0mg/dl en varones y ≥ 6,0mg/dl en mujeres3, y que el índice de hiperuricemia era extremadamente elevado en pacientes que tomaban diuréticos (50%) y en aquellos con hipertensión arterial maligna (> 75%). Las altas concentraciones de ácido úrico aparecen como factor de riesgo cardiovascular potencialmente modificable en pacientes con hipertensión4, con un riesgo de eventos cardiovasculares de 3 a 5 veces superior en comparación con pacientes hipertensos con cifras de ácido úrico normales5.
Se ha comunicado que la hiperuricemia asintomática en pacientes de edad avanzada es un importante factor de riesgo de hipertensión refractaria6. Más importante aún, en pacientes de edad avanzada hospitalizados con hipertensión, la hiperuricemia se asocia con la necesidad de más medicamentos antihipertensivos para el control de la presión arterial, mayor uso de diuréticos y menor reducción de la presión arterial como respuesta al tratamiento médico7. Estos datos indican que la hiperuricemia atenúa la respuesta de la presión arterial al tratamiento antihipertensivo.
Últimamente, varios ensayos clínicos a gran escala han respaldado los efectos positivos del control intensivo de la presión arterial. Por ejemplo, en el ensayo STEP, el control intensivo de la presión arterial mejoró los resultados de pacientes mayores de 60 a 80 años8.
Dadas las complejas interacciones entre la presión arterial y el ácido úrico sérico, se llevó a cabo el presente estudio para ampliar las conclusiones comunicadas previamente, ya que ofrece un análisis más detallado de los objetivos primarios y secundarios según la uricemia basal.
MÉTODOSPoblación de estudio e intervenciónEl presente estudio comportó un análisis a posteriori del ensayo STEP. Los métodos y resultados del objetivo primario se han publicado previamente8,9. En resumen, el STEP es un ensayo prospectivo, multicéntrico, aleatorizado y controlado que se llevó a cabo en 42 centros clínicos de toda China. Los principales criterios de inclusión fueron: a) edad de 60 a 80 años; b) antecedentes de hipertensión y tratamiento con medicamentos antihipertensivos o presión arterial sistólica (PAS) de 140-190mmHg en 3 visitas de control, y c) registro de la uricemia basal del paciente. El principal criterio de exclusión fue el antecedente de accidente cerebrovascular isquémico o hemorrágico. Los criterios detallados de inclusión y exclusión se han descrito previamente en el protocolo del estudio9. Se aleatorizó a los pacientes en una proporción 1:1 a recibir tratamiento intensivo (PAS diana, <130mmHg) o tratamiento estándar (PAS diana, <150mmHg)8.
Este estudio es un análisis a posteriori del ensayo STEP, que fue aprobado por los comités de ética del Hospital Fu Wai y todos los centros colaboradores, y todos los pacientes seleccionados dieron su consentimiento informado por escrito. Por lo tanto, no se requirió aprobación adicional en el presente estudio. Número de registro del ensayo clínico: NCT03015311.
Mediciones de la presión arterial y el ácido úricoPersonal con formación (personal médico o de enfermería) se encargó de las mediciones de la presión arterial en el consultorio mediante un esfigmomanómetro digital de consultorio (OMRON Healthcare, Estados Unidos). Antes de la medición, los participantes permanecieron sentados en silencio al menos 5min y luego el personal del ensayo midió su presión arterial 3 veces a intervalos de 1min (de acuerdo con lo observado). Tanto la presión arterial en el consultorio como los datos analíticos, incluida la uricemia (análisis realizados en el laboratorio clínico del CIC de Pekín), se obtuvieron de manera estándar durante todas las visitas clínicas iniciales y de seguimiento. Los detalles sobre el control de calidad se han aportado en estudios anteriores9.
Resultados del ensayoComo ya se describía en el protocolo del estudio8,9, el resultado principal fue un objetivo compuesto que incluye muerte por causas cardiovasculares, accidente cerebrovascular, insuficiencia cardiaca aguda descompensada, revascularización coronaria, síndrome coronario agudo y fibrilación auricular. Los resultados secundarios fueron los componentes del resultado principal y la muerte por cualquier causa.
Análisis estadísticoEn los modelos de curvas spline cúbicas restringidas, el objetivo principal y los objetivos secundarios (excluida la muerte por cualquier causa) se analizaron según el modelo de riesgos de subdistribución proporcional de Fine-Gray. En el análisis de la muerte por cualquier causa, se utilizó el modelo de regresión de Cox. Respecto a la muerte por cualquier causa, se utilizó cox.zph() para probar la suposición de riesgos proporcionales de un modelo de regresión de Cox. Respecto a otros objetivos, se utilizó el modelo de riesgos de subdistribución proporcional de Fine-Gray para crear un conjunto de datos y luego se probó la suposición de riesgos proporcionales mediante cox.zph(). Las asociaciones entre la uricemia y todos los objetivos se evaluaron en una escala continua con curvas spline cúbicas restringidas. Este es un análisis multivariante que incluye variables relevantes para el pronóstico ajustadas (edad, sexo, índice de masa corporal, presión arterial diastólica, alanina aminotransferasa, aspartato aminotransferasa, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus, tasa de filtrado glomerular estimada)10.
Se incluyó a todos los participantes con una concentración basal de ácido úrico disponible y se los estratificó según estas concentraciones (tercil 1 [T1], <303,0μmol/l; tercil 2 [T2], de 303,0 a <375,8μmol/l, y tercil 3 [T3], ≥ 375,8μmol/l). Se calculó la media±desviación estándar de las variables continuas y, de las variables cualitativas, se calculó la proporción en cada categoría subestratificada por la concentración de ácido úrico. Las características basales en cada estrato se representan adecuadamente y se compararon con las pruebas más adecuadas (como el análisis de varianza, la prueba de la χ2 y la prueba de Kruskal-Wallis).
En los análisis del objetivo principal y los objetivos secundarios (excluida la muerte por cualquier causa), se calculó la incidencia acumulada de los 2 grupos de prueba según varios estratos con el modelo de riesgos de subdistribución proporcional de Fine-Gray, y los resultados se presentan como hazard ratio (HR) de subdistribución11. En el análisis de la muerte por cualquier causa, se utilizó el modelo de regresión de Cox y los resultados se presentan como HR. En el presente análisis se utilizó el principio de intención de tratar. Aunque en este estudio se registraron numerosos eventos y un solo paciente podía presentar más de un evento, en el análisis solo se utilizó el primer evento de cualquier tipo por paciente. El modelo 1 se ajustó por posibles factores de confusión, significativamente distintos entre el grupo de tratamiento intensivo y el grupo de tratamiento estándar. Los valores de p de la interacción en el análisis de subgrupos y las HR de subdistribución o HR con intervalos de confianza del 95% (IC95%) se utilizaron para comparar el control intensivo y el control estándar de la PAS en cada tercil.
Para comprobar la tendencia de las concentraciones de ácido úrico durante los años de seguimiento, el modelo de regresión con efectos mixtos fue utilizado por la función lme() del paquete nlme. En el modelo de efectos fijos, la variable dependiente fue la concentración de ácido úrico en el seguimiento. La interacción entre los años de seguimiento y el grupo de tratamiento proporcionó las diferencias reales entre los grupos de tratamiento. La autocorrelación entre mediciones repetidas se tuvo en cuenta en los efectos aleatorios. Los resultados de este análisis se tradujeron en medias de mínimos cuadrados (medias LS). Como análisis de sensibilidad, las interacciones entre el tratamiento con el ácido úrico como objetivos continuos se analizaron con la regresión de Cox para la mortalidad por cualquier causa y la regresión de Fine-Gray para otros objetivos principales y secundarios. Todos los análisis se llevaron a cabo con el programa R, versión 3.6.3 (R Foundation for Statistical Computing, Austria). Se consideró estadísticamente significativo un valor bilateral de p <0,05.
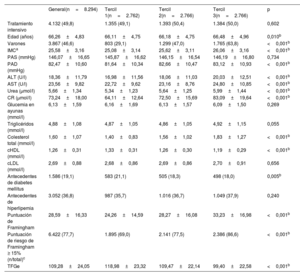
RESULTADOSCaracterísticas basales en 3 estratificaciones de la concentración de ácido úricoLa tabla 1 resume las características de toda la población del estudio y de cada tercil de ácido úrico. Se estratificó a los pacientes en 3 terciles (< 303,0μmol/l, de 303,0 a <375,8μmol/l y ≥ 375,8μmol/l) según su uricemia basal. En general, la media de edad de la muestra al inicio del estudio fue 66,26±4,83 años, la concentración media de ácido úrico al inicio del estudio fue de 347,26±89,15μmol/l, y casi la mitad de los pacientes (46,6%) eran varones. El índice de masa corporal medio fue 25,58±3,16 y la PAS media, 146,07±16,65mmHg. Las características basales estaban bien equilibradas entre los grupos de tratamiento intensivo y tratamiento estándar en cada tercil (tabla 2), lo que es coherente con los resultados del estudio principal8. Esto indica que la inclusión de pacientes en el presente estudio fue representativa.
Datos demográficos basales de los participantes en el ensayo STEP y de aquellos en las 3 estratificaciones de ácido úrico
| General(n=8.294) | Tercil 1(n=2.762) | Tercil 2(n=2.766) | Tercil 3(n=2.766) | p | |
|---|---|---|---|---|---|
| Tratamiento intensivo | 4.132 (49,8) | 1.355 (49,1) | 1.393 (50,4) | 1.384 (50,0) | 0,602 |
| Edad (años) | 66,26±4,83 | 66,11±4,75 | 66,18±4,75 | 66,48±4,96 | 0,010b |
| Varones | 3.867 (46,6) | 803 (29,1) | 1.299 (47,0) | 1.765 (63,8) | <0,001b |
| IMCa | 25,58±3,16 | 25,08±3,14 | 25,62±3,11 | 26,06±3,16 | <0,001b |
| PAS (mmHg) | 146,07±16,65 | 145,87±16,62 | 146,15±16,54 | 146,19±16,80 | 0,734 |
| PAD (mmHg) | 82,47±10,60 | 81,64±10,34 | 82,66±10,47 | 83,12±10,93 | <0,001b |
| ALT (U/l) | 18,36±11,79 | 16,98±11,56 | 18,06±11,03 | 20,03±12,51 | <0,001b |
| AST (U/l) | 23,56±9,82 | 22,72±9,62 | 23,16±8,76 | 24,80±10,85 | <0,001b |
| Urea (μmol/l) | 5,66±1,34 | 5,34±1,23 | 5,64±1,25 | 5,99±1,44 | <0,001b |
| CR (μmol/l) | 73,24±18,00 | 64,11±12,64 | 72,50±15,69 | 83,09±19,64 | <0,001b |
| Glucemia en ayunas (mmol/l) | 6,13±1,59 | 6,16±1,69 | 6,13±1,57 | 6,09±1,50 | 0,269 |
| Triglicéridos (mmol/l) | 4,88±1,08 | 4,87±1,05 | 4,86±1,05 | 4,92±1,15 | 0,055 |
| Colesterol total (mmol/l) | 1,60±1,07 | 1,40±0,83 | 1,56±1,02 | 1,83±1,27 | <0,001b |
| cHDL (mmol/l) | 1,26±0,31 | 1,33±0,31 | 1,26±0,30 | 1,19±0,29 | <0,001b |
| cLDL (mmol/l) | 2,69±0,88 | 2,68±0,86 | 2,69±0,86 | 2,70±0,91 | 0,656 |
| Antecedentes de diabetes mellitus | 1.586 (19,1) | 583 (21,1) | 505 (18,3) | 498 (18,0) | 0,005b |
| Antecedentes de hiperlipemia | 3.052 (36,8) | 987 (35,7) | 1.016 (36,7) | 1.049 (37,9) | 0,240 |
| Puntuación de Framingham | 28,59±16,33 | 24,26±14,59 | 28,27±16,08 | 33,23±16,98 | <0,001b |
| Puntuación de riesgo de Framingham ≥ 15% (n/total)c | 6.422 (77,7) | 1.895 (69,0) | 2.141 (77,5) | 2.386 (86,6) | <0,001b |
| TFGe | 109,28±24,05 | 118,98±23,32 | 109,47±22,14 | 99,40±22,58 | <0,001b |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; CR: creatinina; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada.
El índice de masa corporal se obtiene dividiendo el peso en kilogramos por el cuadrado de la estatura en metros.
Una puntuación de riesgo de Framingham del 15% o superior indica un alto riesgo de enfermedad cardiovascular a 10 años.
Los valores expresan n (%) o media ± desviación estándar. Los porcentajes pueden no sumar 100 debido al redondeo.
Para convertir los valores de glucemia en ayunas a miligramos por decilitro, se divide entre 0,05551. Para convertir los valores de colesterol a miligramos por decilitro, se divide entre 0,02586. Para convertir los valores de triglicéridos a miligramos por decilitro, se divide entre 0,01129.
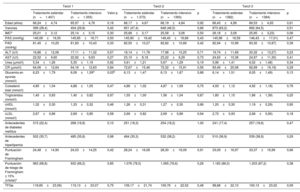
Datos demográficos basales de los pacientes de los grupos de tratamiento estándar y tratamiento intensivo sobre la base de 3 estratificaciones de ácido úrico
| Tercil 1 | Tercil 2 | Tercil 3 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Tratamiento estándar (n=1.407) | Tratamiento intensivo (n=1.355) | Valor p | Tratamiento estándar (n=1.373) | Tratamiento intensivo (n=1393) | p | Tratamiento estándar (n=1382) | Tratamiento intensivo (n=1384) | p | |
| Edad (años) | 66,24±4,74 | 65,97±4,76 | 0,16 | 66,17±4,67 | 66,19±4,84 | 0,92 | 66,43±4,99 | 66,53±4,93 | 0,61 |
| Varones | 399 (28,4) | 404 (29,8) | 0,42 | 651 (47,4) | 648 (46,5) | 0,66 | 873 (63,2) | 892 (64,5) | 0,51 |
| IMCa | 25,01±3,12 | 25,14±3,15 | 0,30 | 25,66±3,17 | 25,58±3,06 | 0,50 | 26,18±3,09 | 25,95±3,23) | 0,06 |
| PAS (mmHg) | 146,08±16,55 | 145,65±16,71 | 0,50 | 145,90±16,42 | 146,40±16,66 | 0,43 | 145,96±16,59 | 146,43±17,01) | 0,47 |
| PAD (mmHg) | 81,45±10,25 | 81,83±10,43 | 0,33 | 82,50±10,27 | 82,82±10,66 | 0,42 | 82,94±10,99 | 83,30±10,87) | 0,39 |
| ALT (U/l) | 16,86±12,06 | 17,11±11,02 | 0,57 | 18,14±11,78 | 17,98±10,25 | 0,71 | 19,74±11,69 | 20,32±13,27) | 0,23 |
| AST (U/l) | 22,52±9,60 | 22,92±9,63 | 0,27 | 23,10±8,18 | 23,22±9,29 | 0,73 | 24,63±10,38 | 24,97±11,30) | 0,41 |
| Urea (μmol/l) | 5,34±1,26 | 5,35±1,19 | 0,92 | 5,61±1,21 | 5,67±1,29 | 0,19 | 5,96±1,41 | 6,02±1,48) | 0,34 |
| CR (μmol/l) | 64,06±12,64 | 64,16±12,63 | 0,84 | 72,67±15,46 | 72,32±15,91 | 0,56 | 83,49±20,08 | 82,69±19,19) | 0,29 |
| Glucemia en ayunas (mmol/l) | 6,23±1,79 | 6,09±1,59d | 0,03b | 6,13±1,47 | 6,13±1,67 | 0,88 | 6,14±1,51 | 6,05±1,49) | 0,13 |
| Colesterol total (mmol/l) | 4,85±1,04 | 4,88±1,05 | 0,47 | 4,86±1,02 | 4,87±1,09 | 0,75 | 4,93±1,12 | 4,92±1,18) | 0,76 |
| Triglicéridos (mmol/l) | 1,40±0,83 | 1,40±0,82 | 0,97 | 1,55±1,00 | 1,56±1,04 | 0,87 | 1,80±1,15 | 1,86±1,39) | 0,25 |
| cHDL (mmol/l) | 1,32±0,30 | 1,33±0,32 | 0,46 | 1,26±0,31 | 1,27±0,30 | 0,66 | 1,20±0,30 | 1,19±0,29) | 0,90 |
| cLDL (mmol/l) | 2,67±0,86 | 2,69±0,85 | 0,58 | 2,69±0,82 | 2,69±0,89 | 0,94 | 2,72±0,93 | 2,68±0,90) | 0,18 |
| Antecedentes de diabetes mellitus | 315 (22,4) | 268 (19,8) | 0,10 | 251 (18,3) | 254 (18,2) | 1,00 | 241 (17,4) | 257 (18,6) | 0,47 |
| Antecedentes de hiperlipemia | 502 (35,7) | 485 (35,8) | 0,98 | 484 (35,3) | 532 (38,2) | 0,12 | 510 (36,9) | 539 (38,9) | 0,29 |
| Puntuación de Framingham | 24,48±14,90 | 24,03±14,25 | 0,42 | 28,24±16,08 | 28,30±16,09 | 0,91 | 33,09±16,97 | 33,37±16,99 | 0,66 |
| Puntuación de riesgo de Framingham ≥ 15% (n/total)c | 963 (68,8) | 932 (69,2) | 0,85 | 1.076 (78,5) | 1.065 (76,6) | 0,26 | 1.183 (86,0) | 1.203 (87,2) | 0,38 |
| TFGe | 118,85±23,56) | 119,13±23,07 | 0,75 | 109,17±21,74 | 109,76±22,52 | 0,48 | 98,68±22,10 | 100,13±23,02 | 0,09 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CR: creatinina; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada.
El índice de masa corporal se obtiene dividiendo el peso en kilogramos por el cuadrado de la estatura en metros.
Una puntuación de riesgo de Framingham del 15% o superior indica un alto riesgo de enfermedad cardiovascular a 10 años.
Ajuste de la glucemia en ayunas.
Los valores expresan n (%) o media ± desviación estándar. Los porcentajes pueden no sumar 100 debido al redondeo. Para convertir los valores de glucosa sérica en ayunas a miligramos por decilitro, se divide entre 0,05551. Para convertir los valores de colesterol a miligramos por decilitro, se divide entre 0,02586. Para convertir los valores de triglicéridos a miligramos por decilitro, se divide entre 0,01129.
Algunas de las características analizadas diferían según el tercil del ácido úrico; por ejemplo, los pacientes en el T1 eran más jóvenes, eran más probablemente mujeres, con más probabilidad de tener antecedentes de diabetes mellitus, menores índice de masa corporal, presión arterial diastólica basal, concentraciones de alanina aminotransferasa, aspartato aminotransferasa, urea, creatinina y triglicéridos y puntuación de Framingham, y mayor tasa de filtrado glomerular estimada (todos, p <0,05) (tabla 1).
Se analizaron comparaciones adicionales entre los grupos de tratamiento intensivo y tratamiento estándar de cada tercil. Excepto por la glucemia en ayunas, todas las características basales estaban bien equilibradas entre los 2 grupos del ensayo por tercil de ácido úrico (tabla 2).
Presión arterialLas tendencias generales en los diferentes terciles de ácido úrico coincidieron con las tendencias generales de cada grupo de tratamiento por separado (figura 1 del material adicional). Además, las 2 estrategias de tratamiento en diferentes terciles de ácido úrico generaron una diferencia entre los grupos igualmente rápida y constante en la PAS (figura 2 del material editorial), que es similar a los resultados de nuestro estudio publicado previamente8.
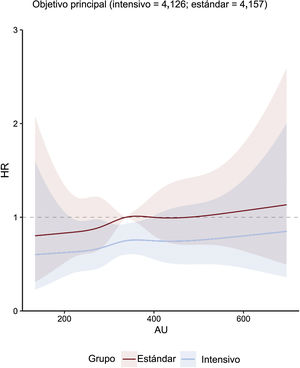
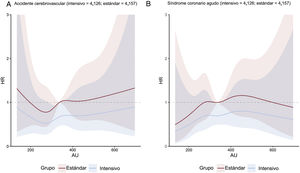
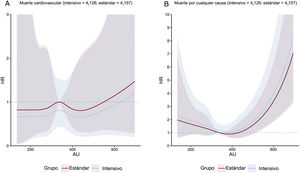
Concentración de ácido úrico y objetivos clínicosEn general, el riesgo del objetivo principal aumentó a medida que aumentaba la concentración de ácido úrico acumulada. Esta asociación se encontró tanto en el grupo de tratamiento intensivo como en el de tratamiento estándar (figura 1). La línea que representa la HR de subdistribución ajustada por múltiples variables del objetivo principal de los pacientes que recibieron tratamiento intensivo continuó por debajo de la equivalente de los pacientes que recibieron tratamiento estándar (figura 1). Sin embargo, las cifras mostraron una amplia superposición de los intervalos de confianza. La HR de subdistribución ajustada por múltiples variables de los objetivos secundarios, excepto la muerte por cualquier causa, mostró una tendencia similar (figura 2 y figura 3). Además, nuestros resultados mostraron que el ácido úrico (como valor continuo y en terciles) cumplió el supuesto de proporcionalidad en todos los objetivos.
Figura central. Regresión con curvas spline cúbicas que relacionan las concentraciones basales de ácido úrico como variable continua con el objetivo principal. La figura muestra HR con intervalos de confianza del 95% sombreados que relacionan las concentraciones basales de ácido úrico con el objetivo principal según el modelo de subdistribución de riesgos de Fine-Gray en cada grupo de tratamiento de la PAS, con concentraciones basales de ácido úrico como variables independientes y ajuste por covariables de edad, sexo, índice de masa corporal, PAD, ALT, AST, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus y tasa de filtrado glomerular estimada. ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; AU: ácido úrico; HR: hazard ratio; PAD: presión arterial diastólica.
A: regresión con curvas spline cúbicas que relacionan las concentraciones basales de ácido úrico como variable continua con el accidente cerebrovascular; la figura muestra HR con intervalos de confianza del 95% sombreados que relacionan las concentraciones basales de ácido úrico con el objetivo principal según el modelo de subdistribución de riesgos de Fine-Gray en cada grupo de tratamiento con PAS, con concentraciones basales de ácido úrico como variables independientes y ajuste por covariables de edad, sexo, índice de masa corporal, PAD, ALT, AST, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus y tasa de filtrado glomerular estimada. B: regresión con curvas spline cúbicas que relacionan las concentraciones basales de ácido úrico como variable continua con el síndrome coronario agudo; la figura muestra HR con intervalos de confianza del 95% sombreados que relacionan las concentraciones basales de ácido úrico con el objetivo principal según el modelo de subdistribución de riesgos de Fine-Gray en cada grupo de tratamiento con PAS, con concentraciones basales de ácido úrico como variables independientes y ajuste por covariables de edad, sexo, índice de masa corporal, PAD, ALT, AST, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus y tasa de filtrado glomerular estimada. ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; AU: ácido úrico; HR: hazard ratio; PAD: presión arterial diastólica.
A: regresión con curvas spline cúbicas que relacionan las concentraciones basales de ácido úrico como variable continua con la muerte cardiovascular; la figura muestra HR con intervalos de confianza del 95% sombreados que relacionan las concentraciones basales de ácido úrico con el objetivo principal según el modelo de subdistribución de riesgos de Fine-Gray en cada grupo de tratamiento con PAS, con concentraciones basales de ácido úrico como variables independientes y ajuste por covariables de edad, sexo, índice de masa corporal, PAD, ALT, AST, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus y tasa de filtrado glomerular estimada. B: regresión con curvas de spline cúbicas que relacionan las concentraciones basales de ácido úrico como variable continua con la muerte por cualquier causa; la figura muestra HR con intervalos de confianza del 95% sombreados que relacionan las concentraciones basales de ácido úrico con el objetivo principal según el modelo de subdistribución de riesgos de Fine-Gray en cada grupo de tratamiento con PAS, con concentraciones basales de ácido úrico como variables independientes y ajuste por covariables de edad, sexo, índice de masa corporal, PAD, ALT, AST, urea, creatinina, triglicéridos, colesterol unido a lipoproteínas de alta densidad, antecedentes de diabetes mellitus y tasa de filtrado glomerular estimada. ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; AU: ácido úrico; HR: hazard ratio; PAD: presión arterial diastólica.
Durante una mediana de seguimiento de 3,34 años, se produjeron 336 eventos del objetivo principal en 144 de 4.132 pacientes (3,5%; 1,0% por año) en el grupo de tratamiento intensivo y en 192 de 4.162 pacientes (4,6%; 1,4% por año) en el grupo de tratamiento estándar (HR de subdistribución = 0,74; IC95%, 0,60-0,92; p=0,007) (tabla 2 del material adicional). Por lo tanto, el tratamiento intensivo redujo de manera considerable la incidencia de eventos del objetivo principal en comparación con el tratamiento estándar, con una diferencia absoluta de 1,1 puntos porcentuales.
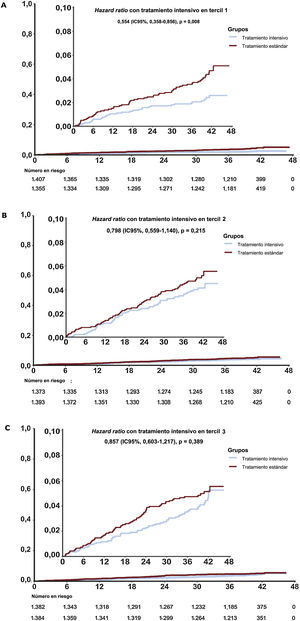
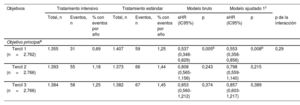
La incidencia de eventos del objetivo principal fue significativamente inferior en la T1 de la intervención intensiva sobre la PAS que con el tratamiento estándar (HR de subdistribución = 0,55; IC95%, 0,36-0,86; p=0,007) (tabla 3 y figura 4A). Además, no se obtuvo ningún beneficio significativo del tratamiento intensivo en los pacientes del T2 y el T3 en comparación con el tratamiento estándar (tabla 3 y figura 4B,C). El valor de p de la interacción entre el control de la PAS y la estratificación del ácido úrico fue 0,29. Los resultados de la mayoría de los objetivos secundarios fueron similares a los de los objetivos principales en varios terciles (tabla 3 del material adicional).
Hazard ratio de los objetivos principales por estratificación de ácido úrico
| Objetivos | Tratamiento intensivo | Tratamiento estándar | Modelo bruto | Modelo ajustado 1c | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Total, n | Eventos, n | % con eventos por año | Total, n | Eventos, n | % con eventos por año | sHR (IC95%) | p | sHR (IC95%) | p | p de la interacción | |
| Objetivo principala | |||||||||||
| Tercil 1 (n=2.762) | 1.355 | 31 | 0,69 | 1.407 | 59 | 1,25 | 0,537 (0,348-0,829) | 0,005b | 0,553 (0,358-0,856) | 0,008b | 0,29 |
| Tercil 2 (n=2.766) | 1.393 | 55 | 1,18 | 1.373 | 66 | 1,44 | 0,808 (0,565-1,156) | 0,243 | 0,798 (0,559-1,140) | 0,215 | |
| Tercil 3 (n=2.766) | 1.384 | 58 | 1,25 | 1.382 | 67 | 1,45 | 0,853 (0,560-1,212) | 0,374 | 0,857 (0,603-1,217) | 0,389 | |
IC95%: intervalo de confianza del 95%; sHR: hazard ratio de la subdistribución.
Incidencia acumulada del objetivo principal por estratificación de ácido úrico. Los riesgos acumulados a lo largo del tiempo se representan en hazard ratio (HR) asociadas del tercil 1 (A), el tercil 2 (B) y el tercil 3 (C). Las líneas representan a los grupos de tratamiento intensivo y estándar. El objetivo principal fue un combinado de accidente cerebrovascular, síndrome coronario agudo, insuficiencia cardiaca aguda descompensada, revascularización coronaria, fibrilación auricular o muerte por causas cardiovasculares. La HR, el intervalo de confianza del 95% (IC95%) y el valor de p del objetivo principal se calcularon mediante el modelo de subdistribución de riesgos de Fine-Gray para el riesgo concurrente de muerte. El recuadro muestra los mismos datos en un eje de ordenadas ampliado.
Como análisis de sensibilidad, la interacción entre el tratamiento y el ácido úrico como variable continua no reveló significación (tabla 4 del material adicional).
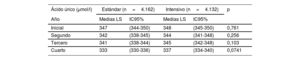
Concentraciones de ácido úrico durante el seguimientoLos resultados del modelo de regresión con efectos mixtos se tradujeron en medias LS (tabla 4). En el grupo de tratamiento estándar, la uricemia basal, en la primera, la segunda y la tercera visita fueron 347, 342, 341 y 333μmol/l. En el grupo de tratamiento estándar, las concentraciones de ácido úrico durante el seguimiento fueron 348, 344, 345 y 337μmol/l respectivamente. Los valores de p no revelaron diferencias significativas a lo largo del tiempo entre los 2 grupos de tratamiento (tabla 4).
Medias previstas de uricemia durante el seguimiento
| Ácido úrico (μmol/l) | Estándar (n=4.162) | Intensivo (n=4.132) | p | ||
|---|---|---|---|---|---|
| Año | Medias LS | IC95% | Medias LS | IC95% | |
| Inicial | 347 | (344-350) | 348 | (345-350) | 0,761 |
| Segundo | 342 | (338-345) | 344 | (341-348) | 0,256 |
| Tercero | 341 | (338-344) | 345 | (342-348) | 0,103 |
| Cuarto | 333 | (330-336) | 337 | (334-340) | 0,0741 |
IC95%: intervalo de confianza del 95%; Medias LS: medias de mínimos cuadrados.
A partir de un modelo de regresión con efectos mixtos (medias de mínimos cuadrados).
Los resultados del presente estudio indican que los efectos del control intensivo de la PAS en el objetivo principal no se vieron influidos por las concentraciones basales de ácido úrico ni en los análisis de regresión con curvas spline cúbicas ni en los análisis de terciles.
Recientemente, numerosos estudios han revelado la asociación entre ácido úrico e hipertensión. Las elevadas concentraciones de ácido úrico pueden contribuir a un mayor riesgo de hipertensión, hipertensión refractaria no controlada y un tratamiento farmacológico más agresivo. Una revisión sistemática reciente y un metanálisis revelaron que un aumento de 1,0mg/dl en la concentración de ácido úrico se asocia con un aumento del 13% en el riesgo de hipertensión de nuevo diagnóstico (IC95%, 1,06-1,20)12. También se ha comunicado que la hiperuricemia asintomática es un importante factor de riesgo de hipertensión refractaria en pacientes mayores6. Entre los pacientes con una media de edad de 59,2 años tratados con fármacos antihipertensivos, la concentración sérica de ácido úrico se asoció significativamente con presión arterial no controlada incluso después del ajuste por edad, índice de masa corporal y tasa de filtrado glomerular estimada13. Otro estudio también mostró que una concentración de ácido úrico elevada perjudica la eficacia del tratamiento antihipertensivo en pacientes mayores con hipertensión, como refleja la necesidad de más medicamentos antihipertensivos, mayor uso de diuréticos y respuestas de presión arterial atenuadas7.
Los posibles mecanismos subyacentes a cómo la alta concentración de ácido úrico puede inducir hipertensión y reducir los efectos protectores del tratamiento intensivo implican una activación excesiva del sistema renina-angiotensina-aldosterona14,15, estrés oxidativo14–17, inflamación18–21 y resistencia a la insulina22–25. Por lo tanto, sobre la base de la evidencia obtenida de la investigación de mecanismos básicos, es razonable suponer que el tratamiento para reducir el ácido úrico podría ser un enfoque terapéutico para la hipertensión. Algunos ensayos aleatorizados y controlados previos mostraron que la reducción del ácido úrico disminuyó considerablemente la presión arterial en adolescentes26,27 y adultos con gota refractaria crónica28, mientras que otros29,30 no revelaron una reducción significativa de la presión arterial. Estos resultados poco coherentes pueden explicarse por diferencias en la metodología junto con el efecto de los cambios en la función renal en las concentraciones séricas de ácido úrico. Por ejemplo, aunque la reducción del ácido úrico no redujo la presión arterial ambulatoria en la población general de adultos con hiperuricemia e hipertensión, hubo una reducción significativa de la presión arterial en el subgrupo preespecificado de pacientes con función renal normal29. La mayoría de los estudios mendelianos31,32 no respaldaron la asociación entre la presión arterial y el ácido úrico. Sin embargo, los estudios mendelianos tienen algunas limitaciones porque solo implican asociaciones vinculadas a genes, y aunque la hiperuricemia tiene un componente genético importante, está causada principalmente por hábitos de vida y dieta33. En los pacientes mayores, los efectos de la reducción de las concentraciones de ácido úrico en el control de la presión arterial siguen sin estar claros. El Scientific Workshop of the National Kidney Foundation informó de que el papel de la uricemia en la hipertensión aún no se ha determinado y requiere mayor investigación en ensayos a gran escala34.
Sin embargo, estudios previos se centraron, sobre todo, en si las concentraciones séricas de ácido úrico influyen en la aparición o el pronóstico de hipertensión. La evidencia sobre si la uricemia basal reduce los beneficios del control intensivo de la PAS aún se desconoce. Nuestro estudio utilizó 2 modelos para detectar la influencia de la uricemia en los efectos de la inervación de la PAS. Primero, los resultados del análisis con curvas spline mostraron una amplia superposición de los intervalos de confianza. En segundo lugar, en el análisis de subgrupos, el valor de p de la interacción entre el tratamiento y la estratificación del ácido úrico del objetivo principal no fue significativo. Además, en el análisis de sensibilidad, la interacción entre el tratamiento con ácido úrico como variable continua tampoco reveló significación. Todos estos resultados indican que los efectos del control intensivo de la PAS no estuvieron influidos por las concentraciones basales de ácido úrico.
En el ensayo STEP, los pacientes comenzaron el tratamiento con comprimidos de olmesartán medoxomilo (un antagonista de los receptores de la angiotensina) (20mg una vez al día) o comprimidos de besilato de amlodipino (un antagonista del calcio) (5-10mg una vez al día) como tratamiento inicial sin incluir hidroclorotiazida8. El olmesartán no aumenta significativamente las concentraciones de ácido úrico35,36 y el tratamiento antihipertensivo con amlodipino, un antagonista del calcio dihidropiridínico (5-10mg), se asocia con menor concentración sérica de ácido úrico37. Sin embargo, en estudios previos el tratamiento con tiazida provocó un aumento del 13% en las concentraciones plasmáticas de ácido úrico38. Aunque la hidroclorotiazida no se administró como tratamiento inicial en el ensayo STEP, el grupo de tratamiento intensivo recibió un mayor número de medicamentos y con toda probabilidad recibió una combinación de diuréticos, al contrario de lo que ocurrió en el grupo estándar39. Por lo tanto, es clínicamente significativo valorar si el control intensivo de la presión arterial eleva las concentraciones de ácido úrico. El modelo de regresión con efectos mixtos se utilizó para probar los cambios en las concentraciones de ácido úrico durante el seguimiento según la interacción entre los años de seguimiento y los grupos de tratamiento. Los resultados no revelaron diferencias significativas en las concentraciones de ácido úrico a lo largo del tiempo entre los 2 grupos de tratamiento (tabla 4).
LimitacionesLa principal limitación de este estudio es que gran parte de la variación notificada en la HR entre los subgrupos se debió al azar y que, en ausencia de una interacción estadísticamente significativa, la mejor estimación del efecto de la intervención vino dada por la estimación del efecto en todo el estudio con la inclusión de todos los pacientes. Además, el análisis a posteriori de ensayos aleatorizados y controlados está sujeto a posibles factores de confusión. En este estudio, este inconveniente se presentó como un gran solapamiento de los intervalos de confianza tanto en los análisis de regresión con curvas spline cúbicas como en los análisis de tertiles.
CONCLUSIONESNuestro estudio no revela diferencias en el beneficio del control intensivo de la PAS en pacientes con diferentes concentraciones basales de ácido úrico. Los conjuntos de datos utilizados y/o analizados durante el presente estudio están disponibles a través del autor para correspondencia mediante la solicitud adecuada.
FINANCIACIÓNEste trabajo contó con el apoyo del Fondo de Innovación CAMS de Ciencias Médicas (CIFMS, 2021-I2M-1-007), Financiación Nacional de Investigación Clínica Hospitalaria de Alto Nivel (2022-GSP-GG-5, 2022-GSP-PT-12), Fundación Nacional de Ciencias Naturales de China (Proyecto ID. 81825002) y el Programa de Jóvenes Científicos Destacados de Beijing (Proyecto ID, BJJWZYJH0120191002302), Comisión Municipal de Ciencia y Tecnología de Beijing (Proyecto ID, Z191100006619106, Z201100005620006), Proyecto clave del Proyecto de Innovación Científica y Tecnológica de la Academia China de Ciencias Médicas Chinas (Proyecto ID: CI2021A00920).
CONTRIBUCIÓN DE LOS AUTORESX. Wang y J. Tan contribuyeron por igual al concepto y el diseño del estudio, la recopilación y el análisis de datos y la redacción del original, y son primeros autores del original. J. Cai y W. Zhang hicieron contribuciones importantes al diseño del estudio, la orientación intelectual y la revisión de la redacción del original. S. Zhang hizo contribuciones importantes a la revisión de la redacción del original. Todos los autores leyeron y aprobaron el artículo final.
CONFLICTO DE INTERESESLos autores declaran que no existe ningún conflicto de intereses en relación con la publicación de este artículo.
- –
Estudios previos han puesto de manifiesto la asociación entre ácido úrico e hipertensión. Las altas concentraciones de ácido úrico pueden contribuir a un mayor riesgo de hipertensión, hipertensión refractaria no controlada y un tratamiento farmacológico más agresivo. Las altas concentraciones de ácido úrico mermaron la eficacia del tratamiento antihipertensivo en pacientes mayores con hipertensión, como lo refleja la necesidad de más medicamentos antihipertensivos, un mayor uso de diuréticos y respuestas de presión arterial atenuadas. Esta información indica que las concentraciones de ácido úrico pueden influir en los beneficios del control intensivo de la PAS.
- –
Nuestro estudio revela que no se observan diferencias en el beneficio del control intensivo de la PAS en pacientes con concentraciones basales de ácido úrico diferentes. Esta conclusión se probó mediante 2 modelos, análisis de regresión con curvas spline cúbicas y análisis de terciles. Además, aunque el grupo de tratamiento intensivo recibió un mayor número de medicamentos y con toda probabilidad recibió una combinación de diuréticos, al contrario de lo que ocurrió en el grupo estándar, no se encontraron diferencias significativas en las concentraciones de ácido úrico a lo largo del tiempo entre los 2 grupos de tratamiento.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2023.01.003