Palabras clave
INTRODUCCION
Si bien los años previos estuvieron marcados por la finalización de los grandes ensayos clínicos con desfibriladores y resincronización, y en el campo de la ablación por la incorporación de la fibrilación auricular a los sustratos tratables, en 2007 la investigación se ha centrado más en lograr incrementar la eficiencia en la práctica clínica de estas terapias a través de un mejor conocimiento de la fisiopatología, la identificación de perfiles clínicos con los que optimizar las indicaciones y el desarrollo de innovaciones técnicas en dispositivos y navegadores. Ha persistido el ritmo vertiginoso de progreso de la genética molecular, creciendo sus implicaciones clínicas.
Veremos como, a pesar de todos estos importantes avances, quedan todavía por resolver numerosas cuestiones. Durante este año se han publicado las guías de la Sociedad Europea de Cardiología sobre indicaciones de marcapasos y resincronización, y se han mantenido con éxito los registros de desfibrilador y ablación de la Sociedad Española de Cardiología.
A continuación, se revisa alguna de la información relevante sobre estos aspectos.
ESTRATIFICACION DE RIESGO EN PREVENCION PRIMARIA DE MUERTE SUBITA
La microalternancia de la onda T (MA-T) es el procedimiento no invasivo de estratificación de riesgo en prevención primaria más evaluado en la literatura científica. En un estudio publicado recientemente1 se demuestra que, incluso en una población de bajo riesgo como los pacientes postinfarto con función ventricular conservada, un test positivo para MA-T se asocia con la aparición de eventos arrítmicos durante el seguimiento, aunque el valor predictivo positivo de la prueba fue muy bajo (9%). En una cohorte de casi 800 pacientes con miocardiopatía isquémica y sin historia previa de arritmias (pacientes tipo MADIT II), Chow et al2 han comprobado que la implantación de un desfibrilador automático implantable (DAI) se asocia con una menor mortalidad total y arrítmica en los pacientes con test para MA-T no negativo (positivo o indeterminado), y no encontraron asociación en los pacientes con test negativo. Este trabajo indica que la MA-T es una herramienta prometedora a la hora de identificar a los pacientes con mayor y menor probabilidad de obtener beneficio de la implantación de un DAI profiláctico. Por otro lado, en un estudio similar pero en una población de mayor riesgo, como la de pacientes con disfunción ventricular izquierda remitidos por síncope o taquicardia ventricular (TV) no sostenida, Cantillon et al3 han demostrado que la MA-T no es capaz de identificar a un subgrupo de pacientes de suficiente bajo riesgo como para obviar la necesidad de implantar un DAI. Varios estudios prospectivos y aleatorizados que ya están en marcha permitirán aclarar el verdadero papel de la MA-T como técnica de rastreo de uso sistemático a la hora de determinar la necesidad de implantar un DAI profiláctico.
En otros estudios publicados en 2007 se exploran otros métodos de estratificación de riesgo más novedosos, como el patrón oscilatorio de ventilación durante el ejercicio4, la dinamicidad de la repolarización ventricular durante el registro Holter de 24 h5, o la identificación de la heterogeneidad tisular en la zona periinfarto mediante cardiorresonancia6. Por otro lado, en un interesante estudio realizado en 600 pacientes con intervalo QT largo de tipo 1 se ha demostrado por primera vez que el análisis genético (tipo de mutación y función biofísica) puede tener utilidad en la determinación del pronóstico de estos enfermos7, aparte de los factores de riesgo clínicos clásicos o la utilización de bloqueadores beta.
Aunque disponemos de múltiples técnicas de estratificación de riesgo en prevención primaria de la muerte súbita, hasta la actualidad la mayor parte de ellas han mostrado importantes limitaciones. La investigación en este campo es intensa, por lo que cabe esperar nuevas e interesantes aportaciones en un futuro no lejano.
GENÉTICA Y ENFERMEDADES HEREDITARIAS
La identificación de la mutación genética puede ser de gran trascendencia en el subgrupo de enfermedades hereditarias; sin embargo, las técnicas de análisis del ADN aún continúan estando muy restringidas debido al coste de la tecnología necesaria. Miller et al8 muestran una técnica que podría facilitar dicho análisis genético. Esta técnica se basa en el análisis del ARN mensajero (obtenido de una muestra de sangre) y permite, de forma más sencilla y barata, identificar mutaciones causantes del síndrome de QT largo (SQTL), la miocardiopatía hipertrófica, la miocardiopatía dilatada y del síndrome de Marfan.
En los últimos años, la concepción del espectro clínico de diferentes enfermedades hereditarias está variando. Sen-Chowdhry et al9 muestran que, en la displasia arritmogénica del ventrículo derecho (VD), la afectación del ventrículo izquierdo (VI) no sólo se produce en la fase final de la enfermedad, lo cual apoya la denominación de la enfermedad como cardiomiopatía arritmogénica. En una cohorte de 200 individuos afectados de la enfermedad demostraron, mediante resonancia nuclear, que un 40% de los pacientes tenía afectación del VI, mientras la función sistólica del VD estaba aún conservada. Habría 3 patrones distintos de enfermedad: la clásica (aparece afectación del VI en las fases finales, cuando el VD está ya dilatado y es disfuncionante), otra con afectación predominante del VI, y la que desde el principio produce afectación biventricular. Estas últimas 2 formas están claramente infradiagnosticadas porque los criterios actuales de displasia arritmogénica se centran en la afectación del VD. En los casos de mutaciones de la desmoplaquina, la afectación del VI fue más frecuente que en las mutaciones de la desmogleína-2 o la placofilina-2.
Recientemente se ha notificado que, dentro del espectro de la miocardiopatía hipertrófica, algunos individuos sólo desarrollan un «fenotipo restrictivo», con fallo diastólico severo con mínima hipertrofía ventricular o ausencia de ella. Kubo et al10 analizaron una serie de 1.226 pacientes afectados de miocardiopatía hipertrófica y 19 pacientes (1,5%) fueron clasificados como fenotipo restrictivo. Dicho fenotipo parece relacionarse con mutaciones en la cadena pesada de la betamiosina y en la troponina I cardiaca.
Es conocido que determinadas mutaciones causantes del SQTL implican un peor pronóstico, pero estos datos suelen proceder del análisis de series de pacientes que en su mayoría han tenido eventos antes de alcanzar la edad adulta. Sauer et al11 han analizado una serie de más de 800 adultos (mayores de 18 años) afectados de SQTL con la mutación identificada, y han encontrado los siguientes factores de riesgo de muerte súbita y/o parada cardiaca reanimada: sexo femenino (hazard ratio [HR] = 2,7), presencia de síncope después de los 18 años (HR = 5,1) y un QTc ≥ 500 ms (HR = 3,3 para QTc de 500-550 ms; HR = 6,4 para QTc > 550 ms). El tratamiento con bloqueadores beta redujo en un 60% este riesgo. El genotipo, un QTc < 500 ms y la historia de síncope antes de los 18 años no fueron factores de riesgo.
Igualmente, hay pocos estudios sobre el riesgo del embarazo en las mujeres afectadas del SQTL. Seth et al12 analizan una serie de 391 mujeres con SQTL que habían estado embarazadas y muestran que tienen un bajo riesgo de eventos cardiacos durante el embarazo (odds ratio [OR] = 0,28; intervalo de confianza [IC] del 95%, 0,10-0,76; p = 0,01), pero ese riesgo está aumentado en los primeros 9 meses del posparto (OR = 2,7; IC del 95%, 1,8-4,3; p < 0,001), especialmente en las que tienen el SQTL tipo 2. Pasados los primeros 9 meses tras el posparto, el riesgo es similar al de antes del embarazo. Los bloqueadores beta redujeron el riesgo de eventos durante el puerperio.
Tampoco hay muchos datos sobre el pronóstico de los niños con el síndrome de Brugada. Probst et al13 analizan la mayor serie de niños con el patrón de Brugada publicada hasta la fecha, consistente en 30 niños con una edad media de 8 ± 4 años. En un seguimiento medio de 37 ± 23 meses, hubo un caso de muerte súbita y 2 de los 5 niños con un DAI recibieron una descarga apropiada. Se identificó la fiebre como el desencadenante más frecuente de síncope (5 casos). Como en los adultos, el riesgo de eventos arrítmicos fue más alto en los niños previamente sintomáticos y en los que en el momento basal presentaban el patrón de Brugada de tipo I.
El síndrome de QT corto es poco frecuente, pero su prevalencia actual no se conoce. Reinig et al14 revelan la rareza de dicho síndrome mediante un trabajo en el que analizaron retrospectivamente más de 475.000 electrocardiogramas (ECG), recogidos a lo largo de 16 años y pertenecientes a más de 100.000 pacientes, en el que no encontraron ningún caso con un QTc < 300 ms.
Dentro de los síndromes de muerte súbita familiar, Antzelevitch et al15 definen una nueva canalopatía consistente en un funcionamiento defectuoso de los canales cardiacos de calcio tipo L. Su manifestación en el ECG es un patrón similar al del síndrome de Brugada en las precordiales derechas combinado con un acortamiento del intervalo QT (QTc ≤ 360 ms).
En cuanto a la fibrilación auricular (FA), se trata de una pandemia cuya prevalencia aumenta con la edad. Aunque mutaciones en el canal de potasio se han asociado con la FA familiar, ésta representa un ínfimo porcentaje de todos los casos de FA. Gudbjartsson et al16 analizaron una serie cercana a 21.000 personas, de origen europeo y chino, y encontraron que dos variantes del cromosoma 4q25 suponían un aumento en el riesgo de presentar FA (incremento de riesgo de 1,4 y 1,7), independientemente de la edad.
FIBRILACION AURICULAR
La FA ha continuado centrando la atención de la comunidad electrofisiológica durante el pasado año, tanto desde el punto de vista asistencial como de investigación. Como muestra el Registro Español de Ablación con Catéter, en el año 2005 no sólo se duplicó el número de laboratorios que realizan ablación de FA respecto al año anterior, sino que también se incrementó notablemente el número de procedimientos, representando el 8% del total17.
Los principales factores que permiten explicar estos datos son la elevada prevalencia y el gran impacto clínico de la FA, así como la relativa ineficacia de los fármacos antiarrítmicos y la mejora progresiva de las técnicas de ablación. Así, en el estudio PREV-ICTUS se realizó un análisis transversal de 7.138 sujetos > 60 años en España y se encontró una prevalencia de FA del 8,5%18. Por otra parte, el Estudio FAP demostró que, en nuestra población, la FA paroxística sin cardiopatía estructural presenta una elevada tasa de recidivas (27,5%) al año tras el primer episodio y que un porcentaje significativo (7%) se cronifica a los 2,5 años de seguimiento19. Aunque la supervivencia a largo plazo (> 30 años) de la FA aislada sin cardiopatía estructural es similar a la de la población general, en el 29% de los pacientes la FA se hizo permanente a pesar de tratamiento con antiarrítmicos clásicos20. Además, estos pacientes mostraron un incremento del riesgo de desarrollar insuficiencia cardiaca y fenómenos embólicos a largo plazo, en especial los que tenían otros factores de riesgo. También la incidencia de FA en el postoperatorio inmediato de cirugía coronaria es elevada (23%), y la ausencia de tratamiento con estatinas conllevó un mayor riesgo de FA en el postoperatorio21. Esto fue confirmado por el estudio aleatorizado ARMYDA-3, en el que la administración de atorvastatina en la semana previa a la intervención redujo un 61% el riesgo de presentar FA en el postoperatorio, en comparación con el placebo22.
En los estudios EURIDIS y ADONIS se evaluó la eficacia de la dronedarona a largo plazo en pacientes con FA paroxística o persistente23. Así, en comparación con el placebo, la dronedarona prolongó significativamente el tiempo hasta la primera recurrencia (53 frente a 116 días) y redujo un 23% el parámetro de valoración combinado de hospitalización o muerte, con un perfil de seguridad superior a la amiodarona. Sin embargo, menos del 36% de los pacientes en tratamiento con dronedarona permaneció libre de FA al año de seguimiento, lo que de nuevo confirma la relativa falta de eficacia de los fármacos antiarrítmicos. Por el contrario, la ablación con radiofrecuencia ha presentado avances significativos en el tratamiento de la FA, aunque en subgrupos de pacientes altamente seleccionados. En el estudio APAF se comparó la eficacia de la ablación circunferencial de las venas pulmonares frente al tratamiento antiarrítmico convencional con flecainida, sotalol o amiodarona en las dosis máximas toleradas en pacientes con FA paroxística de larga evolución24. Tras un año de seguimiento, la proporción de pacientes en ritmo sinusal fue significativamente superior en el grupo que recibió ablación de FA (el 86 frente al 22%; p < 0,001), y el número de pacientes que requirieron ingreso hospitalario también fue menor. Recientemente, este método de ablación circunferencial asociado con la verificación de bloqueo de conducción mediante el uso de catéter circular ha demostrado ser superior al mero aislamiento segmentario de cada una de las venas por separado25. Sin embargo, este método de ablación que incluye parte del tejido auricular que rodea ambas venas ipsolaterales ha demostrado ser insuficiente para mantener en ritmo sinusal a una proporción aceptable de pacientes con FA persistente. Por ese motivo, se han propuesto diversas técnicas, de carácter fundamentalmente empírico, que implican la creación de lesiones en amplias zonas de ambas aurículas26. El grupo de Michigan ha comunicado recientemente los resultados de una estrategia de ablación dirigida de manera exclusiva a la eliminación de electrogramas fragmentados (longitud de ciclo ≤ 120 ms, actividad continua, fragmentados) en pacientes con FA crónica26. Mediante este método, sólo un tercio de los pacientes se mantenía en ritmo sinusal sin fármacos al cabo de un año, mientras que un 44% requirió al menos 2 procedimientos para alcanzar una cifra del 57% en ritmo sinusal.
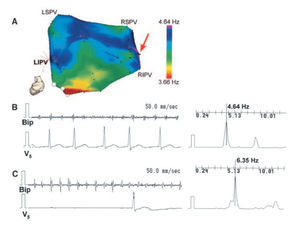
Otros grupos han dedicado su esfuerzo investigador a conocer mejor los mecanismos causantes del mantenimiento de la fibrilación auricular, con la intención de desarrollar métodos de tratamiento con una base fisiopatológica más sólida. Atienza et al27 realizaron infusiones de adenosina durante la FA y evaluaron su efecto sobre las frecuencias dominantes en pacientes con FA paroxística y persistente27. El aumento de las frecuencias dominantes durante el pico de efecto de la adenosina indica que la FA estaría mantenida por una reentrada y descarta la posibilidad de un mecanismo automático o mediado por actividad desencadenada como causante del mantenimiento de la FA (fig. 1). La frecuencia dominante aumentó de manera especial los puntos con una frecuencia de activación basal mayor, permitiendo así identificar los puntos causantes del mantenimiento de la FA que podrían ser eliminados mediante ablación. Finalmente, otros autores han evaluado el efecto de la denervación selectiva auricular mediante ablación endocárdica y epicárdica guiada por estimulación de alta frecuencia en pacientes con FA paroxística supuestamente vagal, y han encontrado que podría ser efectiva por sí sola únicamente en un pequeño subgrupo de pacientes28.
Fig. 1. A. Visión posterior de un mapa de frecuencias dominantes de la aurícula izquierda en un paciente con fibrilación auricular paroxística. El mapa en tiempo real se obtuvo mediante el sistema CARTO previamente a la infusión de adenosina. La flecha roja señala el punto con una frecuencia dominante mayor en las proximidades del ostium de la vena pulmonar inferior derecha (RIPV). B. registro del electrograma basal del punto con mayor frecuencia dominante y el correspondiente espectrograma, junto con la derivación V5 de referencia. C. Registro del electrograma del mismo punto durante el pico de efecto de la adenosina y su correspondiente espectrograma, que demuestra un incremento muy marcado en la frecuencia dominante. LIPV: vena pulmonar inferior izquierda; LSPV: vena pulmonar superior izquierda; RIPV: vena pulmonar inferior derecha; RSPV: vena pulmonar superior derecha. Tomada con permiso de Atienza et al27.
SINCOPE
Dos estudios transversales llevados a cabo en Estados Unidos (condado de Olmsted)29 y Holanda30 aportan nueva información acerca de la prevalencia y la incidencia de síncope en la población general, aspectos cuyos datos disponibles eran limitados y, en parte, contradictorios. En el primer estudio se estima, en una muestra de 1.925 personas > 45 años, una prevalencia de síncope del 19%, mayor en las mujeres que en los varones. El 10% de los episodios se complicó con traumatismo, recurriendo el síncope en la mitad de casos. En el estudio holandés, en el que se incluyó a 524 personas de 35-60 años, se estima una incidencia acumulada de síncope a lo largo de la vida del 35%, también mayor en mujeres, con un pico de incidencia a los 15 años, mientras que el inicio después de los 35 años es excepcional. La incidencia es muy superior a la previamente comunicada en el estudio de Framingham debido, según los autores, a que en este último sólo se interrogó sobre la presencia de síncope previo a los pacientes que tuvieron un episodio durante la fase de estudio.
Todavía no está definitivamente establecido el papel de la estimulación permanente en el tratamiento del síncope vasovagal y, de hecho, las guías europeas31 publicadas en 2007 no establecen ninguna indicación clase I, lo que justifica los ensayos clínicos en curso. A principio de 2007 se publicó un metaanálisis32 de 9 estudios aleatorizados con marcapasos en el síncope vasovagal en el que se encontró una gran hetereogeneidad entre ellos. El marcapasos se mostró efectivo sólo en los estudios no ciegos (OR = 0,04), mientras que no tuvo efecto en los estudios doble ciego (OR = 0,83); ello indica que su supuesta eficacia está mediada por la gran expectativa de beneficio que suscita en los médicos y pacientes. Como no podía ser de otra forma en un tema tan controvertido, Brignole et al33 llegan a conclusiones bien distintas tras comparar la recurrencia de síncope durante asignación a placebo frente a la ausencia de tratamiento en los estudios controlados de fármacos y marcapasos en el síncope vasovagal. Encuentran una tasa de recurrencia de síncope inferior con marcapasos (15%) que con placebo (38%) o ausencia de tratamiento (34%), y concluyen que el placebo no es un tratamiento eficaz para el síncope neuromediado. La discordancia de resultados de los ensayos con marcapasos la ponen en relación con la disparidad en los criterios de inclusión empleados. Quizá, éste es el aspecto más importante que queda por dilucidar: cómo identificar a la población diana que pueda beneficiarse de la estimulación, si es que la hay. No parece que los tests de basculación y del adenosintrifosfato (ATP) vayan a ayudar en la toma de decisiones, atendiendo al resultado del ISSUE II34. Tras incluir a 392 pacientes con al menos 3 síncopes severos en los últimos 2 años, con ECG normal y sin cardiopatía, se pudo documentar, con un registrador de eventos implantable, síncope espontáneo en 106 (26%). Las características clínicas, la evolución y el mecanismo del síncope apenas tuvieron relación con el resultado de estos tests, lo que va en contra de lo publicado inicialmente sobre la utilidad del test de ATP/adenosina para predecir la necesidad de tratamiento con marcapasos.
ABLACION CON CATÉTER
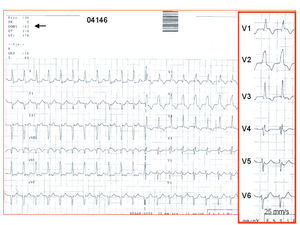
En 2 estudios35,36 se ha abordado un tipo de taquicardia ventricular monomorfa postinfarto caracterizada por tener un complejo QRS poco ancho. Esta presentación electrocardiográfica es infrecuente, induciéndose en el 5,9% (QRS < 140 ms)35 y el 11% de todos los pacientes (QRS < 145 ms)36 con taquicardia ventricular e infarto previo, casi todos ellos con una cicatriz que se extiende al septo interventricular. La explicación del patrón «seudoestrecho» reside, para Abello et al35, en el origen septal de las taquicardias, con independencia del patrón de bloqueo de rama derecha (4 casos) o izquierda (4 casos), que permite una activación rápida de ambos ventrículos. En el estudio de Bogun et al36, 7 de los 9 pacientes tenían taquicardias con un patrón similar al de las fasciculares idiopáticas (bloqueo de rama derecha del eje superior izquierdo; fig. 2), y sólo uno tenía taquicardia con bloqueo de rama izquierda, registrándose un potencial de Purkinje en el septo visible también en ritmo sinusal. Desde él consiguieron el encarrilamiento con fusión oculta con S-QRS corto, así como éxito de la ablación en este punto de salida del circuito. Todo ello indica que el sistema de Purkinje forma parte del circuito de estas taquicardias sobre una cicatriz y es el causante del QRS «seudoestrecho». Hasta ahora, la red de Purkinje se había implicado en las arritmias por isquemia en la fase aguda del infarto y no en las de la fase crónica.
Fig. 2. Taquicardia ventricular con un complejo QRS «seudoestrecho». Registro de 12 derivaciones de la taquicardia clínica en una paciente con infarto inferior. La medida automática de la anchura del QRS (flecha) es 102 ms y muestra un patrón de bloqueo de rama derecha del haz de His con eje superior izquierdo muy similar al de las taquicardias ventriculares fasciculares idiopáticas. En el estudio electrofisiológico se pudo reproducir la taquicardia (medida manual del QRS de 128 ms) y comprobar el origen ventricular y el mecanismo macrorreentrante ligado a la cicatriz postinfarto inferior.
Un paso más en la revolución que están suponiendo los sistemas de navegación no fluoroscópica es el resultado del estudio de Klemm et al37. Estos autores combinan la cartografía de contacto en ritmo sinusal y la cartografía sin contacto durante la taquicardia para identificar, dentro de las zonas de escara, los puntos de salida del circuito de todas las taquicardias inducidas, en 12 pacientes con taquicardia ventricular postinfarto. Con este abordaje consiguieron suprimir el 77% de ellas, con independencia de su longitud de ciclo, simplemente con la realización de una línea de ablación en el borde de la escara que, así, abarcaba todos los puntos de salida, que resultan estar bastante próximos entre sí.
Las guías de práctica clínica asignan a la ablación con catéter un papel limitado en el tratamiento de la taquicardia ventricular monomorfa en la displasia arritmogénica de VD. El estudio de Dalal et al38 realizado en 24 pacientes seguidos durante una media de 3 años confirma que, aunque la tasa de éxito agudo es aceptable (77%), a largo plazo la tasa de recurrencias es muy alta, sea cual sea el resultado inicial de la ablación, debido a la naturaleza difusa y evolutiva de esta miocardiopatía.
La navegación magnética robótica, a pesar de su alto coste, va ganando aceptación gracias a la reproducibilidad de sus resultados, con independencia de la experiencia del operador, un hecho determinante cuando se abordan sustratos más complejos e infrecuentes. En España, según los datos del Registro Nacional de Ablación17 de 2005, los sustratos abordados con más frecuencia siguen siendo la taquicardia intranodal, las vías accesorias y el istmo cavotricuspídeo, que en conjunto constituyen el 76% de los procedimientos. Las taquicardias ventriculares en presencia de cardiopatía suponían únicamente el 4%. En estas últimas, el grupo del Massachusetts General Hospital39 comunica la alta seguridad y eficacia de la navegación magnética robótica para realizar ablación endocárdica y epicárdica del sustrato ventricular en 24 pacientes consecutivos con diversas cardiopatías, con un uso mínimo de la radioscopia. El éxito agudo es del 97%, sin recurrencias tras un seguimiento medio de 7 meses. Este estudio abre nuevos campos a la aplicación clínica de este sistema robótico (Niobe Stereotaxis®) más allá de los sustratos sencillos40 y la fibrilación auricular, donde ya se había validado, entrando en un campo en el que puede resultar especialmente útil en vista de la complejidad y la dificultad técnica que entraña la ablación de taquicardia ventricular.
La ablación del istmo cavotricuspídeo es ya un procedimiento estándar en todas las unidades de arritmias, con indicación establecida en caso de ineficacia de los fármacos antiarrítmicos y no tanto tras un primer episodio bien tolerado, situación donde no disponíamos de ningún estudio aleatorizado. A final de 2006 se publicó un ensayo clínico41 en 104 pacientes mayores de 70 años con un primer episodio de aleteo auricular, que demuestra, a los 13 meses, la superioridad de la ablación sobre la amiodarona para prevenir recurrencias del aleteo (el 3,8 frente al 29,5%; p < 0,0001), con una menor incidencia de efectos secundarios significativos (el 0 frente al 10%; p = 0,03). De esta forma, la ablación del istmo cavotricuspídeo sigue ganando terreno a los fármacos gracias a su gran eficacia y seguridad17.
DESFIBRILADOR AUTOMATICO IMPLANTABLE
Las últimas guías de práctica clínica para el tratamiento de las arritmias ventriculares de las sociedades Americana y Europea de Cardiología, publicadas el año pasado, otorgan un papel preponderante al DAI en el tratamiento de múltiples condiciones clínicas. Sin embargo, durante 2007 han continuado publicándose trabajos que pretenden evaluar la eficacia de esta terapia y la selección apropiada de pacientes en diferentes condiciones fisiopatológicas. Maron et al42 publicaron un registro multicéntrico de los DAI implantados entre 1986 y 2003 en 506 pacientes con miocardiopatía hipertrófica, de los que sólo en un cuarta parte se trataba de una medida de prevención secundaria. El DAI terminó de forma adecuada un episodio taquicardia/fibrilación ventricular (TV/FV) en el 20% de los pacientes durante un seguimiento medio de 3,7 años. Más del 25% de los pacientes que experimentaron descargas apropiadas tomaban amiodarona, lo que refuerza la relativa ineficacia de esta terapia. Llamativamente, en los casos de prevención primaria, más de un tercio de los pacientes con descargas apropiadas presentaba, en el momento del implante, un único factor de riesgo. Con estos datos, los autores concluyen que la presencia de un único factor de alto riesgo para muerte súbita puede ser suficiente para justificar la implantación profiláctica de un DAI en pacientes seleccionados, probablemente, los de edad más joven.
En otro registro multicéntrico publicado a finales de 2006, Sacher et al43 muestran los resultados de 220 pacientes con patrón de Brugada de tipo 1 en el ECG, a los que se implantó un DAI en 14 centros entre 1993 y 2005. Durante un seguimiento medio de 38 meses, sólo el 8% de los pacientes recibió una terapia apropiada (el 22% de los pacientes con historia de muerte súbita, el 10% de los pacientes con historia de síncope y el 4% de los pacientes asintomáticos con estudio electrofisiológico positivo). En el estudio multivariable, el único predictor de descarga apropiada que se encontró fue la historia de muerte súbita recuperada, mientras que la inducibilidad en el estudio electrofisiológico no resultó significativa. Curiosamente, a muchos de los pacientes con historia de muerte súbita recuperada se les realizó un estudio electrofisiológico, que fue positivo sólo en una pequeña proporción. Estos datos demuestran la dificultad que entraña en la actualidad la decisión de implantar un DAI en estos pacientes, dado la baja aunque no despreciable tasa de eventos arrítmicos en el seguimiento y la carencia de métodos efectivos de estratificación del riesgo de arritmias. La validez de estos métodos constituye un tema particularmente controvertido, sobre todo en lo que se refiere a la utilidad pronóstica del estudio electrofisiológico, como se pone de manifiesto en este trabajo.
Durante este año se han publicado también algunos estudios de carácter más técnico sobre el DAI. El estudio ASSURE44 es el primer gran estudio prospectivo multicéntrico en el que se compara el test de margen de seguridad de desfibrilación frente al el test de margen de seguridad de vulnerabilidad al implante. Este estudio se basa en la correlación que se ha demostrado entre el límite superior de vulnerabilidad y el umbral de desfibrilación. Ambos métodos aparentemente proporcionan un grado de seguridad similar con respecto al éxito de la primera descarga en el seguimiento clínico. En una etapa en la que muchos incluso dudan de la necesidad de realizar test de desfibrilación en el momento implante, este trabajo demuestra que es posible limitar o incluso evitar la inducción de FV en pacientes graves. Sin embargo, una importante limitación del test de vulnerabilidad es que no permite evaluar la capacidad del dispositivo para sensar de forma adecuada una FV.
Datos recientes indican que los DAI bicamerales podrían estar asociados con un incremento del riesgo de hospitalización por fallo cardiaco y mortalidad total, probablemente debido a la estimulación ventricular derecha innecesaria. Este año se ha publicado el estudio multicéntrico INTRINSIC RV45, en el que se compara la estimulación DDDR con el algoritmo de histéresis de búsqueda auriculoventricular con la programación en modo VVIR, en pacientes portadores de DAI que no requerían estimulación derecha. Este estudio ha demostrado que el modo DDDR es tan bueno o incluso mejor (se observó una tendencia que no alcanzó significación estadística) que el modo VVIR en cuanto a mortalidad u hospitalización por fallo cardiaco. Los datos indican que los DAI bicamerales constituyen una opción válida en los pacientes que se puedan beneficiar de estimulación DDDR (p. ej., por bradicardia sinusal) o que requieran de una mejor discriminación de sus arritmias.
En el año 2007 se ha publicado también un subestudio del MADIT II46, que demuestra que la implantación de un DAI en pacientes mayores de 75 años con enfermedad coronaria y función ventricular deprimida se asocia con una reducción de la mortalidad equivalente a la de la población más joven, sin compromiso de la calidad de vida de los ancianos. El estudio MADIT II limitó la inclusión de pacientes mayores con comorbilidad severa; sin embargo, es posible que, hasta cierto punto, la edad no deba ser por sí misma causa de exclusión para implantar un DAI.
El Registro Español de DAI de 2005 publicado a final del año pasado47 sigue siendo uno de los pocos registros nacionales publicados en todo el mundo y recoge 2.050 implantes, que suponen una tasa por millón de habitantes de 46,4, 13 puntos superior al año previo. Aunque la indicación más frecuente sigue siendo la prevención secundaria, en especial por taquicardia ventricular monomorfa en la cardiopatía isquémica con disfunción ventricular, se mantiene la tendencia hacia un aumento de la indicación profiláctica (39,5%). Del total de dispositivos implantados, una cuarta parte de ellos fueron dispositivos con TR-C. La gran mayoría de los implantes se realiza en el laboratorio de electrofisiología (65%) fuera del quirófano, con una muy baja incidencia de complicaciones intraoperatorias.
RESINCRONIZACION CARDIACA
Los beneficios de la terapia de resincronización cardiaca (TRC) han sido demostrados en estudios aleatorizados, los cuales implican un estrecho seguimiento de los pacientes y durante un período relativamente corto. El estudio MILOS48 es un registro observacional multicéntrico en el que se ha analizado una serie de 1.303 pacientes que recibieron TRC con un seguimiento medio de 34 meses. La supervivencia libre de eventos fue definida como ausencia de muerte, transplante cardiaco urgente o implante de un dispositivo de asistencia ventricular. Dicha supervivencia libre de eventos fue del 92% a un año y del 56 % a 5 años. La incidencia acumulada de muerte por fallo de bomba fue del 25%, y la de muerte súbita, del 9,5%. Respecto a la TRC sola (fig. 3), el uso de TRC con DAI implicó una reducción no significativa de la mortalidad de un 20% (p = 0,3), con un claro efecto protector del 96% sobre la muerte súbita (p < 0,002). La tasa anual de muerte súbita en los pacientes con TRC sin DAI fue mucho menor que la observada en pacientes similares tratados con bloqueadores beta o espironolactona, pero aumentó progresivamente con el tiempo.
Fig. 3. Análisis multivariable según la regresión de Cox en el que se determinan los distintos tipos de mortalidad en función de que se implante un desfibrilador automático resincronizador (TRC-DAI) o un resincronizador marcapasos (TRC). HR: hazard ratio; IC: intervalo de confianza; VI: ventrículo izquierdo. Modificada con permiso de Auricchio et al48.
Aunque la indicación de la TRC está consolidada en los pacientes con miocardiopatía dilatada, bloqueo de rama izquierda y ritmo sinusal, el papel en los pacientes en FA aún es controvertido. Delnoy et al49 analizan los efectos beneficiosos de la TRC en una serie de 263 pacientes, en la que el 37% tenía FA crónica y el 63%, ritmo sinusal. En ambos grupos se obtuvo, al año de seguimiento, una mejoría similar en la capacidad funcional, la calidad de vida, la reducción del volumen telesistólico del VI, el aumento de la fracción de eyección del ventrículo izquierdo (FEVI) y reducción de la necesidad de hospitalizaciones. Después de un año de TRC, el 25% de los pacientes con FA crónica habían pasado a ritmo sinusal. Aunque se precisan ensayos aleatorizados, este estudio apunta a que el hecho de estar en FA no ha de ser óbice para indicar la TRC, y que puede ser aconsejable implantar un electrodo auricular debido a la probabilidad de pasar a ritmo sinusal.
Actualmente, uno de los principales problemas de la TRC continúa siendo la identificación de parámetros que permitan reducir ese 20-30% de pacientes que no mejoran. La ecocardiografía ha demostrado ser útil para definir qué paciente puede beneficiarse más de la TRC. Sin embargo, son numerosos los métodos ecocardiográficos disponibles para cuantificar la asincronía mecánica, hay una gran variabilidad entre ellos y aún está por definir cuál es el método óptimo. Este año se han publicado trabajos que muestran el dudoso valor de 2 de los parámetros ecocardiográficos aceptados como predictores de respuesta favorable a la TRC: el retraso existente entre el pico sistólico de desplazamiento del septo y de la pared posterior en modo M (retraso SP-PP), y el retraso entre la contracción del septo basal y la pared lateral de VI valorado por Doppler tisular (retraso SP-L). En un trabajo español se ha mostrado, en una serie prospectiva de 67 pacientes con TRC, cómo el retraso SP-PP falla en predecir tanto la respuesta clínica (evaluada como mejoría en el test de los 6 min y ausencia de trasplante cardiaco/muerte) como el remodelado ventricular inverso a los 6 meses de seguimiento50, lo cual concuerda con lo que ya había sido apuntado en un análisis retrospectivo del estudio CONTAK-CD51. Por otra parte, en el trabajo de Soliman et al52 se muestra que un retraso SP-L ≥ 60 ms no sirve para predecir la mejoría clínica y ecocardiográfica. Es más, dado que el 80% de los pacientes con retraso SP-L < 60 ms tuvo una probada mejoría clínica y ecocardiográfica con la TRC, estos pacientes no se hubieran beneficiado de dicha terapia si se hubiese empleado como criterio para indicarla un retraso SP-L > 60 ms.
En cuanto a la técnica del implante del electrodo de VI a través del seno coronario, hoy por hoy, continúa siendo un procedimiento complejo que precisa una combinación de recursos técnicos y experiencia para disminuir la proporción de implantes fallidos. En el trabajo de Macías et al53 se analizan los predictores de implante fallido del electrodo izquierdo en una serie de 212 pacientes consecutivos de 2 centros españoles. Hubo un 12% de implantes fallidos a través del seno coronario y los predictores de dicho fallo fueron 2: la presencia de FA permanente (OR = 7,7; IC del 95%, 2,5-23,9; p = 0,002) y un diámetro anteroposterior de la aurícula izquierda aumentado (OR = 11,7; IC del 95%, 3,1-37,6; p < 0,001), con un punto de corte para este diámetro definido en 48,5 mm. En esta Revista se ha publicado que la técnica de la doble guía puede incrementar la proporción de éxito en el implante del electrodo a través de venas tortuosas, con una entrada muy angulada o con una válvula. Se describen 20 casos en los que de forma convencional no se lograba avanzar el electrodo, y con esta técnica sí pudo lograrse54. Szilagyi et al55 describen que se puede estabilizar el electrodo en el interior del seno coronario mediante el implante de un stent en la vena coronaria que aloja el electrodo. Presentan una serie de 36 pacientes en los que se había producido una dislocación del electrodo del VI (29 durante el implante y 7 en el postoperatorio), y mediante un stent no se volvió a desplazar (tras un seguimiento de 11 ± 5 meses). No hubo ninguna complicación relacionada con este procedimiento.
En los casos en que finalmente no se logra el implante en una vena coronaria, una alternativa puede ser implantar el electrodo por vía transeptal. Van Gelder et al56 presentan una serie de 10 pacientes con implante fallido a través del seno coronario y en los que en 9 se logró con éxito el implante endocárdico en el VI a través de una punción transeptal auricular, obteniéndose un umbral de captura adecuado (0,78 ± 0,24 V) y sin estimulación frénica. La anticoagulación oral se mantuvo de forma crónica debido a que se desconoce el riesgo tromboembólico a medio-largo plazo de este procedimiento.
ABREVIATURAS
DAI: desfibrilador automático implantable.
FA: fibrilación auricular.
MA-T: microalternancia de la onda T.
TRC: terapia de resincronización cardiaca.
Correspondencia: Dr. L. Tercedor Sánchez.
Servicio de Cardiología. Hospital Virgen de las Nieves.
Avda. de las Fuerzas Armadas, 2. 18014. Granada. España.
Correo electrónico: luis.tercedor.sspa@juntadeandalucia.es