Palabras clave
FISIOPATOLOGÍA
Progresión e inestabilización de la aterosclerosis
Este año se han publicado los resultados del estudio ILLUSTRATE, en el que se evaluó el efecto del tratamiento con torcetrapib sobre la progresión de la aterosclerosis coronaria, medida con ecografía intravascular, en 1.188 pacientes con enfermedad coronaria tratados con estatinas. A pesar de inducir un aumento importante de las concentraciones de colesterol unido a lipoproteínas de alta densidad (cHDL) y una reducción adicional del colesterol unido a lipoproteínas de baja densidad (cLDL), este fármaco no tuvo ningún efecto sobre la progresión de la placa de ateroma a los 24 meses1. Poco después se publicaron los resultados del estudio RADIANCE-1, en que el torcetrapib tampoco modificó la progresión de la aterosclerosis carotídea2. Aunque no pueden descartarse efectos adversos específicos del fármaco, que en ambos estudios aumentó la presión arterial, en conjunto estos resultados suponen un revés importante a los intentos de frenar la aterogénesis mediante la inhibición de la proteína de transferencia de colesteril éster. Por contra, en un estudio reciente3 realizado en un modelo de aterosclerosis en conejos se ha confirmado el efecto de la apolipoproteína A1-Milano recombinante sobre la regresión de la placa, y se ha demostrado que su administración disminuye la expresión de diferentes marcadores de inflamación y la actividad gelatinolítica, lo que indica que esta prometedora estrategia antiaterogénica podría tener, además, un efecto estabilizador de las lesiones.
Las técnicas de modificación genética han permitido seguir avanzando en el conocimiento de los factores involucrados en el desarrollo de la aterosclerosis. Así, se ha demostrado que la deficiencia en el receptor para la LDL oxidada LOX-14 o en la proteína A asociada con el embarazo5 protege frente a la aterosclerosis en cepas de ratones propensos a desarrollar esta enfermedad.
Isquemia, reperfusión y remodelado ventricular
En este campo también ha habido contribuciones significativas. La adiponectina es una citocina secretada por el tejido adiposo cuyas concentraciones se asocian inversamente con la presencia de obesidad, diabetes y enfermedad coronaria, y con el riesgo de infarto agudo de miocardio. Recientemente se describió que la adiponectina protege contra el daño por isquemia y reperfusión, y este año, en un estudio se ha confirmado este efecto protector y se ha demostrado que está mediado, en parte, por una disminución del estrés oxidativo y nitrosativo6. En la misma área, en otro estudio se ha subrayado la importancia del mantenimiento de la acidosis durante los primeros minutos de la reperfusión, con la inhibición subsiguiente de la apertura del poro de transición mitocondrial, en el efecto protector del poscondicionamiento isquémico7.
También ha habido avances en el conocimiento de los mecanismos del remodelado ventricular postinfarto. En particular, se ha demostrado que la activación del sistema NADPH-oxidasa desempeña un papel principal en la dilatación y la disfunción ventricular después del infarto8, y que la administración de inhibidores de la ciclooxigenasa 2 puede potenciar esta evolución desfavorable9.
Finalmente, mediante su inhibición genética o su neutralización por anticuerpos, se ha demostrado que la proteína quimiotáctica de monocitos 1 (MCP-1) favorece la fibrosis intersticial, la infiltración por macrófagos y la disfunción ventricular en un modelo murino de miocardiopatía isquémica, lo que podría tener implicaciones terapéuticas10.
TÉCNICAS DIAGNÓSTICAS
Detección de la enfermedad aterosclerótica
La detección de lesiones ateroscleróticas, mediante técnicas no invasivas, es un área de candente actualidad11. Recientemente se ha descrito que la medición del calcio coronario podría complementar los métodos tradicionales de estimación del riesgo cardiovascular12, y se ha comprobado que la tomografía computarizada con multidetectores (TCMD) permite detectar estenosis en los injertos aortocoronarios y en los stents coronarios.
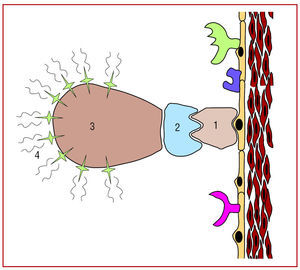
Además, este año se ha avanzado mucho en la caracterización de las placas ateroscleróticas con técnicas de imagen molecular (fig. 1). En estudios realizados con tomografía por emisión de positrones con 18F-fluorodesoxiglucosa se ha demostrado que el aumento de la captación en las lesiones es proporcional a su actividad inflamatoria13. Se ha desarrollado mediante técnicas de fluorescencia un sensor de la actividad de la catepsina K, una proteasa involucrada en la inestabilización de las placas14, y se han sintetizado microburbujas ultrasónicas dirigidas a la molécula 1 de adhesión de las células vasculares (VCAM-1), con las que también se puede estimar la actividad inflamatoria local15. Estos resultados son todavía preliminares, pero permiten aventurar que en un futuro no muy lejano las técnicas de imagen molecular se usarán de forma sistemática para identificar a los pacientes con aterosclerosis, predecir el riesgo de complicaciones agudas y valorar la respuesta al tratamiento.
Fig. 1. Representación esquemática del concepto de imagen molecular. La molécula específica que se quiere investigar (receptores específicos, integrinas, moléculas de adhesión, etc., representadas en la gráfica con el número 1) es identificada por un ligando, que se une a la molécula que se desea estudiar. Los ligandos (representados con el número 2 en la gráfica) suelen ser anticuerpos monoclonales que reconocen específicamente la molécula a estudio. Previamente (in vitro) el ligando ha sido unido a sustancias emisoras de señal (número 4 en la gráfica). Esta unión a los emisores de señal se hace mediante un vehículo (número 3 en la gráfica) que tiene la capacidad de unirse específicamente al ligando y las sustancias emisoras de señal. De esta manera se pueden localizar determinadas moléculas mediante técnicas de imagen. Tomada de Ibáñez et al11.
Visualización del miocardio isquémico e infartado
Durante la reperfusión se expresan proteínas de adhesión por el endotelio, y la P-selectina es la que lo hace en primer lugar. En 2 estudios recientes realizados en roedores se ha podido detectar la existencia precedente de isquemia de breve duración y establecer su localización y extensión mediante ecocardiografía con inyección de microburbujas ligadas a la P-selectina16 o a su ligando17. Estos resultados abren la posibilidad de utilizar este abordaje en la evaluación del dolor torácico de origen incierto, aunque deben confirmarse en humanos y está por determinar la ventana de positividad de esta técnica y sus posibles ventajas sobre los métodos convencionales.
Se ha continuado avanzando en la visualización y la cuantificación del infarto. En particular, se ha comprobado la utilidad de la resonancia magnética (RM) para detectar infartos de ventrículo derecho y para diferenciar entre infartos agudos y crónicos, así como para la estimación de la transmuralidad mediante ecocardiografía con strain bidimensional. Con una ecocardiografía con contraste intracoronario, Bodí et al18 han descrito que, en la mitad de los pacientes con infarto reperfundido con éxito, los defectos de perfusión miocárdica presentes en la fase aguda se mantienen en los meses siguientes, y que esta evolución podría asociarse con el remodelado ventricular18. Finalmente, la RM ha permitido validar distintas escalas de puntuación angiográfica para calcular el área en riesgo en pacientes con infarto agudo de miocardio19.
SÍNDROME CORONARIO AGUDO SIN ELEVACION DEL SEGMENTO ST
Las principales aportaciones en el año 2007, dentro del síndrome coronario agudo sin elevación persistente del segmento ST (SCASEST), se pueden clasificar en los siguientes apartados: a) evaluación del dolor torácico agudo de origen coronario incierto; b) factores pronósticos en el SCASEST; c) estrategia invasiva frente a conservadora; d) tratamiento farmacológico; e) registros de SCASEST, y f) nuevas guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento del SCASEST.
Evaluación del dolor torácico agudo de origen coronario incierto
La toma de decisiones ante un paciente con dolor torácico agudo de posible origen coronario, sin cambios isquémicos en el electrocardiograma y con valores normales de troponina, es una de las situaciones más difíciles a las que se enfrenta el cardiólogo de guardia o el médico de urgencias. En conjunto, se trata de una población de bajo riesgo y, en muchos casos, sin enfermedad coronaria. No obstante, en algunos de estos pacientes, la angina inestable es la causa del dolor torácico y su riesgo es alto. Así, mediante sencillas variables clínicas, se pudo identificar un subgrupo de pacientes cuyo pronóstico es similar al de los pacientes con descenso del segmento ST en el electrocardiograma (ECG) o con elevación de las concentraciones de troponina20 (fig. 2). El desarrollo de una unidad estructural de dolor torácico facilita la correcta evaluación de estos enfermos21. La prueba de esfuerzo constituye la herramienta auxiliar más utilizada para detectar el subgrupo de alto riesgo. Se han investigado, además, otras exploraciones complementarias que superen las limitaciones de la prueba de esfuerzo convencional: ecocardiografía de estrés22, tomografía computarizada con emisión de fotón único (SPECT) de perfusión miocárdica en reposo23 y tomografía computarizada (TC) coronaria24. En todos estos estudios se demostró la eficacia de estas técnicas más complejas que la prueba de esfuerzo, aunque su disponibilidad para el cribado del dolor torácico en los servicios de urgencias de nuestros hospitales aún está lejos.
Fig. 2. Curvas de Kaplan-Meier para muerte o infarto de miocardio, en 4 grupos de pacientes con dolor torácico sin elevación del segmento ST. Grupo 1, sin elevación de troponina, sin descenso del ST y de bajo riesgo según una puntuación clínica de riesgo; grupo 2, sin elevación de troponina, sin descenso del segmento ST y de alto riesgo según una puntuación clínica de riesgo; grupo 3, sin elevación de troponina pero con descenso del segmento ST; grupo 4, con elevación de troponina. Se observa una estrecha superposición de las curvas correspondientes a los grupos 2, 3 y 4 (p = 0,6), en tanto que el pronóstico es significativamente mejor en el grupo 1 (p = 0,0001). El dato más relevante es el pronóstico similar del grupo 2 (a pesar de valores de troponina y electrocardiograma normales) y los grupos 3 y 4. Tomada de Sanchis et al20.
También se han realizado contribuciones importantes en la identificación precoz de los pacientes con posible síndrome coronario agudo mediante biomarcadores. La calprotectina (MRP8/14) es un heterodímero formado por 2 proteínas expresadas, entre otros, por los monocitos y los neutrófilos activados. En pacientes con síndrome coronario agudo se ha demostrado la expresión frecuente de MRP8/14 por estas células en el trombo coronario y su presencia aumentada en la sangre periférica ya desde las primeras horas del inicio de los síntomas, por lo que podría ser útil en el diagnóstico precoz de la enfermedad coronaria inestable25. Respecto a los marcadores tradicionales, también se ha descrito que la práctica de determinaciones seriadas de proteína C reactiva es útil en la estratificación del riesgo de los pacientes con dolor torácico26.
Factores pronósticos en el síndrome coronario agudo sin elevación del segmento ST
Se han validado y comparado los modelos pronósticos, basados en variables clínicas, de los estudios TIMI, PURSUIT y GRACE, en un registro canadiense de síndrome coronario agudo en el que se incluyó a 1.728 pacientes27. Los modelos PURSUIT y GRACE demostraron un elevado poder de discriminación para la mortalidad hospitalaria y al año (estadístico C de 0,80), en tanto que la precisión del modelo TIMI (posiblemente el de utilización más extendida) fue inferior. Queda por dilucidar el valor de estos modelos para predecir el infarto o identificar el subgrupo de pacientes que se podría beneficiar más de una estrategia intervencionista.
También se ha estudiado el valor pronóstico de diferentes biomarcadores, algunos relativamente sencillos y disponibles en cualquier hospital. Así, la hiperglucemia en el momento del ingreso se asoció con una mayor mortalidad tras un seguimiento medio de 42 meses después de un SCASEST28. Un recuento de leucocitos > 10.000 células/ml fue un predictor de mortalidad en pacientes con infarto agudo de miocardio sin elevación del segmento ST, aunque careció de valor pronóstico en los pacientes con troponina normal29. Asimismo, en pacientes con valores normales de creatinina, el cálculo del filtrado glomerular fue un factor independiente de mortalidad hospitalaria30.
También se han investigado otros biomarcadores más sofisticados. La neopterina es un biomarcador sintetizado por los monocitos que indica actividad inmunológica Su elevación a los 7 días de un síndrome coronario agudo incrementó el riesgo de muerte o evento coronario agudo a los 2 años31. Además, el tratamiento con altas dosis de atorvastatina atenuó el riesgo en el subgrupo de pacientes con neopterina elevada. En el futuro se debería validar la relevancia clínica de la neopterina como marcador pronóstico, tras ajustar por todas las posibles variables de valor pronóstico, así como definir el mejor punto de corte para su aplicación práctica. En relación con el NT-proBNP, su incremento fue un predictor independiente de mortalidad, aunque no de infarto, en el estudio ICTUS32. No obstante, no se observó un mayor beneficio de la estrategia invasiva en los pacientes con elevación de NT-proBNP.
Estrategia invasiva frente a conservadora
A finales de 2006 se publicó un metaanálisis en el que se comparó la estrategia conservadora frente a la invasiva en el SCASEST33. Se incluyeron los 7 estudios aleatorizados contemporáneos, es decir, en la época con disponibilidad de stents coronarios e inhibidores de la glucoproteína IIb-IIIa. El metaanálisis tiene interés especialmente desde la publicación del estudio ICTUS (incluido en el metaanálisis), donde no se observaron diferencias entre las estrategias invasiva y conservadora. Una de las limitaciones del metaanálisis es la heterogeneidad del seguimiento, que oscila entre uno (estudio ISAR-COOL) y 60 meses (estudio RITA). En sólo 4 de los 7 estudios el seguimiento alcanzó un año de seguimiento, y en sólo 2, los 2 años años. Tras un seguimiento medio de 23,7 meses, la estrategia invasiva redujo la mortalidad desde el 6,5 hasta el 4,9% (riesgo relativo [RR] = 0,75; intervalo de confianza [IC] del 95%, 0,63-0,90; p = 0,001), aunque en el análisis por períodos de seguimiento las diferencias fueron significativas sólo a partir de los 2 años. La estrategia invasiva también disminuyó el infarto no fatal a partir de los 2 años de seguimiento (fig. 3). Dado que el mayor beneficio de la estrategia invasiva se produce a largo plazo, un punto de discusión es el momento de la intervención, en particular, la necesidad de una intervención muy precoz. En este sentido, los datos del estudio RITA indican que, durante la primera semana, la mortalidad y el infarto fueron superiores en el subgrupo de tratamiento invasivo debido a las complicaciones relacionadas con el procedimiento de revascularización34. Esto abriría la hipótesis de intervenir precozmente sólo a los pacientes de alto riesgo y demorar un tiempo la intervención en los restantes.
Fig. 3. Comparación de los efectos sobre la mortalidad de las estrategias invasiva y conservadora, en función del tiempo. Se observa que las diferencias son significativas a favor de la estrategia invasiva a los 2 años. Tomada de Bavry et al33.
La estrategia invasiva en el SCASEST conduce al hallazgo de un gran número de pacientes con afectación multivaso. La angioplastia sólo de la lesión causante constituye una opción tentadora para el cardiólogo intervencionista por la mayor sencillez del procedimiento. Sin embargo, en un registro realizado en la Clínica de Cleveland de 1.240 pacientes se demostró que la angioplastia multivaso, en comparación con la angioplastia de sólo la lesión causante, redujo la frecuencia de eventos cardiovasculares a los 2 años, aunque esta reducción fue principalmente a expensas de menores tasas de revascularización en el grupo de angioplastia multivaso35.
Tratamiento farmacológico
En este año se han publicado los resultados del estudio ACUITY, en el que se comparó la bivalirudina con la combinación de heparina e inhidores de la glucoproteína IIb-IIIa en el SCASEST con tratamiento invasivo36. La frecuencia de eventos isquémicos fue idéntica con bivalirudina sola que con la combinación de heparina e inhibidores de la glucoproteína IIb-IIIa, pero la bivalirudina aportó la ventaja de una menor tasa de hemorragias. Queda por demostrar si en situaciones de alto riesgo (particularmente en el infarto agudo de miocardio con elevación del segmento ST), donde se utilizan con mayor frecuencia los inhibidores de la glucoproteína IIb-IIIa, la bivalirudina se comporta con la misma eficacia. En el estudio ACUITY también se comparó el uso sistemático de inhibidores de la glucoproteína IIb-IIIa upstream, en el momento del diagnóstico del SCASEST, frente a su uso selectivo tardío en el laboratorio de hemodinámica37. El uso selectivo tardío se asoció con un incremento no significativo de eventos isquémicos a los 30 días y con una disminución de sangrados, con un beneficio clínico neto similar.
Registros de síndrome coronario agudo sin elevación del segmento ST
Se han publicado datos de un registro español, DESCARTES38, uno internacional, GRACE39, y uno americano, CRUSADE40. En el registro DESCARTES se comprobó que, en nuestro país, las recomendaciones de clase I de las guías (aspirina, clopidogrel, bloqueadores beta, inhibidores de la enzima de conversión de la angiontensina [IECA], estatinas y revascularización) se utilizan menos en los pacientes de alto riesgo, y esta infrautilización fue un predictor independiente de mortalidad. En la misma línea, en el registro GRACE, el número de angioplastias coronarias realizadas siguió, curiosamente, una relación inversa al riesgo del paciente. En el registro CRUSADE se observó que, desde la publicación de las guías, en las que se recomendaba el cateterismo precoz en el SCASEST, esta estrategia se incrementó, pero sobre todo en el subgrupo de pacientes de menor riesgo.
El conjunto de estos datos indica que los tratamientos más agresivos, especialmente el intervencionismo, tienden a reservarse para los pacientes de mejor pronóstico, quizá por la percepción del médico (posiblemente equivocada) de que estos pacientes se van a beneficiar más de la intervención o de que el riesgo de complicaciones relacionadas con el procedimiento es mayor en los pacientes de más riesgo. En este sentido, conviene recordar que los modelos predictivos de riesgo se han elaborado en función de los eventos durante el seguimiento y no en función del beneficio de una estrategia invasiva. Dicho en otras palabras, podemos conocer muy bien qué pacientes son de alto riesgo, pero no sabemos de forma tan precisa qué pacientes se van a beneficiar más de una estrategia invasiva.
Nuevas guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento del síndrome coronario agudo sin elevación del segmento ST
En junio de 2007 se publicaron las nuevas guías de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento del SCASEST41 y en agosto, las guías de American Heart Association/American College of Cardiology (AHA/ACC)42. No es objetivo de la presente revisión realizar una revisión exhaustiva de ellas. Dentro de las guías europeas, entre las novedades más relevantes se podrían destacar las que exponemos a continuación
Estrategia invasiva
Se recomienda aplicar una estrategia invasiva (coronariografía con intención de revascularización) urgente en pacientes con angina refractaria, inestabilidad hemodinámica o eléctrica. Se recomienda realizar una coronariografía precoz (< 72 h) sistemática, no urgente, en pacientes de riesgo intermedio o alto (recomendación de clase I/nivel de evidencia A). Las guías de la AHA definen las siguientes características de riesgo para indicar una estrategia invasiva sistemática: elevación de troponina, descenso del segmento ST presumiblemente nuevo, angioplastia coronaria en los 6 meses anteriores, cirugía coronaria previa, score clínico de riesgo elevado según las escalas TIMI o GRACE, y signos de alto riesgo en los tests incruentos. Se desaconseja la estrategia invasiva sistemática en los restantes pacientes (recomendación de clase III/nivel de evidencia C), aunque se debe evaluar la inducción de isquemia mediante tests no invasivos.
Tratamiento anticoagulante
La elección del fármaco anticoagulante depende de la estrategia inicial. Si se decide aplicar una estrategia invasiva urgente, se recomienda administrar heparina no fraccionada (recomendación de clase I/nivel de evidencia C), enoxaparina (recomendación de clase IIa/nivel de evidencia B) o bivalirudina (recomendación de clase I/nivel de evidencia B). En una situación de no intervención urgente, se recomienda utilizar fondaparinux por su mejor perfil de eficacia/seguridad (recomendación de clase I/nivel de evidencia A); la enoxaparina se debería utilizar sólo si el riesgo de sangrado es bajo (recomendación de clase IIa/nivel de evidencia B).
Tratamiento antiagregante
Aspirina (recomendación de clase I/nivel de evidencia A) y clopidogrel (recomendación de clase I/nivel de evidencia A) están recomendados en todos los pacientes. En relación con el clopidogrel, se aconseja utilizar una dosis de carga de 300 mg (recomendación de clase I/nivel de evidencia A), aunque en pacientes asignados a un procedimiento invasivo se puede utilizar una dosis de carga de 600 mg (recomendación de clase IIa/nivel de evidencia B). El clopidogrel se debe mantener 12 meses, salvo que haya un alto riesgo de sangrado (recomendación de clase I/nivel de evidencia A en las guía europeas y de clase I/nivel de evidencia B en las americanas). En pacientes asignados a una estrategia invasiva se puede añadir eptifibatide o tirofibán a los antiagregantes orales (recomendación de clase IIa/nivel de evidencia A). Ahora bien, la combinación elegida de fármacos antiagregantes y anticoagulantes debe hacerse valorando el riesgo de complicaciones isquémicas y hemorrágicas (recomendación de clase I/nivel de evidencia B).
INFARTO AGUDO DE MIOCARDIO CON ELEVACIÓN DEL SEGMENTO ST
El infarto agudo de miocardio sigue siendo un gran reto para el sistema sanitario. Probablemente, hay una relación entre el nivel de recursos sanitarios y el pronóstico de los pacientes43, tal como indica el análisis de una gran base de datos, que demuestra que los pacientes con infarto agudo de miocardio que son ingresados durante un fin de semana tienen una mayor mortalidad a los 30 días (el 12,9 frente al 12,0%; p = 0,006). A pesar de que la letalidad, la incidencia y la mortalidad por infarto de miocardio en la última década están disminuyendo en varones de 35-64 años, esto no es así en pacientes de 65-74 años ni en mujeres44. Es sugestiva la hipótesis de que la combinación de prevención primaria y secundaria ha retrasado la edad de aparición del infarto de miocardio o de las recurrencias.
Estrategias de reperfusión
En amplios registros poblacionales parece que se confirma la superioridad de la angioplastia primaria (AP) sobre la fibrinolisis (FL). La base de datos de infarto de miocardio en Suecia (RISK-HIA) ha concluido que tras un ajuste por edad y comorbilidad, la AP se asocia con una menor estancia hospitalaria, así como con una menor tasa de reinfarto y mortalidad a los 30 días y un año45. La superioridad de la AP sobre la FL, sin embargo, podría cuestionarse cuando los pacientes tienen que ser trasladados desde un centro sin hemodinámica cardiaca a otro terciario. En nuestro medio, investigadores de Murcia y Alicante han comunicado que los pacientes con infarto agudo de miocardio y elevación del segmento ST, que precisan traslado interhospitalario para recibir AP, tienen una evolución clínica similar a la de los pacientes que ingresan en hospitales con disponibilidad para esta técnica, si se aplica en condiciones óptimas46. Datos del estudio PRAGUE-2 añaden que se mantiene el beneficio a largo plazo (5 años) de la AP frente a la FL inmediata en pacientes atendidos en hospitales sin laboratorio de hemodinámica que precisan, por tanto, ser trasladados47. De cualquier forma, en un editorial de Betriu48 se pone el énfasis en la importancia del concepto de individualizar el tratamiento de reperfusión en diferentes medios, en los que el transporte entre hospitales es el factor clave de los retrasos en la reperfusión. En un interesantísimo análisis de los datos de 192.509 pacientes atendidos en 645 hospitales del National Registry of Myocardial Infarction se han relacionado los retrasos puerta-balón en pacientes tratados con AP y puerta-aguja en pacientes tratados con FL49. La diferencia en los tiempos entre puerta-balón y puerta aguja, en la que la AP no es mejor que la FL, dependen de la edad del paciente, la duración de los síntomas y la localización del infarto50. El factor tiempo ha sido estudiado exhaustivamente por el grupo de Krumholz et al51, que ha analizado todas las condiciones asociadas con los tiempos puerta-balón en los pacientes tratados con AP, y las estrategias que permiten su reducción. Este grupo de investigadores realizó una encuesta en 364 hospitales para determinar el uso de cada una de las 28 estrategias que se asocian con la reducción de los tiempos. En el análisis multivariable se detectaron 6 estrategias que, de forma significativa, se asociaron con una mayor rapidez en el tiempo puerta-balón. Dichas estrategias son: la activación por los médicos de urgencias del laboratorio de hemodinámica (reducción del tiempo puerta-balón de 8,2 min), disponer de una sola llamada a una central para activar al laboratorio de hemodinámica (reducción de 13,8 min), la expectativa de que el equipo de hemodinámica llegue al hospital en 20 min tras la llamada (reducción de 19,3 min), tener un cardiólogo de guardia (reducción de 14,6 min), y la rápida comunicación de los datos desde el laboratorio de hemodinámica al servicio de urgencias (data feedback) (reducción de 8,6 min). Fruto de esta investigación ha sido la activación de un gran programa de mejora en el proceso de AP en Estados Unidos, impulsado por el ACC y denominado Door To Balloon (D2B), que la Sección de Cardiopatía Isquémica y la Sección de Hemodinámica de la Sociedad Española de Cardiología está intentando aplicar en hospitales españoles51 (tabla 1).
Tratamiento asociado con la angioplastia primaria
La administración de estreptocinasa intracoronaria (250.000 U) tras una AP, a pesar de ser capaz de mejorar diversos índices de función microvascular a las 48 h del procedimiento, no pudo demostrar ninguna diferencia en la evolución del tamaño ventricular izquierdo, ni de su función, a los 6 meses52. Sin embargo, la efectividad del abciximab en pacientes tratados con AP parece confirmarse a través de un metaánalisis53 sobre los datos individuales de los pacientes incluidos en los estudios ISAR-2, ADMIRAL y ACE. Este estudio muestra una incidencia de mortalidad o reinfarto a los 3 años del 19,0% en el grupo placebo y del 12,9% en el grupo abciximab (p = 0,008), beneficio especialmente significativo en diabéticos.
Otros tratamientos asociados para mejorar la efectividad de la reperfusión podrían ser el pexelizumab, un antiiflamatorio que inhibe el C5 de la cascada del complemento, la adenosina, o la tilarginina, un inhibidor de la óxido nítrico sintasa. El pexelizumab54 y la tilarginina55 (este fármaco en el contexto del shock cardiogénico) no han demostrado beneficio en términos de reducción de la mortalidad o de los eventos combinados. Tan sólo la adenosina intravenosa como terapia asociada con la reperfusión, en un análisis post hoc del estudio AMISTAD-II56, se asocia con una reducción de mortalidad exclusivamente en pacientes tratados durante las primeras 3 h desde el inicio de los síntomas.
Angioplastia posfibrinolisis
La angioplastia de rescate se pone en duda en el estudio MERLIN57, en el que 307 pacientes con criterios de ausencia de reperfusión, por criterios electrocardiográficos, fueron aleatorizados para recibir angioplastia de rescate frente a tratamiento conservador. La mortalidad a los 3 años fue del 16,9 frente al 17,6% (p = 0,9), aunque la tasa de posterior revascularizacion fue mucho menor en el grupo tratado con angioplastia de rescate (el 14,4 frente al 33,8%; p < 0,01)10. Por otro lado, la estrategia de angioplastia sistemática post-FL frente a AP se ha analizado en el estudio GRACIA-258. En este ensayo, 212 pacientes con infarto de miocardio fueron aleatorizados para recibir tratamiento con tenecteplase en dosis completa seguido de angioplastia con stent en el plazo de 3-12 h o AP con abciximab realizada en las primeras 3 h postaleatorización. En relación con la AP, la angioplastia post-FL tuvo un similar tamaño de infarto sobre la base de la curva de insoenzima MB de la creatincinasa (CK-MB) y la función ventricular a las 6 semanas, y una similar incidencia de eventos combinados (muerte, reinfarto, accidente cerebrovascular [ACV] o revascularización a los 6 meses).
En general, la efectividad de la angioplastia tras una FL debe ser analizada en función de la estrategia seguida. En un metaanálisis de los ensayos en los que se ha evaluado la eficacia de la angioplastia de rescate o la repetición de la fibrinolisis, tras un tratamiento fibrinolítico no efectivo, demuestra que la angioplastia de rescate se asocia con una mejor evolución clínica, que no se traduce en una reducción de la mortalidad, pero sí de otros eventos cardiovasculares importantes, como el desarrollo de insuficiencia cardiaca o el reinfarto, con el precio de un ligero incremento en el riesgo de ACV y sangrado menor59. Por otro lado, la repetición de la FL tras su ineficacia inicial no tiene un impacto sobre el pronóstico y, además, aumenta el riesgo de hemorragia menor. Sin embargo, en otro metaanálisis (realizado por otro grupo de investigadores) de los estudios de angioplastia de rescate tras una FL fallida se muestra una reducción de la mortalidad (el 6,9 frente al 10,7%; p = 0,055) y del evento combinado muerte y reinfarto (el 10,8 frente al 16,8%; p = 0,012)60. En este metaanálisis, la angioplastia sistemática y precoz tras la FL, en la era del stent, proporciona una disminución no significativa de la mortalidad, en función de la presencia de isquemia demostrada (el 3,8 frente al 6,7%; p = 0,07), pero sí una reducción del evento combinado de muerte o reinfarto (el 7,5 frente al 13,2%; p = 0,0067). Este beneficio contrasta con el incremento no significativo tanto de la mortalidad (el 5,5 frente al 3,9%; p = 0,33) como del evento muerte o reinfarto (el 9,6 frente al 5,7%; p = 0,06) observado en la era pre-stent. La FL facilitada se asocia con una mayor tasa de reinfarto comparada con la angioplastia (el 5,0 frente al 3,0%; p = 0,03), sin impacto significativo sobre la mortalidad. Estos datos apoyan la práctica de la angioplastia de rescate de forma sistemática precoz tras la FL, pero no la realización de la angioplastia facilitada.
Postinfarto
No cabe duda de que un importante factor pronóstico postinfarto de miocardio es la función ventricular residual. De forma interesante, los pacientes tratados con AP pueden mostrar una mejoría espontánea de su función ventricular (fracción de eyección del 51,6% antes de la intervención y del 57,4% a los 6 meses)61. Además, esta mejoría se asocia con una mayor supervivencia (mortalidad a 3 años del 1,2% entre los que mejoran su función ventricular, y del 5,6% entre los que la empeoran).
Desde hace muchos años se ha postulado que los pacientes con arteria abierta tras un infarto de miocardio tendrían mejor pronóstico que aquellos en los que la arteria permanece cerrada. Sin embargo, la teoría de la arteria abierta, tras un infarto de miocardio, no puede sostenerse tras la publicación de los resultados del estudio OAT, en el que 2.166 pacientes con arteria ocluida a los 3-28 días, tras un infarto de miocardio y con criterios de alto riesgo (fracción de eyección < 50% u oclusión proximal), fueron aleatorizados para recibir angioplastia sistemática y tratamiento médico óptimo frente a tratamiento médico óptimo62. A los 4 años de seguimiento, el evento compuesto de muerte, reinfarto de miocardio o insuficiencia cardiaca en clase IV de la New York Heart Association (NYHA) fue del 17,2% en el grupo de angioplastia y del 15,6% en el grupo de tratamiento médico. Sin embargo, en pacientes asintomáticos con infarto de miocardio reciente y enfermedad coronaria de 1 o 2 vasos con demostración de la isquemia por un test de imagen, la angioplastia, en comparación con el tratamiento médico antiisquémico, mejora la supervivencia libre de eventos (muerte cardíaca, reinfarto o síntomas que requieren revascularización) en un seguimiento medio de 10 años63.
Terapia celular
Sin duda alguna, el tratamiento con células madre adultas o factores de movilización, en pacientes con infarto agudo de miocardio o cardiopatía isquémica crónica, vive un momento de reflexión como consecuencia de la duda científica generada por el resultado de estudios aleatorizados con resultados positivos y negativos64. Así, el último año se ha caracterizado por un análisis sistematizado de éstos, más que por la aparición de nuevos datos65,66. Esta mirada hacia atrás ha permitido avanzar en algunas cuestiones clave sobre esta terapia:
-- ¿Qué tipo de células debemos utilizar? Aunque la tendencia científica de los últimos años invitaba a utilizar subpoblaciones celulares cada vez más seleccionadas, la fracción mononuclear procedente de médula ósea podría ser la mejor opción terapéutica. Esta fracción alberga numerosos tipos de progenitores celulares (con un gran núcleo), es fácil de obtener y no requiere cultivo. Sin embargo, su modo de procesado y almacenaje podría ser clave en la eficacia de este tratamiento y, por tanto, en un futuro sería conveniente estandarizar y universalizar el método de procesado celular67.
-- ¿Cuál es su mecanismo de acción? La duda sobre la capacidad de que las células que liberamos en el territorio infartado se diferencien en cardiomiocitos es cada vez mayor68. Por el contrario, un efecto paracrino capaz de mejorar la supervivencia del tejido cardiaco toma relevancia.
-- ¿Cómo debemos administrar esta terapia? La liberación directa se ha mostrado más eficaz a la hora de mejorar el remodelado ventricular que la movilización de progenitores celulares del estuche óseo con factores de crecimiento65,66,69.
--¿Es eficaz esta terapia? Sin duda, es la pregunta clave en el futuro de la terapia celular. Aunque no hay una respuesta definitiva, en pacientes con infarto agudo de miocardio, el escenario clínico mejor estudiado, el incremento en la fracción de eyección observado se sitúa alrededor del 3% respecto al del grupo no tratado (fig. 4). Este porcentaje es similar al mostrado por los bloqueadores beta y los IECA en el mismo contexto.
Fig. 4. Análisis sistematizado de los ensayos clínicos aleatorizados en los que se ha comparado directamente la inyección intracoronaria de la fracción mononuclear de progenitores hematopoyéticos procedentes de médula ósea con el tratamiento convencional en pacientes con infarto agudo de miocardio. FE: fracción de eyección; IC: intervalo de confianza; N: número; *FE: incremento en la fracción de eyección.
AGRADECIMIENTOS
Agradecemos al Dr. Rafael Gabriel (Unidad de Investigación, Hospital La Paz de Madrid) su colaboración en la realización del análisis sistematizado referente al uso de terapia celular en pacientes con infarto agudo de miocardio.
ABREVIATURAS
AP: angioplastia primaria.
FL: fibrinolisis.
IPC: intervencionismo coronario percutáneo.
SCASEST: síndrome coronario agudo sin elevación del segmento ST.
TCMD: tomografía computarizada con multidetectores.
Correspondencia: Dr. A. Bardají.
Servicio de Cardiología. Hospital Universitario de Tarragona Joan XXIII.
Dr. Mallafré Guasch, 4. 43007 Tarragona. España.
Correo electrónico: abardaji@comt.es