El tratamiento antiagregante plaquetario doble (TAPD), definido como la adición al ácido acetilsalicílico (AAS) de un inhibidor oral del receptor P2Y12, es necesario para todo paciente sometido a intervención coronaria percutánea (ICP). Esta recomendación universal deriva de los ensayos clínicos que indican que, en comparación con el AAS, el TAPD reduce significativamente el riesgo de eventos trombóticos tanto a corto como a largo plazo. La guía vigente se decanta por una duración del TAPD de 6 meses para los pacientes con síntomas estables y 12 meses para los que han sufrido un síndrome coronario agudo (SCA)1. Sin embargo, los efectos favorables del TAPD se producen a costa de las hemorragias, que aumentan gradualmente con la exposición continua a la inhibición plaquetaria. La prevención de las hemorragias, que se ha percibido clásicamente como una molesta complicación del tratamiento antitrombótico, ha pasado a ser una prioridad clínica importante, y este cambio de planteamiento terapéutico es atribuible a varias razones. En primer lugar, la hemorragia tras la ICP se asocia con un riesgo de muerte elevado y duradero, comparable al de un infarto de miocardio (IM)2. Aunque los vínculos de la hemorragia craneal y las hemorragias de trascendencia hemodinámica con la mortalidad inmediata se explican por sí mismos, las hemorragias menos graves que requieren transfusiones de sangre u hospitalización también aumentan el riesgo de mortalidad. En segundo lugar, las plataformas de stents farmacoactivos se caracterizan por tener unos pivotes o struts finos y polímeros biocompatibles, características que reducen la trombogenicidad y modifican el cálculo de la relación riesgo-beneficio de un TAPD prolongado3. En tercer lugar, los trastornos con un riesgo hemorrágico alto (RHA), como la insuficiencia renal, el cáncer activo y la edad avanzada, tienen cada vez mayor prevalencia entre los pacientes de ICP, lo cual hace que la toxicidad del TAPD en cuanto a hemorragias sea más pronunciada en relación con los beneficios que se le atribuyen. Como resultado de estos avances, los nuevos enfoques terapéuticos para el tratamiento antitrombótico tras la ICP consideran la prevención de eventos isquémicos y la de los eventos hemorrágicos como objetivos equivalentes. Una de las estrategias consiste en acortar el TAPD con una transición temprana a un tratamiento antiagregante plaquetario en monoterapia con AAS o un inhibidor del P2Y12.
FUNDAMENTO EXPERIMENTALEl AAS tiene un efecto antiagregante plaquetario relativamente pequeño en comparación con los inhibidores orales del P2Y12 clopidogrel, prasugrel y ticagrelor. Por consiguiente, añadir un inhibidor del P2Y12 al AAS produce un efecto sinérgico en la inhibición plaquetaria y explica la superioridad del TAPD respecto al AAS en monoterapia en reducción del riesgo trombótico. Sin embargo, hay varias líneas de evidencia experimentales y clínicas que indican lo contrario, es decir, que la inhibición del P2Y12 en monoterapia es suficiente para atenuar los eventos isquémicos al tiempo que se evitan las hemorragias asociadas con el AAS. En un estudio en voluntarios sanos, Armstrong et al.4 observaron que los efectos de inhibición plaquetaria del AAS eran mínimos en presencia de un bloqueo intenso del P2Y12. Los resultados de los estudios ex vivo coinciden con los de este estudio. Por ejemplo, el efecto farmacodinámico del ticagrelor en monoterapia fue comparable al observado con el ticagrelor más AAS por lo que respecta a la generación de trombos en los pacientes en alto riesgo sometidos a ICP5. Estos resultados experimentales están respaldados por lo observado en los ensayos clínicos que han puesto de manifiesto la seguridad de retirar el AAS al tiempo que se mantiene la inhibición del P2Y12 con ticagrelor6.
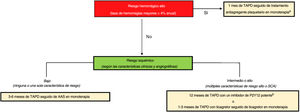
MARCO DE REFERENCIA DE LOS RIESGOS HEMORRÁGICO E ISQUÉMICOLa prescripción de un antiagregante plaquetario en monoterapia, como el de cualquier estrategia antitrombótica, debe individualizarse según el perfil de riesgo hemorrágico y trombótico específico de cada paciente. En consecuencia, la evaluación del riesgo de ambos tipos de eventos constituye un primer paso fundamental para informar la posterior toma de decisiones clínicas. Sin embargo, la evaluación clínica de los riesgos isquémico y hemorrágico resulta difícil, dado el notable solapamiento de los trastornos subyacentes que contribuyen a producir una y otra complicación (deterioro de la función renal, edad avanzada, cáncer activo). A este respecto, la introducción de una clasificación estandarizada para el RHA propuesta por el Academic Research Consortium (BARC) constituye un importante avance tanto para los clínicos como para los investigadores7. En este instrumento, el RHA se define como un riesgo hemorrágico anualizado ≥ 4%, y los pacientes que cumplen al menos 1 criterio mayor o 2 criterios menores pueden clasificarse como en RHA (tabla 1). En los ensayos clínicos se han examinado diferentes estrategias antitrombóticas, incluida la de tratamiento antiagregante plaquetario en monoterapia, en todo el espectro de riesgos hemorrágico y trombótico. Dentro de este marco de referencia, las decisiones clínicas respecto a la duración y la intensidad de la antiagregación plaquetaria pueden tomarse en secuencia, teniendo en cuenta primero el riesgo hemorrágico y luego el isquémico (figura 1). Tal como se comenta a continuación, los pacientes con un RHA pueden clasificarse a su vez según la presencia o ausencia de fibrilación auricular (FA). En los pacientes que no tienen un RHA, el examen del riesgo trombótico (estable frente a agudo) puede ser útil para informar las decisiones relativas al TAPD8.
Criterios de riesgo hemorrágico alto del Academic Research Consortium*
| Mayor | Menor |
|---|---|
| Anticoagulación a largo plazo | Edad ≥ 75 años |
| TFGe <30 ml/min/1,73 m2 | TFGe 30–59 ml/min/1,73 m2 |
| Hemoglobina <11 g/dl | Hemoglobina 11-12,9 g/dl los varones y 11–11,9 g/dl las mujeres |
| Hemorragia espontánea en los 6 meses previos | Hemorragia espontánea que ha requerido hospitalización o transfusión en los 12 meses previos |
| Recuento de plaquetas <100 × 109/l | AINE o corticoides orales a largo plazo |
| Diátesis hemorrágica crónica | |
| Cirrosis hepática con hipertensión portal | |
| Cáncer activo en los últimos 12 meses | |
| HIC espontánea; HIC traumática en los últimos 12 meses; malformación arteriovenosa cerebral; ictus isquémico moderado o grave en los últimos 6 meses | Cualquier ictus isquémico que no cumpla el criterio mayor |
| Cirugía mayor no aplazable durante el TAPD | |
| Cirugía mayor o traumatismo mayor a menos de 30 días de la ICP |
AINE: antiinflamatorios no esteroideos; HIC: hemorragia intracraneal; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada.
Marco de referencia para la duración y la intensidad del tratamiento antiagregante plaquetario doble en relación con los riesgos hemorrágico e isquémico. El riesgo hemorrágico alto se define según los criterios del Academic Research Consortium como una tasa de hemorragias mayores ≥ 4% anual o un riesgo de hemorragia intracraneal del 1% anual. El riesgo isquémico se clasifica en función de las características clínicas (diabetes mellitus que requiera medicación, enfermedad arterial periférica, síndrome coronario agudo) y angiográficas (intervención coronaria percutánea multivaso; longitud del stent > 60 mm; calcificación que requiera aterectomía) asociadas con un aumento de las trombosis. AAS: ácido acetilsalicílico; SCA; síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble. Adaptado con permiso de Baber et al.8. a Los pacientes con alto riesgo hemorrágico y fibrilación auricular concomitante que toman anticoagulación oral pueden ser tratados con clopidogrel solo o con un anticoagulante oral de acción directa. b Puede considerarse una desescalada terapéutica para pasar de prasugrel o ticagrelor a clopidogrel en función de lo indicado por las pruebas genéticas o de función plaquetaria.
Puede ser necesario un tratamiento triple, definido como el TAPD más un anticoagulante oral (ACO), para los pacientes con FA sometidos a ICP, pero ello implica un riesgo hemorrágico prohibitivo. Por consiguiente, minimizar la duración del tratamiento triple ha pasado a ser una prioridad clave en el contexto de los pacientes con RHA. Se examinó en primer lugar una estrategia sin AAS para estos pacientes mediante un ensayo aleatorizado de un tamaño moderado, en el que se comparó una inhibición de doble vía (IDV), consistente en un antagonista de la vitamina K (AVK) más clopidogrel, con el tratamiento triple convencional9. En 1 año, el objetivo principal consistente en las hemorragias mayores o menores alcanzó una reducción absoluta del 40% con la intervención experimental. Es importante señalar que la retirada del AAS no implicó un incremento de los riesgos de IM y muerte. Esta observación inicial se ha ampliado y confirmado en ensayos más grandes, en los que la IDV se obtiene mediante un anticoagulante oral de acción directa (ACOD) y un antiagregante plaquetario en monoterapia, generalmente clopidogrel. Los beneficios de la IDV, en comparación con el tratamiento triple basado en AVK, son atribuibles tanto a la retirada del AAS como al empleo de ACOD según la perspectiva aportada por el ensayo AUGUSTUS10. En este gran estudio aleatorizado, con un diseño factorial de 2 × 2, se incluyó a pacientes con FA sometidos a ICP o con un SCA a los que se aleatorizó a un AVK frente a un ACOD y también AAS frente a placebo. Tras una mediana de seguimiento de 6 meses, las hemorragias clínicamente significativas se redujeron en un 40 y un 20% de los pacientes asignados a placebo (en comparación con AAS) y al ACOD (en comparación con el AVK) respectivamente. Se han obtenido resultados similares favorables a un beneficio global con la IDV basada en ACOD en otros ensayos llevados a cabo en cohortes de pacientes parecidas. Como resultado de esta evidencia acumulada, las recomendaciones de consenso se decantan por utilizar en principio una estrategia consistente en un ACOD más un solo antiagregante plaquetario para la mayoría de los pacientes con FA sometidos a ICP11. En la mayor parte de los ensayos, se administró AAS en el momento de la ICP y generalmente se mantuvo hasta el alta del hospital. Así pues, el momento en que se retira el AAS y, por extensión, el momento de inicio del tratamiento doble, suele ser el del alta tras la ICP. No obstante, para determinados pacientes con un riesgo trombótico especialmente alto, puede ser beneficiosa una duración ligeramente mayor del TAPD, por lo que se aplica un tratamiento triple durante un periodo de hasta 1 mes tras la ICP. En consecuencia, el consenso actual recomienda una duración breve del tratamiento triple para pacientes con un riesgo trombótico alto y un riesgo hemorrágico bajo. Después de 1 año de IDV, puede suspenderse el tratamiento antiagregante plaquetario y pasar a un mantenimiento con un ACOD solo.
RHA sin FAA pesar del riesgo hemorrágico asociado con la FA y el tratamiento triple, otros factores que se dan con frecuencia, como el deterioro de la función renal, la anemia y la edad avanzada, son también criterios que indican un RHA. En esos pacientes, persiste una importante necesidad clínica de minimizar la duración del TAPD y reducir todo lo posible el riesgo de hemorragia. Aunque la guía vigente recomienda una duración del TAPD de 3 meses tras la ICP cuando se emplean stents farmacoactivos en el contexto de RHA, varios ensayos clínicos han mostrado un resultado equivalente con duraciones de solo 1 mes. En el ensayo LEADERS FREE se examinó la seguridad y la eficacia de los stents metálicos en comparación con los farmacoactivos en pacientes con al menos un criterio de RHA (n=2.466)12. La media de edad de la población del estudio era 75 años y aproximadamente un 25% presentaba un SCA con troponina (+). El protocolo del estudio estipulaba que todos los pacientes debían recibir 4 semanas de TAPD seguido de antiagregación plaquetaria en monoterapia, con preferencia por el AAS. A pesar de la duración muy breve del TAPD, la tasa de hemorragias BARC 3 o 5 a 1 año fue > 7%, lo cual supera ampliamente el umbral del 4% establecido por el HBR-ARC. En otro estudio se examinó la seguridad y la eficacia de una duración corta (28 días) frente a una duración mayor (6 meses) del TAPD en una cohorte de pacientes con RHA tratados con el stent farmacoactivo liberador de everolimus. Entre los meses 1 y 6, el objetivo principal consistente en mortalidad por cualquier causa o IM se produjo con menos frecuencia en los pacientes tratados con 1 mes de TAPD (el 3,5 frente al 4,3%; pnoinferioridad <0,0005)13. Las hemorragias BARC 3 o 5 se redujeron también en más de un 50% (el 2,2 frente al 4,5%; p=0,016). Considerados en conjunto, múltiples estudios han examinado la repercusión de la antiagregación plaquetaria en monoterapia en todo el espectro de pacientes con RHA sometidos a ICP. En presencia de una FA, puede ser necesario un TAPD hasta el alta hospitalaria, tras lo cual se puede tratar a la mayoría de los pacientes con un solo fármaco antiagregante plaquetario (preferiblemente clopidogrel) y un ACOD. Para los pacientes sin FA en RHA, la evidencia derivada de los estudios aleatorizados respalda un TAPD muy breve, de 4 semanas, seguido de antiagregación plaquetaria en monoterapia (preferiblemente con AAS).
Sin RHA: SCAEn el contexto del SCA, una inhibición potente del P2Y12 con ticagrelor o prasugrel es superior al clopidogrel para la prevención de los eventos trombóticos, aunque a costa de un aumento de las hemorragias. La retirada del AAS seguida de inhibición del P2Y12 en monoterapia puede permitir a los pacientes con un SCA obtener los beneficios de una inhibición plaquetaria intensa al tiempo que se evita la toxicidad asociada con el AAS, como se resume en la tabla 2 y la figura 2. Así pues, la extensión del paradigma de «tratamiento sin AAS» a los pacientes sin FA tratados con una ICP se examinó primero en el ensayo GLOBAL LEADERS, en el que se compararon 4 semanas de TAPD con AAS y ticagrelor seguidas de ticagrelor en monoterapia durante 23 meses con una estrategia antiagregante plaquetaria convencional en 15.968 pacientes sometidos a ICP18. Aunque el objetivo principal consistente en la mortalidad por cualquier causa o el IM con onda Q mostró una diferencia no significativa entre los grupos a los 2 años (el 3,8 frente al 4,4%; p=0,07), un análisis post hoc sobre los participantes con SCA indicó una reducción significativa de las hemorragias BARC 3 o 5 a 1 año en los pacientes tratados con ticagrelor solo (el 0,8 frente al 1,5%; p=0,004)14. Se obtuvieron resultados en consonancia en un análisis preespecificado de los pacientes con SCA sin elevación del segmento ST incluidos en el ensayo aleatorizado TWILIGHT15. El ticagrelor en monoterapia, en comparación con ticagrelor más AAS, produjo una reducción del 64% de las hemorragia BARC 3 o 5, mientras que las tasas de mortalidad por cualquier causa, IM o ictus fueron comparables entre ambos grupos (el 4,3 frente al 4,4%; p=0,84). En un ensayo de diseño similar en el que se incluyó solo a pacientes con SCA (el 36% con IM con elevación del segmento ST), se obtuvieron reducciones comparables de hemorragias mayores, sin un incremento del riesgo trombótico con ticagrelor en monoterapia16. Aunque los estudios experimentales indican poco efecto farmacodinámico del AAS en el contexto de una inhibición del P2Y12 con prasugrel, el enfoque de evitar el AAS y prescribir prasugrel en monoterapia tras la ICP todavía no se ha evaluado en un ensayo aleatorizado grande y con la potencia estadística suficiente. En otros estudios se ha examinado el clopidogrel en monoterapia en comparación con el TAPD con AAS más clopidogrel en pacientes con riesgo relativamente bajo tras 1-3 meses de TAPD17,19. Aunque estos estudios indican reducciones significativas de las hemorragias con el clopidogrel solo sin que conlleven un coste isquémico, la variabilidad farmacodinámica de la respuesta al clopidogrel y los polimorfismos genéticos del CYP2C19 que influyen en el metabolismo de este fármaco hacen que un enfoque de este tipo sea difícil de aplicar como estrategia estándar. Además, para los pacientes con SCA sometidos a ICP se suelen recomendar preferiblemente los inhibidores del P2Y12 más potentes. A la espera de disponer de nuevos datos, la evidencia más clara por lo que respecta a la seguridad y la eficacia de una estrategia sin AAS para los pacientes sin FA sometidos a ICP en el contexto del SCA es ticagrelor en monoterapia.
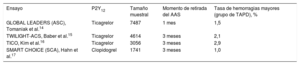
Ensayos clínicos en los que se ha examinado la retirada del ácido acetilsalicílico en el síndrome coronario agudo
| Ensayo | P2Y12 | Tamaño muestral | Momento de retirada del AAS | Tasa de hemorragias mayores (grupo de TAPD), % |
|---|---|---|---|---|
| GLOBAL LEADERS (ASC), Tomaniak et al.14 | Ticagrelor | 7487 | 1 mes | 1,5 |
| TWILIGHT-ACS, Baber et al.15 | Ticagrelor | 4614 | 3 meses | 2,1 |
| TICO, Kim et al.16 | Ticagrelor | 3056 | 3 meses | 2,9 |
| SMART CHOICE (SCA), Hahn et al.17 | Clopidogrel | 1741 | 3 meses | 1,0 |
SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
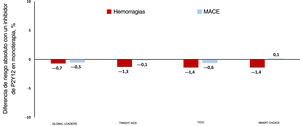
Retirada del AAS en los síndromes coronarios agudos. En el eje y se indica la diferencia absoluta del riesgo en las tasas de hemorragias mayores (columnas rojas) y de eventos adversos cardiovasculares mayores (MACE; columnas azules) en los pacientes con SCA tratados con un inhibidor de P2Y12 en monoterapia en comparación con aquellos en tratamiento antiagregante plaquetario doble en algunos ensayos clínicos seleccionados. Los valores negativos indican un riesgo inferior con un inhibidor del P2Y12 en monoterapia, mientras que los valores positivos indican lo contrario; se define hemorragia según los eventos de tipo 3 o 5 del Bleeding Academic Research Consortium (BARC) en los ensayos GLOBAL LEADERS14 y TWILIGHT-ACS15, los eventos mayores del Thrombolysis in Myocardial Infarction en el ensayo TICO16 y eventos BARC 2 a 5 en el ensayo SMART-CHOICE17. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los pacientes con una cardiopatía isquémica estable sometidos a ICP constituyen una cohorte con riesgo de eventos tanto trombóticos como hemorrágicos relativamente bajo. En consecuencia, el fundamento clínico para las estrategias terapéuticas destinadas a reducir el riesgo hemorrágico (retirar el AAS) o el riesgo isquémico (inhibidores del P2Y12 potentes) son menos claras en estos pacientes que para los que están en más riesgo. A favor de esta hipótesis, cabe mencionar que el efecto del ticagrelor en monoterapia para reducir las hemorragias BARC 2, 3 o 5 se atenuó en los pacientes con síndromes estables en comparación con los que tenían síndromes agudos en el ensayo TWILIGHT (pint=0,03)15. En varios estudios se ha examinado la repercusión de un TAPD breve (3-6 meses) en comparación con 12 meses en pacientes con bajo riesgo sometidos a ICP. En general, en estos estudios no se observó ningún beneficio adicional al ampliar la duración del TAPD más allá de los 6 meses, aunque hubo un aumento numérico del riesgo de hemorragia. Estos resultados respaldan lo indicado por la guía vigente, que recomienda 6meses de TAPD con clopidogrel para la mayoría de los pacientes estables con riesgo bajo sometidos a ICP con stents farmacoactivos. La justificación básica de la antiagregación en monoterapia difiere en cierta medida en función del fenotipo clínico: evitar la toxicidad asociada con el TAPD a los pacientes con RHA y la ausencia de un beneficio adicional con la prolongación del TAPD a los pacientes con riesgo bajo y una cardiopatía isquémica estable.
CONCLUSIONESLa antiagregación plaquetaria en monoterapia tras un TAPD corto ha surgido como estrategia terapéutica viable para todo el espectro de pacientes sometidos a ICP, con una base de evidencia establecida y cada vez más amplia. Aplicar este enfoque depende de los riesgos hemorrágico y trombótico del paciente. Mientras que a los pacientes con FA y RHA se los puede tratar con un ACOD y un inhibidor del P2Y12 inmediatamente después de la ICP, los pacientes en RHA que no sufren FA pueden requerir una tanda breve (de hasta 4 semanas) de TAPD seguida de antiagregación plaquetaria en monoterapia. Para los pacientes sin RHA que presentan un SCA, el ticagrelor en monoterapia proporciona los beneficios de una inhibición plaquetaria potente al tiempo que evita las hemorragias asociadas con el AAS. Para los pacientes con síntomas estables sin RHA, un TAPD breve seguido de AAS en monoterapia proporciona una protección adecuada frente al riesgo isquémico, en comparación con TAPD más prolongado.
FINANCIACIÓNEste trabajo no recibió financiación alguna.
CONFLICTO DE INTERESESU. Baber declara haber recibido honorarios de AstraZeneca y Amgen.