Desde el primer procedimiento realizado por Sigwart en el Hospital Brompton de Londres en 1994, la ablación septal alcohólica (ASA) se ha convertido en una técnica muy popular para el tratamiento de la obstrucción en la miocardiopatía hipertrófica (MCH)1. Los procedimientos percutáneos han supuesto una revolución en el tratamiento de la cardiopatía isquémica y las arritmias, y más recientemente han irrumpido con gran profusión en el tratamiento de las cardiopatías estructurales y las valvulopatías.
En los últimos años el número de procedimientos de ASA realizados es del orden de 5 a 10 veces mayor que el de miectomías. Como denuncian diferentes autores en un artículo reciente, la miectomía ha sufrido un retroceso importante en algunos países europeos a favor de la ASA2. Este hecho ha supuesto la pérdida de programas de miectomía en muchos centros. La miectomía sigue siendo la técnica preferida en algunos países como Estados Unidos, quizá Reino Unido e Italia. Es posible que las características de los sistemas nacionales de salud de los países favorezcan el desarrollo de técnicas percutáneas y dificulten la persistencia de centros de referencia con experiencia quirúrgica.
Existen diferencias en el procedimiento, las complicaciones y los resultados entre las dos opciones que se debe considerar a la hora de elegir el tratamiento más adecuado para un determinado paciente. Es importante que la toma de decisiones se realice en el seno de unidades específicas de miocardiopatías formadas por profesionales con experiencia, con programas integrados de tratamiento invasivo de la obstrucción en la MCH.
EficaciaLa primera cuestión que es preciso responder es si la eficacia de la ASA es comparable a la de la miectomía para reducir la obstrucción.
En la intervención quirúrgica el cirujano cardiaco reseca entre 8 y 10 g de tejido miocárdico del septo anterior basal, mientras en la ASA se ablaciona una cantidad similar de tejido en una posición del septo algo más posterior3 (Figura 1). A pesar de la incorporación del contraste ecocardiográfico, que permite la correcta identificación de la zona objetivo, el área de miocardio ablacionada es habitualmente irregular, y con frecuencia presenta una desviación hacia el lado derecho del tabique. La aparición de bloqueo de rama izquierda (BRI) en la miectomía es la norma, mientras que la ASA se acompaña del desarrollo de bloqueo de rama derecha en más del 80% de los casos (Figura 2). La aparición de BRI podría ser un efecto colateral, en este caso beneficioso, de la miectomía quirúrgica. La pérdida de la sincronía en la contracción del ventrículo izquierdo es uno de los efectos buscados que llevó a la implantación de marcapasos en muchos pacientes con MCH en la década de los años noventa. El marcapasos continúa siendo una opción válida en determinadas situaciones y hay que tenerlo en cuenta para casos en que se indique una miectomía tras una ASA fallida o viceversa. Los pacientes con indicación de desfibrilador automático implantable (DAI) profiláctico que sufren obstrucción pueden beneficiarse de ajustes en la programación de la función de marcapasos guiada por ecocardiografía, con un intervalo auriculoventricular corto que permita la estimulación continua del ápex del ventrículo derecho.
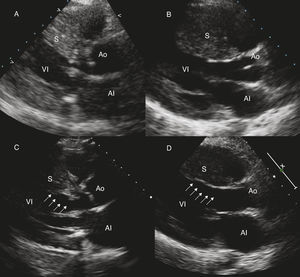
Figura 1. Reducción del grosor septal (flechas) y abolición de la obstrucción. Ecocardiograma basal (A) y 6 meses tras la ablación septal alcohólica (C), de una mujer de 67 años con grosor septal previo de 24 mm. Ecocardiograma basal (B) y 1 mes tras la miectomía (D) en un varón de 20 años con grosor septal previo de 28 mm. AI: aurícula izquierda; Ao: aorta; S: septo; VI: ventrículo izquierdo.
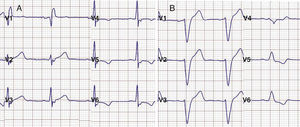
Figura 2. A: bloqueo de rama derecha tras ablación septal alcohólica. B: bloqueo de rama izquierda tras miectomía.
La reducción del gradiente se observa inmediatamente tras la intervención, mientras que el beneficio en la ASA se demora, en ocasiones, hasta más de 6 meses tras la administración del alcohol. La reducción promedio de grosor del miocardio en la ASA es generalmente leve (unos 5 mm). Tanto tras la miectomía como tras la ASA, se produce un proceso de remodelado cardiaco que implica la reducción de grosor en otros segmentos y la reducción del tamaño de la aurícula izquierda, consecuencia de la mejora hemodinámica conseguida. Tal y como se recoge en las guías de práctica clínica4, la cirugía es de elección cuando haya valvulopatía. La válvula mitral presenta, con frecuencia, alteraciones estructurales en los pacientes con MCH, y en ocasiones es complejo discernir qué parte de la insuficiencia mitral es consecuencia del movimiento anterior septal de la válvula mitral o cuándo se trata de una afección valvular principalmente estructural. Es importante apurar todas las herramientas diagnósticas antes de indicar el procedimiento más adecuado.
A pesar de que no existen estudios aleatorizados que comparen la miectomía y la ASA, sí disponemos de una docena de estudios, entre ellos 2 metaanálisis recientes que ofrecen resultados similares para uno y otro procedimiento5, 6, si bien la reducción del gradiente en la miectomía es ligeramente superior con la ASA. En 2006 se publicó un estudio que recoge los resultados y las complicaciones a corto plazo de 3.000 procedimientos de ASA publicados en 42 trabajos; demuestra una reducción en el gradiente basal (de 65 a 15 mmHg) y provocado (de 123 a 35 mmHg) y una mejoría significativa de la clase funcional de la New York Heart Association de 2,9 a 1,27. Las mejorías en la clase funcional y la capacidad de ejercicio tras miectomía y tras ASA son similares.
SeguridadLa segunda cuestión está relacionada con la seguridad: ¿los dos procedimientos tienen tasas similares de complicaciones agudas y tardías?
La mortalidad periprocedimiento tanto de la miectomía como de la ASA es baja, alrededor del 1%, en centros con experiencia. Las complicaciones más frecuentes de la ASA son: disección coronaria (∼ 1%), escape de alcohol en una coronaria principal (< 1%), la perforación del ventrículo derecho o trombosis asociada con la manipulación del marcapasos temporal (∼ 2%), especialmente cuando es preciso mantenerlo durante más de 48 h. Las complicaciones asociadas a la miectomía van desde la aparición de fibrilación auricular, derrames pericárdicos y pleurales que requieren recolocación de drenajes (∼ 5%), infecciones, aparición o persistencia de insuficiencia valvular mitral o aórtica y la temida comunicación interventricular (∼ 1%)8, 9.
Hasta el 50% de los pacientes a los que se practica una ASA sufren bloqueo auriculoventricular (BAV) completo en la sala de intervencionismo o en las 24 h tras el procedimiento. En la mayoría de los casos se trata de un fenómeno autolimitado. Entre el 5 y el 10% de los pacientes precisan implantación de marcapasos permanente por persistencia del bloqueo. El porcentaje de marcapasos definitivos es significativamente superior tras la ASA que tras la miectomía (razón de riesgos=2,6)6.
Los pacientes con BAV de primer grado y los pacientes con BRI presentan un riesgo elevado de bloqueo avanzado persistente durante la ASA, por lo que es aconsejable implantar marcapasos definitivo antes del procedimiento. Se ha analizado una serie de predictores de BAV de alto grado, como la bradicardia, la obstrucción grave en reposo, la persistencia del BAV más allá de las primeras 24 h, el retraso en el pico de enzimas cardiacas y la duración del QRS10. Es importante mantener la monitorización durante 1 semana, ya que se ha descrito la aparición de BAV tardío en pacientes sin trastornos de la conducción en las primeras horas.
Pasado el periodo agudo y solventado el problema de los bloqueos, la complicación más temida es la aparición de arritmias ventriculares malignas tras la ASA. Que este tratamiento sea proarritmogénico aún es objeto de debate. Hay trabajos que demuestran asociación entre la presencia de realce tardío en la resonancia cardiaca y la aparición de taquicardia ventricular no sostenida11, 12. A pesar de que tras la ablación se produce una escara evidenciable y cuantificable con resonancia, esta relación no se ha demostrado claramente en el contexto de la ASA. En uno de los primeros estudios en que se comparó el perfil de riesgo de 100 pacientes consecutivos seguidos durante 1 año, se observó una reducción significativa en los marcadores de riesgo de muerte súbita como el síncope (el 31 frente al 1%) o la respuesta de la presión arterial anormal en la prueba de esfuerzo (el 23 frente al 1%), sin cambios significativos en la taquicardia ventricular no sostenida (el 19 frente al 19%)13.
El impacto beneficioso de la miectomía quirúrgica en la supervivencia de pacientes con MCH se ha demostrado claramente. Hay estudios que muestran una mejoría en la supervivencia total tras la miectomía8, 9 y quizá una reducción de la muerte súbita. Se ha argumentado que la mejoría hemodinámica asociada al tratamiento reduciría no sólo los eventos relacionados con la insuficiencia cardiaca, sino también el riesgo arrítmico.
Hay poca información sobre las complicaciones a largo plazo de la ASA comparada con la miectomía. Los datos disponibles provienen de dos metaanálisis, publicados recientemente, en los que se incluyó a 360 pacientes (5 estudios) en uno y 706 pacientes (12 estudios) en otro5, 6. En ninguno de los dos metaanálisis se observaron diferencias significativas en mortalidad entre las dos opciones terapéuticas. Por las particularidades de esta enfermedad, su gran heterogeneidad y su prevalencia relativamente reducida, es altamente improbable que en un futuro cercano dispongamos de resultados de un estudio aleatorizado que resuelva algunas de estas dudas14.
Aspectos técnicosComo en todas las técnicas cuando se describen, el tratamiento quirúrgico de la obstrucción sufrió un proceso de desarrollo en el que se ensayaron diferentes abordajes. En los años sesenta se debatía sobre si el mejor tratamiento de la obstrucción era la miotomía septal simple —en la que se realizaba una incisión longitudinal en el septo sin resección de miocardio—, la miectomía con resección en cuña del tabique o el recambio valvular mitral de forma aislada. Por otro lado, respecto al abordaje óptimo hubo defensores del acceso apical ventricular izquierdo, auricular izquierdo y transaórtico. Actualmente la técnica quirúrgica está bien establecida y se realiza con pocas modificaciones entre los grupos quirúrgicos en los diferentes hospitales y países. La miectomía por vía transaórtica se ha impuesto como la técnica de elección.
En el ámbito de la ASA, hay algunos aspectos importantes del protocolo todavía por establecer que pueden determinar los resultados agudos y crónicos (Tabla 1). La mayoría de los centros realizan la técnica propuesta por Faber et al15, que incorpora la valoración de la distribución del contraste ecocardiográfico antes de la administración del alcohol. Algunas series que incluyen a pacientes de los primeros años del desarrollo de la técnica presentan un porcentaje superior de complicaciones, que podría estar en relación con el uso de mayor volumen de alcohol. En este sentido, merecen especial consideración los resultados de un trabajo, publicado posteriormente a los metaanálisis, que compara los resultados de la ASA y la miectomía en un centro holandés16. En ese trabajo la tasa anual de muerte cardiovascular o descarga del DAI fue 5,2 veces superior en el grupo de ASA que en el de miectomía (el 4,4 frente al 0,9%). A pesar de que no es un estudio aleatorizado, las características de los pacientes eran superponibles en ambos grupos. El procedimiento concluía cuando se conseguía la abolición de la obstrucción en la sala. El primer paciente de esta serie fue incluido en 1999 y los primeros 25 pacientes recibieron cantidades de alcohol elevadas (4,5ml), aproximadamente el doble de lo que se emplearía actualmente. A pesar de que es muy frecuente observar una reducción del gradiente durante el procedimiento, el efecto beneficioso es consecuencia de un proceso lento de fibrosis y remodelado ventricular que no se consigue hasta pasados unos meses. La relación entre los resultados agudos y el beneficio a largo plazo es pobre. Este trabajo es muy ilustrativo de toda una serie de aspectos técnicos que quedan por definir y podrían explicar las diferencias en los resultados entre los centros. Desafortunadamente, la mayoría de los estudios sobre ASA no describen con tanto detalle la técnica empleada. El alcohol se administró en pequeños bolos de 0,5ml separados por un periodo de 5 min, en los que se realizaba una perfusión de suero salino. En los casos en que no se conseguía reducción del gradiente agudo tras la administración de 2,5 ml en una rama septal, se procedió a tratar una segunda rama en el mismo acto. La mayoría de los grupos demoran el tratamiento de una segunda rama, en caso necesario, hasta pasados unos meses, aunque no hay evidencia de que esta sea la mejor decisión.
Tabla 1. Aspectos técnicos por definir en el procedimiento de ablación septal alcohólica
| Relacionados con la rama septal | • Elección de rama septal principal o segmentaria• Tamaño mínimo de la rama septal• Número de septales por procedimiento• Tipo de contraste ecocardiográfico |
| Administración del alcohol | • Volumen necesario de alcohol• Volumen máximo de alcohol• Ritmo de administración• Tiempo de oclusión |
| Manejo de las alteraciones de conducción | • Implantación de marcapasos temporal (profiláctico o a demanda)• Tiempo de bloqueo auriculoventricular hasta la implantación de marcapasos definitivo• Marcadores de riesgo del bloqueo auriculoventricular tardío |
| Objetivos y análisis de resultados | • Objetivos agudos (en la sala)• Tiempo evaluación de resultados• Marcadores de riesgo arrítmico |
Nos encontramos, por lo tanto, ante una técnica percutánea efectiva y segura para el tratamiento de la obstrucción en la MCH, pero en la que aspectos muy importantes del procedimiento están pendientes de definir.
Herramientas diagnósticas y terapéuticas en desarrolloEl desarrollo tecnológico ha llevado a la incorporación de mejoras en las técnicas diagnósticas y ha abierto nuevas posibilidades terapéuticas que permiten un mejor conocimiento de la fisiopatología de la obstrucción, una correcta identificación de los candidatos y reducir las complicaciones relacionadas con el tratamiento.
Desde el punto de vista del diagnóstico, la resonancia cardiaca, la tomografía computarizada, la ecocardiografia transesofágica y la ecocardiografía tridimensional son herramientas de gran utilidad para sentar la indicación del tratamiento invasivo y para definir la estrategia en la opción quirúrgica. A pesar de que la ecocardiografía transtorácica suele ser suficiente para guiar la ASA en la mayoría de los casos, la ecocardiografía transesofágica puede ser necesaria en casos de imagen deficiente. Hay nuevas sondas de ecocardiografía intravascular, que han surgido con el desarrollo de la cardiología intervencionista estructural y pueden ser de ayuda en este contexto, aunque hasta la fecha se han empleado sólo de manera anecdótica.17
Hace ya unos años se ensayaron otras variantes de la ASA que empleaban coils, esferas y stents teflonados, que rápidamente cayeron en desuso por falta de eficacia. Más recientemente se han comunicado los resultados interesantes de un primer estudio que emplea la ablación por radiofrecuencia aplicada en el septo desde el ventrículo derecho o desde el ventrículo izquierdo18. La reducción del grosor septal en este estudio fue marginal (1 mm) a pesar de múltiples aplicaciones. El mecanismo por el que esta técnica produce la reducción del gradiente en el tracto de salida del ventrículo izquierdo parece explicarse por un efecto mixto de hipocinesia y disincronía por bloqueo de rama.
La plicatura del velo anterior mitral y la técnica de Alfieri pueden ser de utilidad en algunos casos en que el velo anterior mitral es redundante y el tabique presenta una hipertrofia ligera19. De forma similar, el clip mitral es una técnica atractiva para malos candidatos quirúrgicos en los que el mecanismo principal de la obstrucción sea el movimiento anterior septal de la válvula mitral, si bien una de las limitaciones del clip en la MCH es el requerimiento de una cavidad ventricular amplia para maniobrar.
El tratamiento de la obstrucción de localización medioventricular continúa siendo un problema sin resolver; tanto la ASA como la cirugía se han empleado con peores resultados y una tasa de complicaciones superior comparadas con el tratamiento de la obstrucción en el tracto de salida. Algunos centros han publicado resultados de series cortas de pacientes en los que la resección miocárdica se realiza por vía transapical20. Esta técnica podría ser una opción en los casos de hipertrofia severa concéntrica medioapical con o sin obstrucción medioventricular, en los que la cavidad ventricular es mínima. Es importante considerar la posibilidad del trasplante cardiaco en estos y otros casos en los que se agotan las opciones terapéuticas.
Por último, pequeñas modificaciones en la técnica pueden incidir en la reducción de complicaciones en la ASA, como son: el empleo de nuevos electrocatéteres de fijación activa que reducen el riesgo de perforación relacionada con la manipulación del marcapasos temporal, o el empleo del acceso venoso yugular o subclavio que facilita la movilidad del paciente. El acceso arterial radial tiene la ventaja de reducir las complicaciones vasculares, aunque se limita el calibre del catéter guía a 6 Fr. Es importante conseguir un flujo de contraste adecuado para mantener una buena visibilidad de las ramas septales de fino calibre, para lo que se requiere habitualmente de catéteres de 7 Fr.
Acceso al tratamiento invasivo de la obstrucciónEs muy importante disponer de las dos opciones terapéuticas y contar con los especialistas implicados: cardiólogo clínico, ecocardiografista, intervencionista y cirujano cardiaco, y establecer una colaboración estrecha con anestesistas e intensivistas responsables del manejo durante la intervención y el postoperatorio. La decisión de la mejor opción para nuestro paciente debe ser discutida por el equipo e individualizada. Las guías terapéuticas y los documentos de expertos recomiendan cualquiera de las dos opciones en los casos de disnea (clase funcional de la New York Heart Association ≥ III) en relación con la obstrucción (> 50 mmHg en reposo o provocado). La opción quirúrgica es de elección cuando hay enfermedad valvular estructural concomitante. Dadas las características de ambas opciones y aunque no se recoge en las guías, parece más adecuada la cirugía en los casos de pacientes jóvenes o en los que presentan grados de hipertrofia severa (> 25 mm). Los pacientes de mayor edad con menos hipertrofia y los que ya portan marcapasos o DAI, si la anatomía es favorable, podrían ser buenos candidatos a ASA.
Hay desequilibrios en la implantación de los programas de miectomía y ASA entre países y entre hospitales. La relativamente mayor facilidad de la técnica percutánea ha hecho crecer de modo exponencial los programas de ASA en detrimento de la cirugía. Hoy es infrecuente contar con las dos opciones terapéuticas con el mismo nivel de experiencia en un mismo centro, e incluso en un mismo país. En algunos países de nuestro entorno la miectomía se realiza de forma anecdótica o simplemente no se encuentra en la cartera de servicios de los centros con unidades de miocardiopatías. Por otro lado, los centros con gran tradición de miectomía, grandes centros quirúrgicos de Estados Unidos, aglutinan la mayoría de los casos que se realizan actualmente en el mundo. La técnica percutánea tiene la ventaja de ser realizable en todos los hospitales que hacen intervencionismo y, por contra, la desventaja de realizarse en centros sin experiencia y la excesiva dispersión de los casos.
En conclusión, para asegurar el éxito del tratamiento invasivo, es importante realizar correctamente la indicación y la elección del tratamiento, ya sea quirúrgico o percutáneo, en el seno de equipos multidisciplinarios con experiencia. La ASA se ha convertido en una buena alternativa a la miectomía para la mayoría de los pacientes, aunque es preciso trabajar por establecer un protocolo claro y consensuado. En este sentido, es necesario promover la creación de registros multicéntricos prospectivos que permitan confirmar la seguridad de la técnica a largo plazo.
Conflicto de interesesNinguno.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: The Heart Hospital, 16-18 Westmoreland St., Londres W1 8PH, Reino Unido. william.mckenna@uclh.org