Full English text available from: www.revespcardiol.org/en
El síndrome de Brugada (SBr) se caracteriza por una elevación del segmento ST en las derivaciones precordiales derechas (V1-3) en el electrocardiograma (ECG) y un aumento del riesgo de episodios de taquicardia ventricular/fibrilación ventricular (TV/FV) y muerte súbita cardiaca1,2. Aunque han transcurrido más de 2 décadas desde que los hermanos Brugada describieran por primera vez el SBr1, se han encontrado pocas opciones terapéuticas, a pesar del gran interés generado por ese síndrome. De hecho, actualmente hay solo 2 estrategias terapéuticas: el desfibrilador automático implantable (DAI) y el tratamiento crónico con quinidina2. Sin embargo, la quinidina no es eficaz en muchos pacientes, y a menudo su uso se asocia con efectos adversos intolerables. El implante de un DAI puede ser eficaz para prevenir la muerte súbita cardiaca y actualmente se recomienda con una indicación de clase I para los pacientes sintomáticos con un patrón de ECG de Brugada tipo 1 que sufren una muerte súbita recuperada y síntomas asociados con la FV, como síncope, crisis convulsivas o respiración agónica nocturna. Lamentablemente, en muchos pacientes el tratamiento con un DAI implica descargas inapropiadas, fracturas o fallos de los electrodos e infecciones del dispositivo. Además, los pacientes con SBr y alto riesgo presentan episodios de FV recurrentes, que causan descargas frecuentes del DAI o tormentas arritmógenas. Excepcionalmente es necesario el trasplante cardiaco para controlar la tormenta eléctrica.
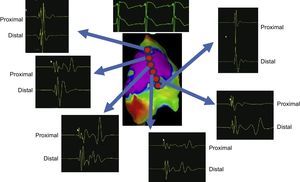
DESCUBRIMIENTO Y CARACTERIZACIÓN DEL SUSTRATO ARRÍTMICO EN EL SÍNDROME DE BRUGADALas técnicas anteriores de mapeo y ablación, que inicialmente se realizaron en un pequeño número de pacientes con SBr seleccionados, se aplicaron tanto al epicardio como al endocardio, con resultados poco satisfactorios. Actualmente hay consenso respecto a que los posibles sustratos arrítmicos causantes de las anomalías que se observan en el patrón de ECG del SBr típico se sitúan en la parte anterior del tracto de salida del ventrículo derecho del pericardio3-10. Ante la falta de estrategias terapéuticas basadas en un sustrato bien definido para controlar y prevenir las taquiarritmias ventriculares malignas en el SBr, se intentó en primer lugar identificar cualquier posible sustrato arrítmico en una población amplia de pacientes con SBr con diferentes formas de presentación clínica y patrones de ECG de SBr en situación basal4,6, combinando técnicas de mapeo endoepicárdico y epicárdico, con mapas de duración de potencial tridimensionales y después de una infusión de ajmalina (1 mg/kg en 5 min). Se identificaron con exactitud amplias áreas anormales bien definidas electrofisiológicamente, que la ajmalina puso de manifiesto, exclusivamente en la parte anterior del tracto de salida del ventrículo derecho del pericardio o en la pared libre anterior del ventrículo derecho6 (figura 1). Se observaron áreas anormales más amplias en los pacientes con la forma de presentación clínica más grave o con un patrón de ECG de SBr de tipo 1. Sin embargo, en pacientes menos sintomáticos, la infusión de ajmalina puso al descubierto áreas anormales de un tamaño similar6. En los pacientes menos sintomáticos sin síntomas típicos asociados con el SBr, el sustrato aumentó en más de 3 veces tras la administración de la ajmalina, lo cual indica que en esta población de pacientes es necesario que haya o persistan factores moduladores o agravantes para activar el sustrato de manera que facilite la aparición de TV/FV. En general, el aumento del sustrato inducido por la ajmalina fue mayor en los varones que en las mujeres6, lo que confirma lo observado en estudios previos sobre la diferencia entre sexos en el SBr. Tiene interés señalar que se observaron potenciales de bajo voltaje (< 1 mV) muy prolongados y fragmentados exclusivamente en pacientes con la peor forma de presentación clínica, mientras que en los pacientes con SBr menos sintomáticos se observaron potenciales ventriculares anormales con una amplitud de voltaje conservada6. A la vez que pone de manifiesto el papel de los sustratos epicárdicos complejos extensos, esta estrategia basada en el sustrato explica claramente la ineficacia de la ablación endocárdica sola, así como el menor éxito de la ablación epicárdica menos extensa no guiada sistemáticamente mediante la administración de fármacos de clase Ic, como propusieron inicialmente otros autores. En nuestra experiencia, la reexposición a la ajmalina tras la ablación puede mostrar potenciales anormales adicionales en muchos pacientes (> 60%), lo que puede requerir nuevas aplicaciones de RF para normalizar de manera persistente el patrón del ECG6. Solo después de la ablación de todos los sustratos residuales, confirmada mediante una reexposición a la ajmalina, se puede normalizar de manera persistente el patrón de ECG haciendo que la TV/FV deje de ser inducible6 (figura 2). Estos datos y el papel de la infusión de ajmalina son importantes para una ablación satisfactoria del sustrato eléctrico en el SBr. En consecuencia, por primera vez, la estrategia de ablación basada en el sustrato propuesta por nuestro grupo podría aplicarse a la inmensa mayoría de pacientes con SBr.
Diferentes muestras de señales obtenidas tras la infusión de ajmalina, que muestran señales de baja frecuencia y larga duración anormales en el núcleo del área electrofisiológicamente anormal (púrpura) y señales normales en los demás lugares. Se muestra la señal proximal y distal en cada localización. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
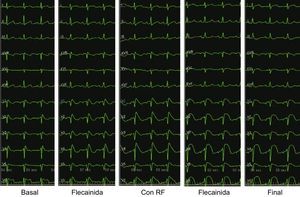
Cinco ECG consecutivos en los que se observa la progresión de la elevación del segmento ST, en situación basal, tras la administración de ajmalina, durante la ablación, nuevamente tras la administración de ajmalina y en el ECG final. Obsérvese que las derivaciones precordiales se presentan mediante V1-V2 en el segundo espacio intercostal (indicado con V1-V2), V1-V2 en el tercero (indicado con V3-V4) y V1-V2 en el cuarto (indicado con V5-V6) en cada ECG. Obsérvese el aumento de la elevación del segmento ST durante la aplicación de la radiofrecuencia (RF) y cómo después de la ablación el ST se redondea y deja de ser del tipo en ensenada más largo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Propusimos por primera vez la infusión de ajmalina como método novedoso para determinar con exactitud la localización y el tamaño del sustrato eléctrico arrítmico (SEA) en una serie de 14 pacientes4. Más recientemente, esta estrategia, en combinación con los mapas de duración tridimensionales, se ha confirmado en una serie de otros 135 pacientes, en la que se ha demostrado que es más fiable para identificar a los pacientes con riesgo de TV/FV que la estratificación del riesgo basada solo en la forma de presentación clínica, incluido el patrón de ECG espontáneo, los síntomas o los antecedentes genéticos o familiares6. La infusión de ajmalina reveló un aumento significativo del tamaño del sustrato del SBr, a pesar de que la mayoría de los pacientes con la forma de presentación clínica más grave no presentaban un patrón de ECG espontáneo de SBr de tipo 1 en situación basal, antecedentes familiares de MSC a edad < 45 años ni un resultado positivo para el SCN5A6. En nuestra experiencia, la capacidad de identificar con exactitud cualquier posible sustrato es la única manera de realizar con éxito una ablación con RF, para asegurar que se realiza la ablación de toda el área de SEA y reducir al mínimo la cantidad de tejido sano afectado por la ablación. En 135 pacientes consecutivos con SBr, la muestra más amplia del mundo, la ablación del sustrato usando este método normalizó el patrón de ECG e hizo que la TV/FV no fuera inducible en los pacientes6 (figura 3). El mapeo epicárdico es importante tanto para la identificación como para la ablación del área eléctrica anormal. Es necesario el empleo de la ajmalina junto con el mapeo epicárdico para la identificación y ablación del SEA, que puede provocarse durante determinados eventos, como se ha comentado antes. Por consiguiente, la ajmalina puede ser especialmente útil en pacientes anteriormente considerados más «en bajo riesgo», y que en realidad podrían sufrir una TV/FV si uno de los muchos factores moduladores o desencadenantes la originara.
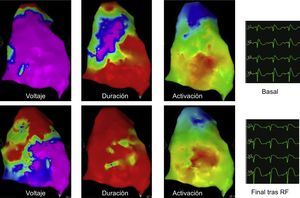
Mapas de voltaje, duración y activación antes y después de la ablación de un sustrato eléctrico epicárdico. Los ECG se presentan mediante V1-V2 en el segundo espacio intercostal y mediante V1-V2 en el tercer espacio intercostal (indicado con V3-V4). El mapa de voltaje es normal antes de la ablación y muestra luego una ligera disminución en el área en la que se ha aplicado la ablación. El mapa de duración se normalizó por completo tras la ablación. A pesar de la presencia de señales anormales antes de la ablación (el área púrpura corresponde a las señales de más de 200 ms de duración), no persisten señales anormales después de la ablación. El mapa de activación muestra una secuencia de activación y una duración antes y después de la ablación que son normales, lo cual indica que no hay áreas de conducción anormal antes de la ablación y que esta no fue transmural, ya que la activación continuó estando dentro de los límites normales tras la ablación epicárdica. El ECG muestra una clara elevación del segmento ST de tipo en ensenada antes de la ablación y una elevación del segmento ST de tipo redondeado inmediatamente después de esta. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El empleo de la ajmalina se repitió sistemáticamente durante el seguimiento. Durante una mediana de seguimiento de 10 meses, de 135 pacientes con SBr sintomático, solo 2 (1,5%) con síntomas asociados con el SBr y múltiples episodios recurrentes de TV/FV antes de la ablación presentaron solo 1 episodio de TV/FV después de la intervención, y en 1 de ellos el mecanismo desencadenante fue un desequilibrio electrolítico6. Estos resultados son importantes desde el punto de vista clínico y ponen de relieve por primera vez un papel terapéutico efectivo de la ablación epicárdica en la prevención de la FV en una serie amplia de pacientes con SBr de alto riesgo y TV/FV recurrentes.
RELACIÓN ENTRE EL PATRÓN DE ECG DEL SÍNDROME DE BRUGADA TÍPICO Y LA EXTENSIÓN DEL SUSTRATOSe demuestra por primera vez que, independientemente de la forma de presentación clínica, existe una correlación entre el grado de elevación del ST de tipo en ensenada y la magnitud del sustrato6, lo que aporta una evidencia que indica que los aumentos de la elevación del segmento ST de tipo en ensenada en las derivaciones precordiales derechas V1-3 representan realmente los cambios electrofisiológicos correspondientes de sustratos epicárdicos anormales amplios del ventrículo derecho. Además, la normalización del patrón de ECG coincidió con la eliminación completa del sustrato, que a menudo requiere la aplicación repetida de RF6. Estos resultados indican claramente que, independientemente de la forma de presentación clínica o del patrón de ECG espontáneo, la población con SBr tiene un sustrato epicárdico potencialmente amplio y bien definido, que en muchos pacientes puede ser difícil de activar sin la presencia de factores moduladores o desencadenantes. Nuestras observaciones explican el motivo de que: a) la aparición de TV/FV en el SBr sea un hecho muy poco frecuente e impredecible; b) la TV/FV en los pacientes con SBr sea difícil de tratar y que interrumpirla suela requerir varias cardioversiones eléctricas, y c) el estudio electrofisiológico por sí solo no prediga bien los resultados, en especial en los pacientes menos sintomáticos o asintomáticos, que a menudo requieren múltiples estímulos adicionales en diferentes lugares del endocardio.
COMPLICACIONESNo se produjeron complicaciones relacionadas con la intervención en ninguno de los pacientes y no apareció ninguna taquiarritmia ventricular durante la administración de ajmalina4,6. Cuatro meses después de la intervención, solo una minoría de los pacientes (3%) sufrieron un derrame pericárdico autolimitado, sin deterioro hemodinámico agudo, que se detectó en la ecocardiografía. Se trató ambulatoriamente a estos pacientes con antiinflamatorios esteroideos y no esteroideos, sin recurrir a pericardiocentesis.
CONSECUENCIAS CLÍNICASLa observación constante de sustratos epicárdicos bien definidos y extensos en los pacientes con SBr, independientemente de su forma de presentación clínica o del patrón de ECG de SBr espontáneo, tiene consecuencias clínicas importantes. La ablación epicárdica con guía electrofisiológica del sustrato arritmógeno puede obtenerse de manera segura y efectiva en un creciente número de centros de alto volumen, con lo que se reduce el número de eventos que se producen en esta población de alto riesgo, lo que podría limitar el número de DAI necesarios para la prevención de la TV/FV10.
CONCLUSIONES Y PERSPECTIVAS FUTURASNuestra experiencia en una cohorte amplia de pacientes consecutivos con SBr y diversas formas de presentación clínica, que son representativos de la inmensa mayoría de los pacientes a los que actualmente se diagnostica un SBr, ha aportado nueva información y nuevas perspectivas para comprender la fisiopatología, el mecanismo y el tratamiento de la enfermedad para la prevención de la TV/FV. Nuestra conclusión es que las áreas epicárdicas anormales extensas y bien definidas electrofisiológicamente, según lo determinado mediante la administración de ajmalina, son la principal localización del sustrato del SBr y causa del patrón de ECG del SBr de tipo 1 y de la posibilidad de inducir la TV/FV. La normalización persistente del patrón de ECG, sin potencial de inducción de TV/FV ni siquiera tras la exposición repetida a la ajmalina, indica que la ablación del sustrato puede considerarse segura y una posible forma de prevenir la recurrencia de las arritmias ventriculares y la muerte súbita en la mayoría de los pacientes con SBr. A la vista de nuestra amplia experiencia, la ablación del sustrato epicárdico en los pacientes con SBr es una estrategia terapéutica adicional efectiva. Esperamos que haya más pacientes con SBr a los que se pueda tratar con éxito mediante una ablación percutánea sin necesidad de un DAI. Sin embargo, será necesario un estudio aleatorizado para confirmar nuestros resultados. Aunque no se produjeron complicaciones graves en nuestros pacientes, estos resultados no pueden extrapolarse automáticamente a otros centros con menor experiencia de todo el mundo. Para los pacientes con SBr de alto riesgo que presentan episodios recurrentes de FV, la ablación epicárdica puede considerarse el tratamiento de elección, pero los beneficios aportados por esta nueva estrategia deben compararse con los riesgos que la intervención de ablación conlleva.
CONFLICTO DE INTERESESNinguno.