Palabras clave
El término ventilación no invasiva (VNI) se aplica a la administración de una ayuda ventilatoria sin establecer una vía endotraqueal1. Las primeras experiencias con VNI y presión positiva provienen de los años treinta, cuando se utilizó precisamente en pacientes con edema agudo de pulmón (EAP). Sin embargo, su utilización posterior no se extendió debido, en parte, a la proliferación de mecanismos ventilatorios con presión negativa externa, como el «pulmón de acero» usado en las epidemias de poliomielitis de los años treinta y, con posterioridad, por la extensión de la ventilación «invasiva», con intubación orotraqueal (IOT) ligada a las unidades de cuidados intensivos (UCI). En los años ochenta, la VNI con presión positiva volvió a resurgir con la introducción de la presión continua en al vía aérea (CPAP) en el tratamiento de la apnea del sueño2, aunque el espaldarazo definitivo se ha producido en la década de los noventa, a raíz de la introducción de la presión de soporte (PS) como modalidad ventilatoria.
El objetivo principal de la VNI es prevenir la IOT (no sustituirla)2, ya que ésta conlleva una serie de riesgos tanto al inicio (aspiración, traumatismos, hipotensión, arritmias), como durante la ventilación (por la incapacidad de toser y expectorar que favorece la neumonía nosocomial) y tras la extubación (disfonía, edema de laringe, granuloma, etc.). En la práctica, la clave del éxito en la aplicación de la VNI pasa por conseguir una buena adaptación de las mascarillas que permita mantener presiones positivas sin fugas significativas.
En la actualidad, básicamente se utilizan tres modalidades de VNI basadas en la aplicación de presión positiva: la CPAP, la ventilación con PS (NIPSV o BIPAP) y la ventilación por volumen (poco utilizada).
CPAP
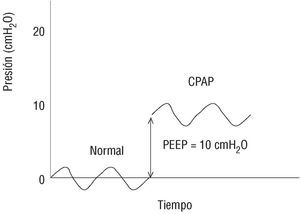
El término CPAP significa presión positiva continua en la vía aérea (continuous positive airway pressure) (fig. 1). Aunque en realidad se produce presión positiva continua siempre que se utiliza un respirador con PEEP en cualquiera de sus modalidades (en pacientes intubados o no), el término se reserva exclusivamente para cuando se aplica con respiración espontánea, sin insuflación de aire a presión. Por tanto, la CPAP no es propiamente ventilación mecánica, ya que con ella no «se ventila al paciente», pero dado que provoca presión positiva, se la considera en este grupo. En general, para generar CPAP se utilizan mascarillas con válvula de PEEP, aunque recientemente se ha introducido un sistema de barrera de aire, sin válvula.
Fig. 1. Curvas de presión/tiempo. En la parte izquierda se registran las presiones generadas por un individuo que respira en condiciones normales y genera una presión negativa intratorácica que provoca la entrada de aire por gradiente desde el exterior hasta los pulmones, oscilando sus presiones en la vía aérea alrededor de 0 cmH2O. Si se coloca una mascarilla hermética nasal o facial con un flujo que renueve el aire en su interior y una válvula espiratoria unidireccional (válvula de PEEP) por donde salga el aire espirado, se generará CPAP o presión positiva continua en la vía aérea, ya que se retendrá una cantidad de aire al final de la espiración. El nivel de CPAP lo determinará, por tanto, la válvula de PEEP utilizada (habitualmente 5, 7,5 o 10 cmH2O).
La PEEP mantiene los alveolos desplegados en espiración, lo cual facilita el intercambio gaseoso durante todo el ciclo respiratorio, mejorando la oxigenación. También aumenta la presión intratorácica, con lo que disminuye el retorno venoso y modifica favorablemente la relación de las fuerzas de Starling del complejo capilar/intersticio/alveolo. En la práctica clínica se ha utilizado CPAP en el tratamiento de la insuficiencia respiratoria, fundamentalmente con atelectasia, en el weaning, en el síndrome de la apnea del sueño, en el EAP y en el control de la respiración de Cheyne-Stockes asociado a insuficiencia cardíaca3.
Estudios con CPAP en pacientes con EAP
Desde 1987 se han publicado varios estudios que han demostrado la utilidad de la CPAP en el EAP cardiogénico, con una mejora de la oxigenación y de los parámetros fisiológicos y una reducción de las necesidades de IOT4-6. El análisis agrupado de los principales estudios aleatorios también demuestra una reducción significativa de la mortalidad7, aunque ningún ensayo aislado haya encontrado diferencias en este parámetro. Se ha descrito que el aumento de la presión intratorácica obtenido con la CPAP en estos pacientes reduce el trabajo respiratorio8,9, la poscarga9 y el shunt intrapulmonar6, sin disminuir el índice cardíaco (si la PCP es > a 12 mmHg)6,9.
Recientemente se ha publicado el primer estudio multicéntrico10 en el que se han analizado pacientes con insuficiencia respiratoria aguda no hipercápnica que presentaban infiltrados bilaterales en la radiografía de tórax, muchos de ellos secundarios a insuficiencia cardíaca. La aplicación de CPAP una media de 8 h durante 7 días no ha demostrado diferencias significativas respecto a la oxigenoterapia convencional. No obstante, el diseño de este estudio, con administración prolongada intermitente y la heterogeneidad de la población incluida, con una proporción de neumonías del 55%, hace que estos resultados no puedan compararse con los anteriores.
Como sea que los estudios prospectivos provocan sesgos poblacionales con los criterios de selección, el análisis de registros puede proporcionar una mejor idea del impacto de la CPAP en el EAP. Así, Kelly et al11 analizaron los resultados en una serie retrospectiva de 75 pacientes con una duración de 1,9 h de promedio de tratamiento y evidenciaron una tasa de intubación del 4%, un 6% de intolerancias a la mascarilla y un 3% de hipotensiones ligeras transitorias.
VENTILACIÓN NO INVASIVA CON PRESIÓN DE SOPORTE (NIPSV O BIPAP)
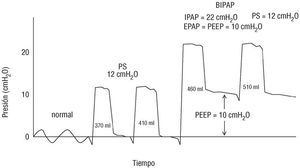
La modalidad de VNI más extendida se basa en la aplicación de PS o asistencia inspiratoria. Con la PS se efectúa una verdadera ventilación, ya que se insufla aire mediante un respirador que se adapta a la demanda del paciente (fig. 2). Aunque no sea totalmente cierto, se puede decir que el paciente regula el inicio y la duración del ciclo. Si a la PS se le añade PEEP se está ventilando con dos niveles de presión (bilevel) y a las ventajas de la asistencia inspiratoria se le añaden los beneficios de la PEEP. Existen 2 tipos de ventiladores para esta modalidad2: los clásicos de cuidados intensivos que, aunque son más caros, facilitan un mejor sistema de alarmas y monitorización, permitiendo ventilación por volumen y mayores presiones inspiratorias (su ventilación suele llamarse NIPSV), y los portátiles (denominados con el término patentado BIPAP), más económicos, manejables y diseñados especifícamente para VNI, que presentan sistemas de compensación de fugas y en las últimas versiones facilitan la adaptación del paciente al permitir ajustar el trigger o bien el «tiempo de ascenso» (hasta alcanzar la presión preseleccionada), además de incorporar también alarmas y monitorización. El inconveniente de los portátiles BIPAP es la utilización de un solo tubo para la inspiración y la espiración que puede facilitar la re-respiración de CO2. Pendiente de ser aprobada por la FDA, la incorporación al mercado de la ventilación asistida proporcional tiene buenas expectativas, ya que permitirá ajustar la proporción exacta de ayuda inspiratoria que se desee.
Fig. 2. Curvas de presión/tiempo. Con la PS, el ventilador suministra aire en cada inspiración hasta alcanzar la PS prefijada (parte central del registro), que se mantiene constante gracias a la desaceleración del flujo. Con esta modalidad la cantidad de aire recibida o volumen corriente (en ml) es variable y viene condicionado por el nivel de PS seleccionado previamente y por la duración del ciclo que determina el paciente con su demanda (en la práctica, cuanto más alto sea el nivel de PS prefijado, mayor será el volumen recibido). Cuando además de PS se aplica PEEP (parte derecha del panel), se producen dos niveles de presión (bilevel o BiPAP), uno espiratorio (EPAP) definido por la PEEP y otro inspiratorio (IPAP) condicionado por la PS (IPAP = PS + PEEP).
Utilización de la NIPSV o BIPAP
En pacientes con EPOC descompensada existe probada evidencia del beneficio de la NIPSV, con una reducción de la tasa de intubación, de la estancia hospitalaria y de la mortalidad12-15. Sin embargo, cuando se analizan sus efectos en pacientes con insuficiencia respiratoria debida a otras causas (neumonías, distrés respiratorio del adulto, etc.) los resultados son más contradictorios16,17, aunque parece que en pacientes hipercápnicos sea superior a la oxigenoterapia convencional16,18. La NIPSV se ha ensayado con éxito en pacientes inmunodeprimidos, en el postoperatorio y en el weaning1,2, e incluso se ha llegado a comparar con la IOT, sin que se encontraran diferencias significativas, aunque con menos complicaciones (fundamentalmente menor número de neumonías asociadas al ventilador)19.
Estudios con NIPSV o BIPAP en el EAP
Hasta hace poco, la experiencia de la NIPSV en el EAP se basaba en series no controladas o descripciones de casos20-24 que ponían de manifiesto, en síntesis, una tasa de intubación del 3-21%, una mejor respuesta en pacientes hipercápnicos y una peor respuesta en pacientes con IAM.
Cabría esperar que la NIPSV presentase resultados similares o incluso superiores a la CPAP, ya que la ayuda inspiratoria adicional que proporciona debería ser determinante en los casos graves con fatiga muscular. Si bien en pacientes postoperatorios se comprobó una mayor reducción del trabajo respiratorio con la NIPSV25, en el EAP el único estudio comparativo de ambas técnicas no fue concluyente. En este ensayo, Mehta26 estudió a 27 pacientes y encontró que la BIPAP provocaba mayor reducción de la PaCO2, del pH, de la frecuencia cardíaca y de la presión arterial (PA) que la CPAP a los 30 min, aunque ello no repercutió en la tasa de IOT. Sin embargo, este estudio fue interrumpido por detectarse una incidencia de IAM superior en el grupo BIPAP (el 71 frente al 31%), lo cual hizo alertar sobre un posible riesgo asociado a esta técnica. Los autores invocaron la mayor reducción de la PA como posible explicación, pero lo cierto es que todos los pacientes que sufrieron un infarto ya presentaban dolor torácico a su llegada a urgencias. Por tanto, parece más probable que la mayor tasa de infartos fuera debida a una muestra no homogénea de pacientes más que a una consecuencia del tratamiento. Por otro lado, existen experiencias positivas con el uso de CPAP en pacientes con IAM2 7.
Nuestro grupo28,29 estudió una serie de 40 pacientes con EAP severo que fueron distribuidos de forma aleatoria en 2 grupos, uno tratado con NIPSV y el otro con oxigenoterapia convencional. Para la NIPSV se utilizó un respirador estándar (Puritan Benett 7200) con un rango de PS entre 10-20 cmH2O (media, 15) y una PEEP de 5 cmH2O. Todos los pacientes recibieron de entrada 40 mg de furosemida, 4 mg de cloruro mórfico y nitroglicerina en perfusión y en bolos de 1 mg cuando la PA era > 170 mmHg. No había restricciones en el tratamiento ni en la FiO2, que inicialmente era de 0,5. Los resultados más llamativos del estudio fueron una reducción del tiempo de resolución del EAP, que fue de 105 min en el grupo control y de 30 min en el grupo NIPSV, al mismo tiempo que menos pacientes requirieron IOT (33% en el grupo control frente a 6% en el grupo NIPSV). Con la NIPSV se objetivó una mejoría más rápida y sostenida de la oxigenación (medida con la SaO2 y la PaO2/FiO2) y una mayor reducción de la PaCO2. No se encontraron diferencias en la tasa de IAM entre ambos grupos.
En esta serie, el 43% de los pacientes tenía hipercapnia y el pH medio era de 7,29. Los pacientes de riesgo se caracterizaron por tener un mayor grado de edema en la radiografía de tórax, una clase clínica NYHA más elevada, una peor puntuación en el APACHE II (índice de severidad que recoge los antecedentes y parámetros agudos) y concentraciones de PaCO2 más elevadas en el momento del ingreso. También se insinuó un peor pronóstico en los pacientes con IAM como causa del EAP (tenía IAM el 57% de los pacientes intubados frente al 23% de los no intubados). A los 30 min de la inclusión, los pacientes de riesgo presentaban una SaO2 más baja (84 frente a 95%) y una FR significativamente más alta (34 frente a 27 respiraciones/min), mientras que a los 60 min existían diferencias en la práctica totalidad de los parámetros fisiológicos y gasométricos analizados.
Recientemente se han publicado 2 nuevos estudios con el uso de la VNI en pacientes afectados de EAP. El primero, desarrollado en Italia y presentado como resumen, demuestra una reducción de las necesidades de IOT en pacientes con EAP e hipercapnia tratados con BIPAP30. El segundo, efectuado por un grupo israelí, es el primer estudio con resultados negativos pero, a nuestro juicio, los errores metodológicos del diseño cuestionan sus resultados y por ello merece ser comentado con mayor detalle.
Sharon et al31 efectuaron el estudio en UCI móviles y analizaron a 40 pacientes distribuidos aleatoriamente en 2 grupos: BIPAP o oxigenoterapia convencional. Todos los pacientes debían recibir un flujo de O2 de 10 l/m, 80 mg de furosemida y 3 mg de morfina. Lo más llamativo es que la BIPAP se inició con una EPAP (PEEP) de 3 cmH2O y una IPAP de 8 cmH2O, que según la respuesta podía aumentarse en 1 cmH2O de forma escalonada, hasta 12 cmH2O (no obstante, la media de todo el estudio fue de 4 y 9 cmH2O, respectivamente). Los autores encontraron una tasa de IOT del 80% en el grupo BIPAP frente a un 20% en el grupo control, una incidencia de IAM del 55% frente al 10% y una mortalidad del 10 frente al 0%. Estas cifras tan llamativas, que son las más elevadas de la bibliografía, sólo se explican por la mala aplicación de la técnica. En efecto, cualquier médico experto en ventilación mecánica sabe que una IPAP de 8 (PS de 5 cmH2O) escasamente permite compensar las resistencias del circuito. En todos los estudios se han utilizado PS alrededor de 15 cmH2O (es decir, una IPAP de 20) para conseguir volúmenes corrientes > 400 ml, por lo cual es muy probable que la mayoría de los pacientes del estudio de Sharon estuvieron hipoventilados con el perjuicio consiguiente (desafortunadamente, con el equipo utilizado, los autores no pudieron medir el volumen corriente). En este sentido, Kallet et al32 demostraron en un estudio reciente el empeoramiento del edema pulmonar al usar bajos volúmenes corrientes, ya que el aumento de la presión negativa intratorácica secundario al mayor esfuerzo inspiratorio provocaba un incremento en el gradiente alveolo-capilar. La situación es más grave en el estudio israelí, por el estricto protocolo que prácticamente no permitía ajustar la PS ni variar la FiO2. Además, el grupo BIPAP recibió dosis significativamente más bajas de vasodilatadores (dinitrato de isosorbida i.v.) que el de oxigenoterapia convencional (3,5 frente a 10,8 mg, respectivamente), cuando en un estudio previo33 los mismos autores habían demostrado la superioridad de las dosis más altas y, por último, las dosis de morfina fueron también muy bajas (2,2 y 2,5 mg, respectivamente, lo cual no se entiende si todos debían recibir 3 mg en el momento del ingreso) perjudicando al grupo BIPAP, ya que para la adaptación a la VNI suele necesitarse más sedación. Cabe concluir, por todo lo expuesto, que los resultados de este estudio no deben interpretarse como un reflejo de la falta de efectividad de la técnica, si no de su mala utilización.
Recomendaciones de la VNI en el EAP
Una revisión sistemática reciente apuntaba la superioridad de la VNI respecto a la oxigenoterapia convencional para reducir la tasa de IOT y evidenciaba una tendencia a disminuir la mortalidad34. Los resultados agrupados de los principales estudios aleatorios confirman esta hipótesis (tabla 1). Admitida la superioridad, cabe destacar, sin embargo, que no todos los pacientes son óptimos candidatos a la VNI, ya que estas técnicas no están exentas de riesgo si se emplean de manera inadecuada, como desgraciadamente ha demostrado el estudio antes comentado y, por tanto, es probable que deban reservarse para los casos graves con el objetivo de prevenir la IOT. Así, los casos graves podrían ser identificados clínicamente en el momento del ingreso o al detectarse un importante edema alveolar en la radiografía de tórax o hipercapnia en la gasometría. Los pacientes tratados inicialmente con oxigenoterapia convencional deberían ser revaluados a los 30 min, y en los casos de hipoxemia y taquipnea persistente (SaO2 < 90% y FR > 30 respiraciones/min ) debería considerarse la VNI con celeridad.
Dada la menor complejidad en su manejo, puede ser recomendable la utilización de CPAP cuando exista poca experiencia en el uso de la NIPSV o BIPAP, siendo éstas probablemente preferibles en los pacientes hipercápnicos. El nivel de CPAP más utilizado es de 10 cmH2O, no recomendándose < 5 o > 12,5 cmH2O. Cuando se use NIPSV o BIPAP, la PEEP o EPAP recomendada es < 10 cmH2O (habitualmente 5 cmH2O). En estos casos, el médico debe permanecer a la cabecera del paciente, controlando en todo momento los parámetros del respirador, incrementando escalonadamente la PS (el rango habitual está entre 10 y 20 cmH2O, lo que corresponde a una IPAP entre 15 y 25 cmH2O) y ocasionalmente el trigger o el tiempo de ascenso, para obtener el máximo volumen corriente y evitar fugas. Esto suele ser necesario en la primera hora, que es cuando se producen la mayoría de las IOT. Es fundamental conseguir el máximo hermetismo en la mascarilla, siendo necesario el concurso activo del equipo terapéutico al inicio para presionarla.
A diferencia de los afectados por EPOC, los pacientes con EAP suelen estar agitados y, por tanto, deben recibir instrucciones precisas para adaptarse a la presión de la mascarilla y al «tempo» del respirador, para lo cual el uso generoso de morfina es fundamental. Las mascarillas faciales deben ser amplias, ya que se toleran mejor y no deben usarse mascarillas nasales. La duración de la VNI debería ser de unas 2-4 h de promedio, aunque algunos pacientes puedan necesitar más. De todos modos, la aplicación de VNI no puede hacer olvidar la administración concomitante de altas dosis de vasodilatadores (recomendamos la NTG en bolos hasta conseguir una PA sistólica < 170 mmHg) y dosis no elevadas de diuréticos. Debe aplicarse de entrada la FiO2 más alta posible (100% si es posible). Finalmente, cabe decir que, como norma, debería ensayarse la NIPSV antes de proceder a la IOT en todos los pacientes, pero no cuando ésta ya sea inmediata, exista hipotensión arterial o deterioro severo del nivel de conciencia.
Aunque hacen falta nuevos estudios con series más amplias para sentar las indicaciones definitivas de la VNI y evaluar la hipotética superioridad de la NIPSV/ BIPAP respecto a la CPAP en algunos enfermos, en el momento actual existe suficiente evidencia de la utilidad de la VNI y debe tenerse en cuenta en el manejo del EAP.
Correspondencia: Dr. J. Masip Utset. Unidad de Vigilancia Intensiva. Consorcio Hospitalario de Cruz Roja de Cataluña. Hospital de Barcelona.
Dos de Mayo 301. 08025 Barcelona. Correo electrónico: jmasip@medicina.ub.es