La afección renal en los pacientes con enfermedad cardiovascular confiere un carácter pronóstico y un incremento del riesgo cardiovascular. La disfunción renal es un marcador de lesiones en otras partes del árbol vascular. Su detección permite la identificación precoz de individuos con riesgo elevado de acontecimientos cardiovasculares. La valoración de la afección renal del paciente con enfermedad cardiovascular se llevará a cabo mediante la determinación de albuminuria en una muestra aislada de orina y por la estimación del filtrado glomerular a partir de fórmulas o ecuaciones predictivas derivadas de la creatinina. Se recomienda la fórmula de la Chronic Kidney Disease Epidemiology Collaboration o la de Modification of Diet in Renal Disease. Como alternativa, puede utilizarse la fórmula de Cockcroft-Gault. La administración de fármacos que bloqueen el sistema renina-angiotensina puede asociarse en determinadas ocasiones a disfunción renal aguda o hiperpotasemia. Es importante conocer las situaciones con riesgo de que se produzcan estas complicaciones para dar el mejor tratamiento posible: la prevención. Dado el incremento progresivo de los procedimientos diagnósticos y terapéuticos con contraste intravenoso en el ámbito de la cardiología, la nefrotoxicidad por contraste supone un problema relevante. Es de interés detectar los factores de riesgo y a los pacientes con mayor probabilidad de sufrirla, así como prevenir su aparición.
Palabras clave
La importancia de la enfermedad cardiovascular (CV) como primera causa de morbimortalidad en nuestro medio justifica el extraordinario esfuerzo realizado en la investigación de su etiopatogenia, el pronóstico, la detección de marcadores precoces y el tratamiento. Dentro de este marco, en los últimos años se ha ido tomando conciencia del papel de la insuficiencia renal (IR) en el pronóstico de las enfermedades CV (Tabla 1).
Tabla 1. Relación entre corazón y riñón: importancia pronóstica
| • La enfermedad cardiovascular es la primera causa de muerte en la población con ERC |
| • A medida que la función renal disminuye, se incrementa la probabilidad acontecimientos cardiovasculares, incluso en individuos con una disminución moderada de la función renal. |
| • Los pacientes con ERC presentan importante comorbilidad, lo que favorece el desarrollo de enfermedad cardiovascular |
| • Un 30-50% de los pacientes que presentan un síndrome coronario agudo tienen algún grado de disfunción renal |
| • Hasta un 50% de los pacientes con insuficiencia cardiaca presentan ERC |
| • La administración de contrastes intravenosos en intervenciones sobre las arterias coronarias puede favorecer la aparición de disfunción renal por nefrotoxicidad |
| • La detección de la disfunción renal permite una identificación precoz de los sujetos con riesgo elevado de acontecimientos cardiovasculares, con la finalidad de mejorar su pronóstico mediante una intervención precoz en diagnóstico y tratamiento |
ERC: enfermedad renal crónica.
Los pacientes con función renal disminuida tienen más riesgo de complicaciones CV1, y en pacientes con enfermedad cardiaca conocida, el riesgo de muerte se incrementa a medida que la función renal disminuye o si aparecen marcadores de daño renal (p. ej., proteinuria). De hecho2, los pacientes con filtrado glomerular (FG) < 20ml/min/1,73 m2 tienen un riesgo de muerte 6 veces mayor que con FG > 60ml/min/1,73 m2. Esta relación directa entre el deterioro de la función renal y la aparición de acontecimientos CV y mortalidad se ha mostrado ya en individuos con una disminución moderada (incluso leve) de la función renal, y este riesgo aumenta a medida que se deteriora el FG1, 2. De esta forma, múltiples estudios, así como recientes metaanálisis3 han demostrado que la presencia de enfermedad renal crónica (ERC), definida por disminución del FG o presencia de marcadores de daño renal (albuminuria/proteinuria), es un importante predictor de morbimortalidad.
La ERC es un problema de salud mundial; se constata un progresivo incremento de los pacientes que inician terapia sustitutiva renal, que actualmente es de un 5-8% anual4 y además supone un importante problema económico. En España5, el 6,8%2 de la población presenta una disminución del FG < 60ml/min/1,73 m2. Los factores que determinan este incremento en la prevalencia de la ERC son fundamentalmente el envejecimiento progresivo de la población en los países desarrollados, el aumento en la prevalencia de diabetes mellitus y la hipertensión arterial, la mayoría de ellos presentes en pacientes con enfermedad cardiaca.
Por otra parte, los pacientes con ERC sufren importante comorbilidad, lo que favorece el desarrollo de enfermedad CV, y esta es la principal causa de muerte de estos pacientes4, pues afecta a aproximadamente la mitad de los casos.
Enfermedad renal crónica y enfermedad cardiacaLa prevalencia de ERC entre los pacientes con enfermedad cardiaca es muy elevada y tiene carácter pronóstico.
Alta prevalencia de enfermedad renal crónica en pacientes con cardiopatía isquémicaUn 30-50% de los pacientes que sufren síndrome coronario agudo tienen algún grado de disfunción renal2, y su presencia tiene un claro significado pronóstico CV2, 6, 7.
Tras un procedimiento de revascularización coronaria percutánea, la mortalidad de los pacientes que tienen IR (FG < 60ml/min/1,73 m2) es similar a la de los pacientes que previamente han tenido un infarto de miocardio8. Este aumento de la mortalidad relacionado con la IR no se debe a una mayor tasa de reestenosis8 y parece explicable por la mayor presencia de factores de riesgo CV, especialmente por la afección más difusa y grave del árbol coronario y la mayor evolución a insuficiencia cardiaca8, 9.
Entre los pacientes cardiópatas sometidos a cirugía, especialmente de bypass coronario, la presencia de IR multiplica por 3 el riesgo de disfunción renal como complicación postoperatoria, con alta probabilidad de que requieran diálisis, cuando se compara con pacientes con función renal normal. Incluso leves deterioros de la función renal se han asociado a un incremento significativo de la morbimortalidad10.
Alta prevalencia de enfermedad renal crónica en pacientes con insuficiencia cardiacaHasta un 50% de los pacientes con insuficiencia cardiaca presentan ERC. En un estudio multicéntrico prospectivo con más de 1.000 pacientes hospitalizados por insuficiencia cardiaca, la prevalencia de disfunción renal fue del 27%, y ocurrió en la mayoría de los casos los primeros 3 días de hospitalización. Los factores de riesgo independientes asociados a un mayor riesgo de insuficiencia cardiaca fueron historia de insuficiencia cardiaca, diabetes mellitus, creatinina sérica > 1,5mg/dl y presión arterial > 160mmHg11. Un estudio realizado en nuestro país ha mostrado que la prevalencia de IR en pacientes con insuficiencia cardiaca fue del 43,3 y el 41,8% en pacientes con función sistólica preservada (fracción de eyección del ventrículo izquierdo ≥ 50%) y disminuida (fracción de eyección del ventrículo izquierdo < 50%) respectivamente12.
Por otra parte, el 40% de los pacientes con IR tienen insuficiencia cardiaca, prevalencia que se incrementa a medida que disminuye la función renal.
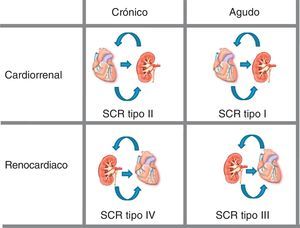
Síndrome cardiorrenalEsta relación entre los sistemas CV y renal ha dado lugar a que recientemente se haya introducido el término «síndrome cardiorrenal», ya que muchos pacientes presentan diversos grados de disfunción de uno u otro órgano.
El síndrome cardiorrenal es una condición fisiopatológica del corazón y el riñón —de forma que la disfunción primaria de un órgano, ya sea aguda o crónica, da lugar a la disfunción secundaria o lesión del otro— en la que se muestran los efectos negativos de la función renal disminuida en el corazón.
Se han definido cinco tipos de síndrome cardiorrenal13 (Figura 1):
• Tipo I (síndrome cardiorrenal agudo): deterioro agudo en la función cardiaca que produce daño renal agudo.
• Tipo II (síndrome cardiorrenal crónico): alteraciones crónicas de la función cardiaca (p. ej., insuficiencia cardiaca congestiva) que causan ERC progresiva y permanentemente.
• Tipo III (síndrome renocardiaco agudo): deterioro agudo en la función renal (p. ej., isquemia aguda o glomerulonefritis) que causa alteraciones cardiacas agudas (insuficiencia cardiaca, arritmia, isquemia).
• Tipo IV (síndrome renocardiaco crónico): ERC (p. ej., por enfermedad glomerular o nefroangiosclerosis) que contribuye a disminución en la función cardiaca, hipertrofia cardiaca y/o riesgo incrementado de acontecimiento CV.
• Tipo V (síndrome cardiorrenal secundario): condición sistémica (p. ej., diabetes mellitus, sepsis) que causa disfunciones renal y cardiaca simultáneamente.
Figura 1. Síndrome cardiorrenal: bidireccionalidad riñón-corazón. SCR: síndrome cardiorrenal. Modificada con permiso de Ronco et al 13 .
¿Por qué medir la función renal en el paciente con enfermedad cardiaca?El objetivo de detectar la disfunción renal es identificar precozmente a los pacientes con riesgo elevado de acontecimientos CV con la finalidad de mejorar su pronóstico mediante una intervención precoz de diagnóstico y tratamiento. El riñón es un endotelio especializado, y cualquier lesión que se produzca en él puede ser un marcador de lesiones en otras partes del árbol vascular, especialmente el corazón. Además del diagnóstico y la valoración del riesgo CV, detectar y estimar el daño renal nos permitirá monitorizar ciertas intervenciones como el ajuste de algunos fármacos (digoxina, algunos bloqueadores beta) y la detección de pacientes con riesgo de nefrotoxicidad (tras administración de contrastes, administración de antiinflamatorios no esteroideos en determinadas circunstancias, etc.).
Estimación de la afección renal en el paciente con enfermedad cardiovascularLa valoración de la disfunción renal en el paciente con enfermedad CV se realizará mediante la determinación de albuminuria y la estimación del FG con fórmulas derivadas de la creatinina sérica. La presencia de ambos factores (albuminuria y FG reducido) tiene efecto sinérgico como factor predictor de riesgo CV14, 15. En las Guías de la Sociedad Europea de Hipertensión y la Sociedad Europea de Cardiología, un FG estimado < 60ml/min/1,73 m2 o una excreción urinaria de albúmina por encima de los valores considerados normales son diagnósticos de lesión orgánica subclínica16. La realización de un sedimento urinario completa el cribado del paciente con enfermedad CV, ya que ayudará a descartar otras enfermedades no relacionadas con el riesgo CV.
La aparición simultánea de albuminuria y un descenso en el FG se ha mostrado como factor independiente predictor de mortalidad CV en la población general17. Estos datos han planteado que en próximas guías quizá se añada un sufijo (P) (presencia o ausencia de albuminuria/proteinuria) junto al estadio de ERC para una mejor estratificación del riesgo CV de los pacientes. La presencia de albuminuria tendrá un carácter pronóstico diferenciado en pacientes con el mismo estadio de ERC17.
Definición de enfermedad renal crónicaEn un intento de esclarecer la definición y la clasificación de la ERC, la National Kidney Foundation publicó unas directrices con el fin de unificar criterios para definir la situación de la función renal (Kidney Disease Outcomes Quality Initiative, Guías K/DOQI)18. Se estableció una clasificación basada en el cálculo del FG estimado por fórmula de la Modification of Diet in Renal Disease (MDRD) y no por la concentración de creatinina. Esta clasificación de la ERC permite, además, el análisis de resultados de múltiples estudios de una forma sencilla e incluso retrospectiva, lo que ha ayudado a conocer mejor el impacto de la ERC en el pronóstico CV de los pacientes (Tabla 2).
Tabla 2. Estadios de la enfermedad renal crónica por filtrado glomerular estimado. Clasificación según la Kidney Disease Outcomes Quality Initiative
| Estadio | Descripción | FGe (mil/min/1,73 m2) |
| Sin ERC | Pacientes con riesgo | > 90, con factor de riesgo |
| 1 | Lesión renal * con FGe normal o aumentada | > 90 |
| 2 | Ligera disminución de la FGe | 60-89 |
| 3 | Moderada disminución de la FGe | 30-59 |
| 4 | Importante disminución de la FGe | 15-29 |
| 5 | Insuficiencia renal terminal | < 15 o diálisis |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado.
* Definición de lesión renal según la National Kidney Foundation: «anomalías histopatológicas o marcadores de lesión renal, incluidas alteraciones analíticas en sangre y orina o pruebas de diagnóstico por la imagen».Adaptado con permiso de National Kidney Foundation18 .
La definición de la K-DOQI para ERC incluye:
• Daño renal durante al menos 3 meses, definido por lesión renal diagnosticada por método directo (alteraciones histológicas en biopsia renal) o indirecto, por marcadores como la albuminuria o proteinuria, alteraciones en el sedimento urinario o en pruebas de imagen.
• FG < 60ml/min/1,73 m2 durante más de 3 meses con o sin daño renal.
Es decir, que el concepto de ERC considera dos vertientes, el descenso en el FG y la presencia de albuminuria. Se considera que cualquier paciente con albuminuria persistente durante más de 3 meses tiene ERC, aunque presente un FG > 60ml/min/1,73 m2. El término IR crónica (diferente de ERC) se define como una pérdida progresiva (3 meses o más) e irreversible de la función renal, cuyo grado de afección se determina con un FG < 60ml/min/1,73 m2.
Determinación de albuminuriaAlbuminuria y riesgo cardiovascularLa albuminuria supone una alteración en la barrera de filtración glomerular (membrana basal) y puede ser un reflejo de una disfunción vascular generalizada19. Tanto en pacientes diabéticos como en no diabéticos, es un factor de riesgo CV19, 20. Su valor, de carácter continuo, también se considera pronóstico en pacientes con albuminuria considerada dentro de lo «normal»20. Su disminución se asocia a una reducción en los acontecimientos CV y renales21. La albuminuria se ha asociado a un mayor riesgo de insuficiencia cardiaca y enfermedad coronaria, riesgo que es mayor según aumenta la albuminuria22, 23.
Definición de albuminuriaSe define albuminuria como la eliminación urinaria de albúmina > 30mg/24 h, equivalente a 20μg/min en una orina recogida durante cierto tiempo o 30 mg/g de creatinina en una muestra aislada (Tabla 3). Valores mayores se asocian a mayor riesgo CV y renal, así como a la presencia de lesión orgánica renal subclínica16. Aunque para la definición de albuminuria se haya utilizado un parámetro cuantitativo (> 30mg/g), la albuminuria debe considerarse como una variable continua, y el riesgo CV aumenta a medida que lo hace su excreción en orina ya desde valores tan bajos como 8-10mg/día24. Por ello se considera que la forma más adecuada de definirla es como «excreción urinaria de albúmina» y que, incluso dentro del rango de la normalidad, una mayor excreción de albúmina urinaria se asocia a peor pronóstico cardiovascular y renal24. Cuando la cifra es > 300 mg/día en una muestra o 300mg/día en orina de 24 h, se denomina proteinuria e indica nefropatía establecida.
Tabla 3. Albuminuria en la detección de la afección renal
| • Método de determinación (de elección): cociente albúmina/creatinina (mg/g de creatinina) |
| • Definición de albuminuria: > 30 mg/g en una muestra de orina aislada |
| • Dada la variabilidad de la determinación, son necesarias 2 de 3 determinaciones positivas en un periodo de 3-6 meses para considerarla patológica |
| • Muestras válidas: primera orina de la mañana, media mañana y media tarde |
| • Situaciones que aumentan la albuminuria: ejercicio físico intenso, fiebre, infección, insuficiencia cardiaca, descompensación hiperglucémica |
| • Falsos positivos: hematuria, piuria, orina muy concentrada |
| • Menor precisión del cociente albúmina/creatinina en valores extremos de creatinina: sobrestima en masa muscular disminuida y subestima en personas musculadas |
Aunque desde hace más de 20 años se dispone de tests diagnósticos semicuantitativos para la determinación de albuminuria en la consulta del médico mediante tiras reactivas (Micral-Test y Clinitek), estos presentan sensibilidad y especificidad alrededor de un 80-97% y un 33-80% respectivamente. Dadas la baja especificidad y las altas tasas de falsos positivos y falsos negativos, estos tests sólo se utilizan cuando no se dispone de técnicas inmunológicas estándar (immunonefelometría, immunoturbidometría y radioinmunoanálisis).
Recogida de orina de 24 hLa determinación de proteinuria o de albuminuria en orina de 24 h ha sido considerada el patrón referencia (en caso de realizarla correctamente), pero se ha asociado a importantes errores derivados de la recogida incompleta de la orina; por ello no se debe utilizar como cribado.
Cociente albúmina/creatinina en una muestra de orinaLa determinación de albuminuria mediante el análisis del cociente albúmina/creatinina en una muestra aislada es el método de cribado recomendado para pacientes con hipertensión arterial o diabetes mellitus y para la valoración del riesgo CV o renal24, 25, 26. Con este método no se requiere recogida de orina de 24 h ni muestras de orina minutadas (en un tiempo determinado), no es imprescindible utilizar la primera orina de la mañana, sus resultados se correlacionan con los obtenidos mediante recogida de orina de 24 h, es barato (entre 1 y 2 euros/determinación por nefelometría) y se puede repetir para confirmar si hay albuminuria o no (Tabla 3). No obstante, se prefiere la utilización de una muestra de la primera orina de la mañana.
Factores que modifican la eliminación de albúmina. LimitacionesDada la variabilidad en la excreción urinaria de albúmina, es necesario tener 2-3 determinaciones positivas en un periodo de 3-6 meses para considerarla patológica. Aunque no existen recomendaciones para la frecuencia de cribado, salvo en caso de diabetes mellitus, la determinación de albuminuria debe formar parte de la valoración inicial y la estratificación del riesgo CV de cualquier paciente con hipertensión arterial, diabetes mellitus o enfermedad CV. Si los valores de albuminuria son patológicos, se debe repetir para su confirmación (2 de 3 muestras)26. Se recomienda valorarla periódicamente después, con una frecuencia que puede ser anual o mayor, dependiendo de los valores y los objetivos terapéuticos planteados. En pacientes con valores inferiores a los considerados normales o normales-bajos (< 15mg/g), la periodicidad de determinación puede dilatarse más (cada 3 o 5 años).
La determinación de albuminuria puede estar influida por otras condiciones clínicas que pueden modificar sus valores. Algunas situaciones elevan la cifra de albuminuria detectada: ejercicio físico intenso, infección activa, fiebre, descompensación hiperglucémica o insuficiencia cardiaca. Otras situaciones producen elevaciones por «falsos positivos»: orina muy concentrada, hematuria o piuria.
La precisión de la determinación del cociente albúmina/creatinina disminuye si la excreción de creatinina es diferente del valor esperado (valor del denominador en el cociente). Ello debe considerarse en situaciones cercanas a los valores límite. Por ejemplo, la excreción de albúmina mediante el cociente albúmina/creatinina puede estar sobrestimada en un paciente con masa muscular disminuida. Por el contrario, en personas muy musculadas o en la raza negra (afroamericanos) puede estar subestimada27 (Tabla 3).
Aunque el mecanismo por el que la albuminuria se asocia a mayor riesgo CV no es del todo conocido, el riñón, mediante la albuminuria, informa del estado del resto del árbol vascular con una medición muy exacta y precoz. Por ello debe formar parte en la valoración y la estratificación del riesgo CV.
Estimacion de la función renal en pacientes con enfermedad cardiovascularFiltrado glomerular y aclaramiento de creatininaEl FG es la salida de líquido desde los capilares glomerulares a la cápsula de Bowman y es reflejo de la filtración de agua y solutos pequeños. En el glomérulo renal se filtran 125ml de líquido por minuto (180 l/día) (el 20% del gasto cardiaco). Esto se denomina FG y es la suma de la filtración de cada una de las nefronas funcionantes, que son en total unos 2 millones. La disminución del FG indica IR.
El FG normal varía en función de la edad, el sexo y el tamaño corporal. En los adultos jóvenes, oscila entre 120 y 130ml/min/1,73 m2 (o 180 l/día/1,73 m2). El resultado se expresa como ml/min/1,73 m2 ya corregido por superficie corporal. El FG va declinando con la edad a partir de los 40 años, a un ritmo aproximado de 10ml/min/1,73 m2/década. Las técnicas de referencia para la determinación del FG son el cálculo del aclaramiento de inulina y la medida por isótopos radiactivos (51Cr-EDTA, 99Tc-DTPA, 125I-iotalamato), pero la aplicación de estas sustancias resulta imposible en la práctica clínica.
El aclaramiento de creatinina es una forma de medir la tasa de FG. El aclaramiento de una sustancia es la cantidad de dicha sustancia extraída del plasma en un tiempo determinado. Así pues, el aclaramiento de creatinina es la cantidad de creatinina depurada del plasma en 24 h, en este caso. Cuando la función renal se determine utilizando orina de 24 h, se medirá mediante el aclaramiento de creatinina porque utiliza para su cálculo la creatinina en orina y la creatinina en plasma (concepto de aclaramiento). De la misma forma, si se utiliza la estimación de creatinina a partir de la fórmula de Cockcroft-Gault28, se hablará de aclaramiento de creatinina estimado, expresado en ml/min, ya que para el cálculo de esta fórmula, el método de referencia era el aclaramiento de creatinina realizado con orina de 24 h tomado en dos ocasiones. No está corregido por superficie corporal. En cambio, cuando se hable de estimación de la función renal mediante fórmulas derivadas de la creatinina, como MDRD29 o CKD-EPI30, se hablará de FG estimado, y el resultado se expresará en ml/min/1,73 m2, ya que en dicha estimación el método de referencia fue 125I-iotalamato, que medía el FG, y el resultado está ajustado por superficie corporal.
Por ello, la valoración de la función renal se puede hacer mediante el aclaramiento de creatinina utilizando orina de 24 h o mediante estimación de la función renal por medio de ecuaciones predictivas o fórmulas derivadas de la creatinina: fórmula de MDRD o CKD-EPI en las que se obtiene el FG estimado y mediante la fórmula de Cockcroft-Gault, en la que se obtiene el aclaramiento de creatinina estimado.
La creatinina plasmática como marcador de función renalLa concentración de creatinina sérica, por su sencillez y su rapidez, ha venido utilizándose como medida de función renal. Así, en la clínica diaria ha sido habitual interpretar los valores de función renal basándose en la creatinina sérica. No obstante, la concentración de creatinina se ve afectada por diversos factores (masa muscular, sexo, raza, tipo de alimentación), aparte de otros factores relacionados con la propia filtración de la creatinina, como la secreción tubular, la producción y la excreción extrarrenal31.
En estadios iniciales de la IR, cuando el FG es prácticamente normal, una disminución conlleva sólo un ligero aumento de la creatinina plasmática, ya que en esa situación se eleva la secreción proximal tubular de creatinina. La consecuencia es que con un FG ya reducido la creatinina plasmática se encuentra dentro de lo considerado normal, por lo que una creatinina plasmática normal o casi normal no necesariamente implica que el FG se ha mantenido. Cuando el FG ha descendido hasta cifras del 50%, apenas se produce un leve incremento en la cifra de creatinina sérica (p. ej., 1,3mg/dl), y cuando esta cifra llega a 1,5mg/dl, la función renal se ha deteriorado dos tercios de su función basal. Puede ocurrir que la creatinina sérica esté dentro de los límites normales y el FG esté disminuido (< 60ml/min/1,73 m2). Esta situación se denomina enfermedad renal oculta.
Estimación de la función renal/filtrado glomerularComo la cifra de creatinina no es el mejor indicador de función renal, se debe buscar mejores marcadores. Por ello se recurre a la estimación del FG o al aclaramiento de creatinina.
Aclaramiento de creatinina en orina de 24hLa determinación del aclaramiento de creatinina con orina de 24 h presenta inconvenientes derivados de que la secreción tubular de creatinina sea variable, la recogida incompleta y la incomodidad que supone para el paciente acarrear el bote de orina durante 24 h. Además no mejora, salvo en determinadas circunstancias, la estimación del FG obtenido a partir de las ecuaciones. Por ello no se utiliza como método habitual o de cribado.
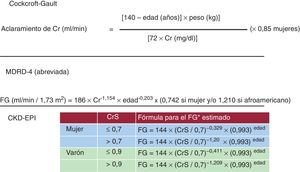
Determinación del filtrado glomerular mediante fórmulas derivadas de la creatininaLa estimación del FG mediante fórmulas es la mejor prueba disponible, por el momento, en la práctica clínica para evaluar la función renal de pacientes con enfermedad CV. Se utilizan ecuaciones predictivas que incluyen creatinina, sexo, edad y peso de los pacientes28, 29, 30, 31, 32, 33. En la Figura 2 se exponen las fórmulas recomendadas para el cálculo del aclaramiento estimado de creatinina.
• Fórmula del aclaramiento de creatinina por Cockcroft-Gault. Para calcular la fórmula de Cockcroft-Gault28, se necesita conocer el peso del individuo y, además, el resultado puede ser corregido mediante otra fórmula a una superficie corporal de 1,73 m2. La utilización de esta fórmula tiene el inconveniente de utilizar el peso, no siempre disponible en la hoja del laboratorio. Esta fórmula clásicamente se ha utilizado para el ajuste de fármacos a la función renal. No obstante, la sobrestimación de aproximadamente un 10-15% de la función renal con esta fórmula, además de la necesidad de disponer del peso del paciente, puede suponer ciertas limitaciones a su uso habitual.
• Ecuación del MDRD. La ecuación abreviada del estudio MDRD29 sólo requiere conocer la edad y el sexo del paciente, y el resultado obtenido se corrige por superficie corporal. Se considera que la ecuación abreviada del MDRD29 tiene mayor fiabilidad que la fórmula de Cockcroft-Gault28, especialmente cuando el FG es < 60ml/min/1,73 m2 y es más fácil de calcular, por lo que se propugna su uso en la práctica asistencial diaria32, 33. No obstante, con función renal normal o casi normal, el cálculo del FG mediante la ecuación del MDRD puede subestimar la función renal, especialmente en mujeres. Debido a esta subestimación, se recomienda informar los valores > 60ml/min/1,73 m2 como > 60ml/min/1,73 m2, y no con el valor numérico calculado a partir de la ecuación por estimación. Por ello la aplicación de la fórmula de Cockcroft-Gault quizá pueda tener cierta utilidad en esta situación (teniendo en cuenta que sobrestima la función renal alrededor del 10%).
• Ecuación de CKD-EPI. Recientemente se ha publicado una modificación de la fórmula del MDRD, la fórmula CKD-EPI30, que disminuye el sesgo o la subestimación que se da en MDRD, sobre todo en FG > 60ml/min/1,73 m2. Por ello se propone que la fórmula de CKD-EPI pueda sustituir a la del MDRD para su utilización en la práctica clínica diaria. Aunque todavía no se ha descrito la fórmula perfecta, quizá la de CKD-EPI sea la menos imperfecta en la actualidad para la estimación del FG.
Figura 2. Distintas fórmulas para el aclaramiento de creatinina y estimación del filtrado glomerular. CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; Cr: creatinina; CrS: creatinina sérica (mg/dl); FG: filtrado glomerular; MDRD: Modification of Diet in Renal Disease. *En caso de raza negra, la constante, en lugar de ser de 144, es de 166 para mujeres y de 163 para varones.
Estas fórmulas, a pesar de su complejidad matemática, pueden calcularse en muchas páginas web (p. ej., la de la Sociedad Española de Nefrología: www.senefro.org); es más recomendable que los laboratorios las proporcionen automáticamente en las analíticas al conocer la edad y el sexo del paciente.
El documento de consenso de la Sociedad Española de Nefrología y la Sociedad Española de Medicina Familiar y Comunitaria sobre la ERC hace unas recomendaciones para la valoración de la función renal. En él se incluyen las situaciones en que se debe utilizar la orina de 24 h33 (Tabla 4).
Tabla 4. Principales recomendaciones para la estimación de la función renal
| La determinación de creatinina sérica no debe ser utilizada como único parámetro para evaluar la función renal. La estimación del FG mediante ecuaciones es el mejor índice disponible en la práctica clínica para evaluar la función renal |
| Para la estimación del FG, se recomienda en primer lugar la fórmula del estudio CKD-EPI o MDRD. Como alternativa puede utilizarse la fórmula de Cockcroft-Gault |
| Medir el aclaramiento de creatinina mediante la recogida de orina de 24 h no mejora, salvo en determinadas circunstancias, la estimación del FG obtenido a partir de las ecuaciones |
| Estas circunstancias en que las ecuaciones no son útiles son: |
| • Peso corporal extremo: índice de masa corporal < 19 o > 35 kg/m2 |
| • Alteraciones importantes en la masa muscular (amputaciones, pérdida de masa muscular, enfermedades musculares o parálisis) |
| • Insuficiencia renal aguda, embarazo, hepatopatía grave, edema generalizado o ascitis |
| En estos casos se recomienda la utilización de otros métodos para estimar el FG, como el aclaramiento de creatinina convencional (orina de 24 h) |
CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; FG: filtrado glomerular; MDRD: Modification of Diet in Renal Disease.
Se incluyen las situaciones en que se debe utilizar la orina de 24 h para estimación de la función renal.
Modificado con permiso de Alcázar et al 33 .
Como las fórmulas predictivas se han calculado con grupos de población concretos, y utilizando fórmulas derivadas de la creatinina sérica, las ecuaciones para la estimación del FG no son adecuadas en las siguientes circunstancias:
• Peso corporal extremo: índice de masa corporal < 19 o > 35 kg/m2.
• Alteraciones importantes en la masa muscular (amputaciones, pérdida de masa muscular, enfermedades musculares o parálisis).
En estas situaciones clínicas especiales, y relativamente poco frecuentes, en las que la estimación del FG mediante fórmulas no es adecuada, deberá utilizarse la estimación del aclaramiento de creatinina con orina de 24 h33.
Prevención de la disfunción renal aguda y la hiperpotasemia. precauciones y limitaciones de bloqueadores del sistema renina-angiotensina-aldosteronaEl bloqueo del sistema renina-angiotensina-aldosterona (SRAA) asume un papel fundamental en la patología CV humana y forma parte del esquema de tratamiento en pacientes con ERC (albuminuria o disminución en el FG) y en pacientes con enfermedad cardiaca (cardiopatía isquémica, insuficiencia cardiaca y fibrilación auricular).
El tratamiento con fármacos que bloquean el SRAA (inhibidores de la enzima de conversión de la angiotensina [IECA], antagonistas de los receptores de la angiotensina II [ARA-II] o inhibidores directos de la renina) no suele causar generalmente disfunción renal ni hiperpotasemia en pacientes con función renal normal. Estas complicaciones pueden observarse en el paciente con alto riesgo CV y enfermedad ateromatosa generalizada como, por supuesto, ateromatosis renal y/o función renal alterada.
La disfunción renal aguda, la hipotensión y/o la hiperpotasemia se producen debido a una disminución en la presión arterial sistémica y la presión intraglomerular al dilatarse la arteriola eferente, con la reducción consecuente del FG. Por ello es importante reconocer las situaciones de riesgo en que pueden presentarse estas complicaciones para dar el mejor tratamiento posible, la prevención, y la monitorización de pacientes con riesgo de sufrir tales complicaciones.
Autorregulación del flujo sanguíneo renalEn el riñón sano hay un proceso de autorregulación que mantiene constante el flujo de sangre renal y la presión capilar intraglomerular a pesar de fluctuaciones en la presión arterial sistémica entre 80 y 170mmHg. Cuando la presión arterial sistémica disminuye, la presión glomerular se mantiene por efecto de la angiotensina II, que produce vasoconstricción de la arteriola eferente (arteriola posglomerular)34. En el paciente anciano, el hipertenso crónico y el diabético y en la ateromatosis avanzada, se pierde en parte esta capacidad de autorregulación, es decir, hay poca capacidad de compensación por menor respuesta vasoconstrictora de sus arteriolas eferentes por estar ateromatosas (con hialinosis o hipertrofia de la íntima). Por ello estos pacientes presentarán con más frecuencia disfunción renal aguda tras tratamiento con dichos fármacos. Este deterioro renal es hemodinámico (y reversible en la mayoría de los casos), no es consecuencia de daño renal estructural, y refleja que la presión arterial ha bajado por debajo de los límites de la autorregulación renal.
En la práctica clínica, algunos médicos, cuando detectan un deterioro en la función renal como respuesta al inicio de un tratamiento con fármacos que bloquean el SRAA, lo primero que hacen es suspender el fármaco o disminuir la dosis. Al disminuir o retirar el fármaco, la presión arterial e igualmente la presión glomerular se incrementan, y la creatinina retorna a su concentración original. Este enfoque no es el adecuado para preservar a medio y largo plazo la función renal ni para compensar los efectos cardiacos de la angiotensina.
Si tras el tratamiento con fármacos que bloquean el SRAA se presenta un ligero incremento en la cifra de creatinina sérica (siempre < 20-30% de la cifra basal) en el contexto de un adecuado control de las cifras de presión arterial, se debe considerar que la presión glomerular se ha reducido satisfactoriamente, y ello es beneficioso para la prevención de la progresión de la enfermedad renal35, 36, 37 (tanto para la albuminuria como para la prevención de la disminución del FG), así como en otras situaciones cardiacas (insuficiencia cardiaca, cardiopatía isquémica)38, 39.
¿Cuándo un deterioro en la función renal tras fármacos que bloquean el sistema renina-angiotensina-aldosterona es beneficioso y cuándo es peligroso?En general, podríamos decir que es peligroso cuando se acompaña de hiperpotasemia (K > 5,5 mEq/l), por sus consecuencias cardiacas, y cuando el deterioro en la función renal es > 30% sobre la función renal basal, porque puede favorecer IR más grave y con otras complicaciones, que a veces llevan a la necesidad de diálisis. En ambos casos se deberá suspender el fármaco e investigar si se dan situaciones favorecedoras de dicho deterioro renal, con el fin de tratarlas, de ser posible, o conocerlas y saber qué limitación tenemos para administrar determinados tratamientos.
Disfunción renal y/o hiperpotasemia tras administración de fármacos que bloquean el sistema renina-angiotensina-aldosteronaTras el inicio del tratamiento con fármacos que bloqueen el SRAA, habrá que tener precauciones para evitar disfunción renal aguda, hipotensión y/o hiperpotasemia sólo con los pacientes con factores de riesgo de sufrirlas y no en todos los pacientes a los que se administra dichos fármacos.
Hipotensión y disfunción renalSe puede manifestar como debilidad, hipotensión como tal o como síncope, mareo en estado basal o tras incorporarse o a la bipedestación. En el estudio ONTARGET40, este efecto secundario ocurrió en el 1,7% de los pacientes que recibieron ramipril o telmisartán y en el 4,7% de los que recibieron la combinación (p < 0,001). La hipotensión, especialmente tras la primera dosis, se suele producir en pacientes que están muy hipovolémicos ya sea por presentar vómitos, diarrea o tratamiento diurético intenso. En ocasiones el paciente está estable y recibe su bloqueador del SRAA, pero puede aparecer hipotensión si se incrementa el tratamiento diurético o se presenta alguna de las complicaciones comentadas. Con cierta frecuencia ocurre en pacientes que han sido hospitalizados por insuficiencia cardiaca. Tras el alta, reciben moderadas/altas dosis de diuréticos o incluso combinaciones de diuréticos distales (antialdosterónicos) que deben ser ajustadas, en general a la baja, durante el seguimiento ambulatorio y según respuesta clínica. Si no se ajustan, el paciente puede sufrir un exceso de tratamiento diurético e hipotensión que favorecerán la hiperpotasemia y/o la disfunción renal.
Tanto la isquemia renal por ateromatosis como fundamentalmente la detección de una baja concentración de sodio por la mácula densa en estados depletivos (exceso de tratamiento con diuréticos, dietas excesivamente hiposódicas, diarrea, vómitos) inducen una importante activación del SRAA para mantener la presión arterial del paciente y la perfusión renal. Para mantener un FG adecuado, la angiotensina II incrementa la resistencia de la arteriola eferente (vasoconstricción posglomerular). Si administramos un fármaco que bloquea el SRAA (IECA, ARA-II o inhibidores directos de la renina), se bloquea ese mecanismo de mantenimiento de la presión arterial y se produce un descenso importante en la presión intraglomerular, descenso en el FG secundario e incremento de la creatinina, generalmente más del 30%.
Cuando se presente hipotensión tras la administración de estos fármacos, habrá que investigar posibles causas35. Las más frecuentes se enumeran en la Tabla 5. También habrá que valorar la presencia de estenosis bilateral significativa de la arteria renal como posible causa. En caso de que el paciente presente estenosis de la arteria renal unilateral no susceptible de angioplastia, pueden administrarse fármacos que bloqueen el SRAA. En estos casos prácticamente no se aprecia deterioro del FG ni caída de la presión arterial sistémica debido a que se produce un incremento compensatorio del FG en el riñón contralateral41.
Tabla 5. Factores de riesgo de deterioro de la función renal tras tratamiento con bloqueadores del sistema renina-angiotensina-aldosterona
| Insuficiencia renal avanzada |
| Estenosis bilateral de la arteria renal |
| Disminución del volumen sanguíneo: |
| • Hipotensión |
| • Depleción de volumen (diuréticos, vómitos, diarrea) |
| • Uso de antiinflamatorios no esteroideos |
| • Sepsis/vasodilatación |
El riesgo de hiperpotasemia en pacientes que reciben bloqueadores del SRAA es de aproximadamente un 3,3%40, pero se incrementa a medida que se presentan más factores de riesgo, así como por la combinación con otros fármacos, especialmente diuréticos distales (antialdosterónicos) y antiinflamatorios no estroideos42 (Tabla 6). Un incremento en la cifra de potasio dentro del límite de la normalidad (p. ej., 4,5-5 mEq/l) no requiere retirada del fármaco ni ajuste de dosis, ya que el bloqueo del SRAA se asocia a mejoría en el pronóstico CV por producir nefroprotección21, 43 y cardioprotección38, 39. Si se presenta hiperpotasemia una vez corregidos los factores desencadenantes, no se podrá administrar dichos fármacos. Siempre se deberá equilibrar los beneficios y los riesgos de dichos tratamientos.
Tabla 6. Factores favorecedores de la hiperpotasemia
| Edad avanzada |
| Insuficiencia renal, enfermedad renal oculta |
| Diabetes mellitus con potasio basal elevado |
| Depleción de volumen |
| Potasio basal elevado |
| Uso de sales de potasio como suplemento (sal de régimen) |
| Tratamiento previo con: |
| • IECA/ARA-II, AINE, espironolactona, amilorida, bloqueadores beta |
| • Altas dosis de los tratamientos previos |
| • Combinación de varios de los tratamientos anteriores |
| Hipoperfusión tisular (ateromatosis generalizada): |
| • ACV, cardiopatía isquémica, claudicación intermitente, angina intestinal, insuficiencia renal, tabaquismo |
ACV: accidente cerebrovascular; AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas de los receptores de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Modificado con permiso de Palmer et al 42 .
La baja incidencia de hiperpotasemia en los ensayos clínicos se atribuye a que los pacientes incluidos son de bajo riesgo y se excluye frecuentemente a los pacientes con IR; además presentan una monitorización frecuente. Por otra parte, se debe considerar la edad de los pacientes incluidos en los estudios. La media de edad en el estudio CHARM39 fue 65 años. Todavía es más distante de la clínica diaria la situación cuando se analiza el tratamiento de la insuficiencia cardiaca con diuréticos distales. Las medias de edad en los estudios que han utilizado espironolactona o eplerenona en insuficiencia cardiaca asociada a otras condiciones clínicas (RALES44, EPHESUS45 y EMPHASIS46) fueron 65, 64 y 68 años respectivamente, y la creatinina media era de 1,1mg/dl. La extrapolación de los resultados de estos estudios, en población seleccionada, a pacientes de la clínica diaria puede favorecer la hiperpotasemia grave, ya que el porcentaje de ancianos atendidos en las consultas es muy elevado, muchos de ellos octogenarios o nonagenarios, con mayor o menor disminución del FG.
¿Cómo minimizar el riesgo de disfunción renal aguda y/o hiperpotasemia en pacientes que reciben bloqueadores del sistema renina-angiotensina-aldosterona?Se proponen las siguientes actitudes:
• Identificar y corregir los factores asociados a la aparición de hiperpotasemia y/o disfunción renal (Tabla 6).
• Estimar el riesgo de hiperpotasemia, especialmente edad avanzada, depleción importante y fármacos concomitantes. Si existe algún factor potencialmente reversible, debe ser corregido antes de la administración de IECA o ARA-II.
• Es importante medir la función renal (fórmulas de MDRD, CKD-EPI o Cockroft-Gault). El paciente con función renal normal raramente presentará hiperpotasemia. A medida que disminuye la función renal, hay más riesgo de hiperpotasemia.
• En pacientes con función renal normal y sin factores de riesgo, se puede dar dosis plena de IECA o ARA-II. En dicha situación no es preciso realizar control analítico tras la introducción del fármaco, incluso se puede plantear la utilización simultánea de más de un grupo de fármacos.
• En pacientes con factores de riesgo o IR, pero en los que el bloqueo del SRAA sea beneficioso para la nefroprotección o la cardioprotección, o por cualquier otra indicación, se propone empezar con dosis bajas de IECA o ARA-II e ir aumentándolas progresivamente. Si los pacientes tienen varios factores de riesgo (Tabla 6), es conveniente monitorizar la creatinina y el potasio a los 7-10 días de iniciar el tratamiento, especialmente si se objetiva un moderado descenso de la presión arterial tras la primera dosis. En este caso deberá descartarse estenosis de la arteria renal bilateral, así como otras causas descritas en los factores de riesgo, especialmente depleción. Si se incrementa la dosis de bloqueadores del SRAA, hay que valorar una nueva monitorización de potasio y creatinina.
• En pacientes estables y con tratamientos crónicos con IECA o ARA-II, pueden presentarse hiperpotasemia, hipotensión o disfunción renal aguda en el contexto de exceso de tratamiento con diuréticos, diarrea aguda, vómitos o cualquier otra causa de depleción. En esos casos se suspenderá el IECA o el ARA-II transitoriamente hasta que el paciente se recupere de la hipotensión, se corregirán los factores favorecedores de la situación. Posteriormente, si está indicado, se reinstaurará el tratamiento con el fármaco bloqueador del SRAA, progresivamente si es posible42.
Otros aspectos que tener en cuenta son:
• Prescribir los antialdosterónicos cuidadosamente, teniendo en cuenta la edad y la función renal del paciente y estableciendo claramente la indicación clínica.
• No administrar suplementos de potasio ni sal de régimen (cloruro potásico) a pacientes con riesgo de hiperpotasemia o con un FG estimado < 30ml/min/1,73 m2, a pesar de administrar altas dosis de diuréticos de asa. Este nivel de FG se considera como mayor riesgo de hiperpotasemia y/o disfunción renal aguda. Si se utilizan bloqueadores del SRAA, deberá realizarse frecuente monitorización de potasio y creatinina (p. ej., como mínimo cada 2-3 meses).
• El peso es un buen indicador del estado de hidratación del paciente. La reducción de peso en corto tiempo en un paciente con tratamiento diurético puede indicar un exceso de dosis de diuréticos y, a menudo, que debe reducirse la dosis del tratamiento diurético si la clínica no indica lo contrario.
• Informar al paciente de la posible interacción de otras medicaciones (evitar especialmente antiinflamatorios no esteroideos).
• Restricción del potasio de la dieta.
• Utilizar diuréticos de asa (furosemida o torasemida) si no se habían usado previamente (las tiacidas tienen menor efecto con IR).
• Añadir resinas captadoras de potasio (poliestireno sulfonato cálcico) (Resincalcio®, Sorbisterit®), un sobre de 15 g después de comida y cena, teniendo en cuenta que el sabor no es agradable y que produce cierto grado de estreñimiento (dependiente de la dosis). Se aconseja administrarlas junto con un laxante osmótico que, por otra parte, también favorecerá la pérdida de potasio por el intestino.
Hay que corregir la acidosis metabólica (bicarbonato sódico) si la hay, especialmente en pacientes con IR.
Si la cifra de potasio persiste elevada (> 5,5 mEq/l) a pesar de las medidas previas y habiendo suspendido los fármacos sospechosos, puede asumirse que el paciente tiene hipoaldosteronismo hiporreninémico. En tal caso no podrán administrarse fármacos que bloqueen el SRAA. Se utilizarán diuréticos, antagonistas del calcio o incluso bloqueadores beta (aunque tienen un efecto inhibidor de la renina, pero menos potente que los IECA/ARA-II).
Nefrotoxicidad por contrastes y por fármacosNefropatía inducida por contrasteEl incremento progresivo de pacientes sometidos a procedimientos diagnósticos y terapéuticos con contraste intravenoso sitúa la nefrotoxicidad por contraste como un problema muy relevante, especialmente en el área cardiológica.
Definición y pacientes en riesgoLa nefropatía inducida por contraste (NIC) se define como un deterioro de la función renal traducido en un aumento relativo de la creatinina de un 25% o un aumento absoluto de creatinina de 0,5mg/dl respecto a la basal que ocurre durante los primeros 3 días tras la administración de contraste y no se debe a ningún otro mecanismo.
Pese a ser una entidad muy prevalente (es la tercera causa de fracaso renal agudo en los pacientes hospitalizados), la fisiopatología de la NIC no está del todo bien definida. Muchos estudios han llegado a la conclusión de que la causa final de la NIC es la combinación de varios mecanismos: el efecto directo del contraste, que disminuye la perfusión renal, las alteraciones reológicas en el túbulo renal debidas a aumento de la viscosidad sanguínea que el contraste origina y el efecto tóxico directo en las células tubulares47.
Entre todos los procedimientos en que se utiliza contraste intravenoso, las intervenciones sobre las arterias coronarias (angiografías e intervenciones coronarias percutáneas diagnósticas o terapéuticas) son las que más se asocian a la NIC. En estudios prospectivos, la incidencia de NIC asciende hasta el 3,3%48. De estos pacientes, el subgrupo que además ha sufrido un infarto de miocardio y precisaba una angioplastia primaria es el que tiene mayor propensión a una NIC, con una incidencia que llega al 19%49.
En el 80% de los casos de NIC se produce elevación de la creatinina en las primeras 24 h. Cuando el aumento de la creatinina es < 0,5mg/dl, la probabilidad de NIC es baja. Por el contrario, la mayoría de los pacientes con evolución a fracaso renal agudo establecido habían aumentado la creatinina durante el primer día50.
No todos los pacientes tienen el mismo riesgo de NIC cuando se les administra contraste intravenoso. En la Tabla 7 se describen los factores de riesgo de NIC más importantes. Detectarlos y modificarlos en la medida de lo posible antes de administrar contraste es fundamental para evitar la aparición de NIC51.
Tabla 7. Factores de riesgo de nefropatía inducida por contraste, modificables y no modificables
| Factores de riesgo no modificables | Factores de riesgo modificables |
| Edad | Volumen de contraste administrado |
| Diabetes mellitus | Hipotensión |
| Insuficiencia renal (filtrado glomerular < 60 ml/min) | Anemia |
| Insuficiencia cardiaca avanzada | Deshidratación |
| Baja fracción de eyección del ventrículo izquierdo | Uso de fármacos: IECA, ARA-II, diuréticos, AINE |
| Infarto agudo de miocardio | Hipoalbuminemia |
| Shock cardiogénico | Uso de balón intraaórtico |
| Trasplante renal | Uso de antibióticos nefrotóxicos |
AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas de los receptores de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Lo más importante para prevenir la NIC es detectar a los pacientes en riesgo de sufrirla (Tabla 7). La administración de tratamiento profiláctico antes de la administración del contraste puede evitar complicaciones y disminuir el tiempo de hospitalización. Para ello se ha utilizado la profilaxis con N-acetilcisteína (NAC) y, sobre todo, un correcto estado de hidratación.
Correcto estado de hidrataciónLa fluidoterapia es la piedra angular en la prevención de la NIC. Múltiples estudios observacionales aleatorizados han demostrado su efectividad. Los protocolos de fluidos utilizados son diferentes, pero todos los estudios coinciden en que la combinación de fluidoterapia intravenosa e hidratación oral es la mejor pauta para prevenir la NIC, sobre todo en pacientes de riesgo medio-alto. La dosis recomendada, siempre que la logística lo permita, es suero salino fisiológico (0,9%) iniciado 12 h antes de proceder, a una velocidad de 1 ml/kg/h, y mantenerlo hasta 24 h tras su finalización. Además, se aconseja la hidratación oral, al menos con una ingesta de 500 ml de líquidos (agua, té, etc.) el día de la prueba y hasta 2.500 ml las 24 h siguientes52.
Algunos estudios aislados han mostrado que la administración intravenosa de bicarbonato sódico como parte de la fluidoterapia puede ser beneficiosa en la prevención de la NIC, pues produce una alcalinización en el túbulo renal que reduce la formación de radicales libres53.
Profilaxis farmacológicaEn los últimos años, muchos estudios se han orientado a identificar posibles fármacos que protejan de la NIC. Muchos de ellos, como los antagonistas del calcio, el manitol, la teofilina o el fenoldopam, no han demostrado eficacia; sin embargo, la NAC ha obtenido beneficios en varios estudios54, 55.
La NAC es un potente antioxidante que elimina una gran variedad de radicales libres, capaz de prevenir la NIC mejorando la hemodinámica renal y previniendo el daño directo del estrés oxidativo. Varios estudios prospectivos aleatorizados de pequeño tamaño han concluido que la administración de NAC junto con una hidratación adecuada reduce de manera significativa la NIC en pacientes de alto riesgo; sin embargo, otros estudios no encuentran beneficio al añadir NAC a la hidratación estándar56, 57, 58.
Algunos metaanálisis muestran datos no concluyentes debido a la heterogeneidad de los estudios incluidos, e indican que parece ser sólo preventiva para la NIC en pacientes que tienen una creatinina basal < 1,9mg/dl o reciben más de 140 ml de contraste59. Otros estudios se han orientado a establecer la dosis eficaz de NAC, y han concluido que su efecto protector contra la NIC depende de la dosis, pues muestra mayor nefroprotección con dosis orales de NAC de 1.200 mg antes del procedimiento y 1.200 mg cada 12 h los 2 días siguientes al procedimiento58, 60.
Todos los estudios coinciden en que la NAC es segura y barata, por lo que recomiendan su administración conjunta con la fluidoterapia a todos los pacientes para prevenir la NIC, especialmente en los de alto riesgo60, 61. En los casos en que sea posible, se administrará vía intravenosa, ya que su biodisponibilidad es mayor.
Detectar fármacos concomitantes potencialmente perjudicialesVarios grupos farmacológicos pueden aumentar la probabilidad de sufrir una NIC debido a su efecto en la integridad renal.
Fármacos que afectan a la hemodinámica renal:
• Antiinflamatorios no esteroideos e inhibidores de la ciclooxigenasa 2. Deben suspenderse antes de administrar el contraste, por el riesgo aumentado de fracaso renal, pues altera el mecanismo hemodinámico glomerular62.
• Tratamiento antihipertensivo: es importante mantener una adecuada presión arterial antes del procedimiento, ya que recibirá fluidoterapia intensa. Evitar cifras de presión arterial 20-30mmHg más bajas que las habituales del enfermo y, en la medida de lo posible, no administrar contraste si la presión arterial es inaceptablemente baja. Los IECA y los ARA-II se asocian más frecuentemente a la NIC, especialmente en pacientes en situación de depleción35, 46.
• Dopamina: ningún ensayo ha demostrado su beneficio en la prevención de la NIC.
Fármacos que causan toxicidad tubular:
• Diuréticos: en muchas ocasiones son imprescindibles para el paciente, pero el clínico debe saber que, aunque no son tóxicos, aumentan el riesgo de hipovolemia. Deben suspenderse de manera programada al menos el día antes del procedimiento63.
• Aminoglucósidos: se debe evitarlos debido a su conocido daño medular e intersticial renal.
• Tacrolimus y ciclosporina A: suelen ser imprescindibles para el paciente, por lo que en estos casos se avisará a radiología para intentar reducir el volumen de contraste administrado.
Fármacos que son potencialmente tóxicos tras la administración de contraste:
• Metformina: es un antidiabético oral que, cuando se acumula en el organismo debido a una disminución del FG y especialmente en situaciones de hipoperfusión, puede asociarse a acidosis láctica grave. Su uso en pacientes que se va a someter a inyección de contraste intravenoso es controvertido; la Food and Drug Administration recomendó retirar la metformina el día de la realización de la prueba y reintroducirla en 2-3 días62. Sin embargo, recientemente, una revisión sistemática de las guías reconoce que actualmente no hay evidencia suficiente para suspender la metformina en pacientes con función renal previa normal a los que se administra una cantidad «moderada» de contraste64.
El efecto tóxico del contraste en el riñón comienza a los pocos minutos de la exposición; de hecho, los primeros marcadores de daño tubular aparecen en orina en las primeras horas. Sin embargo, la creatinina sérica presenta un ascenso más lento, que se inicia el primer día hasta un pico máximo a los 3-5 días tras la administración de contraste, y un descenso que se acerca a su basal en 1-3 semanas65.
En cuanto al seguimiento de un paciente que ha sufrido una NIC, debe monitorizarse su función renal hasta que recupere sus cifras de creatinina basales.
Uso del gadolinio en paciente con enfermedad renal crónicaEl gadolinio se utiliza como contraste para mejorar los resultados de las imágenes obtenidas tras la realización de resonancias magnéticas y se había planteado como una alternativa con menos potencial nefrotóxico. No obstante, se trata de un contraste nefrotóxico en sí, pero se ha demostrado que su uso en pacientes con IR puede asociarse a un trastorno sistémico denominado fibrosis sistémica nefrogénica. Se trata de una alteración progresiva que causa fibrosis de la piel, pero que puede afectar también a tejido subcutáneo y órganos internos. Suele tener una evolución tórpida, con un desenlace fatal, y no tiene tratamiento específico. Por ello no se recomienda66 su utilización en pacientes con FG < 30ml/min/1,73 m2 y valorar los riesgos y los beneficios de su utilización en pacientes con FG en 30-60ml/min/1,73 m2.
Conflicto de interesesNinguno.
Recibido 11 Agosto 2011
Aceptado 22 Agosto 2011
Autor para correspondencia: Servicio de Nefrología, Hospital Universitario Dr. Peset, Avda. Gaspar Aguilar 90, 46017 Valencia, España. jlgorriz@senefro.org