Aunque se recomienda 0,60 cm2/m2 para el área valvular aórtica (AVA) indexada por superficie corporal (SC) para el diagnóstico de estenosis aórtica (EA) grave, existe poca evidencia de su valor pronóstico. Nuestro objetivo fue analizar el valor de AVA/SC para predecir eventos cardiovasculares en EA.
MétodosSe incluyeron prospectivamente 190 pacientes con al menos EA moderada (AVA <1,50 cm2). El AVA se indexó por superficie corporal (AVA/SC) y por altura. El objetivo primario fue la mortalidad cardiovascular en pacientes bajo tratamiento médico. Se realizó una curva receiver operating characteristic para establecer el mejor punto de corte para predecir el objetivo primario.
ResultadosUn punto de corte de 0,50 para AVA/SC tuvo una sensibilidad del 96% y una especificidad del 51%. Un punto de corte de 0,49 en AVA/altura mostró una sensibilidad del 96% y una especificidad del 52%. Durante un seguimiento medio de 247±190 días, hubo 24 muertes cardiovasculares, con mayor incidencia en pacientes con AVA/SC <0,50 cm2/m2 (el 21 frente al 2,5%, p <0,001) y AVA/altura <0,49 cm2/m (el 25 frente al 12%, p <0,001). La supervivencia a 2 años de pacientes con AVA/SC> 0,50 cm2/m2 fue de 95±5%, mientras los pacientes con AVA/SC <0,50 cm2/m2 fue de 37±5% (p <0,001). El riesgo de muerte cardiovascular fue mayor en pacientes con AVA/SC <0,50 cm2/m2 (ajustado 10,9 [1,2-103,7], p=0,037), pero no fue significativamente mayor en AVA/altura <0,49 cm2/m en el análisis multivariante (2,0 [0,6-6,0], p=0,22).
ConclusionesNuestro estudio identificó un subgrupo de pacientes con EA de mayor riesgo de mortalidad cardiovascular, por lo que podría proponerse un punto de corte de AVA/SC de 0,50 cm2/m2 para identificar un subgrupo de pacientes de mayor riesgo cardiovascular.
Palabras clave
La estenosis aórtica (EA) es la valvulopatía cardiaca más frecuente en los países desarrollados1. Las decisiones de tratamiento se basan en una evaluación exacta de la gravedad de la EA junto con la función del ventrículo izquierdo (VI) y los síntomas del paciente2,3. La ecocardiografía es una herramienta clave para el diagnóstico y la evaluación de la EA. Los principales parámetros hemodinámicos recomendados para la evaluación clínica de la gravedad de la EA son la velocidad máxima, el gradiente medio y el área valvular aórtica (AVA) determinada mediante la ecuación de continuidad.
Dado que todas las estructuras cardiovasculares tienen un tamaño proporcional al tamaño corporal, podría ser razonable indexar el AVA respecto al área de superficie corporal (AVA/ASC). Sin embargo, el valor de corte propuesto para el AVA/ASC se calculó indexando el AVA para un adulto medio5. Además, el valor de corte de 0,6 recomendado por las guías se basa en estudios publicados en las décadas de los sesenta y los setenta6,7, y el valor pronóstico del AVA/ASC no se ha estudiado por completo.
Nuestro objetivo es examinar la utilidad del AVA/ASC para predecir el pronóstico en los pacientes con EA, así como identificar el mejor valor de corte del AVA/ASC para la predicción del riesgo aumentado de eventos cardiovasculares durante el seguimiento.
MÉTODOSPoblación de pacientesEntre enero de 2015 y noviembre de 2017, se incluyó prospectivamente a 190 pacientes con diagnóstico de EA valvular nativa moderada-grave (AVA < 1,5cm2). Los criterios de exclusión fueron la presencia concomitante de una insuficiencia aórtica o valvulopatía mitral de carácter moderado o grave, la EA subvalvular o supravalvular (definida por una velocidad > 1,5 m/s), el diámetro de la aorta torácica < 25mm, la edad < 18 años, la cardiopatía congénita (excepto la válvula aórtica bicúspide), los antecedentes de reparación o implante valvular, una ventana acústica deficiente y la pérdida para el seguimiento. El protocolo del estudio fue aprobado por el Comité de Ética de la provincia de Cádiz. Todos los participantes dieron su consentimiento para participar en el estudio.
Datos clínicosLos datos clínicos registrados fueron los siguientes: edad, sexo, hipertensión, diabetes mellitus, antecedentes de tabaquismo, hipercolesterolemia, índice de masa corporal, insuficiencia renal crónica y enfermedad coronaria. Se examinaron cuidadosamente las historias clínicas para detectar la posible presencia de disnea, angina o síncope según la clasificación funcional de la New York Heart Association. En los pacientes con manifestaciones de angina, síncope, insuficiencia cardiaca congestiva o disnea de esfuerzo de clase ≥ 2, los síntomas se consideraron atribuibles a la EA. Se determinó la presión arterial en el momento de la evaluación ecocardiográfica. El ASC se calculó con la fórmula de Dubois8.
Las decisiones clínicas relativas al tratamiento médico las tomó el médico encargado del paciente, en función de la gravedad de la EA, la función del VI y el estado sintomático, ateniéndose a lo indicado en las guías2,3.
Examen ecocardiográficoSe realizaron exploraciones de ecocardiografía transtorácica bidimensional y Doppler con equipos clínicos de ecococardiografía equipados con transductores de 2,5 a 3,5 MHz (iE33 Phillips Medical Systems, The Best, Países Bajos). Todas las exploraciones las realizó un ecografista experimentado. Se utilizó la proyección de eje largo paraesternal con ampliación para medir el diámetro del anillo aórtico en la fase inicial de la sístole. Se obtuvo la integral de la velocidad respecto al tiempo mediante Doppler pulsado en el tracto de salida del VI y colocando un volumen de muestra de 1cm debajo de la válvula aórtica. Se calculó entonces el volumen de eyección partiendo del supuesto de una forma circular del tracto de salida del VI. Se realizó un registro Doppler de onda continua del flujo a través de la válvula desde diferentes ventanas, con objeto de registrar los gradientes de presión instantáneo máximo y medio a través de la válvula aórtica.
El AVA se calculó con la ecuación de continuidad. El AVA indexada se calculó como AVA/ASC. Dado el papel incierto del tejido adiposo adquirido en el AVA indexada, también se calculó el cociente AVA/estatura. Se obtuvo el valor medio del gradiente de presión transvalvular con la ecuación de Bernouilli modificada. Se calculó un índice de velocidad Doppler, que es una simplificación de la ecuación de continuidad, mediante la integral de la velocidad respecto al tiempo en el tracto de salida del VI/integral de la velocidad respecto al tiempo del chorro aórtico.
Los intervalos de tiempo sistólico del flujo a través de la válvula aórtica se midieron con la curva de velocidad del registro Doppler de onda continua: tiempo de eyección, tiempo de aceleración y cociente de tiempo de aceleración/tiempo de eyección, según lo descrito con anterioridad9.
Se realizó una ecocardiografía de estrés con dobutamina cuando el AVA calculada con la ecuación de continuidad era < 1,0cm2, el valor medio del gradiente transvalvular aórtico era < 40mmHg y la fracción de eyección del VI era < 40%. Los datos que indicaban una EA grave eran un chorro de EA > 4 m/s o un gradiente medio > 40mmHg y un AVA ≤ 1,0cm2 en la ecocardiografía de estrés.
Todas las mediciones corresponden a un promedio de 3 ciclos cardiacos en los pacientes en ritmo sinusal y como mínimo 6 ciclos si el paciente estaba en un ritmo diferente del sinusal. Se evitó siempre la estimación de latidos extrasistólicos. El examen ecocardiográfico se realizó siguiendo lo establecido en la guía de la AHA10. Se realizaron registros Doppler a una velocidad de barrido de 150 mm/s.
Resultados clínicosEl objetivo principal fue la evaluación de la muerte de causa cardiovascular durante el tratamiento médico. En los pacientes a los que se practicó un implante de válvula aórtica, utilizamos la fecha de implante para calcular la duración del seguimiento, pero el implante de válvula aórtica no formó parte del objetivo principal. Se consideraron objetivos secundarios un objetivo combinado (muerte de causa cardiovascular y reemplazo de válvula aórtica) y la mortalidad total.
Los datos de resultados clínicos se obtuvieron de las visitas de los pacientes o de la historia clínica, entrevistas telefónicas o certificados de defunción si procedía.
Análisis estadísticoLos datos se expresan como media ± desviación estándar para las variables continuas y se compararon con una prueba de la t de Student para datos no emparejados. Las variables cualitativas se presentaron mediante porcentajes y se compararon con la prueba de la X2 o la prueba exacta de Fisher. La relación entre las variables continuas y los 3 grupos se exploró con pruebas de ANOVA unidireccional. Se elaboró una curva ROC para determinar los mejores valores de corte de la AVA/ASC y la AVA/estatura para predecir la muerte cardiovascular en pacientes con EA. Este valor de corte se determinó como el valor que proporciona un mejor equilibrio entre la sensibilidad y la especificidad, pero se prefirió utilizar un valor de corte con mayor sensibilidad, dada la elevada mortalidad de esta enfermedad. Se calculó el área bajo la curva ROC.
Se estimaron las tasas de eventos según el método de Kaplan-Meier y se compararon con pruebas de orden logarítmico (log-rank test) bilaterales. Se realizaron análisis univariantes y multivariantes del tiempo transcurrido hasta los eventos mediante modelos de riesgos proporcionales de Cox. Las variables introducidas en los modelos fueron las que han mostrado una repercusión pronóstica en la EA: edad, fracción de eyección del VI, gradiente medio, velocidad aórtica máxima, estado sintomático, AVA/ASC y masa del VI indexada.
Las diferencias se consideraron significativas con valores de p < 0,05. Para el análisis de los datos se utilizó el programa SPSS versión 17.0 (SPSS Inc., Chicago, Illinois, Estados Unidos).
RESULTADOSEn total, se incluyó a 94 mujeres (49%) y 96 varones (51%), con una media de edad de 74,1±13,0 años; la prevalencia de diabetes fue del 48%; la de hipertensión, del 74% y la de enfermedad coronaria, del 30%. La causa más frecuente de la EA fue la calcificación degenerativa (91%), seguida de la válvula aórtica bicúspide (8%) y la enfermedad reumática (1%). Hubo 125 pacientes (66%) con un AVA < 1cm2 y 65 (34%) con un AVA de 1,5-1,0cm2. En general, la velocidad aórtica máxima fue de 3,91 ± 0,75 m/s; el gradiente medio, 39,2 ± 15,7mmHg; el AVA, 0,92 ± 0,32cm2; el AVA/ASC, 0,50 ± 0,17, y el AVA/estatura, 0,57 ± 0,20.
Hubo 29 pacientes (15%) con disfunción sistólica del VI (fracción de eyección < 50%): 4 pacientes con fracción de eyección del VI del 40-50%, aunque con gradientes altos, y 25 pacientes con un valor < 40%: 4 con gradientes altos y 17 con EA grave tras la ecocardiografía con dobutamina.
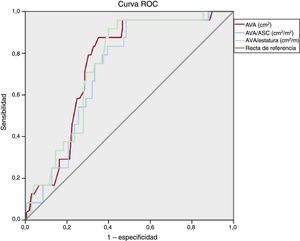
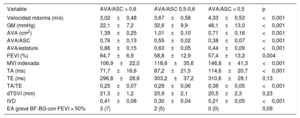
Análisis de las características operativas del receptorEl análisis de la curva ROC (figura 1) puso de manifiesto que tanto el AVA/ASC como el AVA/estatura podían predecir de manera significativa la muerte de causa cardiovascular. Los valores más altos del área bajo la curva fue del AVA (0,75; p < 0,001), el AVA/estatura (0,74; p < 0,001) y el AVA/ASC (0,72; p < 0,001). Empleando un valor de corte de 0,50, el AVA/ASC mostró una sensibilidad del 96% y una especificidad del 51%, un valor predictivo negativo del 99% y un valor predictivo positivo del 22%. Con el valor de corte de 0,60 recomendado por las guías, mostró una sensibilidad del 97% y una especificidad del 25%, un valor predictivo negativo del 96% y un valor predictivo positivo del 15%.
Para el AVA/estatura, un valor de corte de 0,49 mostró una sensibilidad del 96%, una especificidad del 52%, un valor predictivo negativo del 95% y un valor predictivo positivo del 25%. Un valor de corte de 1,0cm2 para el AVA mostró una sensibilidad del 96%, una especificidad del 38%, un valor predictivo negativo del 98% y un valor predictivo positivo del 18%.
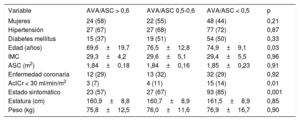
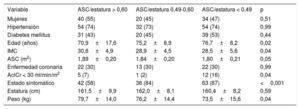
Parámetros de área valvular aórtica indexadosSe dividió a los pacientes en 3 grupos según el valor de corte calculado (0,50) y el recomendado en las guías (0,60) para el AVA/ASC. De los 190 pacientes incluidos, 41 (22%) presentaron un AVA/ASC > 0,60; 40 (21%), un valor de 0,50-0,60, y 109 (57%), un AVA/ASC < 0,50. En la tabla 1 se comparan las características basales de los pacientes. Los pacientes con un AVA/ASC < 0,50 mostraron unos parámetros ecocardiográficos más graves (tabla 2).
Características iniciales según el AVA/ASC
| Variable | AVA/ASC > 0,6 | AVA/ASC 0,5-0,6 | AVA/ASC < 0,5 | p |
|---|---|---|---|---|
| Mujeres | 24 (58) | 22 (55) | 48 (44) | 0,21 |
| Hipertensión | 27 (67) | 27 (68) | 77 (72) | 0,87 |
| Diabetes mellitus | 15 (37) | 19 (51) | 54 (50) | 0,33 |
| Edad (años) | 69,6±19,7 | 76,5±12,8 | 74,9±9,1 | 0,03 |
| IMC | 29,3±4,2 | 29,6±5,1 | 29,4±5,5 | 0,96 |
| ASC (m2) | 1,84±0,18 | 1,84±0,16 | 1,85±0,23 | 0,91 |
| Enfermedad coronaria | 12 (29) | 13 (32) | 32 (29) | 0,92 |
| AclCr < 30 ml/min/m2 | 3 (7) | 4 (11) | 15 (14) | 0,01 |
| Estado sintomático | 23 (57) | 27 (67) | 93 (85) | 0,001 |
| Estatura (cm) | 160,9±8,8 | 160,7±8,9 | 161,5±8,9 | 0,85 |
| Peso (kg) | 75,8±12,5 | 76,0±11,6 | 76,9±16,7 | 0,90 |
AclCr: aclaramiento de creatinina; ASC: área de superficie corporal; AVA: área valvular aórtica; IMC: índice de masa corporal.
Los valores expresan media ± desviación estándar o n (%).
Características ecocardiográficas basales según el valor de AVA/ASC
| Variable | AVA/ASC > 0,6 | AVA/ASC 0,5-0,6 | AVA/ASC < 0,5 | p |
|---|---|---|---|---|
| Velocidad máxima (m/s) | 3,02±0,48 | 3,67±0,58 | 4,33±0,53 | <0,001 |
| GM (mmHg) | 22,1±7,2 | 32,6±9,9 | 48,1±13,0 | <0,001 |
| AVA (cm2) | 1,39±0,25 | 1,01±0,10 | 0,71±0,16 | <0,001 |
| AVA/ASC | 0,76±0,13 | 0,55±0,02 | 0,38±0,07 | <0,001 |
| AVA/estatura | 0,86±0,15 | 0,63±0,05 | 0,44±0,09 | <0,001 |
| FEVI (%) | 64,7±6,9 | 58,8±12,9 | 57,4±13,2 | 0,004 |
| MVI indexada | 106,9±22,0 | 118,6±35,6 | 146,8±41,3 | <0,001 |
| TA (ms) | 71,7±16,6 | 87,2±21,5 | 114,6±20,7 | <0,001 |
| TE (ms) | 296,8±28,6 | 303,2±37,2 | 310,6±29,1 | 0,13 |
| TA/TE | 0,25±0,07 | 0,29±0,06 | 0,38±0,05 | <0,001 |
| dTSVI (mm) | 21,3±1,2 | 20,9±2,1 | 20,5±2,3 | 0,23 |
| IVD | 0,41±0,08 | 0,30±0,04 | 0,21±0,05 | <0,001 |
| EA grave BF-BG con FEVI > 50% | 3 (7) | 2 (5) | 0 (0) | 0,09 |
ASC: área de superficie corporal; AVA: área valvular aórtica; BF-BG: bajo flujo-bajo gradiente; dTSVI: diámetro del tracto de salida del ventrículo izquierdo; EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; GM: gradiente medio; IVD: índice de velocidad Doppler; MVI: masa ventricular izquierda; TA: tiempo de aceleración; TE: tiempo de eyección.
Los valores expresan media ± desviación estándar o n (%).
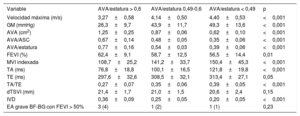
Se clasificó a los pacientes en 3 grupos según el valor de AVA/estatura: 73 pacientes (38%) con un AVA/estatura > 0,6, 44 (22%) con un AVA/estatura de 0,49-0,6 y 73 (38%) con un AVA/estatura < 0,49. Las características clínicas y ecocardiográficas de los pacientes según el AVA/estatura se muestran en la tabla 3 y la tabla 4.
Características basales según el valor de AVA/estatura
| Variable | ASC/estatura > 0,60 | ASC/estatura 0,49-0,60 | ASC/estatura < 0,49 | p |
|---|---|---|---|---|
| Mujeres | 40 (55) | 20 (45) | 34 (47) | 0,51 |
| Hipertensión | 54 (74) | 32 (73) | 54 (74) | 0,99 |
| Diabetes mellitus | 31 (43) | 20 (45) | 39 (53) | 0,44 |
| Edad (años) | 70,9±17,6 | 75,2±8,9 | 76,7±8,2 | 0,02 |
| IMC | 30,6±4,9 | 28,9±4,5 | 28,5±5,6 | 0,04 |
| ASC (m2) | 1,89±0,20 | 1,84±0,20 | 1,80±0,21 | 0,05 |
| Enfermedad coronaria | 22 (30) | 13 (30) | 22 (30) | 0,99 |
| AclCr < 30 ml/min/m2 | 5 (7) | 1 (2) | 12 (16) | 0,04 |
| Estado sintomático | 42 (58) | 36 (84) | 63 (87) | <0,001 |
| Estatura (cm) | 161,5±9,9 | 162,0±8,1 | 160,4±8,2 | 0,59 |
| Peso (kg) | 79,7±14,0 | 76,2±14,4 | 73,5±15,6 | 0,04 |
AclCr:aclaramiento de creatinina; ASC: área de superficie corporal; AVA: área valvular aórtica; IMC: índice de masa corporal.
Los valores expresan media ± desviación estándar o n (%).
Características ecocardiográficas basales según el valor de AVA/estatura
| Variable | AVA/estatura > 0,6 | AVA/estatura 0,49-0,6 | AVA/estatura < 0,49 | p |
|---|---|---|---|---|
| Velocidad máxima (m/s) | 3,27±0,58 | 4,14±0,50 | 4,40±0,53 | <0,001 |
| GM (mmHg) | 26,3±9,7 | 43,9±11,7 | 49,3±13,6 | <0,001 |
| AVA (cm2) | 1,25±0,25 | 0,87±0,06 | 0,62±0,10 | <0,001 |
| AVA/ASC | 0,67±0,14 | 0,48±0,05 | 0,35±0,06 | <0,001 |
| AVA/estatura | 0,77±0,16 | 0,54±0,03 | 0,39±0,06 | <0,001 |
| FEVI (%) | 62,4±9,1 | 58,7±12,5 | 56,5±14,4 | 0,01 |
| MVI indexada | 108,7±25,2 | 141,2±33,7 | 150,4±45,3 | <0,001 |
| TA (ms) | 76,8±18,8 | 100,1±16,5 | 121,8±19,8 | <0,001 |
| TE (ms) | 297,6±32,6 | 308,5±32,1 | 313,4±27,1 | 0,05 |
| TA/TE | 0,27±0,07 | 0,35±0,06 | 0,39±0,05 | <0,001 |
| dTSVI (mm) | 21,4±1,7 | 21,0±1,5 | 20,6±2,4 | 0,15 |
| IVD | 0,36±0,09 | 0,25±0,05 | 0,20±0,05 | <0,001 |
| EA grave BF-BG con FEVI > 50% | 3 (4) | 1 (2) | 1 (1) | 0,23 |
ASC: área de superficie corporal; AVA: área valvular aórtica; BF-BG: bajo flujo-bajo gradiente; dTSVI: diámetro del tracto de salida del ventrículo izquierdo; EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; GM: gradiente medio; IVD: índice de velocidad Doppler; MVI: masa ventricular izquierda; TA: tiempo de aceleración; TE: tiempo de eyección.
Los valores expresan media ± desviación estándar o n (%).
Se obtuvo el seguimiento completo del 100% de los pacientes. La media de seguimiento fue de 247±190 días, sin que hubiera diferencias significativas en función del grupo de AVA/ASC (226±150 frente a 245±262 frente a 256±172 días; p = 0,70) o del grupo de AVA/estatura (235±220 frente a 220±134 frente a 275±184 días; p = 0,26)
Hubo 36 muertes durante el seguimiento, y 24 de ellas se debieron a causas cardiovasculares. Se realizó reemplazo de la válvula aórtica en 51 pacientes (27%). Se alcanzó el objetivo combinado en 75 pacientes (39%).
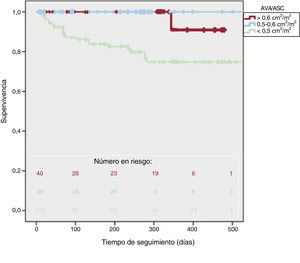
En la figura 2 se presenta la supervivencia según el valor de AVA/ASC. La mortalidad cardiovascular fue mayor en los pacientes con un AVA/ASC inferior (el 2,5 frente a 0 frente al 21%; p < 0,001). Hubo más eventos del objetivo combinado cardiovascular en el AVA/ASC < 0,50 (el 10 frente al 12 frente al 61%; p < 0,001), pero la mortalidad general no alcanzó diferencias significativas (el 7 frente al 17 frente al 24%; p = 0,07). La supervivencia a 1 año fue del 91 ± 5% para un AVA/ASC > 0,60, del 100% ± 0% para un AVA/ASC de 0,50-0,60 y del 75 ± 5% para un AVA/ASC < 0,50 (log-rank test, p = 0,001). Además, la supervivencia a 2 años fue del 95 ± 5% de los pacientes con un AVA/ASC > 0,50 y del 37 ± 5% de los pacientes con un AVA/ASC ≤ 0,50 (p < 0,001).
No se observaron diferencias en las tasas de supervivencia de los pacientes con un AVA/ASC > 0,6 y las de quienes lo tenían de 0,5-0,6 (p = 0,39).
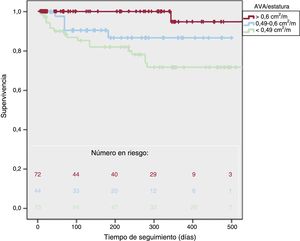
Por lo que respecta al AVA/estatura, hubo más muertes de causa cardiovascular entre los pacientes con un valor inferior de AVA/estatura (el 1 frente al 11 frente al 25%; p < 0,001), así como más eventos cardiovasculares (el 7 frente al 57 frente al 62%; p < 0,001) y mayor mortalidad en general (el 14 frente al 11 frente al 29%; p = 0,02). La supervivencia a 1 año (figura 3) fue del 95 ± 5% con un AVA/estatura > 0,6, del 87 ± 5% con un AVA/estatura de 0,6-0,49 y del 72 ± 5% con un AVA/estatura < 0,49 (log-rank test, p = 0,001). La supervivencia a 2 años fue del 91 ± 4% de los pacientes con un AVA/estatura ≥ 0,49 y del 36 ± 4% con un AVA/estatura < 0,49 (p = 0,001).
Se observaron unas tasas de supervivencia significativamente diferentes tras la exclusión de los pacientes con disfunción del VI. La supervivencia a 1 año fue del 81 ± 4% de los pacientes con un AVA/ASC ≤ 0,50 y del 94 ± 5% de los pacientes con un AVA/ASC > 0,5 (p = 0,003). La supervivencia a 1 año fue también mayor con un AVA/estatura ≥ 0,49 que con un valor < 0,49 (el 92 ± 4% frente al 78 ± 6%; p = 0,006) tras la exclusión de los pacientes con disfunción sistólica del VI.
Solo hubo 41 pacientes asintomáticos con una fracción de eyección del VI ≥ 50%, de los que 1 falleció por causa cardiovascular (AVA/ASC < 0,5).
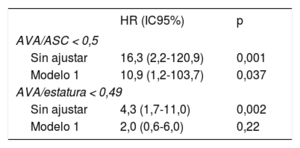
Análisis multivarianteEl exceso de riesgo de mortalidad cardiovascular en el análisis univariante para el AVA/ASC < 0,5 (hazard ratio [HR] = 16,3; intervalo de confianza del 95% [IC95%], 2,2-120,9; p = 0,001) se observó también tras el ajuste por edad, sexo, fracción de eyección del VI, estado sintomático, velocidad aórtica máxima y masa del VI indexada (HR = 10,9; IC95%, 1,2-103,7; p = 0,037) (tabla 5). Sin embargo, la mayor mortalidad cardiovascular observada en el análisis multivariante en los pacientes con un AVA/estatura < 0,49 (HR = 4,3; IC95%, 1,7-11,0; p = 0,002) no fue significativa en el análisis multivariante (HR = 2,0; IC95%, 0,6-6,0; p = 0,22).
Riesgo relativo de mortalidad cardiovascular durante el seguimiento asociado con los valores de AVA/ASC y AVA/estatura
| HR (IC95%) | p | |
|---|---|---|
| AVA/ASC < 0,5 | ||
| Sin ajustar | 16,3 (2,2-120,9) | 0,001 |
| Modelo 1 | 10,9 (1,2-103,7) | 0,037 |
| AVA/estatura < 0,49 | ||
| Sin ajustar | 4,3 (1,7-11,0) | 0,002 |
| Modelo 1 | 2,0 (0,6-6,0) | 0,22 |
ASC: área de superficie corporal; AVA: área valvular aórtica; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Los valores expresan mediana [rango intercuartílico]. El modelo 1 se ha ajustado por edad, sexo, fracción de eyección del ventrículo izquierdo, estado sintomático, velocidad máxima aórtica y masa ventricular izquierda indexada.
La EA grave tiene peor pronóstico que la EA moderada3, por lo que es de vital importancia disponer de una evaluación fiable de la gravedad. Dado que no hay una medida ideal de la gravedad de la EA debido a la falta de un patrón de referencia estándar en esta valvulopatía cardiaca, se prefirió utilizar los resultados clínicos, puesto que se considera que este es el único criterio de valoración disponible para definir la gravedad11. Además, puesto que los pacientes con EA tienen una elevada comorbilidad, pueden producirse síntomas incluso en estadios más leves de esta enfermedad.
Hay varios parámetros que han mostrado un valor pronóstico en la EA: velocidad máxima12–14 y AVA15,16; por lo tanto, una velocidad máxima > 4,0 m/s y un área valvular aórtica < 1cm2 son los apropiados valores de corte para la gravedad que se han adoptado.
Podría ser razonable indexar el AVA respecto al tamaño corporal con objeto de aumentar el rendimiento diagnóstico del AVA. Sin embargo, aunque las guías recomiendan un valor de corte de 0,6 para el AVA/ASC2–4, no hay estudios de morbilidad y mortalidad en la población occidental que respalden ese valor de corte. De hecho, solo el estudio de Saito et al.17 pudo demostrar una frecuencia superior de eventos cardiovasculares en individuos japoneses con un AVA/ASC < 0,6, si bien estos pacientes tenían un ASC especialmente baja.
En el estudio SEAS18, las discrepancias entre el AVA y el gradiente medio aumentaron en vez de disminuir tras la indexación del AVA respecto al ASC utilizando un valor de corte de 0,6. Se ha señalado que un valor de AVA/ASC inferior podría mejorar la exactitud diagnóstica y predecir los eventos cardiovasculares19.
Nuestro principal resultado es que, hasta donde se sabe, este es el primer estudio prospectivo en el que se muestra una mayor mortalidad cardiovascular en los pacientes con un AVA/ASC < 0,5 en tratamiento médico, con una capacidad pronóstica superior a la de un AVA < 1cm2. Esta intensa influencia en la mortalidad persistió incluso después de introducir un ajuste por otras variables con valor pronóstico, por lo que es posible que en este subgrupo de pacientes pudiera obtenerse un beneficio con una intervención temprana, a pesar de la ausencia de síntomas, si bien esta cuestión deberá determinarse en futuros estudios. Aunque otros autores han estudiado el pronóstico del AVA/ASC mediante un objetivo combinado de muerte de causa cardiovascular y reemplazo de la válvula aórtica17,20, para este trabajo se prefirió utilizar la mortalidad cardiovascular, ya que refleja la evolución natural de la enfermedad.
Tribouilloy et al.20 mostraron también que un valor de corte del AVA/ASC inferior predecía los resultados cardiovasculares, a diferencia de lo observado por Saito et al.17, probablemente por el valor bajo de la ASC en su muestra. Para la nuestra se eligió un valor de corte de 0,5 para el AVA/ASC debido a su alta sensibilidad para predecir la muerte de causa cardiovascular en el análisis ROC.
Se ha criticado anteriormente el uso de una indexación respecto al ASC en los pacientes con obesidad, en los que corrige no solo según el peso corporal, sino también respecto al tejido adiposo adquirido. Este es el motivo por el que se evaluó el AVA/estatura en los pacientes con EA, con el que se observó una exactitud predictiva similar a la del AVA/ASC. Sin embargo, no se pudo demostrar un valor pronóstico independiente con un valor de AVA/estatura < 0,49.
En nuestra opinión, la principal limitación del estudio es el pequeño tamaño muestral, que podría dificultar la obtención de diferencias estadísticamente significativas en algunos subgrupos. De hecho, como en otros estudios21, no se pudo aumentar la exactitud predictiva en comparación con el AVA. Sería interesante evaluar si la exactitud pronóstica puede diferir en función del tamaño corporal22, lo cual permitiría predecir cuándo debe usarse la indexación. Es probable que un aumento del tamaño muestral fuera útil para responder a esta pregunta. La ecuación de continuidad parte del supuesto de una morfología circular del tracto de salida del VI, mientras que varios autores han demostrado que la forma real es elíptica, con lo que se subestima el AVA23,24. La puntuación de calcio valvular aórtico25 no se determinó de manera sistemática en nuestros pacientes, por lo que no se dispuso de este parámetro para el análisis de los resultados clínicos. Habría tenido interés analizar los eventos cardiovasculares en pacientes asintomáticos, pero no se disponía de un tamaño muestral suficiente para obtener resultados significativos. Por último, aunque hay otras fórmulas alternativas para la determinación del ASC, el cálculo con la fórmula de Dubois8 no modificó los resultados de manera significativa26.
CONCLUSIONESEste estudio pone de manifiesto que la indexación del AVA respecto al ASC es útil para la estratificación del riesgo, puesto que se pudo identificar un subgrupo de pacientes en tratamiento médico con un riesgo alto de muerte de causa cardiovascular. De hecho, los pacientes con un AVA/ASC < 0,50 presentaron una mortalidad cardiovascular significativamente superior y, por consiguiente, se propone el empleo de ese valor de corte para identificar un subgrupo de pacientes con un riesgo cardiovascular más elevado.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Las guías recomiendan un valor de corte de 0,6 para el AVA indexada en la estenosis aórtica, si bien no hay estudios que muestren su valor pronóstico.
- –
Los pacientes con un AVA indexada < 0,50 presentaron una mayor mortalidad cardiovascular, lo cual pone de manifiesto un estadio más grave de la valvulopatía.
- –
La supervivencia a 2 años fue del 95 ± 5% de los pacientes con un AVA/ASC > 0,50 frente al 37 ± 5% de los que tenían un AVA/ASC ≤ 0,50.