Presentamos nuestra experiencia en el tratamiento quirúrgico del origen anómalo de la arteria pulmonar izquierda en 8 niños, intervenidos entre 2004 y 2009. La cardiopatía asociada más frecuentemente fue la persistencia del conducto arterioso. A 5 se realizó cirugía con circulación extracorpórea y a 3, sin ella. Se realizó división de la arteria pulmonar anómala y translocación al tronco de la arteria pulmonar. Hubo un fallecimiento de forma temprana por inestabilidad hemodinámica y una muerte más tardía por complicaciones respiratorias. La evolución de los pacientes en seguimiento ha sido satisfactoria con permeabilidad de la arteria reimplantada en todos los casos y mejoría de la clínica respiratoria; uno de ellos precisó de técnicas endoscópicas.
Palabras clave
El nacimiento anómalo de la arteria pulmonar izquierda (API), o sling de la arteria pulmonar (AP), es una rara malformación en que la API se origina de la parte posterior de la rama pulmonar derecha, se dirige hacia la izquierda y se sitúa entre la tráquea y el esófago. El vaso aberrante, frecuentemente hipoplásico, comprime el esófago anteriormente y la tráquea posteriormente1. Su prevalencia podría estar en 1/17.000 niños en edad escolar2, aunque no hay datos en lactantes que son el grupo de pacientes más frecuentes y graves. Produce síntomas respiratorios por obstrucción de la vía aérea, muchas veces de forma aguda con consecuencias fatales.
El tratamiento es quirúrgico con desinserción de la API aberrante y reimplantación en el tronco de AP. En casos de estenosis traqueales significativas la cirugía es diversa3,4,5.
MétodosEntre enero de 2004 y noviembre de 2009 se intervino a 8 niños. Uno de estos pacientes fue referido anteriormente6.
En la Tabla 1 se muestran las características de los pacientes. La mayoría eran menores de 1 año en el momento de la cirugía. La clínica de presentación fue distrés respiratorio en todos y un paciente con insuficiencia cardiaca asociada por los defectos cardiacos acompañantes. Las anomalías asociadas se describen en la Tabla 1.
Tabla 1. Características de los pacientes
| Edad | Sexo | Clínica | Anomalías asociadas | Edad y peso a la cirugía | Cirugía | Duración cirugía/CEC | Evolución postoperatoria | |
| 1 | 5 meses | V | Dificultad respiratoria. Estridor | 7 meses, 10 kg | Esternotomía media. Desinserción de API y anastomosis al tronco de AP. Plastia en origen de bronquio principal derecho | 3 h y 40’/95’ | Permeabilidad de la API. Ventilación mecánica, 5 días | |
| 2 | 3 meses y medio | V | Dificultad respiratoria. Soplo sistólico I/VI | Ductus arterioso | 4 meses, 6 kg | Esternotomía media. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 2 h y 30’/65’ | Permeabilidad de la API. Ventilación mecánica, 9 días |
| 3 | 11 meses | V | Asintomático | VCSI persistente | 21 meses, 12,9 kg | Esternotomía media. Desinserción de API y anastomosis al tronco de la AP | 2 h y 25’/73’ | Permeabilidad API. Extubación postoperatorio inmediato |
| 4 | 11 meses | M | Dificultad respiratoria. Estridor | Ductus arterioso | 11 meses, 11 kg | Esternotomía media. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 2 h y 45’/50’ | Permeabilidad de la API. Ventilación mecánica, 19 días |
| 5 | 1 mes | V | Dificultad respiratoria. Soplo sistólico III/VI | CIA. Comunicación interventricular. Ductus arterioso. Síndrome polimalformativo | 1 mes y medio, 4 kg | Toracotomía izquierda. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 1 h y 25’/sin CEC | Permeabilidad de la API. Ventilación mecánica y ventilación no invasiva en forma intermitente durante las primeras 6 semanas del postoperatorio. Estenosis traqueal con dos dilataciones |
| 6 | 2 meses | V | Dificultad respiratoria. Insuficiencia cardiaca | CIA. Ductus arterioso. Bronquio traqueal a lóbulo superior derecho | 2 meses, 3,5 kg | Toracotomía izquierda. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 1 h y 55’/sin CEC | Permeabilidad de la API. Ventilación mecánica, 1 día |
| 7 | 3 meses | V | Dificultad respiratoria. Estridor | Ductus arterioso | 3 meses 1 semana, 5 kg | Esternotomía media. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 2 h y 35’/44’ | Permeabilidad de la API. Ventilación mecánica, 87 días. Estenosis traqueal con 3 dilataciones, stent traqueal. Muerte |
| 8 | 3 días | M | Asintomática | Dextrocardia. Bronquio traqueal a lóbulo superior derecho. Ductus arterioso | 1 mes y 11 días, 2 kg | Toracotomía izquierda. Sección del ductus, desinserción de API y anastomosis al tronco de la AP | 1 h y 05’/sin CEC | Permeabilidad de la API. Ventilación mecánica, 1 día. Muerte |
AP: arteria pulmonar tronco; API: arteria pulmonar izquierda; CEC: circulación extracorpórea; CIA: comunicación interauricular; M: mujer; V: varón; VCSI: vena cava superior izquierda persistente a seno coronario.
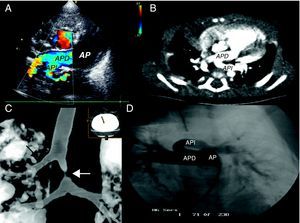
En todos la sospecha se produjo por ecocardiografía, confirmado con angio-tomografía computarizada (TC) y/o resonancia magnética (RM) (Figura 1). A 1 paciente se le realizó cateterismo diagnóstico. Con la TC se definieron las anomalías traqueobronquiales concomitantes. Todos presentaban estenosis traqueal, 5 eran estenosis segmentarias con laringotraqueomalacia acompañante y 3 tenían estenosis largas con anillos completos; en la necropsia de uno de estos se objetivó una atresia bronquial izquierda. Dos tenían bronquio traqueal a lóbulo superior derecho (Bronchus suis).
Figura 1. A: ecocardiografía con origen aberrante de la arteria pulmonar izquierda que nace de la derecha. B: tomografía computarizada , la flecha negra indica la tráquea. C: tomografía computarizada, bronquio traqueal derecho (flecha negra) y estenosis traqueal (flecha blanca). D: angiografia pulmonar. AP: arteria pulmonar tronco; APD: arteria pulmonar derecha; API: arteria pulmonar izquierda.
La media de seguimiento ha sido 30,5 (intervalo, 12-67) meses.
ResultadosSe realiza corrección quirúrgica en todos, con dos fallecimientos.
La media de edad al diagnóstico fue 4,6 meses (intervalo, 3 días-11 meses). La edad de los primeros 4 pacientes fue 7,6 meses y la de los últimos cuatro fue 1,5 meses, considerablemente menor quizá por una mayor sensibilidad en la detección. En el último paciente el diagnóstico se realizó a los 3 días de vida por estudio de dextrocardia detectada prenatalmente.
La cirugía se realizó con una media de edad de 5,5 meses (intervalo, 1 mes y 11 días-21 meses). La media de edad de los últimos 4 pacientes fue 2 meses, en comparación con 10,7 meses de los primeros cuatro.
En 5 pacientes la cirugía fue con estereotomía media y circulación extracorpórea (CEC); se practicó desinserción de la API anómala con liberación del espacio retrotraqueal y anastomosis directa al lado izquierdo del tronco de AP. En 3, además se seccionó el ductus. De este grupo, 1 paciente falleció a los 87 días de la cirugía por problemas respiratorios secundarios a estenosis traqueal grave que no respondió a dilataciones e implantación de stent traqueal.
En 3 pacientes, los lactantes más pequeños y en peor situación clínica, el acceso fue por toracotomía izquierda; se realizó la misma técnica quirúrgica descrita anteriormente. Un paciente presentaba una comunicación interventricular perimembranosa de 3 mm y una comunicación interauricular (CIA) de 8 mm que se manejaron con tratamiento médico con buena respuesta. Otro paciente tenía una CIA pequeña que no se consideró significativa. El tercer paciente falleció. Presentaba gran inestabilidad hemodinámica y respiratoria antes de la cirugía con varias paradas cardiorrespiratorias. Tras la intervención, se comprobó la permeabilidad de la arteria reimplantada, pero a las 12 h falleció.
La media de duración de la cirugía fue 137,5 (intervalo, 65-220) min. La duración de la CEC, cuando se utilizó, fue 64 (intervalo, 44-95) min.
Los controles ecocardiográficos mostraron permeabilidad de la arteria reimplantada en todos sin necesidad de procedimientos terapéuticos.
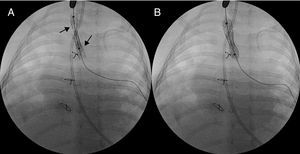
Todos tuvieron estenosis traqueal que mejoró tras la cirugía, excepto en 2 pacientes, niños de muy corta edad, con estenosis muy graves, en que la evolución fue tórpida y precisaron ventilación mecánica prolongada y técnicas endoscópicas con dilatación traqueal. En 1 paciente (caso 5), se realizaron dos dilataciones con mejoría respiratoria que permitió la extubación. Otro paciente (caso 7) precisó tres dilataciones e implantación de dos stent en la tráquea (6×22 mm y 7×22 mm, Numed®) (Figura 2); falleció a los 3 meses de la cirugía por complicaciones respiratorias. En los demás pacientes no se han observado ingresos hospitalarios por procesos traqueobronquiales. El estridor residual se ha resuelto en todos y 1 paciente presenta problemas en la deglución por parálisis de la cuerda bucal izquierda secundaria a parálisis del recurrente izquierdo.
Figura 2. A: doble stent en tráquea (flechas negras). B: posición final con stents expandidos.
DiscusiónLa API anómala se produce por una anormal involución de la parte proximal del sexto arco aórtico izquierdo. Los defectos cardiacos asociados más frecuentes son el ductus arterioso, los defectos septales y la vena cava superior izquierda persistente a seno coronario. Entre las no cardiacas destacan estenosis traqueal, bronquio traqueal derecho e hipodesarrollo del pulmón derecho7.
El diagnóstico de sospecha es por ecocardiografía mientras que la TC helicoidal con reconstrucción tridimensional y la angio-RM pueden definir las anomalías traqueobronquiales y la presencia de anillos traqueales completos8.
El tratamiento es quirúrgico, y se realiza con dos técnicas. Una consiste en la división de la API con translocación anterior a la tráquea y reimplantación. Se realiza por toracotomía sin CEC o por estereotomía media con bypass cardiopulmonar. Esta última permite más fácilmente la disección de la API y su reimplante, disminuye la tensión en las anastomosis3 y permite la reparación de defectos intracardiacos y de anillos traqueales si es preciso3,9. Fue la técnica utilizada en nuestros pacientes.
La segunda opción consiste en resección y anastomosis de la estenosis traqueal con recolocación de la API anterior a la tráquea, esta se pasa entre los dos extremos de la tráquea dividida, con estereotomía media y CEC1. Produce compresión traqueal, kinking de la arteria reimplantada1,5 y no puede emplearse en estenosis traqueales significativas3.
El tratamiento de las estenosis traqueales dependerá de la gravedad, siendo un tema de discusión máxime cuando hay interrogantes sobre el crecimiento de las anastomosis traqueales circunferenciales en neonatos y niños. En estenosis cortas la reimplantación de la API es suficiente y no se necesita actuar en la estenosis traqueal. En estenosis de segmentos largos las técnicas incluyen la traqueoplastia con material autólogo y la traqueoplastia deslizante3,10,11. Con la primera se realiza la reconstrucción traqueal con parche pericárdico o cartílago costal y tiene la ventaja del potencial crecimiento, pero los inconvenientes son mayor mortalidad periperatoria y complicaciones respiratorias. La traqueoplastia deslizante reconstruye la tráquea con tejido traqueal propio y permite el crecimiento de los segmentos reparados, con menor tendencia al desarrollo de tejido de granulación, rápida reepitelización y menores tiempos de ventilación mecánica.
Algunos grupos han utilizado técnicas endoscópicas con dilatación o stent con buen resultado en estenosis traqueal congénita12.
La mortalidad comunicada es variable según las series. En dos de las más representativas, oscila entre el 31 y el 6%3,4.
Como conclusiones, es necesario comentar que nuestra experiencia es similar a la de otros centros y la más representativa publicada en nuestro país. Abogamos por la técnica de elección para la mayoría de los autores, con división y reimplantación, que se puede realizar con o sin CEC según el estado del paciente. La mortalidad, comparable con la de otros centros, ha sido por complicaciones respiratorias. Nuestra actitud sobre la vía aérea ha sido conservadora. No hemos realizado cirugía traqueal en estenosis traqueales ligeras o moderadas ni en lactantes con menos de 3 meses de vida debido a la alta mortalidad en este grupo etáreo. Hemos intervenido en obstrucciones graves cuando la sintomatología no mejoraba y de forma endoscópica. En 5 pacientes, niños de mayor edad, no fue necesaria ninguna actitud terapéutica sobre la vía área. En 2 pacientes, lactantes de corta edad con estenosis muy graves y que necesitaron más tiempos de ventilación mecánica, se realizaron técnicas endoscópicas (dilataciones con balón y en uno de ellos, además, colocación de stent) que han permitido un manejo favorable en uno de ellos. Evidentemente, el número de pacientes y el tiempo de seguimiento nos hacen ser prudentes a lo hora de realizar conclusiones definitivas.
Conflicto de interesesNinguno.
Recibido 31 Marzo 2010
Aceptado 3 Junio 2010
Autor para correspondencia: Servicio de Cardiología, Hospital Sant Joan de Dèu, P.o Sant Joan de Dèu 2, 08950 Esplugues, Barcelona, España. jcarretero@hsjdbcn.org