El tratamiento farmacológico de la fibrilación auricular recae en dos aspectos fundamentales, la prevención del ictus mediante la anticoagulación oral y el control de la arritmia en sí, fundamentalmente control de la frecuencia cardiaca o del ritmo. En la presente revisión se repasan los principales anticoagulantes, desde los clásicos antagonistas de la vitamina K hasta los más recientes anticoagulantes directos, y se revisan las principales características de cada uno de ellos. También se revisan los distintos tratamientos para controlar la frecuencia cardiaca, así como los fármacos antiarrítmicos utilizados tanto para lograr la reversión a ritmo sinusal como para mantenerlo una vez conseguido.
Palabras clave
ácido acetilsalicílico
antagonistas de la vitamina K
fibrilación auricular
nuevos anticoagulantes orales
En el manejo de la fibrilación auricular (FA), los 2 puntos clave son la anticoagulación oral para prevenir la embolia y decidir entre el control del ritmo o de la frecuencia cardiaca. En este artículo, se revisa la anticoagulación en el paciente con FA y a continuación se abordan los tratamientos farmacológicos para controlar el ritmo o la frecuencia cardiaca.
El primer estudió que vinculó de alguna forma la FA no valvular y las embolias es el estudio de Framingham1 en 1982. En 1987 Wolff et al2 presentaban ya a la FA como un contribuyente «mayor» al ictus en la población anciana sin que todavía se lo considerase factor «independiente». Todavía en 1990 Phillips et al3 se preguntaban si la FA era un factor de riesgo independiente y, en un editorial, Chesebro et al4 advertían de la necesidad de estudios a largo plazo. Finalmente, en 1991 Wolff et al5, dentro del estudio de Framingham, demostraron de manera inequívoca su poderoso efecto predictor independiente de embolias sistémicas.
En los años noventa se fijó el valor de los antiagregantes y los anticoagulantes antagonistas de la vitamina K (AVK) para los pacientes con FA no valvular, entendida como tal la que no estaba asociada a prótesis o valvulopatía reumática (mayoritariamente estenosis mitral).
Se demostró que el ácido acetilsalicílico (AAS) tiene un valor protector discutible y, en cualquier caso, escaso6, mientras que los AVK sí suponían una muy significativa reducción del riesgo embolígeno (65%)7. Todas las comparaciones contra antiagregación, doble antiagregación, AVK a dosis bajas, etc., fueron, sin excepción, favorables a los AVK6–10. La falta de beneficio del AAS se ha confirmado en un estudio reciente11.
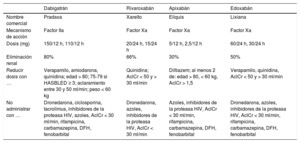
Dabigatrán primero12 y rivaroxabán13, apixabán14 y edoxabán15 después han abierto un abanico de posibilidades a los cardiólogos y médicos en general para tratar profilácticamente a los pacientes con FA no valvular.
Este artículo no pretende sustituir a las magníficas revisiones y guías publicadas en los últimos años sobre este tema16–23, solo aborda aspectos prácticos clave que, en nuestra opinión, aparecen cada día en la toma de decisiones en nuestras consultas (tabla 1).
Nuevos anticoagulantes orales.
| Dabigatrán | Rivaroxabán | Apixabán | Edoxabán | |
|---|---|---|---|---|
| Nombre comercial | Pradaxa | Xarelto | Eliquis | Lixiana |
| Mecanismo de acción | Factor IIa | Factor Xa | Factor Xa | Factor Xa |
| Dosis (mg) | 150/12 h, 110/12 h | 20/24 h, 15/24 h | 5/12 h, 2,5/12 h | 60/24 h, 30/24 h |
| Eliminación renal | 80% | 66% | 30% | 50% |
| Reducir dosis con … | Verapamilo, amiodarona, quinidina; edad > 80; 75-79 si HASBLED ≥ 3; aclaramiento entre 30 y 50 ml/min; peso < 60 kg | Quinidina; AclCr < 50 y > 30 ml/min | Diltiazem; al menos 2 de: edad > 80, < 60 kg, AclCr > 1,5 | Verapamilo, quinidina, AclCr < 50 y > 30 ml/min |
| No administrar con … | Dronedarona, ciclosporina, tacrolimus, inhibidores de la proteasa HIV, azoles, AclCr < 30 ml/min, rifampicina, carbamazepina, DFH, fenobarbital | Dronedarona, azoles, inhibidores de la proteasa HIV, AclCr < 30 ml/min | Azoles, inhibidores de la proteasa HIV, AclCr < 30 ml/min, rifampicina, carbamazepina, DFH, fenobarbital | Dronedarona, azoles, inhibidores de la proteasa HIV, AclCr < 30 ml/min, rifampicina, carbamazepina, DFH, fenobarbital |
En general no se recomienda usar los nuevos anticoagulantes orales con aclaramientos < 30 ml/min y reducir las dosis a la mitad si se encuentran entre 50 y 30 ml/min. AclCr: aclaramiento de creatinina; DFH: dinfenilhidantoína; HIV: hipertrofia ventricular izquierda.
La guía de la American Heart Association (AHA) sobre FA de 200624 y la de ACCCF/AHA/HRS de 201121, omnipresente hasta 2012, consideraban anatema no antiagregar, al menos con AAS, a cualquier paciente con FA.
La guía europea de 201222 supuso una revolución porque por primera vez había una clara apuesta por no antiagregar (y por no anticoagular) a los pacientes con una puntuación CHA2DS2-VASc 0 si se estima que el riesgo embólico es sumamente pequeño y lo supera el riesgo hemorrágico de tomar AAS. No hay que olvidar que la incidencia de sangrado mayor o hemorragia intracraneal no es menor con AAS que con ACO e incluso puede ser superior en ancianos (> 75 años), población muy prevalente en las consultas de FA.
Esta eliminación de la recomendación de antiagregar se ha extendido a las guías británica25 y canadiense26. En la guía de la sociedad estadounidense23, sin embargo, se deja libertad de prescripción de AAS, aunque se establece como alternativa no intervenir.
¿A Quién anticoagular en fibrilación auricular no valvular?Hay unanimidad en las guías internacionales en anticoagular a todos los pacientes con puntuación CHA2DS2-VASc ≥ 2.
La recomendación se extiende a los pacientes con CHA2DS2-VASc 1 en la mayoría de las guías, a excepción de la estadounidense23 de 2014, que en este subgrupo de riesgo da libertad de prescripción entre AAS, anticoagulación o incluso no intervención. ¿Por qué esta diversidad de criterios? Porque se trata de un nivel de riesgo de embolias relativamente bajo y con un riesgo de hemorragia mayor con cualquier anticoagulante escogido, en general ligeramente superior al riesgo embólico.
El estudio AVERROES observó que la incidencia de sangrado mayor entre los que tomaban apixabán y AAS era similar27. La puntuación CHAD2DS2-VASc 1 no es equipotencial en el riesgo embólico; es mayor si se consigue por ser mayor de 65 años que si se consigue por diabetes o hipertensión. Esto quiere decir que se tiende a ser más proactivo en la anticoagulación si el paciente es mayor de 65 años y tiene un riesgo hemorrágico bajo que si, por el contrario, es hipertenso y con un riesgo hemorrágico alto, por ejemplo.
¿Qué fármaco utilizar?La práctica cotidiana es la libertad de prescripción de cualquier anticoagulante, nuevo anticoagulante oral (NACO) o AVK tras una minuciosa explicación de los pros y contras de cada elección. Se prescribiría un NACO a casi todos los pacientes de nueva anticoagulación, prácticamente sin excepción, si no existieran limitaciones a la prescripción. Durante más de 25 años, los AVK han permitido reducir el número de ictus embólicos en los pacientes con FA de todo tipo. Como contrapartida, se ha pagado un no desdeñable tributo en hemorragias menores y mayores, sangrados cerebrales, incomodidad en el control e interacciones farmacológicas y alimentarias muy frecuentes. Los NACO, todos ellos con estudios de no inferioridad frente a AVK demostrada de manera inapelable, han abierto un escenario bien distinto en la actualidad.
¿Qué novedad aportan los NACO? Comodidad, disminución del número de ictus, reducción de la mortalidad cardiovascular y total, de los sangrados mayores, de los sangrados cerebrales, menor tasa de abandonos del tratamiento, etc.
Todo eso es básicamente cierto, pero lo que puede llevar a iniciar la anticoagulación con uno de los NACO en lugar de un AVK como primera elección es la reducción de la incidencia del sangrado cerebral, que se estima entre 2 y 3 veces menor que con AVK. Todas las demás afirmaciones, aun siendo ciertas, no serían tan definitivas en la elección.
Los defensores de los AVK frente a los NACO argumentan, no sin razón, que las ventajas de los NACO son prácticamente nulas en las poblaciones controladas férreamente en los niveles de anticoagulación con international normalized ratio (INR) entre 2 y 3 y tiempo en rango terapéutico (TRT) > 70%28. Aunque cierto (excepto en la variable sangrado cerebral), se sabe que el 40% de los pacientes con AVK están fuera de rango terapéutico29.
El informe de posicionamiento terapéutico del Ministerio de Sanidad30 fue sensato y razonable en un primer momento en que todavía no había muchas evidencias, aparte de los estudios fundamentales, de la seguridad en la vida real de los NACO.
En este momento y con múltiples estudios en la vida real31–34, parece razonable que los grupos médicos de expertos convocados por las administraciones públicas para la toma de posición en la prescripción de los NACO hagan valer criterios objetivos de eficacia, seguridad e incluso de coste-beneficio para lo que, en opinión de estos autores, es más importante: la libre elección del médico en su toma de decisión tras hablar con el paciente de ventajas, inconvenientes, riesgos, etc. En general no se suele prescribir NACO en insuficiencia renal avanzada (aclaramiento de creatinina < 30 ml/min).
SI SE Escoge un naco, ¿cuál de ellos?¿Hay un NACO mejor que otro?Difícil pregunta de casi imposible respuesta. Todos los NACO en el mercado (dabigatrán, rivaroxabán y apixabán) y de entrada inmediata (edoxabán) se han demostrado no inferiores en eficacia de prevención de embolias sistémicas frente a AVK.
El diseño de los estudios ha sido distinto. El TRT del grupo de AVK también (se entiende que si el grupo control tiene un TRT bajo, la posibilidad de que salga favorecido en la comparación con el NACO estudiado es mayor). Tampoco la puntuación CHADS de los grupos ha sido la misma y la tasa de sangrado puede estar gravada por una puntuación HAS-BLED alta en el grupo de análisis.
La solución sería hacer un gran estudio comparativo entre los diferentes NACO en comparación con los AVK. Desgraciadamente, este estudio no está en el horizonte, de manera que nos tenemos que guiar por percepciones, deducciones, sensaciones, experiencia personal, etc.; en definitiva, con nada objetivamente incuestionable.
En opinión de estos autores, la máxima eficacia frente al ictus isquémico se consigue con dabigatrán 150 mg (a costa de un ligero exceso de sangrado y un 10% de pacientes con dispepsia inducida por el fármaco). La máxima seguridad en cuanto a hemorragias la tenemos con apixabán y edoxabán 60 (sin apenas dispepsia), y dabigatrán 110 mg (con algún abandono por dispepsia). La eficacia antiictus del apixabán es superior a la de los AVK, por lo que supone un buen equilibrio entre eficacia y seguridad. El hecho de que la eliminación del apixabán sea fundamentalmente hepática (menos prevalente la afección hepática que la renal en la población de FA) y la del dabigatrán sea renal (más susceptible a un deterioro brusco intercurrente de la función renal) hace que en general se utilice más el apixabán que el dabigatrán, especialmente si hay algún dato de disfunción renal, por pequeño que sea.
El rivaroxabán tiene un exceso de sangrado digestivo frente a los demás en los estudios fundamentales. La compañía sostiene que ese exceso se debe a un mayor CHADS y, por lo tanto, un mayor HAS-BLED que el grupo del resto de los NACO. Alguno de los miembros del panel en la FDA de aprobación del fármaco manifestó sus dudas sobre si la dosis única diaria sería la mejor opción para un fármaco que, curiosamente, era el que tenía menor vida media de los NACO existentes y si esto no podría colaborar en el exceso de sangrado. Lo cierto es que el sangrado del grupo control con AVK del estudio fundamental de rivaroxabán no fue superior al de los demás grupos de control de los otros NACO, cosa difícil de casar con el argumento explicativo del exceso de sangrado dado por la compañía. Sin embargo, el estudio en la vida real del rivaroxabán XANTUS35 parece dar la razón a la compañía, porque cuando se analiza el subgrupo con una puntuación CHADS similar a la del grupo control de los otros NACO, tienen cifras equiparables de sangrado. Por otra parte, el estudio XANTUS adolece de no tener grupo de control con AVK en el análisis, lo que invalida, al menos parcialmente, sus resultados. En un reciente análisis en vida real de los diferentes NACO, se confirma la sensación que se obtiene de la lectura de los estudios fundamentales: el rivaroxabán tiene unas cifras de sangrado ligeramente inferiores que los AVK, pero en cualquier caso superiores a dabigatrán y apixabán, por lo que no sería ni el más eficaz ni el más seguro, y su única ventaja sería la toma única diaria.
¿Qué papel tendría el edoxabán, nuevo anticoagulante pendiente de comercialización? Este nuevo fármaco gozaría de la seguridad del dabigatrán 110 y del apixabán en cuanto a sangrado mayor, con la ventaja añadida de ser dosis única diaria, con un riguroso ensayo clínico farmacológico de dosis única frente a doble que lo sustenta36. Está por definir su comportamiento en la vida real, en poblaciones amplias, pero no se espera ninguna sorpresa a tenor del estudio fundamental.
¿Merece la pena que haya varios NACO?Sí; las características de vida media, interacciones, efectos secundarios, eliminación, etc., hacen muy útil la presencia de alternativas terapéuticas.
¿Son seguros?De todos sin excepción se ha demostrado, en estudios fundamentales o en vida real, igual o menos sangrados mayores que con los AVK y muchos menos eventos de sangrado cerebral. Además, el estudio comparativo de sangrados mayores con ingreso en UCI frente a AVK no demuestra exceso de mortalidad de los NACO37. La inmediata presencia en los hospitales de los nuevos antídotos andexanet alfa38, idurizizumab39 o aripazina40 hará que otro de los argumentos contra la utilización de los NACO desaparezca.
Si no se hacen controles, ¿se banaliza la toma y se corre el riesgo de abandono?Los estudios en vida real no sostienen esta afirmación. Los NACO tienen, si acaso, mayor adherencia terapéutica en vida real que los AVK.
¿Mejor toma única que doble?Depende; si el desarrollo clínico de la molécula ha sido el correcto, la respuesta es que es mejor una dosis única. Un problema que han tenido las compañías desarrolladoras ha sido establecer la dosis adecuada para conseguir los efectos deseados (ausencia de embolias) sin un exceso de sangrado. Para definir bien qué dosis, y si es preferible una dosis única o doble, hay que hacer un diseño de desarrollo clínico farmacológico riguroso, largo y costoso, en el que no valen atajos.
Para concluir esta primera parte, se debe comentar que los antiagregantes probablemente no tengan un papel en la prevención de embolias en FA y que se debe utilizar anticoagulantes a partir de CHADS 1, preferiblemente con NACO, tras una discusión detallada con el paciente sobre todas las alternativas terapéuticas.
¿Control del ritmo o control de la frecuencia cardiaca?Actualmente, uno de los aspectos más discutidos en el manejo de la FA es si optar por el intento de mantener el ritmo sinusal o únicamente controlar la frecuencia cardiaca, ya que diversos estudios no han encontrado diferencias significativas entre ambas estrategias, aunque sí cierta tendencia favorable al control de frecuencia, que podría explicarse por el aumento de eventos en el grupo de control de ritmo sinusal al retirar el tratamiento anticoagulante y por los efectos adversos de los antiarrítmicos. No obstante, datos más recientes de un metanálisis que incluía 10 de estos estudios tampoco encontró diferencias en la población global (riesgo relativo [RR] de mortalidad total = 1,15; intervalo de confianza del 95% [IC95%], 0,88-1,50; p = 0,31), pero cuando analizaron los resultados en pacientes menores de 65 años, sí que había una reducción de la mortalidad total en el grupo de control del ritmo (RR = 3,03; IC95%, 1,59-5,75; p < 0,01)41. Otro de los aspectos que podría influir en los resultados neutros es el corto seguimiento de la mayoría de los estudios (no más de 4 años), ya que en algún análisis que ha prorrogado el seguimiento a partir del cuarto año, aparecía el beneficio del control del ritmo42. Por último, un subanálisis del estudio AFFIRM indica que mantener el ritmo sinusal (independientemente del brazo de tratamiento) se asocia a mejor pronóstico43. Como norma general, la decisión de control del ritmo o de la frecuencia deberá ser individualizada, pero normalmente, para pacientes mayores de 65 años con buena tolerancia a la arritmia, la estrategia de control de la frecuencia sería la recomendada, mientras que para los menores de 65 sí que puede haber un beneficio con la estrategia de control del ritmo44.
Por último, y antes de pasar a hablar de los antiarrítmicos, es importante resaltar que estos fármacos no son perfectos y, pese a ellos, los pacientes pueden tener recidivas, por lo que el objetivo del tratamiento debe ser una reducción de las recidivas junto con una mejor tolerancia, más que la completa desaparición de la arritmia.
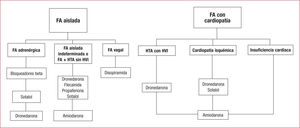
Mantenimiento del ritmo sinusalFármacos antiarrítmicos para el mantenimiento en ritmo sinusalLa probabilidad de mantener al paciente en ritmo sinusal se duplica con los distintos antiarrítmicos45. Elegir uno u otro dependerá del tipo de FA o de la presencia de cardiopatía estructural, y se debe elegir preferentemente los que tengan mejor perfil de seguridad (figura). Los principales antiarrítmicos se resumen a continuación y en la tabla 2.
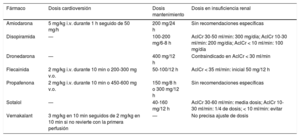
Dosis de los distintos fármacos antiarrítmicos según su uso (cardioversión o mantenimiento del ritmo sinusal) o presencia de insuficiencia renal.
| Fármaco | Dosis cardioversión | Dosis mantenimiento | Dosis en insuficiencia renal |
|---|---|---|---|
| Amiodarona | 5 mg/kg i.v. durante 1 h seguido de 50 mg/h | 200 mg/24 h | Sin recomendaciones específicas |
| Disopiramida | — | 100-200 mg/6-8 h | AclCr 30-50 ml/min: 300 mg/día; AclCr 10-30 ml/min: 200 mg/día; AclCr < 10 ml/min: 100 mg/día |
| Dronedarona | — | 400 mg/12 h | Contraindicado en AclCr < 30 ml/min |
| Flecainida | 2 mg/kg i.v. durante 10 min o 200-300 mg v.o. | 50-100/12 h | AclCr < 35 ml/min: inicial 50 mg/12 h |
| Propafenona | 2 mg/kg i.v. durante 10 min o 450-600 mg v.o. | 150 mg/8 h o 300 mg/12 h | Sin recomendaciones específicas |
| Sotalol | — | 40-160 mg/12 h | AclCr 30-60 ml/min: media dosis; AclCr 10-30 ml/min: 1/4 de dosis; < 10 ml/min: evitar |
| Vernakalant | 3 mg/kg en 10 min seguidos de 2 mg/kg en 10 min si no revierte con la primera perfusión | — | No precisa ajuste de dosis |
AclCr: aclaramiento de creatinina; i.v.: intravenosa; v.o. vía oral.
Ejerce su acción antiarrítmica en multiples canales (sodio, potasio y calcio). Es el antiarrítmico más eficaz en la reducción de recidivas de FA; de hecho, en distintos estudios se ha mostrado superior a los fármacos de clase I, a sotalol45,46 y a dronedarona47. No obstante, presenta gran cantidad de efectos adversos sistémicos (pulmonar, hepático, tiroideo, muscular) que se debe tener en cuenta a la hora de prescribirlo, especialmente a jóvenes, ya que su toxicidad es acumulativa. Dada la tendencia actual con el uso de los antiarrítmicos a minimizar los efectos adversos, es prudente dejar la amiodarona como fármaco de segunda elección, salvo para pacientes con insuficiencia cardiaca (IC), para los que se convierte en la única opción.
DisopiramidaEs un antiarrítmico de clase IA bloqueador de los canales de sodio con efecto anticolinérgico, motivo por el que se recomienda en la FA de predominio vagal48. Además, por su efecto inotropo negativo, se puede utilizar en pacientes con miocardiopatía hipertrófica obstructiva49.
DronedaronaEs un derivado benzofurano de la amiodarona sin su fracción yodada, lo que elimina parte de su toxicidad extracardiaca. Actúa como bloqueador multicanal con eficacia superior a la del placebo50, pero inferior a la de la amiodarona47.
Sus resultados en el estudio ATHENA51 (reducción de hospitalizaciones y mortalidad respecto a placebo en pacientes con factores de riesgo cardiovascular y FA paroxística o persistente) dieron pie a un gran optimismo, lo que motivó explorar nuevas indicaciones, como para pacientes con FA permanente (estudio PALLAS)52, pero el hallazgo de un aumento de mortalidad, ictus e IC en estos pacientes tratados con dronedarona hizo que se paralizara el estudio precozmente. Estos resultados, sumados a los del estudio ANDROMEDA53, en el que el uso de dronedarona duplicó la mortalidad de los pacientes con IC en clases II-IV de la New York Heart Association (NYHA) y fracción de eyección del ventrículo izquierdo (FEVI) ≤ 35% motivó gran controversia sobre su uso. A raíz de estos últimos 2 estudios, está contraindicada para pacientes con IC, disfunción ventricular izquierda grave o FA permanente. Tampoco se recomienda para pacientes con toxicidad hepática o pulmonar por amiodarona.
Para reducir los efectos adversos y optimizar su eficacia, en el estudio HARMONY54 se ha probado el uso combinado de una dosis baja de dronedarona (225 mg/12 h) combinada con ranolazina (750 mg/12 h), y se ha demostrado su eficacia con un buen perfil de seguridad, por lo que se postula como una alternativa futura de uso.
Se recomienda realizar un ECG antes de iniciar el tratamiento con dronedarona y cada 6 meses, para suspenderla en caso de detectar una recidiva de la FA. También se recomienda una analítica para valorar la función hepática y renal antes del inicio, a la semana de tratamiento y posteriormente según ficha técnica.
Flecainida y propafenonaSon antiarrítmicos de la clase IC eficaces y seguros en pacientes sin cardiopatía estructural. Se deben evitar en caso de enfermedad coronaria, IC o hipertrofia ventricular izquierda significativa, por el riesgo de proarritmia y por su efecto inotrópico negativo. Se recomienda su uso concomitante con un bloqueador del nódulo auriculoventricular (bloqueador beta, antagonista del calcio o digoxina) por el riesgo de inducir flutter auricular con conducción auriculoventricular 1:1.
Especialmente en el caso de la flecainida, se recomienda vigilar regularmente el ECG, especialmente al inicio del tratamiento o si se aumenta la dosis, ya que un ensanchamiento del QRS > 25% respecto al basal debe alertar sobre el riesgo de proarritmia y se debe interrumpir el tratamiento con este fármaco.
Las dosis de ambos fármacos se deben ajustar en caso de insuficiencia hepática o renal. Los efectos adversos más frecuentes de la propafenona son digestivos (náuseas) y, por su efecto bloqueador beta, debe evitarse en pacientes con broncospasmo grave. Los efectos adversos más comunes de la flecainida son neurológicos leves, como el temblor o la cefalea.
SotalolEs un bloqueador de los canales de potasio (Ikr) con propiedades de bloqueo beta no selectivo. El estudio SAFE-T55 mostró que, en el subgrupo de pacientes con cardiopatía isquémica, la eficacia del sotalol era similar a la de la amiodarona, por lo que su utilización se recomienda para pacientes con cardiopatía isquémica y FA. El problema del sotalol es la proarritmia por alargamiento del intervalo QT; se recomienda la vigilancia del QT y, si es > 500 ms56 o aparecen ondas T-U gigantes57, se debe interrumpir o reducir la dosis. No se recomienda (por mayor riesgo de proarritmia) en mujeres y en hipertrofia ventricular izquierda, bradicardia importante, hipopotasemia o hipomagnesemia20. Su eliminación es renal.
Ablación para el mantenimiento del ritmo sinusalEste tema se aborda en profundidad en otro artículo de este suplemento. Brevemente, hay que recordar que las guías22 recomiendan de primera elección (I A) la ablación para los pacientes con FA paroxística sintomática y refractaria a tratamiento antiarrítmico, e incluso se recomienda también como primera línea de tratamiento (antes que el tratamiento con fármacos antiarrítmicos) para determinados pacientes con FA paroxística sintomática (lia B). De hecho, recientemente, el estudio AATAC58 ha demostrado que la ablación es superior a la amiodarona en la reducción de recidivas de la FA, de hospitalización e incluso de la mortalidad, lo cual convierte esta técnica en una gran alternativa al tratamiento farmacológico.
Fármacos antiarrítmicos para la cardioversión a ritmo sinusalLa cardioversión farmacológica suele ser de gran eficacia durante los primeros 7 días de evolución de la FA. Su principal ventaja respecto a la eléctrica es que no precisa anestesia, pero tiene el inconveniente de su menor eficacia y la posibilidad de proarritmia, por lo que son necesarios monitorización médica y ECG continuos.
La administración de flecainida intravenosa a pacientes con FA de más de 24 h tiene una eficacia del 67-92% a las 6 h; también puede administrarse por vía oral, con una leve reducción de la eficacia. La propafenona tiene una tasa de cardioversión entre el 41 y el 91% después de su administración intravenosa. El tiempo de cardioversión varía de 30 min a 2 h.
Por vía oral, la propafenona 450-600 mg o la flecainida 200-300 mg puede administrársela el propio paciente fuera del hospital con la estrategia denominada pill in the pocket20. Alboni et al59 mostraron en 569 pacientes que era segura (solo 1 caso de flutter auricular con conducción rápida) y efectiva (el 94% de reversión).
En casos de cardiopatía estructural, solo puede utilizarse la amiodarona, aunque su eficacia a corto/medio plazo es menor.
El vernakalant es un nuevo antiarrítmico multicanal de uso endovenoso, vida media corta (2 h) y alta selectividad por los cardiomiocitos auriculares. Se recomienda para la cardioversión de pacientes con FA de menos de 7 días y con las únicas contraindicaciones de hipotensión grave (< 100 mmHg), IC en NYHA III-IV, estenosis aórtica grave o síndrome coronario agudo en los 30 días previos. La eficacia mostrada en los estudios fundamentales del fármaco está sobre el 51%60, pero en la experiencia de estos autores, recientemente publicada, la eficacia fue del 86% en cuanto a reversión con vernakalant a ritmo sinusal de manera rápida y segura61. De hecho, el tiempo medio de reversión tras el inicio de la primera infusión fue de tan solo 12,5 min, y solo el 9% presentó efectos adversos leves, del tipo de la disgeusia o tos y náuseas, que fueron autolimitados.
Otro nuevo antiarrítmico utilizado para la cardioversión es la vanoxerina, que ejerce su efecto multicanal por vía oral y ha sido evaluada recientemente en un pequeño estudio (n = 41), RESTORE SR62; ha mostrado buena eficacia (el 69% de reversión a ritmo sinusal frente al 20% con placebo), pero con un exceso de muerte súbita por torsade de pointes (el 11,5% frente a 0).
Mantenimiento en fibrilación auricular y control de la respuesta ventricularEl estudio RACE II63 demostró que un control laxo de la frecuencia (frecuencia cardiaca en reposo < 110 lpm) es igual o más seguro que un control estricto (frecuencia cardiaca en reposo < 80 lpm), motivo por el que las guías recomiendan un control laxo20, salvo que el paciente permanezca sintomático, refiriendo palpitaciones taquicárdicas, en cuyo caso es recomendable un control más estricto de la frecuencia.
Para el control de la frecuencia cardiaca se utilizan bloqueadores beta (cardioselectivos), antagonistas del calcio no dihidropiridínicos (verapamilo y diltiazem) y digoxina. Los bloqueadores beta son de gran utilidad para el control de la frecuencia cardiaca en respuesta al ejercicio físico o estrés, e igualmente indicados en pacientes con IC. Además, datos recientes señalan que su uso se relaciona con una reducción de la mortalidad64.
La digoxina consigue peor control de la respuesta ventricular (especialmente con los esfuerzos), aunque es de utilidad en pacientes con escasa actividad, IC o hipotensión arterial. Su uso se ha puesto en tela de juicio recientemente por la aparición de estudios que la asociaban a mayor mortalidad65,66, que se puede explicar por dosis excesivas, con lo que la tendencia actual es recomendar valores máximos de 1,0 ng/ml y no ajustar la dosis según la frecuencia cardiaca66.
ConclusionesEl tratamiento de la FA se apoya en 2 pilares: la prevención del ictus y el manejo de la arritmia. Para la prevención del ictus, los NACO han mostrado evidentes ventajas de comodidad de uso respecto a los AVK, pero además todos ellos reducen el riesgo de hemorragia intracraneal y algunos también el riesgo de ictus o hemorragias mayores. No obstante, pese a estas claras ventajas se siguen utilizando mayoritariamente AVK no solo por las limitaciones del visado de prescripción, sino también por una inercia terapéutica, ya que muchos pacientes con TRT < 60% siguen en tratamiento con AVK.
Del tratamiento de la arritmia, el control de la frecuencia cardiaca es la estrategia más usada en mayores de 65 años, especialmente si la toleran bien. Por el contrario, en jóvenes o pacientes con mala tolerancia, siempre se intentará la reversión a ritmo sinusal, para lo que el vernakalant puede ayudar a la cardioversión, y después se elige el antiarrítmico según la tolerabilidad del episodio y la presencia de cardiopatía.
Conflicto de interesesJ. Cosin Sales: honorarios de Boehringer Ingelheim, Bayer, Cardiome, Daiichi Sankyo y Pfizer/BMS, por asesorías, participación en sesiones científicas o trabajos de investigación.