La disfunción renal es común en pacientes con insuficiencia cardiaca (IC) que aumenta a medida que disminuye el filtrado glomerular estimado. Además, tiene implicaciones en el pronóstico del paciente con IC. Las recomendaciones de tratamiento de pacientes con IC y enfermedad renal crónica (ERC) concomitante no difieren, en general, de las de los pacientes con función renal normal. Pero los pacientes con enfermedad renal moderada o grave han sido excluidos de la mayoría de los ensayos clínicos, y faltan evidencia y seguridad en los tratamientos que aplicar a estos pacientes. En este artículo se analizan las evidencias existentes de los diferentes tratamientos de la IC en pacientes con ERC moderada o grave, incluidas las terapias con ultrafiltración mediante diálisis peritoneal, así como complicaciones del tratamiento como la hiperpotasemia y el deterioro en la función renal.
Los inhibidores duales de la neprilisina y angiotensina parecen un tratamiento prometedor que podría reducir el riesgo de IC con seguridad entre los pacientes con ERC. El beneficio podría estar mediado, entre otros, por sus efectos renales. Otros tratamientos como los inhibidores del cotransportador de sodio-glucosa tipo 2 han mostrado beneficio en la IC de pacientes diabéticos con distintos grados de función renal. Se requieren ensayos clínicos que permitan conocer las evidencias de los tratamientos de la IC y reducir con confianza el exceso de riesgo de enfermedad cardiovascular en la enfermedad renal.
Información sobre el suplemento: este artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.
Palabras clave
La disfunción renal es común en pacientes con insuficiencia car–diaca (IC), con una prevalencia muy superior a de la población general y que aumenta a medida que disminuye la tasa de filtrado glomerular estimada (TFGe). Su prevalencia oscila entre el 20 y el 57% en pacien–tes con IC crónica estable y del 30 al 67% en grandes registros de pacientes admitidos con IC aguda o descompensada1. Además, el empeoramiento de la función renal ocurre en un 18-40% de los pacientes durante la hospitalización por IC aguda o descompensada2.
Link cardiorrenalEl daño agudo o crónico de uno de los órganos, corazón o riñón, puede llevar al daño agudo o crónico del otro, y se produce lo que se ha venido a llamar síndrome cardiorrenal3. Aunque este concepto y su clasificación en 5 categorías se han utilizado desde un punto de vista práctico y para concienciación entre clínicos e investigadores, existen críticas a esta clasificación, ya que podría considerarse simplemente como una respuesta fisiológica (y pasiva) del riñón a un corazón defectuoso. Probablemente en un futuro, nuevos datos puedan ayu–dar a establecer una clasificación actualizada de los síndromes cardio- rrenales que incorpore evidencia reciente y resalte las áreas de interés y las áreas de incertidumbre.
Lo más importante de esta condición es que la asociación de daño cardiaco y renal marca de forma importante el pronóstico de la enfer–medad, de manera que la supervivencia de los pacientes con IC se ve claramente modificada por el grado de ERC que presenten. En un reciente metanálisis se encontró que la concentración de creatinina sérica era 1 de los 5 predictores más potentes asociados con la morta–lidad junto con la fracción de eyección, la edad, la clase funcional de la NYHA y la diabetes mellitus4.
Evidencias de los tratamientos de la insuficiencia cardiaca en la enfermedad renal crónicaEl tratamiento de la IC busca como objetivo mejorar los síntomas y la calidad de vida de los pacientes reduciendo las hospitalizaciones y la mortalidad.
En general, las recomendaciones para el tratamiento de los pacien–tes con IC y ERC concomitante no difieren de las de los pacientes con función renal normal5.
Un aspecto importante que considerar es que los pacientes con ERC grave (TFGe < 30 ml/min/1,73 m2) han sido excluidos de la mayo–ría de los ensayos clínicos, y por ello falta evidencia de los tratamien–tos que aplicar a estos pacientes. Sin embargo, en los escasos estudios disponibles6, el beneficio observado en la mayoría de estos ensayos también fue similar, si no mayor, que en los pacientes con TFGe en 30-60 ml/min/1,73 m2.
Por todo ello, hay escasa evidencia de los tratamientos en los pacientes con disfunción renal. Pero los pacientes con ERC en estadios 3 a 5 tienen mayores tasas de muerte e ingreso hospitalario, y por ello la disminución del riesgo relativo con estos tratamientos será poten–cialmente mucho mayor que en el resto de la población. De ahí la importancia de aclarar el efecto beneficioso y las posibles limitacio–nes para su uso.
En general, el abordaje de la IC debe ser similar a los pacientes sin disfunción renal, pero teniendo en cuenta la monitorización electrolí–tica y de función renal para evitar la hiperpotasemia y deterioros renales importantes. El tratamiento se basará en diuréticos, bloquea- dores del sistema renina-angiotensina-aldosterona (BSRAA), bloquea–dores beta, antagonistas del receptor de mineralocorticoides (ARM), inhibidores de la neprilisina en pacientes con fracción de eyección reducida y, en caso de refractariedad de la congestión, se puede con–siderar la ultrafiltración venovenosa o mediante diálisis peritoneal. En la figura 1 se expresa la fuerza de la evidencia del uso de estos grupos terapéuticos en la ERC.
Fuerza de la evidencia de mejora en el resultado clínico en la insuficiencia cardiaca para cada grupo de tratamiento según los estadios de la enfermedad renal crónica. ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; DAI: desfibrilador automatico implantable; Hidralazina + DNIS: combinación de hidralazina y dinitrato de isosorbida; IECA: inhibidores de la enzima de conversión de la angiotensina; TRC: terapia de resincronización cardiaca. Modificado de Nuñez et al.8.
Los diuréticos son el tratamiento principal para el control de los signos y/o los síntomas de congestión que caracterizan la IC. Sin embargo, pocos datos apoyan un beneficio de mortalidad o una alte–ración en la progresión de la enfermedad.
Existen diferentes tipos de diuréticos según el lugar de acción sobre los túbulos renales, pero en todos ellos el grado de función renal que presente el paciente va a influir en el efecto de los diferentes diu–réticos.
Diuréticos del asaInhiben el cotransportador de Na/K/2Cl de la rama ascendente gruesa del asa de Henle (AH), donde se reabsorbe un tercio del sodio filtrado. Esto causa una disminución de la reabsorción de sodio y clo–ruro y un aumento de la diuresis.
Los diuréticos del asa se unen a la superficie luminal del transpor–tador, por lo tanto, deben ser secretados en la luz tubular. A medida que se reduce la TFG, disminuye la secreción luminal y menos fár–maco alcanza el sitio activo.
La absorción oral de furosemida varía ampliamente. La bumeta- nida y la torasemida tienen una mayor biodisponibilidad y una farma- cocinética más predecible.
Diuréticos tiacídicosInhiben el transportador de Na-Cl en la porción distal de la rama ascendente del AH y la primera parte del túbulo distal. Evitan la dilu–ción máxima de la orina, lo que aumenta el aclaramiento de agua libre y la excreción de sodio y cloro a través del epitelio tubular renal. El mayor suministro de sodio a los conductos colectores aumenta el intercambio de sodio con potasio y, como resultado, aumenta la depleción del potasio.
Son menos efectivos en pacientes con TFG reducida, porque ejer–cen sus efectos diuréticos desde el lado luminal de la nefrona. Aunque son menos potentes que los diuréticos del asa, pueden funcionar en sinergia con ellos. Los diuréticos tiacídicos, cuando se combinan con los diuréticos del asa aumentan la natriuresis incluso en pacientes con ERC avanzada. Ello se debe a que impiden la reabsorción distal del sodio que escapa al asa de Henle y que se produce como consecuencia del efecto antinatriurético relacionado con la disminución del volu–men extracelular que ocurre tras la administración aguda de diuréti–cos del asa7.
Diuréticos ahorradores de potasioSon los antagonistas de los receptores de la aldosterona. Actúan en el conducto colector cortical, en particular reduciendo la absorción de sodio y agua y aumentando la excreción de iones de hidrógeno y pota–sio, y su acción está mediada por el antagonismo de las acciones de los mineralocorticoides. Solo el 3% del sodio filtrado se reabsorbe en el conducto colector, por lo que esta clase de medicamentos no tiene un efecto diurético apreciable. Sin embargo, a menudo se usan en combinación con otros diuréticos más efectivos para corregir o preve–nir la deficiencia de potasio.
Otros diuréticos- •
Inhibidores de la anhidrasa carbónica (acetazolamida). Su princi–pal efecto secundario es la acidosis, pero usado con diuréticos del asa y/o tiacídicos, es útil para contrarrestar la alcalosis que estos producen8.
- •
Diuréticos osmóticos (manitol). No tienen utilidad cuando hay deterioro de la función renal.
- •
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) son fármacos utilizados para el tratamiento de la diabetes mellitus tipo 2 y, aunque no se los considera diuréticos, por su efecto natriurético inicial y los beneficios en pacientes con IC plan–tean un abordaje complementario al menos en pacientes con dia–betes mellitus tipo 2 (véase «iSGLT2», p. 34).
- •
Es importante que el tratamiento con diuréticos siempre se com–bine con un bloqueo del sistema neurohormonal, con el fin de frenar el progreso de la enfermedad.
- •
En general no existe contraindicación de ningún diurético en los diferentes grados de ERC, si bien al disminuir la TFG disminuye la biodisponibilidad y surge la resistencia a los diuréticos.
La eliminación del exceso de líquido generalmente se logra mediante una combinación de restricción de sal y diuréticos del asa, pero en algunos casos la congestión persiste a pesar de un trata–miento adecuado con diuréticos. Esto se ha denominado resistencia diurética. Varios mecanismos contribuyen a la resistencia diurética:
- •
«Fenómeno de frenado»: resistencia a corto plazo después de una dosis en bolo y puede estar relacionada con la activación neuro–hormonal que actúa para preservar el volumen intravascular como consecuencia de la disminución del volumen extracelular.
- •
Hipertrofia compensatoria del túbulo contorneado distal, que reabsorbe ávidamente el sodio y contrarresta los efectos natriuré- ticos de los diuréticos del asa.
- •
Disminución de la TFG: a medida que disminuye, se necesita una dosis más alta de diurético para lograr un efecto terapéutico.
- •
Absorción gastrointestinal y biodisponibilidad de los diuréticos orales que pueden verse afectadas por la IC por edema de la pared intestinal.
La resistencia diurética se asocia de forma independiente con la mortalidad total, la muerte súbita y la muerte por fallo de bomba. Hay varias opciones para superar la resistencia a los diuréticos:
- •
Aumento de la dosis.
- •
Infusión intravenosa continua.
- •
Agregar diuréticos, generalmente un diurético del asa y un tiacídico.
El principal problema cuando se utiliza el bloqueo secuencial de nefronas es la posible excesiva depleción de agua y electrolitos. La alteración de la función renal con el tratamiento diurético puede deberse a alteraciones directas en la hemodinámica glomerular debi–das a mecanismos de retroalimentación neurohormonal e intrarrenal o por reducción manifiesta del volumen.
Las guías proponen usar la menor dosis necesaria para conseguir el control y evitar la posible deshidratación y el deterioro de la fun–ción renal.
Por otra parte, recientemente se ha reconocido que los diuréticos pueden mejorar la función renal si existe congestión renal, por lo que es necesario adaptar la dosis de diurético al estado del paciente de manera individualizada. La utilización de biomarcadores de conges–tión como el CA 125 para guiar el tratamiento diurético sería un ejem–plo válido9.
Otros tratamientos para la congestión- •
Infusión de solución salina hipertónica junto con tratamiento diu–rético10. Los beneficios potenciales de este tratamiento son la recu–peración más rápida del volumen intraarterial que reduce la esti–mulación neuroendocrina y mejora la perfusión glomerular.
- •
Antagonista de la arginina-vasopresina (vaptanes)11.
- •
Tratamiento de ultrafiltración (UF)12. La UF mueve el agua y los solutos de peso pequeño a mediano a través de una membrana semipermeable para reducir la sobrecarga de volumen. El princi–pal problema de esta técnica es que la UF debe realizarse a una velocidad tal que permita el rellenado plasmático para que no se produzcan una hipovolemia relativa y deterioro renal.
Desde hace relativamente poco, se viene utilizando esta técnica de diálisis en pacientes con IC congestiva para la mejoría de los síntomas cuando el tratamiento habitual no consigue controlar la enfermedad.
La diálisis peritoneal (DP) consigue la extracción de agua y solutos (entre ellos el sodio) por el paso a través del peritoneo tras la infusión de una solución con capacidad osmótica.
Su principal ventaja es la capacidad de retirar líquido extracelular de una manera lenta, fisiológica y sin alteración de la hemodinámica. Es técnicamente sencilla y se realiza en el domicilio del paciente sin necesidad de aparataje.
La extracción de sodio es fundamental en el tratamiento para la congestión, pues se ha visto que la extracción de agua libre de sodio tiene poco o ningún impacto en el pronóstico de estos pacientes. Eli–giendo la modalidad de DP por unidades especializadas se consigue personalizar la extracción de sodio según las características del paciente y sus necesidades clínicas, con lo que se optimizan las pro–piedades descongestivas de la DP13.
Por otra parte, muchos de los pacientes con IC y ERC presentan hiperpotasemia, que impide el uso de determinados tratamientos cla–ramente demostrados como beneficiosos, en concreto los BSRAA. Usando la DP se corrige esta alteración electrolítica y se pueden rein- troducir ciertos medicamentos14.
La mayoría de los estudios publicados encuentran una mejoría importante en la clase funcional y la calidad de vida, una disminución muy marcada de los días de ingreso por IC y algunos incluso mejora en la supervivencia15-17, que hacen que la diálisis peritoneal constituya una alternativa en el tratamiento de la IC refractaria.
En ese sentido, la recientemente publicada guía de la Sociedad Europea de Cardiología para el tratamiento de la IC avanzada incluye en su algoritmo de tratamiento la posibilidad de remitir a una unidad de IC especializada en UF, probablemente trabajando conjuntamente con nefrologia, aquellos casos de IC refractaria o en NYHA II con deter–minadas condiciones (FEVI < 20%, hiponatremia, intolerancia a los BSRAA o inhibidores duales de la angiotensina y neprilisina [ARNI], más de un ingreso no planificado en los últimos 12 meses, deterioro renal o hepático debido a IC, congestión persistente a pesar de esca–lado de diuréticos)18.
iSGLT2Grandes ensayos clínicos en pacientes con diabetes mellitus tipo 2 (DM2) y distintos grados de riesgo cardiovascular han demostrado que los iSGLT2 reducen el riesgo de hospitalización por IC19-21. No obs–tante, los 3 ensayos clínicos se realizaron en pacientes con TFGe > 60 ml/min/1,73 m2 en más del 75% de los casos. Recientemente se han publicado los resultados del estudio CREDENCE22, que ha incluido a pacientes con alto riesgo de progresión renal y en el que el 60% de los pacientes presentaban una TFGe < 60 ml/min/1,73 m2. En este estudio, el tratamiento con un iSGLT2 (canagliflozina) se asoció con una reducción significativa del 39% en la tasa de hospitalización por IC.
Este sorprendente e inicialmente inesperado efecto beneficioso de los iSGLT2 se ha observado en todos los estudios poco después de la aleatorización, lo que indica mecanismos de acción diferentes de los que generalmente se consideran con los tratamientos convencionales para reducir la glucosa. Aunque los mecanismos no son del todo bien conocidos, y presentes en pacientes con y sin insuficiencia renal, quizá pueda ocurrir también en pacientes sin diabetes. El ensayo clí–nico DAPA-HF, que incluyó a 4.744 pacientes con IC y FEVI < 40%, mos–tró una reducción significativa del 26% del criterio de valoración com–puesto de muerte cardiovascular, ingreso por IC y visita a urgencias por empeoramiento de IC. El efecto beneficioso fue similar en DM2 y no DM223. Varios estudios están en marcha para valorar su efecto en pacientes con IC con y sin diabetes: el EMPEROR (EMPagliflozin outcomE tRial in Patients With chrOnic heaRt Failure With Preserved Ejection Fraction), el DELIVER (Dapagliflozin Evaluation to Improve the LIVEs of Patients With PReserved Ejection Fraction Heart Failure) y el SOLOIST-WHF (Effect of Sotagliflozin on Cardiovascular Events in Patients With Type 2 Diabetes Post Worsening Heart Failure). En el estudio DAPA-HF, el 41% de los pacientes tenían una TFGe por debajo de 60 ml/min/1,73 m2 al inicio del estudio23.
Sin duda alguna, los iSGLT2 formarán parte de la prevención y tra–tamiento de la IC, y así se ha empezado a considerar en las guías para pacientes con DM2. Quedan por definir tanto el efecto en pacientes con ERC avanzada que confirmen los resultados del estudio CRE–DENCE en más estudios como el efecto en pacientes no diabéticos.
Bloqueadores del sistema renina-angiotensina-aldosteronaLos grandes estudios fundamentales de IC excluyen a los pacien–tes con ERC avanzada, por lo que no hay evidencia clara del beneficio de estos medicamentos en esta población. Sin embargo, estudios basados en la experiencia en pacientes con ERC moderada o con empeoramiento de la función renal durante su evolución demues–tran claramente el beneficio de los inibidores de la enzima de con–versión de la angiotensina (IECA).
Se podría concluir que estos tratamientos muestran beneficios consistentes en pacientes con insuficiencia renal moderada (ERC esta–dio 3), mientras que hay muy escasos datos sobre pacientes con insu–ficiencia renal grave (ERC 4 o 5). La prescripción debe ser individuali–zada valorando daño y beneficio, especialmente en los pacientes en estadios 4-5, de los que hay muy pocos datos disponibles6.
Inhibidores de la enzima de conversión de la angiotensinaDiferentes estudios (CONSENSUS, SOLVD, ATLAS, SAVE) valoran el efecto de los IECA en la IC e incluyen cierto número de pacientes con
ERC24-26. De ellos se extrae una evidencia razonable y consistente de la mejoría en el pronóstico con IECA en pacientes con ERC en estadio 3, y es posible que este beneficio también se produzca en estadios 4 o 5, aunque no hay datos concluyentes.
Debe tenerse especial cuidado en vigilar la función renal y los elec–trolitos en estos pacientes para obtener la mejor relación riesgo- beneficio.
Antagonistas del receptor de la angiotensina II (ARA-II)En este caso los estudios son más escasos que con los IECA27. No se encuentran diferencias significativas entre la TFGe basal y el efecto del fármaco, lo que indica que el beneficio observado se mantiene en los diferentes grados de ERC. Hay poca evidencia para el uso de trata–miento solo con ARA-II en pacientes con ERC en estadio 3 y ausencia de datos sobre el efecto en estadios 4-5.
Bloqueo doble del SRAA: añadir un ARA-IIDe varios estudios se puede concluir que debe considerarse añadir un ARA-II en pacientes con IC crónica que no toleren un ARM, incluso en estadio 3 de ERC28. Los datos en estadio 4 o 5 se limitan a un estu–dio en hemodiálisis29 que demuestra beneficio. Al igual que con los IECA, debe vigilarse de cerca la función renal y los electrolitos.
Antagonistas del receptor de mineralocorticoidesEl estudio RALES incluye un 48% de pacientes con TFGe < 60 ml/ min/1,73 m2, y un análisis posterior demostró que la espironolactona mejoraba el resultado independientemente de la función renal30. En el estudio EPHESUS31 se encontró que la eplerenona no mejoraba la mortalidad por todas las causas con creatinina basal > 1,10 mg/dl. Sin embargo, no hubo interacción con la mortalidad cardiovascular o la hospitalización por IC31. En el estudio EMPHASIS-HF32, el 33% de los pacientes tenían TFGe < 60 ml/min/1,73 m2 y no se alteró el efecto beneficioso de la eplerenona32.
Por tanto, hay evidencia convincente de un beneficio significativo del uso de ARM en IC con insuficiencia renal moderada (estadio 3), pero no hay datos disponibles en estadios 4-5.
Recientes estudios han mostrado que la finerenona, un ARM no esteroideo con mayor selectividad por el receptor de mineralocorti- coides que la espironolactona y una afinidad más fuerte que la eplere- nona, se asocia con una buena tolerancia y reducción de los péptidos natriuréticos, de manera similar que la eplerenona33. Se requieren estudios que confirmen la teórica menor incidencia en la tasa de hiperpotasemia, así como los resultados en eventos clínicos.
Bloqueadores betaLos datos de los estudios MERIT-HF34 y CIBIS-II35 indican que los bloqueadores beta son claramente eficaces en pacientes con TFGe
45 ml/min/1,73 m2, al igual que los estudios SENIORS, COPERNICUS o CAPRICORN36,37. Sin embargo, el número de pacientes con TFGe
30 ml/min/1,73 m2 de estos estudios es muy bajo. A pesar de ello, parece muy probable que el efecto sea el mismo en estadios 4-5.
Es importante recordar que algunos bloqueadores beta tienen excreción renal, como el atenolol, el nadolol o el sotalol, y sería inteli–gente evitar estos fármacos en pacientes con ERC avanzada.
DigoxinaEl estudio DIG38 examinó los efectos de añadir digoxina (con dosis individualizadas) al tratamiento con diurético e iECA en pacientes con IC y FEVI reducida, y encontró que su efecto no se modificaba con la TFGe38. Incluso el efecto era mayor en pacientes con creatinina basal más alta.
Debido a su excreción renal y potencial toxicidad en la ERC, se debe vigilar la concentración sérica de digoxina, además de la función renal y los electrolitos.
IvabradinaPor el efecto farmacológico de la ivabradina, es poco probable que se produzca deterioro de la función renal y no es necesario ajuste de dosis. No hay estudios en pacientes con aclaramiento de creatinina < 15 ml/min/1,73 m2.
Hidralacina-dinitrato de isosorbidaUna alternativa al tratamiento con BSRAA cuando deteriora la fun–ción renal o aparece hiperpotasemia es la dosis fija combinada de hidralazina y dinitrato de isosorbida.
Su efecto se ha investigado en poblaciones que no tenían la ERC como criterio de exclusión (estudios V-HeFT y A-HeFT), y se ha encon–trado efecto beneficioso39. Podrían administrarse a grados más graves de disfunción renal.
Parece justificable cuando nos enfrentamos a pacientes que no toleran los 1ECA o los ARA-II.
Inhibidores duales de la neprilisina y el receptor de la angiotensina (ARNI)Las guías de la Sociedad Europea de Cardiología han incluido recientemente en el arsenal terapéutico de la IC la inhibición dual de la neprilisina y el receptor de la angiotensina (ARNI) con sacubitrilo y valsartán. Su indicación es en la IC sintomática con FEVI < 35% o si el paciente persiste sintomático a pesar de las dosis máximas toleradas según la evidencia con los 1ECA (o ARA-II), bloqueadores beta y ARM5. El estudio PARADIGM demostró que el sacubitrilo-valsartán se asoció con una reducción significativa en la mortalidad y las hospitalizacio–nes comparado con elenalapril40. El sacubitrilo-valsartán permite la inhibición simultánea de la neprilisina y del receptor de la angioten- sina 1. La neprilisina degrada numerosos péptidos vasoactivos endó–genos, incluidos los péptidos natriuréticos, la bradiquinina y la adrenomedulina. La inhibición de la neprilisina aumenta las concen–traciones de estas sustancias, con lo que se incrementa el efecto natriurético y se contrarresta la sobreactivación neurohormonal que contribuye a la vasoconstricción, la retención de sodio y la remodela–ción de mala adaptación en pacientes con IC41.
El 36,2% de los 8.442 pacientes incluidos en el estudio PARADIGM presentaban una TFGe < 60 ml/min/1,73 m2, y ello supone una impor–tante muestra que apoya la eficacia de dicho tratamiento en pacientes con disminución leve-moderada de la función renal. No obstante, los pacientes con TFGe < 30 ml/min/1,73 m2 fueron excluidos del estudio. Por ello la tolerabilidad y la eficacia en este grupo de pacientes con ERC avanzada no quedan claramente establecidas (véase la siguiente sección). Sin embargo, la ficha técnica abre la puerta a su utilización en pacientes con filtrados entre 15 y 30 ml/min/1,73 m2, aunque pro–pone una monitorización estrecha.
Desfibrilador automático implantable (DAI)En los estudios sobre el papel del DAI en la prevención primaria o secundaria de arritmias ventriculares graves, se registró la función renal basal en los estudios MADIT (Multicenter Automatic Defibrillator Implan–tation Trial), MADIT II (Multicenter Automatic Defibrillator Implantation Trial II) y SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial). Los aná–lisis de subgrupos han mostrado42 efectos beneficiosos en todos los pacientes, incluidos aquellos con TFGe en 35-60 ml/min/1,73 m2.
En prevención secundaria estaría indicado un DAI con las indica–ciones apropiadas en pacientes con ERC en estadio 3 y se debería con–siderar en estadios 4 y 5.
En prevención primaria estaría indicado para pacientes con IC de etiología isquémica o no isquémica, con FEVI < 35% y sintomáticos con ERC en estadio 3 y 443. Su indicación para pacientes con ERC ter–minal en hemodiálisis es mucho más controvertida. Un ensayo clínico reciente mostró ausencia de beneficio a largo plazo del implante pro–filáctico de DAI en pacientes con FEVI > 35% en hemodiálisis44.
Terapia de resincronización cardiaca (TRC)En diferentes estudios sobre los efectos de la TRC (CARE-HF, MADIT-CRT, RAFT) que incluían a pacientes con ERC moderada, no se encontró influencia de la TFGe basal en los resultados45. Desde un punto de vista fisiopatológico, la TRC mejora el gasto cardiaco y pro–bablemente la perfusión y la función renales. No hay datos específicos de pacientes con ERC en estadio 4-5 en estos estudios.
Otros tratamientos coadyuvantes en pacientes con ERCAdemás de la prevención de la IC en pacientes con ERC avanzada mediante la restricción de sal, así como de un control óptimo de la presión arterial y la glucemia en los pacientes con diabetes mellitus y la utilización de los fármacos y/o estrategias anteriormente mencio–nadas, se deberá descartar un déficit férrico y tratarlo si se detecta.
Tratamiento del déficit férrico y la anemiaMientras que el tratamiento de la anemia con agentes estimulado–res de la eritropoyesis en pacientes con IC no ha demostrado un bene–ficio en la morbimortalidad, e incluso se ha asociado con más efectos adversos46, el tratamiento con hierro intravenoso (carboximaltosa de hierro) en pacientes con IC, FEVI reducida y déficit de hierro, ya sea con o sin anemia, se asocia con una mejoría clínica47.
Un metanálisis reciente ha mostrado que las hospitalizaciones por IC y la mortalidad disminuyeron significativamente en el grupo tra–tado con hierro, en el que más del 40% tenía TFGe < 60 ml/min/1,73 m2 y deficiencia de hierro (ferritina < 100 mg/dl o índice de saturación de transferrina < 20%) independientemente de las cifras de hemoglo- bina48. Por ello se puede considerar administrar hierro parenteral para los pacientes con IC y ERC, dado el historial de seguridad comprobado en pacientes con ERC avanzada.
Complicaciones renales en pacientes con insuficiencia cardiacaHiperpotasemiaLa hiperpotasemia es frecuente en los pacientes con ERC e IC. En un registro danés que incluyó a 31.649 pacientes con IC, el 39% tuvo algún episodio de hiperpotasemia durante un seguimiento de 2,3 años, con una elevada prevalencia de recurrencia: 2, 3 o 4 episodios durante dicho seguimiento en el 43, el 54 y el 60% de los pacientes respectivamente, con mayor frecuencia según disminuye la TFGe49.
En los pacientes con IC y FEVI reducida, el uso de BSRAA y ARM se asocia con beneficios sustanciales en la morbilidad y la mortalidad cardiovasculares, pero existe elevado riesgo de hiperpotasemia, y es motivo frecuente de la reducción de la dosis de estos fármacos cardio- protectores y nefroprotectores, interrupción de dichos tratamientos y aumento del riesgo de mortalidad50.
Entre las recomendaciones para la prevención y el tratamiento5,51, destaca la restricción del potasio de la dieta, suspensión de los BSRAA en caso de hiperpotasemia grave (> 6 mEq/l), reducir la dosis de BSRAA si el potasio sérico es > 5,5 mEq/l (aunque en la práctica clínica en muchos casos se suspenden) y no iniciarlos hasta que el potasio sérico no esté por debajo de 5 mEq/l, evitar fármacos que puedan interferir en la eliminación de potasio, como los AINE, así como la administración de sales de potasio (cloruro potásico: sal de régimen).
Los tratamientos actuales para quelar el potasio (polestireno sulfo- nato cálcico) son mal tolerados, por lo que las alternativas son la administración de diuréticos del asa en caso de hipervolemia, y sus–pender fármacos cardioprotectores o nefroprotectores (BSRAA o ARM). Existen nuevas opciones terapéuticas para el tratamiento de la hiperpotasemia: patiromer y ciclosilato de zirconio y sodio. Ambos son quelantes con demostradas eficacia y seguridad en el tratamiento de la hiperpotasemia, de los que se ha demostrado en ensayos clínicos su efectividad para normalizar las concentraciones de potasio eleva–das, mantener la normopotasemia a lo largo del tiempo y prevenir las recurrencias de la hiperpotasemia en pacientes con BSRAA y con un buen perfil de seguridad.
De cualquier forma, el tratamiento de la IC en pacientes con ERC debe llevar consigo una monitorización periódica de electrolitos y función renal, especialmente cuando se realicen cambios en el trata–miento diurético o si aparecen complicaciones intercurrentes como vómitos o diarrea, ya que pueden requerir ajustes para evitar tanto la hiperpotasemia como la hipopotasemia.
Deterioro agudo de la función renal en pacientes con insuficiencia cardiacaLa disfunción renal aguda es muy frecuente en la IC. No obstante, los criterios para su definición no son siempre los mismos. La defini–ción más utilizada en la mayoría de los estudios es el aumento de la creatinina sérica > 0,3 mg/dl, aunque en otros trabajos se utiliza el incremento > 0,5 mg/dl o una disminución de la TFGe del 20%. Esta situación es más frecuente en los pacientes con ERC avanzada y cuando se dan otros factores predisponentes, como la diabetes mellitus, la hipertensión arterial o la disfunción diastólica. A estos factores de base se añaden respuestas adaptativas a la hipoperfusión renal y la congestión venosa que hacen que la hipoperfusión sea más acusada.
En muchas ocasiones, y especialmente en la ERC avanzada, durante el inicio de tratamiento con un IECA o un ARA-II, un 10-35% de los pacientes experimentan cierto grado de aumento de la creatinina sérica. El riesgo es similar entre IECA y ARA-II y es mayor con mayores dosis de estos fármacos23.
El efecto de los ARM en el cambio de la TFGe es similar. Tras un descenso inicial, el empeoramiento posterior es paralelo al del grupo placebo52 y la incidencia de disfunción renal clínicamente importante parece ser similar entre ambos grupos.
No obstante, es de interés comentar que no todos los deterioros en la función renal durante el tratamiento de la IC suponen un mal pro–nóstico. El deterioro agudo en la función renal solo se asocia con peor pronóstico si el estado clínico del paciente se deteriora simultánea–mente al deterioro de la función renal, y esto suele ocurrir cuando el paciente está en estado de congestión.
Es decir, si el estado clínico de un paciente mejora o permanece igual, el pronóstico no debe ser desfavorable independientemente de que aumente levemente la creatinina sérica53.
Estas situaciones de mejor pronóstico suelen ocurrir en casos de hemoconcentración, pacientes sin congestión o en pacientes que en el momento del deterioro renal presentan presión arterial baja e inician tratamiento con BSRAA. Incluso la respuesta diurética del paciente se ha planteado como un marcador pronóstico del paciente, haya o no deterioro de la función renal en ese contexto clínico. Este hecho se ha podido demostrar en ensayos clínicos en los que, pese al empeora–miento de la función renal, no hay mayor mortalidad54.
Aunque un deterioro extremo de la función renal puede ser peli–groso, es difícil encontrar el grado exacto de empeoramiento que obli–gue a reducir dosis o a suspender el tratamiento.
Las guías indican5 que es aceptable un aumento hasta un 50% de la creatinina basal o un valor absoluto de creatinina de 3 mg/dl o una TFGe < 25 ml/min/1,73 m2. Cuando empeora la función renal con un BSRAA, se debe suspender todos los posibles nefrotóxicos y valorar disminuir los diuréticos. Si esto no soluciona el problema y empeora aún más, se debe reducir la dosis a la mitad y vigilar la creatinina sérica en 2 semanas. Si la creatinina aumenta más del 100% del basal o hasta ser > 3,5 mg/dl o con una TFGe < 20 ml/min/1,73 m2, se debe suspender el tratamiento.
Por lo tanto, la definición de deterioro renal agudo debe diferen–ciar entre 2 situaciones: una en la que el deterioro renal es un tras–torno transitorio (seudodeterioro renal) que resulta de una terapia intensiva y se sigue de una respuesta favorable de los síntomas y sig–nos de congestión al tratamiento, por lo que no presenta un pronós–tico negativo ya que se acompaña de una respuesta de fondo más per–sistente, y otra en que la disfunción renal aguda se asocia con congestión resistente al tratamiento y se sigue de un resultado con peor pronóstico55. Esta consideración de deterioro renal agudo permi–tiría a los clínicos mejorar su enfoque terapéutico.
En el caso de deterioros importantes en la función renal o más gra–ves, se deberá considerar una serie de factores concurrentes como la administración de otros fármacos potencialmente nefrotóxicos, como algunos antibióticos (aminoglucósidos), contraste radiológico, AINE o dosis muy altas de diuréticos combinados con BSRAA. En estos casos la consulta a un servicio de nefrología se hace imperativa.
Arni: un nuevo tratamiento en la insuficiencia cardiaca con implicaciones en la hemodinámica glomerular y la congestión renalLa gran mayoría de los pacientes con ERC tienen una afección car–diaca1 y es prácticamente universal en los pacientes con ERC avanzada que inician diálisis, que tienen una incidencia de IC el doble que los pacientes sin insuficiencia renal56. Por ello el sacubitrilo-valsartán, a través de su acción sobre el receptor AT1 de la angiotensina II y de incremento del efecto natriurético, sin duda produce beneficio en pacientes con ERC por diversos mecanismos, no todos bien conocidos. Es de interés resaltar que en un análisis secundario con los pacientes del estudio PARADIGM, se observó una disminución de la tasa de dis–minución de la TFGe (-1,3 frente a -1,8 ml/min/1,73 m2 por año; p < 0,0001), especialmente en el subgrupo de pacientes con diabetes mellitus57, incluso después de ajustar por diferencias en la presión arterial durante el tratamiento.
Este hallazgo es particularmente importante, ya que hay gran inte–rés en la utilización de fármacos con beneficio cardiovascular y que además reduzcan la progresión de la ERC, pacientes generalmente excluidos de la mayoría de los ensayos.
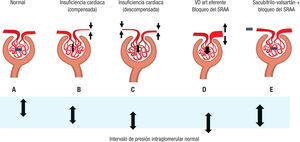
Fisiopatología de la insuficiencia cardiaca y la intervención con sacubitrilo-valsartánEn el paciente con IC (insuficiencia del VI) se produce una dismi–nución del gasto cardiaco y del volumen circulante arterial eficaz o de perfusión efectiva renal, además de en otros tejidos. La congestión venosa, asimismo, contribuye a una menor perfusión renal. Esta dis–minución del volumen de perfusión eficaz implica un descenso de la señal registrada por los receptores de llenado en carótida, arco aórtico y la arteriola aferente glomerular produciéndose una respuesta seme–jante a la de la disminución de volumen para retener sodio y agua y mantener constante el filtrado glomerular. Esta respuesta incluye la activación del sistema nervioso simpático, SRAA y arginina vasopre- sina, un aumento de la sensibilidad a la retroalimentación túbulo- glomerular y vasoconstricción de la arteriola eferente58. Esta situación que ocurre en una IC compensada permite que el filtrado glomerular disminuya solo un tercio o como máximo a la mitad a pesar de la importante disminución de la perfusión renal. La vasoconstricción de la arteriola eferente, inducida por la secreción de renina, permite un incremento en la presión intraglomerular, con incremento en la frac–ción de filtración por nefrona que da como resultado una perfusión renal mantenida58(figura 2B).
Efecto de los bloqueadores del sistema renina-angiotensina (1ECA o ARA-II) en la hemodinámica glomerular en el paciente con insuficiencia cardiaca y efecto del sacu- bitrilo-valsartán. El intervalo de la presión intraglomerular normal viene marcado por la franja azul claro. A: situación normal. B: insuficiencia cardiaca compensada con vaso–constricción de la arteriola eferente para mantener el flujo glomerular. C: insuficiencia cardiaca descompensada con activación extrema del SRAA con vasoconstricción preglome- rular y posglomerular para mantener la presión arterial sistémica y redistribuir el gasto cardiaco disminuido principalmente al cerebro y al corazón. D: efecto de los bloqueadores del SRAA (vasodilatación de la arteriola eferente). E: efecto de sacubitrilo-valsartán con modulación/vasodilatación de la arteriola aferente y modulación/vasoconstricción de la arteriola eferente que consigue una normalización de la presión intraglomerular, en pacientes en los que la perfusión renal o volumen efectivo arterial renal está disminuido. SRAA: sistema renina-angiotensina-aldosterona; VD: vasodilatación.
En cambio, en el paciente con IC descompensada los mecanismos de compensación están incrementados de forma muy importante, con activación extrema del SRAA y del eje neurohormonal que induce una vasoconstricción preglomerular maximizada (junto a la VC pos–glomerular existente), cuyo objetivo es mantener la presión arterial sistémica y redistribuir el gasto cardiaco disminuido principalmente al cerebro y el corazón (figura 2C). En esta situación, el filtrado glome- rular disminuye de manera importante, a pesar de un incremento en la reabsorción de sodio y agua para intentar mantener la perfusión renal, sin que haya incremento en la fracción de filtración por nefrona. La consecuencia es una respuesta maladaptativa con oligoanuria, retención de líquidos y empeoramiento de la congestión58. En este contexto, el único enfoque es intensificar el uso de diuréticos.
Sin embargo, con los diuréticos la mejora de la congestión solo se logra en detrimento del volumen arterial efectivo e hipoperfusión renal, que contribuye al deterioro renal. Es decir, que el deterioro renal se producirá por las consecuencias de la IC descompensada, congestión renal y el tratamiento diurético necesario.
Por lo tanto, el tratamiento de la IC requerirá diuréticos para el tra–tamiento de la congestión (véase «Diuréticos», p. 32), así como el resto de los tratamientos recomendados en las guías (BSRAA, bloqueadores beta, ARM, sacubitrilo-valsartán en las indicaciones aprobadas).
¿Cómo actúa el sacubitrilo-valsartán en el riñón?El sacubitrilo-valsartán, por una parte, obtiene el beneficio deri–vado de la inhibición de la degradación de los péptidos natriuréticos, favoreciendo la excreción de sodio y agua (inhibe la reabsorción de sodio y agua en el túbulo proximal y, además, favorece la excreción de agua libre inhibiendo el efecto antidiurético de la vasopresina en el túbulo distal y colector). Es decir, que tiene efecto en el túbulo proxi–mal y distal. Además, el efecto de potenciación de los péptidos natriu- réticos favorecido aún más por su efecto en la inhibición del SRAA y el sistema nervioso simpático, aumenta la fracción de filtración por nefrona y mantiene o aumenta levemente el filtrado glomerular. Esto se debe a un efecto vasoconstrictor en la arteriola eferente y el efecto vasodilatador en la arteriola proximal y a un incremento en la super–ficie de filtración glomerular por el efecto de los péptidos natriuréti- cos en la relajación del mesangio59(figura 2E).
Como resultado general, se produce un incremento en la presión intraglomerular o, más bien, una «normalización» de la presión intra–glomerular, en pacientes con perfusión renal o volumen efectivo arte–rial renal disminuidos (figura 2). La combinación de efecto natriuré- tico como tratamiento de la congestión renal y la normalización de la presión intraglomerular que estaba disminuida mejora el flujo plas–mático renal y consigue efectos beneficiosos con incremento de la diuresis. Estos mecanismos producen mejoría de la perfusión renal por el efecto hemodinámico en arteriolas aferente y eferente, relaja–ción del mesangio y descenso en la congestión renal (menor presión tubular hidrostática, presión abdominal)60. Este beneficio podría ser mayor en los pacientes con ERC avanzada, ya que podría producir una mejor perfusión en el riñón isquémico. No obstante, esta hipótesis no está demostrada en estudios.
Estos mecanismos que inicialmente pudieran ser contraproducen–tes por un aumento en la presión intraglomerular y sus consecuencias en la progresión renal, son beneficiosos para los pacientes con frac–ción de eyección reducida, ya que en esta situación la perfusión renal está comprometida y lo que producen es normalizar dicha perfusión.
Una prueba de ello es que los pacientes del estudio PARADIGM que recibieron sacubitrilo-valsartán presentaron menor tasa de hiperpo- tasemia grave y menos tiempo para desarrollarla que los que recibie–ron enalapril61. La mejoría de la perfusión renal por el incremento del flujo plasmático renal permitió un mayor intercambio de sodio por potasio que dio como resultado una mayor excreción de potasio uri–naria en el grupo de sacubitrilo-valsartán. Por ello, se puede concluir que la inhibición de la neprilisina con sacubitrilo-valsartán puede atenuar el riesgo de hiperpotasemia cuando los ARM se combinan con otros inhibidores del SRAA en pacientes con IC y FEVI reducida.
La siguiente cuestión es si el aumento de presión intraglomerular producido por el sacubitrilo-valsartán se puede asociar con incre–mento de la albuminuria.
En el estudio PARADIGM los pacientes de ambos grupos partieron de una albuminuria media de 10 mg/g (1,2 mg/mmol). A los 8 meses el grupo de sacubitrilo-valsartán mantuvo el mismo nivel de albumi–nuria y el grupo de enalapril presentó un leve descenso, hasta 7 mg/g (0,9 mg/mmol). Esas mínimas variaciones, siempre dentro del inter–valo de la normalidad (< 30 mg/g) no tienen implicación patológica y pueden deberse a la variabilidad intrínseca de la albuminuria. No obs– tante, y para descartar la posibilidad de incremento de la albuminuria con sacubitrilo-valsartán, se realizó un pequeño ensayo clínico (estu–dio UK HARP III) con 414 pacientes con elevado riesgo de progresión renal y distintos grados de albuminuria62. Se comparó el sacubitrilo- valsartán con el irbesartán 300 mg, y ambos fármacos presentaron efectos similares en la función renal y la albuminuria, sin diferencias significativas en ambos parámetros, aunque en el grupo del sacubi- trilo-valsartán se detectaron efectos beneficiosos adicionales en los péptidos natriuréticos (NT pro-BNP, que era un objetivo secundario). En este estudio solo el 4% de los pacientes tenían IC.
Este estudio demuestra que el sacubitrilo-valsartán no produce incremento de la albuminuria. Aunque en el estudio PARADIGM se asoció con beneficio en la progresión renal, el estudio HARP III no mostró diferencias en la progresión, si bien no estaba diseñado para analizar cambios en la progresión renal. Recientemente un análisis retrospectivo en pacientes que habían utilizado sacubitrilo-valsartán en IC con fracción de eyección reducida demostró una mejoría signifi–cativa en la función renal al año de uso de sacubitrilo-valsartán com–parado con los controles históricos60.
Por lo tanto, se puede decir que el sacubitrilo-valsartán es bien tolerado por los pacientes con ERC, no presenta efecto perjudicial ni en la albuminuria ni en la función renal. Los análisis post-hoc del estu–dio PARADIGM han demostrado que presenta menos tasas de hiper–potasemia y beneficio en la progresión renal, aunque este último aspecto debe analizarse en estudios específicamente diseñados para ello. Queda por definir el efecto en los mismos parámetros en pacien–tes con fracción de eyección conservada, así como los eventos cardio–vasculares. A estos aspectos pueden responder el estudio PARAGON- HF y sus subanálisis.
Por otra parte, la inhibición de la neprilisina puede tener efectos beneficiosos en el riñón independientemente del efecto hemodiná- mico. Experimentos con modelos de nefrectomía 5/6 han indicado que la inhibición de la neprilisina reduce la proteinuria y los marca–dores histológicos de daño renal más que la sola inhibición del SRAA63.
Aunque los efectos del sacubitrilo-valsartán en la función renal no son especialmente relevantes, no excluyen un beneficio en la progre–sión a largo plazo de la evolución de la ERC. No obstante, los efectos en la presión arterial y los biomarcadores cardiacos respaldan la hipóte–sis de que el sacubitrilo-valsartán puede reducir el riesgo de eventos CV (en particular la IC) en pacientes con ERC. Se requieren estudios especialmente diseñados para ello en pacientes con ERC e IC, ya que esta es una de las principales causas de comorbilidad del paciente con ERC y la posible existencia de beneficio podría ayudar a reducir el importante riesgo CV residual de estos pacientes.
Conflicto de interesesJ.L. Górriz declara que ha recibido honorarios por conferencias para Novartis, Janssen, Mundipharma, Astrazeneca y Boehringer- Ingelheim. M. González Rico no tiene conflictos de intereses. J. Núñez declara que ha recibido honorarios por conferencias para Novartis, Rovi, Astrazeneca y Boehringer-Ingelheim.
FinanciaciónCIBER CV 16/11/00420.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «Controversias para una nueva era en el tratamiento de la insuficiencia cardiaca», que ha sido patrocinado por Novartis.