Palabras clave
INTRODUCCIÓN
Debido a la evolución de la cirugía cardiaca y la cardiología, los pacientes pediátricos que antaño fallecían a causa de cardiopatías congénitas (CC) actualmente llegan a la edad adulta. De hecho, en algunos países, el volumen de población adulta con CC reparadas en la infancia supera ya a la población pediátrica1. En los pacientes afectos de transposición de grandes vasos (TGV), las técnicas de reparación fisiológica o intraauricular (Mustard y Senning) han sido empleadas durante más de 20 años2. Ambas técnicas fueron descritas a finales de la década de los sesenta. Dado que la técnica de Senning puede realizarse sin necesidad de emplear material protésico para la reconducción sanguínea, ésta fue la técnica más empleada, dado su potencial de crecimiento. La corrección anatómica (intervención de Jatene o switch arterial) permite evitar el empleo del ventrículo derecho como ventrículo sistémico3 pero, dado que su desarrollo fue posterior (en la década de los setenta), aún son muchos los pacientes que llegan a la edad adulta con alguna técnica intraauricular. Durante la vida adulta, la mayoría de estos pacientes está clínicamente bien, pero algunos, como consecuencia del posible fracaso del ventrículo derecho (sistémico), pueden evolucionar hacia la insuficiencia cardiaca4,5. Los malos resultados obtenidos con otras técnicas quirúrgicas, tales como el switch arterial tardío, convierten al trasplante cardiaco en una buena alternativa terapéutica en caso de que se desarrolle insuficiencia ventricular derecha5,6. La cirugía previa y la alteración en la anatomía auricular dan al trasplante cardiaco una serie de peculiaridades propias y la eventual necesidad de realizar alguna variación técnica.
MÉTODOS
Estudio descriptivo de 4 pacientes (3 mujeres, 1 varón) con TGV y corrección fisiológica, en situación de insuficiencia cardiaca terminal, sometidos a trasplante cardiaco entre 1992 y 2004. Los datos han sido recogidos por revisión de la historia clínica (tabla 1); 3 pacientes presentaban d-TGV y uno de ellos d-TGV, dextrocardia y situs inversus visceroauricular; 3 pacientes presentaban corrección tipo Senning y el restante presentaba corrección tipo Mustard. Ningún paciente tenía hipertensión pulmonar. El intervalo de edades en el momento del trasplante fue 13-25 años. En 3 casos se realizó el implante según técnica bicava y en 1, técnica clásica biauricular.
RESULTADOS
En los pacientes con corrección Senning, la reconducción sanguínea se consigue por medio de la alteración quirúrgica del tabique interauricular y la conexión de la aurícula izquierda (AI), abierta en la desembocadura de las venas pulmonares derechas, con la pared lateral de la aurícula derecha (AD). Esta situación origina que la pared libre de la AD sea, en realidad, la pared libre de la aurícula sistémica. La canulación venosa debe realizarse teniendo en cuenta esta circunstancia. La vena cava superior (VCS) puede ser canulada directamente. El drenaje de la cava inferior (VCI) puede realizarse accediendo directamente a ella, cerca del diafragma, o a través de la vena femoral. Al iniciar la cardiectomía, la primera cavidad a la que se accede es la aurícula sistémica. Tras su apertura se procede a la extracción del neotabique interauricular, para acceder a la aurícula venosa. Tras explantar el tabique, se liberan y se seccionan ambas venas cavas. Finalmente se prepara el remanente de AI, que se secciona circunferencialmente.
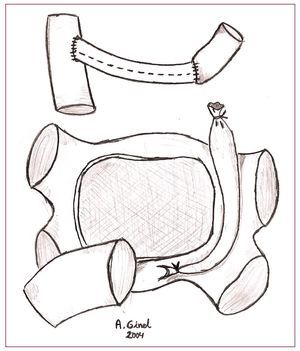
En estos 3 casos, el trasplante cardiaco se realizó según la técnica bicava. En uno de estos pacientes no había vena innominada y persistía la VCS izquierda. En la cirugía se realizó recanalización de ésta hasta la VCS derecha con un conducto protésico (fig. 1).
Fig. 1. Representación de las estructuras mediastínicas realizada la cardiectomía. Se aprecia la reconducción de la sangre por medio de un conducto protésico.
En la corrección Mustard, la reconducción sanguínea se consigue extrayendo el tabique interauricular y formando un túnel en el interior de la aurícula que conecta ambas venas cavas con la válvula mitral. De esta forma las venas pulmonares drenan a la válvula tricúspide. Durante la intervención, el drenaje venoso se consigue mediante la canulación directa de ambas cavas.
En la paciente que presentaba d-TGV y dextrocardia, la corrección tipo Mustard permitía que la sangre venosa se dirigiera desde el lado izquierdo hacia el derecho. La cardiectomía fue realizada manteniendo la recanalización intraauricular, de tal forma que el drenaje venoso quedaba situado a la derecha de la paciente (fig. 2). El trasplante cardiaco se realizó según la técnica biauricular. Durante éste se suturó la AI del donante con el drenaje situado a la izquierda, y la AD del donante, con el drenaje situado a la derecha. Finalizado el implante, el corazón donante quedó situado en posición de mesocardia con levoápex.
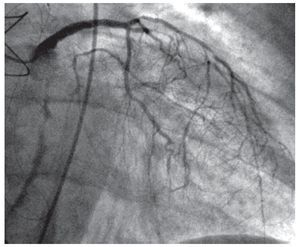
Fig. 2. Representación de las estructuras mediastínicas realizada la cardiectomía. La reconducción tipo Mustard permitió el implante cardiaco según la técnica biauricular.No se produjo ninguna muerte hospitalaria. Una paciente falleció a los 6 años por vasculopatía del injerto (fig. 3). El seguimiento medio ha sido de 75 meses, con los 3 pacientes restantes en clase funcional I de la NYHA e injerto normofuncionante.
Fig. 3. Coronariografía a los 5 años del trasplante cardiaco.
DISCUSIÓN
Hay gran controversia acerca de la evolución a largo plazo de los pacientes con TGV que han sido sometidos a corrección fisiológica. No se conoce con certeza la incidencia con la que se desarrolla fallo del ventrículo sistémico durante el seguimiento. Determinadas series presentan cifras de hasta un 61% de fallo ventricular a los 25 años4, mientras que otras presentan cifras menores, con supervivencia de hasta el 85% a los 32 años7,8.
Las opciones quirúrgicas para el tratamiento de estos pacientes son escasas. La sustitución de la válvula tricúspide generalmente es insuficiente para evitar el deterioro funcional. Otra opción sería la reconversión tardía a switch arterial en dos tiempos: banding de la arteria pulmonar y después deconstrucción de la corrección intraauricular y switch arterial6. En un principio esta técnica presentó unos resultados alentadores. Estudios posteriores, con mayor periodo de seguimiento, permitieron comprobar que la tasa de éxito era inferior al 20% en pacientes mayores de 12 años9. La causa fundamental del fracaso fue la incapacidad del VI de adaptarse a la presión sistémica. Dado que la mayoría de los pacientes en que se desarrolla fracaso ventricular se encuentran entre la segunda y la tercera década de la vida, esta técnica no se considera una alternativa real. Ante esta situación, en los pacientes que evolucionan hacia la insuficiencia cardiaca, el trasplante cardiaco se presenta como una interesante opción terapéutica, aunque todavía no se puede generalizar su empleo por la escasa experiencia que se tiene en este grupo de pacientes9.
El trasplante cardiaco en pacientes adultos con CC presenta una serie de problemas propios: cirugías previas, presencia de material protésico y anomalías anatómicas son las complicaciones fundamentales. La realización del trasplante cardiaco en estas situaciones se ve facilitada por una serie de constantes anatómicas. La AI es una estructura situada en la línea media y que recibe el drenaje de las venas pulmonares. La arteria pulmonar es una estructura situada en la línea media en algún punto de su recorrido mediastínico. La aorta, en su salida del pericardio, se encuentra situada anterior y a la derecha de la arteria pulmonar. Estas constantes anatómicas permiten la realización del trasplante cardiaco en prácticamente cualquier tipo de CC10.
La preparación del retorno venoso es el elemento fundamental en estas situaciones. En pacientes intervenidos con técnica de Senning, se debe prestar especial atención a esta circunstancia, ya que la estructura más anterior del mediastino es la aurícula sistémica. Ambas venas cavas quedan en su interior, en una situación más profunda.
En el caso de la paciente con situs inversus y dextrocardia, el trasplante cardiaco de un corazón normal constituye un gran reto. La recolocación del drenaje venoso es la clave de la intervención10. Diversos autores han propuesto la posibilidad de trasladar la sangre desde el lado izquierdo al derecho por medio de conductos protésicos10,11. En nuestro caso, debido a la presencia de una recanalización tipo Mustard, la reconducción venosa ya estaba realizada. La cardiectomía se hizo preservando esta reconducción, que permitió el implante cardiaco sin grandes alteraciones.
El trasplante cardiaco en pacientes con CC complejas puede realizarse con resultados semejantes a los obtenidos en la población normal. Es fundamental conocer las cirugías realizadas con anterioridad, la anatomía resultante de las mismas y las variaciones propias de cada paciente, para poder planear cada intervención.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. C. Muñoz-Guijosa.
Servicio de Cirugía Cardíaca. Hospital de la Santa Creu y de Sant Pau. Sant Antoni Maria Claret, 167. 08025 Barcelona. España.
Correo electrónico: cmunozg@santpau.es
Recibido el 11 de marzo de 2008.
Aceptado para su publicación el 12 de mayo de 2008.