Palabras clave
VALORACIÓN PRONÓSTICA
El bloqueo auriculoventricular (BAV) secundario a fármacos se ha considerado clásicamente un cuadro de buen pronóstico y con baja tasa de recurrencia. Sin embargo, Zeltser et al1, al analizar la evolución de 92 pacientes con BAV secundario a bloqueadores beta o antagonistas del calcio, han encontrado que un 56% de estos pacientes tiene un BAV recurrente en ausencia de fármacos. Sólo en un 15% de los casos el bloqueo es realmente causado por la medicación, mientras en los casos restantes los fármacos desenmascaran un trastorno de la conducción preexistente. Por ello, estos pacientes requieren un seguimiento clínico estrecho tras la retirada del fármaco.
El valor pronóstico de la presencia de extrasístoles ventriculares (EV) durante el ejercicio, en pacientes asintomáticos, es controvertido. Morshedi-Meibodi et al2 analizan la evolución clínica de 2.885 pacientes, incluidos en el estudio Framingham, durante un período de seguimiento de 15 años. En esta población asintomática, un 27% presenta extrasistolia con el ejercicio en una ergometría de cribado. La presencia de EV se relacionó con un incremento significativo de la mortalidad (riesgo relativo [RR] = 1,86; intervalo de confianza [IC] del 95%, 1,24-2,79 para los EV infrecuentes, y 1,71, IC del 95%, 1,18-2,49 para los EV frecuentes frente a la ausencia de EV), que fue independiente del grado de disfunción ventricular o los cambios isquémicos en el segmento ST.
Otro de los factores asociados con un incremento de la mortalidad en pacientes asintomáticos es el balance simpático/parasimpático. Jouven et al3 lideran un grupo francoitaliano que analiza la evolución de 5.713 pacientes sin enfermedad cardiovascular detectable sometidos a una ergometría. Tras un seguimiento medio de 23 años, 81 pacientes fallecieron súbitamente. El riesgo de muerte súbita fue mayor en los pacientes con una frecuencia cardíaca en reposo > 75 lat/min (RR = 6,18; IC del 95%, 2,37-16,11), en los que tenían un incremento de la frecuencia con el ejercicio inferior a 89 lat/min (RR = 3,92; IC del 95%, 1,91-8,00), y en los que tenían una disminución de la frecuencia cardíaca menor de 25 lat/min tras la finalización del ejercicio (RR = 2,20; IC del 95%, 1,02-4,74). Esta asociación con el incremento en la tasa de muerte súbita se mantuvo en el análisis multivariable.
Ninguno de estos 2 artículos tiene una repercusión clínica inmediata, pero aportan datos sobre el riesgo de muerte súbita en la población asintomática; hay que recordar que es en estos pacientes en los que se producen un mayor número de muertes súbitas en términos absolutos. Quizás en un futuro tengamos más datos que nos permitan diseñar estrategias destinadas a su prevención.
ENFERMEDADES HEREDITARIAS
Durante los últimos años, los análisis genéticos han logrado identificar una serie de entidades relacionadas con la muerte cardíaca súbita. Es mucho lo que se ha avanzado en el conocimiento del QT largo, el síndrome de Brugada o la displasia arritmogénica. Sin embargo, nuestros conocimientos distan mucho de ser completos. Una prueba de ello es el artículo de Chugh et al4 que valoran, mediante un análisis genético exhaustivo, a 12 pacientes con muerte cardíaca súbita inexplicable. Únicamente se encontró un gen HERG anormal en 2 pacientes; en el resto no se encontró ninguna anomalía genética conocida. Probablemente estamos todavía muy lejos de que el análisis genético sirva para identificar a las subpoblaciones de mayor riesgo de muerte cardíaca súbita en la población general.
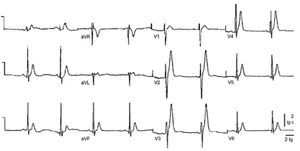
Recientemente se ha caracterizado el síndrome de QT corto como una entidad que produce un intervalo QT en el electrocardiograma < 300 ms (fig. 1), ondas T picudas y un alto riesgo de muerte cardíaca súbita5. Los estudios invasivos han demostrado que se asocia con un período refractario efectivo ventricular corto y con la inducibilidad de arritmias ventriculares. Ramón Brugada6 es el primer genetista que lo ha relacionado con una mutación en el gen que codifica la Ikr (KCNH2), lo que produce un marcado incremento en esta corriente celular. Gaita et al7 analizan el efecto de diferentes fármacos antiarrítmicos en 6 pacientes con el síndrome. Únicamente la quinidina prolongaba de forma significativa el intervalo QT.
Fig. 1. Ejemplo de un paciente con síndrome de QT corto. El QT corregido mide 293 ms. Tomado con permiso de Brugada et al6.
También ha habido avances en el síndrome de QT largo. Etheridge et al8 demuestran en 8 pacientes con síndrome de QT largo de tipo 2 (el determinado por un gen HERG anormal, que codifica el canal del Ikr) que el tratamiento con suplementos de potasio y espironolactona produce una mejoría en el patrón de repolarización de estos pacientes. El estudio no tiene seguimiento y no hay datos que avalen una disminución de eventos arrítmicos, pero es un paso más en el tratamiento específico de las diferentes anomalías genéticas causantes del QT largo.
Muchas de las arritmias que ocurren en el síndrome de QT largo se producen durante períodos de estrés emocional o físico. Por el contrario, en el síndrome de Brugada son más frecuentes cuando predomina el tono vagal; además, los agonistas adrenérgicos disminuyen las alteraciones de la repolarización, mientras que los agonistas parasimpáticos las aumentan. La razón de este dato clínico no se entendía muy bien. Kies et al9 investigaron la función presináptica y postsináptica en 9 pacientes con síndrome de Brugada de forma no invasiva, mediante tomografía por emisión de positrones (PET). La recirculación presináptica de noradrenalina se encontraba aumentada en los pacientes con síndrome de Brugada frente a los controles (92,9 ± 16,2 frente a 69,1 ± 14,2 ml/g; p = 0,05); mientras que la densidad de receptores postsinápticos fue similar en pacientes y controles (10,4 ± 6,7 frente a 10,2 ± 2,9 pmol/g; p = NS). Estos hallazgos confirman la hipótesis de un disbalance autonómico en el síndrome de Brugada que explica en parte los hallazgos clínicos.
El síndrome de Brugada se ha descrito clásicamente como una enfermedad eléctrica primaria en la que no hay alteraciones estructurales. Sin embargo, el grupo de Martin Borggrefe10 ha estudiado mediante resonancia magnética a 20 pacientes consecutivos, comparándolos con un grupo control. El área del tracto de salida del ventrículo derecho fue significativamente mayor en los pacientes con Brugada (11 frente a 9 cm2; p = 0,018), y también había una tendencia hacia un mayor volumen telediastólico, telesistólico y una menor fracción de eyección del ventrículo derecho (p = 0,3, p = 0,08, y p = 0,06, respectivamente). Se encontró una señal intramiocárdica similar a la grasa en 4 (20%) pacientes con Brugada y en ningún control, mientras que no se encontró diferencias en ningún parámetro del ventrículo izquierdo. Son pocos pacientes y los resultados no son espectaculares, pero éste es el primer trabajo que describe anomalías estructurales en pacientes con síndrome de Brugada.
Respecto al pronóstico y la estratificación de riesgo en esta población, Eckardt et al11 publican un seguimiento largo (40 ± 50 meses) de 212 pacientes con un patrón electrocardiográfico de tipo 1 (un patrón electrocardiográfico de ascenso del segmento ST > 2 mm y convexo hacia arriba). De ellos, 123 (58%) pacientes se encontraban asintomáticos en el momento del diagnóstico, 63 (31%) habían presentado un síncope y 24 (11%) habían sido resucitados de un episodio de fibrilación ventricular (FV). En 125 (59%) pacientes, el patrón electrocardiográfico apareció de forma espontánea, mientras que en el resto lo hizo tras la administración de un fármaco antiarrítmico del grupo I. La elevación del segmento ST fue significativamente mayor en el grupo de pacientes sintomáticos (2,3 ± 1,2 frente a 1,9 ± 1,5; p = 0,04). Durante el seguimiento, 4 (17%) de los pacientes con FV previa y 4 (6%) de los pacientes con síncope tuvieron un nuevo evento arrítmico, mientras que tan sólo 1 (0,8%) paciente asintomático presentó su primer episodio de arritmia; 4 (44%) de los 9 pacientes que recurrieron no fueron inducibles en el estudio electrofisiológico (EEF). Globalmente, la tasa de recurrencia de la arritmia es baja, en especial en pacientes asintomáticos. El antecedente de muerte súbita o síncope, y la presencia de un patrón del tipo 1 en el electroencefalograma (ECG) en ausencia de fármacos se relacionaron con el pronóstico, mientras que en esta población de tan bajo riesgo el EEF no aportó información adicional.
El tratamiento actual del síndrome de Brugada pasa por implantar un desfibrilador automático implantable (DAI) en pacientes sintomáticos. Belhassen et al12 analizan la eficacia del bisulfato de quinidina (dosis 1.483 ± 240 mg) en la prevención de FV inducida o espontánea en 25 pacientes con síndrome de Brugada. De ellos, 15 habían presentado síntomas (7 episodios de muerte súbita y 7 síncope) y todos ellos eran inducibles en el EEF. La quinidina previno la inducibilidad de FV en 22 de los pacientes (88%), y tras un seguimiento entre 6 meses y 22 años, los 19 pacientes que recibieron quinidina se encontraba libres de eventos arrítmicos. Cabe destacar que un 36% de los pacientes no toleró el tratamiento crónico con quinidina. Éste es un estudio pequeño y no aleatorizado, no tiene fuerza suficiente para cambiar nuestra práctica clínica actual; sin embargo, resalta el valor de este viejo fármaco en pacientes con síndrome de Brugada. La quinidina puede ser una opción para reducir el número de eventos13 o una alternativa al DAI en países subdesarrollados.
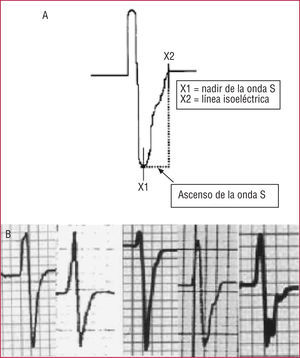
La displasia arritmogénica del ventrículo derecho (DAVD) es una enfermedad poco frecuente, en la que el diagnóstico suele ser complicado. Nasir et al14 analizan las alteraciones electrocardiográficas en 50 pacientes con DAVD, comparándolos con controles sanos y pacientes con taquicardias del tracto de salida del ventrículo derecho. El bloqueo de rama derecha (BRD) está presente en 11 pacientes (22%), mientras que la inversión de la onda T de V1 a V3 se observó en el 85% de los pacientes con DAVD que no tenían BRD, frente a ningún paciente del grupo control. Un 33% de los pacientes con DAVD tenía ondas épsilon en el ECG, mientras que un complejo QRS mayor de 110 ms se encontraba presente en el 64% de los pacientes. Los autores describen un nuevo criterio electrocardiográfico, una porción ascendente de la onda S de V1 a V3 > 55 ms, en ausencia de BRD (fig. 2). Este nuevo criterio es el más prevalente (95%) en los pacientes con DAVD y se correlaciona con la severidad de la enfermedad y la inducibilidad de arritmias en el EEF. Además, es el parámetro electrocardiográfico que mejor discrimina entre pacientes con DAVD y con taquicardia ventricular (TV) de tracto de salida derecho.
Fig. 2. Un nuevo criterio electrocardiográfico para el diagnóstico de la DAVD. Una porción ascendente de la onda S de V1 a V3 mayor de 55 ms, en ausencia de BRD, identifica a los pacientes con DAVD. BRD: bloqueo de rama derecha; DAVD: displasia arritmogénica del ventrículo derecho. Tomado con permiso de Nasir et al14.
Yoerger et al15 analizan los hallazgos ecocardiográficos de 29 pacientes con un nuevo diagnóstico de DAVD. Las dimensiones del ventrículo derecho son mayores en los pacientes con DAVD que en los controles, mientras que la fracción de eyección (FE) es menor. El tracto de salida es la zona más frecuentemente dilatada, con unas medidas de 37,9 ± 6,6 frente a 26,2 ± 4,9 mm (p = 0,00001). Se encontró un diámetro del TSVD > 30 mm en el 89% de los pacientes con DAVD frente al 14% en los controles. Otros hallazgos en pacientes con DAVD fueron la presencia de trabeculaciones en el ventrículo derecho (54%), bandas moderadoras (34%) y saculaciones (17%).
SÍNCOPE
Hay pocos datos en la bibliografía sobre la historia natural de los pacientes con síncope; además, una buena parte de los trabajos publicados no refleja la historia natural real, al haberse empleado diferentes fármacos durante el seguimiento. Baron-Esquivias et al16 han analizado la evolución de 334 pacientes con un síncope vasovagal y un tilt-test anormal. Ningún paciente recibió tratamiento farmacológico específico y todos fueron tratados únicamente mediante consejos posturales. Tras un seguimiento medio de 30,4 ± 21 meses, ningún paciente falleció y un total de 101 (30,2%) experimentaron al menos una recurrencia, que no se vio influida por el tipo de respuesta durante el tilt-test o por la edad. El principal factor pronóstico durante el seguimiento fue el número de episodios de síncope previos al test de basculación. Los pacientes que presentaron más de 5 episodios tuvieron una mayor frecuencia de recurrencia (el 25,1 frente al 44%; p = 0,001) y un intervalo libre de síntomas menor (39,6 frente a 54,1 meses; p = 0,0005).
Durante el último año varios estudios han analizado el valor diagnóstico del Holter insertable. Quizás el más relevante es el publicado por Solano et al17 al frente de un grupo multicéntrico italiano. Estos autores analizan de manera prospectiva un total de 2.052 pacientes con síncope; de ellos, 371 (18%) tiene un diagnóstico sin aclarar tras la valoración inicial. En 103 pacientes (5% del grupo total y 28% del grupo de síncope inexplicado) se implantó un Holter insertable; 38 (37%) tenían cardiopatía estructural y 65 (63%), no. Tras un seguimiento medio de 13 meses se registró un episodio sincopal en 52 (50%) pacientes, con una incidencia de síncope igual en pacientes con y sin cardiopatía. Sin embargo, el mecanismo del síncope fue diferente, los pacientes con cardiopatía tuvieron un BAV paroxístico con mayor frecuencia (34 frente a 13%; p < 0,01) y una mayor incidencia de taquicardia como causa del síncope (13 frente a 0%; p < 0,05). Por el contrario, la incidencia de síncope neuromediado fue superior en los pacientes sin cardiopatía (el 31 frente al 10%; p < 0,02).
FIBRILACIÓN AURICULAR
La fibrilación auricular (FA) es la arritmia sostenida más frecuente y tiene un impacto enorme en el sistema sanitario, en todos sus aspectos. Cada año es uno de los temas que más atención recibe en las revistas médicas desde múltiples enfoques.
Singh et al18 publican en el New England Journal of Medici ne los resultados del estudio SAFE-T (Sotalol Amiodarone Atrial Fibrillation Efficacy Trial); en este trabajo se analiza el valor de los dos fármacos más empleados para restaurar y mantener el ritmo sinusal. En este estudio se aleatorizó a 655 pacientes con FA persistente a recibir amiodarona (267 pacientes), sotalol (261) o placebo (137). Tras 28 días de tratamiento, los pacientes que continúan en FA recibieron una cardioversión eléctrica. La reversión a ritmo sinusal en los primeros 28 días del estudio ocurrió en un 27,1% en el grupo de la amiodarona, un 24,2% en el grupo de tratamiento con sotalol y un 0,8% con placebo (p = 0,45 amiodarona frente a sotalol y p < 0,001 ambos fármacos frente a placebo). La mediana de tiempo hasta la primera recurrencia fue de 487 días en el grupo de la amiodarona, 74 días en el grupo del sotalol y 6 días en el grupo placebo (análisis por intención de tratar, p < 001 amiodarona frente a sotalol y p < 0,001 ambos fármacos frente a placebo). En el subgrupo de pacientes con cardiopatía isquémica, la mediana de tiempo hasta la primera recurrencia fue de 569 días con amiodarona y 428 con sotalol, sin que hubiera diferencias estadísticamente significativas entre ambos fármacos (p = 0,53). El mantenimiento del ritmo sinusal se asoció con una mejoría en los tests de calidad de vida y en la capacidad de ejercicio, pero no en la mortalidad ni en otros eventos clínicos.
Para el tratamiento de episodios paroxísticos de FA, muchos cardiólogos recomendaban a sus pacientes la dosis única de fármacos antiarrítmicos; esta estrategia se había testado en estudios con un número bajo de pacientes hospitalizados. Alboni et al19 publican un trabajo en el que analizan la eficacia de la flecainida o la propafenona en dosis única para el tratamiento de episodios de FA bien tolerada. Analizan el resultado en 268 pacientes, que acuden a urgencias y son sometidos a una prueba de eficacia hospitalaria con el fármaco, bajo control durante al menos 8 h; en 58 pacientes no se continuó el estudio por ineficacia del fármaco o efectos secundarios en esta primera fase, y los restantes 210 pacientes fueron seguidos ambulatoriamente. Tras un período de seguimiento medio de 15 ± 5 meses, 165 pacientes (79%) presentaron 618 episodios de arritmia; de ellos, 569 (92%) fueron tratados; el tratamiento fue eficaz en 534 episodios (94%). El tiempo medio de desaparición de los síntomas de FA fue de 113 ± 84 min y los fármacos fueron efectivos en todos los episodios de FA en el 84% de los pacientes. Los efectos secundarios fueron raros (7% en total), únicamente 1 paciente presentó un episodio de aleteo auricular con respuesta ventricular rápida, mientras que 11 pacientes tuvieron efectos secundarios no cardíacos. Estos resultados avalan la estrategia del tratamiento ambulatorio de episodios de FA, pero hay que ser muy cuidadoso con su generalización. Primero hay que recordar que el estudio excluye a pacientes con preexcitación, un complejo QRS más ancho de 120 ms, episodios mayores de 7 días, cardiopatía isquémica, miocardiopatía dilatada o hipertrófica, un episodio previo de insuficiencia cardíaca, enfermedad valvular, cor pulmonale, FE < 50%, QT largo, síndrome de Brugada, enfermedad del seno, bloqueo AV, embolismos previos, enfermedades agudas y crónicas, insuficiencia hepática o renal, embarazo o sospecha de embarazo, hipopotasemia previa o intolerancia a los fármacos empleados. Además, recordar que todos los pacientes fueron sometidos a un primer período de control de al menos 8 h, lo que permitió identificar a aquellos en los que el tratamiento no fue eficaz (15%) o que tuvieron efectos secundarios con la medicación (5%).
Un subestudio del CAPRICORN (Carvedilol Post-Infarct Survival Control in LV Dysfunction)20 ha analizado la eficacia del carvedilol, añadido a un inhibidor de la enzima de conversión de la angiotensina (IECA), para reducir los episodios de arritmias auriculares después de un infarto agudo de miocardio (IAM). Se aleatorizó a un total de 1.959 pacientes con disfunción ventricular tras un IAM, y en tratamiento con IECA, a carvedilol o placebo. El carvedilol fue eficaz para reducir el número de arritmias auriculares (FA o aleteo) (el 2,3 frente al 5,4%; RR = 0,41; IC del 95%, 0,25-0,68; p = 0,0003). También redujo el número de arritmias ventriculares (el 0,9% frente al 3,9%; RR = 0,24; IC del 95%, 0,11-0,49; p = 0,0001). Este estudio confirma el potente efecto antiarrítmico de los bloqueadores beta en pacientes post-IAM.
El desarrollo de nuevos fármacos antiarrítmicos, destinados específicamente a tratar arritmias auriculares, continúa. Roy et al21 comunicaron en la última reunión de la Heart Rhythm Society los resultados del estudio ACT I, que estudia la eficacia de un nuevo fármaco antiarrítmico (RSD 1235) para revertir episodios de FA. Se trata de un estudio aleatorizado, doble ciego y controlado con placebo que incluye a 356 pacientes con FA de 3 h a 45 días de duración. El objetivo primario fue la conversión a ritmo sinusal en 90 min, que se alcanzó en un 52% de pacientes con el fármaco frente al 4% con placebo (p < 0,0001). La mediana de tiempo para pasar a ritmo sinusal fue de únicamente 11 min. No hubo episodios de torsión de puntas y los principales efectos secundarios fueron alteraciones del gusto, estornudos y parestesias. El interés de este nuevo fármaco es que tiene una acción selectiva en el miocardio auricular, prolongando sus períodos refractarios sin apenas modificar los ventriculares. De esta forma se espera que quede libre de proarritmia ventricular.
Siguiendo el camino abierto por Hernández Madrid et al22 en 2002, son muchos los estudios que han analizado el valor de los fármacos no antiarrítmicos para prevenir los episodios de FA. Un subestudio del estudio LIFE (Losartan Intervention For End point reduction in hypertension)23 analiza la incidencia de episodios de FA de nueva aparición en pacientes hipertensos, con criterios electrocardiográficos de crecimiento del ventrículo izquierdo. Un total de 9.193 pacientes fueron aleatorizados a losartán o atenolol para el control de su hipertensión arterial (HTA) y seguidos una media de 4,8 ± 1 años. Apareció FA en 150 pacientes que recibieron losartán y 221 que recibieron atenolol (el 6,8% frente al 10,1%; RR = 0,67; IC del 95%, 0,55-0,83; p = 0,001), pese a que el control de la presión arterial fue similar en ambos grupos. Además, los pacientes que recibieron losartán se mantuvieron más tiempo en ritmo sinusal (1,809 ± 225 frente a 1,709 ± 254 días; p = 0,057) y tuvieron un riesgo menor de ACV agudo, eventos cardiovasculares u hospitalización por insuficiencia cardíaca.
También las estatinas han demostrado un papel en la reducción de la incidencia de FA en pacientes con FE deprimida. Hanna presentó en el último congreso de la Heart Rythm Society los resultados del registro Advancent, que incluye a más de 25.000 pacientes. Un total de 7.027 (27%) pacientes desarrolló FA durante el seguimiento, sin que hubiera diferencias entre los pacientes con valores lipídicos normales y con valores elevados pero no tratados (el 32,8 frente al 32,6%); sin embargo, los pacientes tratados con estatinas tuvieron una prevalencia de FA del 25%, lo que representa una disminución total del 23% (p < 0,001). Este efecto beneficio de las estatinas se mantuvo tras ajustar los casos en función de la edad, el sexo, la diabetes mellitus, la etiología de la cardiopatía, la clase funcional o la terapia con bloqueadores beta, IECA o antagonistas del receptor de la angiotensina 2, y probablemente refleja el efecto beneficioso de este tipo de fármacos para atenuar los procesos inflamatorios y reducir el estrés oxidativo.
DESFIBRILADOR AUTOMÁTICO IMPLANTABLE
El valor del DAI en la prevención primaria de pacientes postinfarto ha sido estudiado por los estudios MADIT I y II (Multicenter Automatic Defibrillator Implantation Trial); sin embargo, su utilidad en pacientes con miocardiopatía dilatada no había sido analizada en un estudio amplio. El estudio DEFINITE (Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation)25 incluyó a 458 pacientes con miocardiopatía dilatada idiopática, una FE < 36% y EV o episodios de taquicardia ventricular no sostenida, que fueron aleatorizados a DAI o placebo. Tras un seguimiento medio de 29 ± 14,4 meses, la mortalidad súbita se redujo significativamente en el grupo que recibió un DAI (3 muertes frente a 14 en el grupo placebo; RR = 0,2; IC del 95%, 0,06-0,71; p = 0,006). Hubo una tendencia hacia la reducción de la mortalidad total favorable al grupo del DAI que, sin embargo, no alcanzó significación estadística (7,9 frente a 14,1%; RR = 0,65; IC del 95%, 0,4-1,06; p = 0,08). La falta de eficacia del DAI en reducir la mortalidad total se ha intentado explicar por el relativamente pequeño tamaño de la muestra y por una menor incidencia de muerte súbita durante el seguimiento, muy inferior al 50% esperado.
El segundo gran estudio con DAI publicado en los últimos meses es el SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial)26. Analiza la evolución de 2.521 pacientes con insuficiencia cardíaca, clase funcional II o III de la NYHA y una FE < 35% que fueron aleatorizados a tratamiento convencional y placebo (n = 847), tratamiento convencional y amiodarona (n = 845) o tratamiento convencional y DAI (n = 829). El DAI se programó en una única zona y solamente con terapias de desfibrilación, mientras que la amiodarona y el placebo se administraron de forma doble ciego. Tras un seguimiento medio de 45,5 meses se registraron 244 (29%) muertes en el grupo placebo, 240 (28%) en el grupo con amiodarona y 182 (22%) en el grupo del DAI (fig. 3). La amiodarona no proporcionaba ninguna ventaja en la mortalidad respecto al placebo, mientras que el DAI logró una reducción del 23% en la mortalidad total (RR = 0,77; IC del 97,5%, 0,62- 0,96; p = 0,007). La reducción de mortalidad en términos absolutos fue de 7,2% al cabo de 5 años. El beneficio obtenido con el DAI fue el mismo en pacientes con miocardiopatía isquémica o dilatada.
Fig. 3. Curva de supervivencia del estudio SCD-HeFT. Los pacientes aleatorizados a amiodarona o placebo tienen una curva superponible. El grupo con DAI tiene una supervivencia significativamente mejor. DAI: desfibrilador automático implantable; HR: hazard ratio; IC: intervalo de confianza. Reproducido con permiso de Bardy et al26.
Para reducir el número de choques durante el seguimiento del paciente con DAI, clásicamente se había recurrido al tratamiento con bloqueadores beta o amiodarona, aunque había pocos datos en la bibliografía que compararan ambos tratamientos. Durante el último congreso del American College of Cardiology se presentaron los resultados del estudio OPTIC (The Optimal Pharmacological Therapy in Implantable Cardioverter Defibrillator)27, en el que se aleatoriza a 412 pacientes con un DAI bicameral a recibir un bloqueador beta, un bloqueador beta y amiodarona o sotalol. La amiodarona en combinación con un bloqueador beta redujo la incidencia de choques un 73% en comparación con el tratamiento aislado con bloqueadores beta, tanto de choques apropiados como inapropiados. El sotalol se mostró menos efectivo y peor tolerado que la asociación de amiodarona y bloqueadores beta.
Sin embargo, por desgracia, durante los últimos meses también se han producido una serie de avisos de seguridad, recalls, en varias familias de dispositivos implantables28-31. El recall, algo habitual en la industria farmacéutica, no es tampoco algo nuevo en los marcapasos y desfibriladores, pero la variedad de problemas detectados durante los últimos meses y la repercusión clínica que han tenido han abierto un debate sobre el manejo de la información y el seguimiento postimplante de estos dispositivos. Necesitamos mejores sistemas de seguimiento de los marcapasos y desfibriladores, que permitan detectar precozmente los problemas que puedan aparecer durante el seguimiento. Además, se deben regular las obligaciones de las compañías de electromedicina a la hora de informar a los médicos, y también establecer las posibles responsabilidades de los médicos, las instituciones sanitarias y las propias compañías en el seguimiento de los dispositivos.
RESINCRONIZACIÓN CARDÍACA
La novedad más importante de los últimos meses en resincronización cardíaca es la publicación del CARE-HF (Cardiac Resynchronization-Heart Failure trial)32. En él se aleatoriza a 813 pacientes en grado funcional III-IV y disfunción sistólica a ser tratados únicamente con fármacos, o a recibir un dispositivo de resincronización. El objetivo primario fue la mortalidad por cualquier causa y el ingreso por causas cardiovasculares mayores; la mortalidad total fue un objetivo secundario. Tras un seguimiento de 29,4 meses, un número significativamente menor de pacientes tratados con el dispositivo alcanzó el objetivo primario, 159 frente a 224 (el 39 frente al 55%; RR = 0,63; IC del 95%, 0,51-0,77; p < 0,001). La mortalidad total también ocurrió en un número menor de pacientes aleatorizados a recibir un resincronizador, 82 frente a 120 pacientes (el 20 frente al 30%; RR = 0,64; IC del 95%, 0,48-0,85; p < 0,002). La resincronización cardíaca redujo la asincronía interventricular, el volumen telesistólico, el área de insuficiencia mitral, aumentó la FE y mejoró los síntomas y los resultados del test de calidad de vida (p < 0,01 para todas las comparaciones).
Una de las novedades más significativas del estudio es que incorpora criterios ecocardiográficos de selección de pacientes; para aquellos con un QRS entre 120 y 149 ms se requería un tiempo preeyectivo aórtico > 140 ms, una asincronía interventricular > 40 ms o un retraso en la activación de la pared posterior del ventrículo izquierdo. No disponemos todavía del subanálisis ecocardiográfico del estudio CARE-HF, pero será muy interesante conocer el grado de mejoría en función de los parámetros basales.
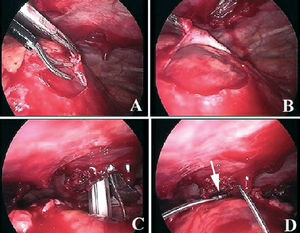
El implante de un dispositivo de resincronización es, con frecuencia, un procedimiento laborioso y complejo; la tasa de fracaso oscila entre el 5 y el 12%. En esta revista se ha publicado una serie muy interesante, que describe el abordaje del electrodo epicárdico mediante una toracotomía mínimamente invasiva asistida por toracoscopia33. Se describen los casos de 14 pacientes con un tiempo medio de procedimiento de 92,4 ± 31 min, sin complicaciones y únicamente en un caso se requirió una toracotomía completa para completar el procedimiento (fig. 4).
Fig. 4. Imagen de videotoracoscopia para el implante de un electrodo en el ventrículo izquierdo. A: apertura del pericardio parietal. B: exposición de la cara lateral del ventrículo izquierdo. C y D: implante del electrodo. Reproducido con permiso de Fernández et al33.
También se han publicado los resultados del estudio SCAR (Spanish Cardiac Resynchronisation Study)34, un estudio multicéntrico español que trata de identificar criterios de falta de respuesta a la terapia de resincronización. En él se analiza a 197 pacientes consecutivos, un 34% isquémicos, con una FE media de 27 ± 7 y una anchura del QRS media de 165 ± 26 ms. Define a los pacientes no respondedores como aquellos que fallecen por insuficiencia cardíaca, precisan un trasplante cardíaco o no mejoran un mínimo del 10% en el test de los 6 min. Tr as un seguimiento de 6 meses, la tasa de no respuesta fue del 20%. El análisis multivariable muestra que los predictores de falta respuesta fueron la presencia de cardiopatía isquémica (RR = 2,9; IC del 95%, 1,2-7; p = 0,023), insuficiencia mitral severa (RR = 3,5; IC del 95%, 1,3-9; p = 0,014) y la presencia de un diámetro telediastólico > 75 mm (RR = 3,1; IC del 95%, 1,1 a 8; p = 0,026). Los pacientes que cumplían estos 3 criterios tenían una probabilidad de respuesta favorable de tan sólo el 27%.
ABLACIÓN CON CATÉTER
La mayor parte de la actividad investigadora en el campo de la ablación con catéter sigue centrada en la FA. En este sentido, se ha publicado por primera vez un estudio multicéntrico aleatorizado en el que se compara la ablación con los fármacos antiarrítmicos como primera opción terapéutica, y al año se ha encontrado una tasa de recurrencia menor (el 13 frente al 63%; p < 0,001) y una calidad de vida mejor en los pacientes tratados con ablación35. Al mismo tiempo, durante 2004 se publicó un registro mundial con la participación de 181 centros, que recogió para el año 2002, 5.050 procedimientos de ablación de FA36. Este registro muestra cómo ha ido evolucionando la técnica, desde la ablación lineal de la aurícula derecha en 1995-1997, la ablación del foco desencadenante en 1998 y 1999, hasta la desconexión de múltiples venas pulmonares en 2000-2002, con una mediana de procedimientos por centro para ese período de 37. En ese registro, aproximadamente un 25% de los pacientes requirió más de un procedimiento de ablación, un 50% de los pacientes se encontró asintomático sin fármacos antiarrítmicos y un 25% se encontró asintomático con fármacos antiarrítmicos previamente inefectivos. Las complicaciones se situaron en torno al 6%. Otros autores también han encontrado una elevada eficacia del procedimiento, que se considera incluso de elección en algunos pacientes. Sin embargo, al mismo tiempo se ha demostrado la existencia de algunas limitaciones para evaluar la eficacia del procedimiento, que sugieren que se ha podido sobrestimar ésta cuando sólo se evalúa la sintomatología referida por el paciente. Así, hasta un 37% de los pacientes continúan presentando episodios de fibrilación tras la ablación, aunque ahora ya de forma asintomática, incluso cuando previamente cursaban de forma sintomática37.
Continúa abierto el debate sobre cuál es el mejor abordaje para la ablación de la FA, el de desconexión eléctrica de las venas pulmonares mediante aplicación ostial de radiofrecuencia, del grupo pionero de Haissaguerre, o el de ablación circunferencial en la aurícula izquierda en torno a las venas pulmonares, del grupo de Pappone. Durante el año 2004 se publicaron varios estudios que sugerían una mayor eficacia del procedimiento circunferencial. Sin embargo, durante el año 2005 otros estudios han encontrado una eficacia similar entre ambos procedimientos, que era al año de un 54% para el circunferencial y del 82% para el del aislamiento de venas pulmonares, sin diferencias estadísticamente significativas entre ambos38. Al mismo tiempo, el grupo de Burdeos ha estudiado la eficacia de la ablación circunferencial en una serie reducida de 20 pacientes y ha observado que, a pesar de completarse el procedimiento, aproximadamente un 45% seguía presentado conducción venoatrial y cerca del 20% presentaba un aleteo macrorreentrante izquierdo tras el procedimiento39. La incidencia de taponamiento cardíaco periprocedimiento, de este mismo grupo, es del 2,9% y se relaciona con la utilización de potencias superiores a 42 W.
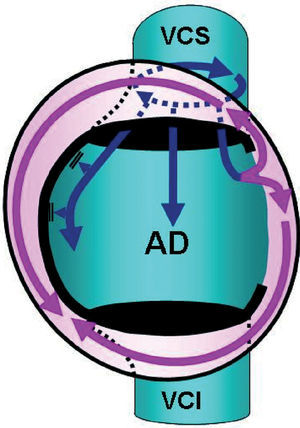
Por otro lado, se ha tratado de comprender mejor las potenciales complicaciones de la ablación de la FA y los métodos para reducirlas. Así, se ha observado la frecuente aparición de trombos sobre el catéter introductor o vaina vascular transeptal, a pesar de usar valores convencionales de anticoagulación con heparina. La frecuencia de trombos disminuye al utilizar una solución lavadora con mayor concentración de heparina40. Se ha profundizado el estudio sobre el desarrollo de las temidas fístulas atrioesofágicas durante el procedimiento de ablación circunferencial. Así, se ha descrito la relación anatómica del esófago con la aurícula izquierda, cuya pared se encuentra a menos de 5 mm de la superficie endocárdica en el 40% de los casos41. Esta relación se ha comprobado y controlado durante el procedimiento de ablación con un sistema electroanatómico de navegación y con una sonda medidora de temperatura intraesofágica, y se ha observado un curso difícilmente predecible a priori del esófago, que aproximadamente se reparte con una frecuencia similar en posiciones sobre las venas pulmonares derechas, la pared auricular izquierda posterior o las venas pulmonares izquierdas42-44. Más recientemente se ha descrito una nueva complicación, derivada de lesionar durante la aplicación de radiofrecuencia las fibras nerviosas periesofágicas y que puede desembocar en hipomotilidad gástrica y espasmo pilórico; estos trastornos incluso pueden requerir una cirugía para su corrección45. En cuanto a la estenosis de las venas pulmonares, su frecuencia se encontraría en torno al 38%, cuando se consideran las estenosis leves, y del 3,8% cuando se consideran sólo las estenosis severas46. La angioplastia con balón, con o sin la implantación de un stent asociado, demostró en un estudio que produce un rápido e importante alivio sintomático en los pacientes con estenosis severas de las venas pulmonares; sin embargo, una elevada proporción de pacientes desarrolló reestenosis del vaso o intra-stent, por lo que es necesario buscar otras alternativas para estos pacientes47. Se ha evaluado, asimismo, la aparición de arritmias auriculares tras la ablación de la FA que, para algunos autores, tendrían la participación de la musculatura del seno coronario en un 25% de los pacientes48; también podría ser la consecuencia de taquicardias del interior de la venas pulmonares49. En este sentido, en otros estudios que han demostrado mecanismos de reentrada por movimiento circular por la superficie interior de la vena cava superior se ha sugerido la posibilidad de que los fenómenos de macrorreentrada en la grandes venas torácicas no sean tanto resultado de la ablación con catéter como la causa del sostenimiento de la FA (fig. 5)50.
Fig. 5. Esquema en visión oblicua anterior izquierda que representa un circuito reentrante (flechas curvadas azules) de flúter de la vena cava superior (VCS), desde el que se activa (flechas rectilíneas azules y curvadas violetas) la aurícula derecha (AD) y la vena cava inferior (VCI).
Los sistemas de navegación no fluoroscópica siguen desarrollándose y ya incorporan la posibilidad de integrar imágenes anatómicas, obtenidas mediante tomografía computarizada multicorte o resonancia magnética, con el mapa electroanatómico obtenido en el laboratorio de electrofisiología, lo que aumenta el detalle anatómico de éste51. A pesar de todo, hay que tener en cuenta en estos procedimientos que la posición y el diámetro del orificio de las venas pulmonares varía durante el ciclo cardíaco y el procedimiento, lo que puede restar validez a la reconstrucción anatómica obtenida con estos sistemas52. Asimismo, se ha extendido el uso del nuevo sistema de navegación no-fluoroscópica Ensite-NavX, que reduce de manera muy importante la cantidad de radioscopia empleada y que incluso permite realizar procedimientos en ausencia total de ella53-55. Por último, se ha seguido trabajando en la navegación remota del catéter, con resultados aceptables incluso en sustratos complicados, como el de las vías accesorias perihisianas56. Asimismo, se ha publicado la ablación con catéteres con electrodos distales de oro en lugar de los convencionales de platino, lo que permite aumentar la potencia y profundizar las lesiones, manteniendo una temperatura de la interfaz electrodo-tejido similar a la de los electrodos convencionales, por lo que no aumenta la tasa de carbonizaciones57.
En cuanto a la ablación con catéter de otros sustratos arrítmicos, se ha demostrado una alta eficacia y una baja incidencia de complicaciones (desarrollo de bloqueo AV en torno al 3%), en pacientes ancianos > 75 años, por lo que se debe considerar la ablación como una terapia de primera elección también para las arritmias en este grupo de pacientes58.
Correspondencia: Dr. I. Fernández Lozano.
Unidad de Arritmias. Servicio de Cardiología. Clínica Puerta de Hierro.
Julio Palacios, 20, 1.o D. 28029 Madrid. España.
Correo electrónico: ifernandezl@sego.es