Palabras clave
INTRODUCCIÓN
La limitación más importante del intervencionismo coronario percutáneo (ICP) es la reestenosis, habitualmente definida como la documentación angiográfica en el seguimiento de una estenosis > 50% en el segmento tratado y/o en los 5 mm adyacentes. Ocurre al menos en el 30% de los casos tras la dilatación con balón ( ~ 20% con stent convencional) y en más de la mitad se precisan nuevos procedimientos de revascularización.
La fisiopatología de la reestenosis tras la angioplastia con balón incluye 3 fenómenos: a) retroceso elástico precoz; b) remodelado negativo, por el que disminuye el área total del vaso por estrechamiento en las semanas posteriores a la angioplastia, y c) proliferación neointimal, fundamentalmente en los 3-5 meses posteriores al ICP. En comparación con el balón, el stent disminuye el riesgo de complicaciones graves y, por tanto, la necesidad de revascularización quirúrgica de urgencia1, y reduce la reestenosis2. Inicialmente se demostró una reducción de la reestenosis en pacientes con retroceso elástico precoz3 o resultado subóptimo4 tras la dilatación con balón. Con posterioridad, los estudios BENESTENT, STRESS y START mostraron que el stent implantado de forma electiva también reduce la reestenosis5-7. Las lesiones de estos estudios eran favorables y se hallaban en pacientes con cardiopatía isquémica estable. Sin embargo, en estudios posteriores se demostró que el stent también reduce la reestenosis en otros contextos (tabla 1). Con respecto a los vasos pequeños (< 3 mm), los estudios no han sido concluyentes, pero en un metaanálisis de 11 estudios aleatorizados se observó que la reestenosis fue significativamente menor con stent (el 25,8 frente al 34,2%)8. Una vez demostrados estos beneficios, la utilización de presiones de implantación elevadas9 y la administración de tienopiridinas en asociación con la aspirina10 han permitido disminuir el riesgo de trombosis del stent a ~ < /FONT>1%, generalizándose así su utilización.
A pesar de sus ventajas, la tasa de reestenosis tras la implantación de stents convencionales supera el 20%, y la necesidad de nuevos procedimientos de revascularización, el 10%11. En lesiones complejas y largas, vasos pequeños y pacientes diabéticos, la tasa de reestenosis es incluso > 50%, hecho importante si tenemos en cuenta que estas lesiones son la mayor parte de las que actualmente se abordan mediante ICP.
La menor tasa de reestenosis del stent se debe fundamentalmente a una mayor ganancia luminal aguda, puesto que la pérdida tardía (disminución del diámetro luminal mínimo desde la implantación hasta los 6 meses posteriores) es incluso superior a la obtenida con balón. Ello se debe a que, aunque el stent elimina virtualmente el retroceso elástico precoz y el remodelado negativo, la proliferación neointimal es incluso más importante que con balón12. Además, hay otros factores relacionados realmente con un procedimiento inicial subóptimo («seudorreestenosis»), como una inadecuada expansión del stent, la protrusión precoz de material a través de éste y la implantación de stents con un diámetro inadecuado13.
La mayor parte de los agentes farmacológicos administrados por vía sistémica (antiplaquetarios, anticoagulantes, antiinflamatorios, hipolipemiantes, inhibidores de la enzima de conversión de la angiotensina, antagonistas del calcio, antioxidantes, etc.)14,15 y diferentes dispositivos mecánicos han fracasado en el objetivo de reducir la reestenosis. Debido al paralelismo entre el crecimiento tumoral y el neointimal intra-stent se decidió utilizar agentes antiproliferativos con objeto de reducir la reestenosis intra-stent (RIS). Algunos fármacos fracasaron inicialmente, probablemente por una escasa eficacia, por el uso de dosis insuficientes o por formas de liberación inapropiadas. Sin embargo, el convencimiento de que la administración local de estos fármacos es más eficaz que su utilización sistémica, al conseguir concentraciones locales mucho mayores con efectos sistémicos virtualmente nulos, abrió el paso al desarrollo de los stents liberadores de fármacos antiproliferativos (SLFA).
STENTS LIBERADORES DE FÁRMACOS ANTIPROLIFERATIVOS
Los SLFA constan de 3 componentes: el stent, el fármaco y la forma de liberación del fármaco.
1. El stent. Es la plataforma en la cual se une el fármaco y permite que éste llegue a la pared vascular.
2. Fármacos antiproliferativos (tabla 2). La rapamicina (sirolimus) y el paclitaxel son los fármacos más utilizados y con los que se han obtenido mayores beneficios.
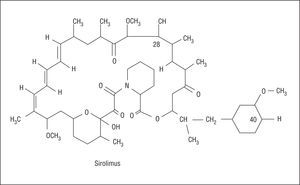
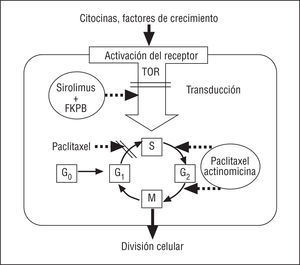
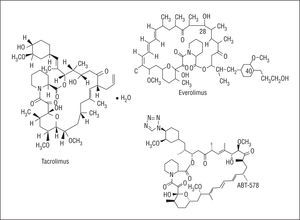
La rapamicina es un antibiótico macrólido producto natural de la fermentación producida por Estreptomyces hygroscopicus (fig. 1). Fue inicialmente empleado como antifúngico, pero al conocerse sus propiedades inmunodepresoras, antiinflamatorias y antiproliferativas se propuso su empleo en otras áreas de la medicina, como la prevención de la enfermedad vascular del injerto y la reestenosis en trasplantados cardíacos y el tratamiento del rechazo del trasplante renal16. La rapamicina se une a la proteína intracelular FKBP12, inactiva la proteína TOR (Target Of Rapamycin) y, finalmente, inhibe el paso desde la fase G1 a la fase S (fig. 2). A través de estos mecanismos ejerce un efecto antimigratorio y antiproliferativo sobre las células musculares lisas17. Al actuar en una fase tan precoz del ciclo celular, bloquea la proliferación sin inducir muerte celular, con lo que se minimizan las posibles secuelas vasculares.
Fig. 1. Estructura química de la rapamicina.
Fig. 2. Mecanismo de acción de la rapamicina.
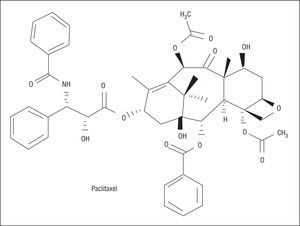
El paclitaxel se extrajo inicialmente del árbol Taxux brevifolia (fig. 3). Inhibe la proliferación y migración celular mediante la supresión de la dinámica de los microtúbulos18. En dosis bajas actúa en la transición entre Go y G1 y entre G1 y S, produciendo citostasis; sin embargo, en dosis altas bloquea la transición entre G2 y M y entre M y G1, produciendo muerte celular. Por tanto, uno de los aspectos más importantes de paclitaxel ha sido encontrar la menor dosis capaz de bloquear la respuesta celular, pero evitando producir daño vascular. El taxol está formado por 7,0 mmol/l de paclitaxel disuelto en un vehículo lipoide.
Fig. 3. Estructura química del paclitaxel.
3. Polímero. Hay 2 formas de liberar el fármaco: modificando la superficie del stent o utilizando un polímero desde el cual se libera el fármaco. La modificación de la superficie del stent es más barata y sencilla, pero ofrece una liberación del fármaco menos uniforme y controlada; además, durante la expansión del stent puede perderse parte del fármaco. La utilización de polímero es más cara y puede, en teoría, asociarse con reacciones de inflamación y/o hipersensibilidad local, pero permite una dosificación más uniforme y una liberación más sostenida y controlada del fármaco.
En la actualidad se dispone de varios SLFA comercializados o a punto de comercializarse (tabla 3). Sin embargo, sólo se dispone de evidencias sólidas de la eficacia del Cypher y el Taxus; son los stents BX Velocity (Cordis Corp.) y Express (Boston Scientific), con liberación polimérica de rapamicina y taxol, respectivamente.
Stents liberadores de fármacos antiproliferativos de rapamicina
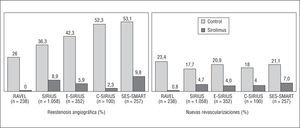
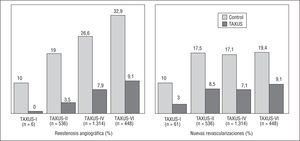
El stent Cypher está recubierto de un polímero que libera rapamicina (140 μg/mm2) de forma gradual y sostenida (un 80% durante 28 días) y ha reducido drásticamente la reestenosis en lesiones de novo en comparación con el stent convencional, según se ha constatado en varios estudios aleatorizados (fig. 4)19-22: RAVEL, SIRIUS, E-SIRIUS y C-SIRIUS.
Fig. 4. Beneficio del stent Cypher en comparación con los stents convencionales en estudios aleatorizados publicados.
En el RAVEL, 238 pacientes con lesiones de ≤ 18 mm en vasos de 2,5-3,5 mm fueron aleatorizados a recibir Cypher o un stent convencional19, con una tasa de reestenosis del 0 y del 26,6%, respectivamente. Esto se tradujo en una disminución de la tasa de eventos al año (el l5,8 frente al 28,8%), sobre todo en nuevos procedimientos de revascularización. En el SIRIUS se incluyó a 1.058 pacientes con una situación más desfavorable que los del RAVEL (vasos de 2,5-3,5 mm, lesiones de 15-30 mm y mayor proporción de diabéticos)20. El Cypher disminuyó significativamente la tasa de reestenosis (el 8,9 frente al 36,3%) y de nuevos procedimientos de revascularización (el 4,1 frente al 16,6%). En el E-SIRIUS, con 352 pacientes con lesiones de 15-32 mm en vasos pequeños (2,5-3,0 mm) también se observó una reducción significativa de la reestenosis (el 5,9 frente al 42,3%) y de la tasa de nuevos procedimientos (el 4,0 frente al 20,9%)21. En el C-SIRIUS, con 100 pacientes similares a los del E-SIRIUS, también se redujeron la reestenosis (el 2,3 frente al 52,3%) y la necesidad de nuevos procedimientos (el 4 frente al 18%)22.
Globalmente, en estos 4 estudios se incluyó a 1.748 pacientes. La tasa de reestenosis fue del 6,3% con Cypher y del 37,2% con el stent convencional, lo que significa una reducción absoluta y relativa del 30,9 y del 83,1%, respectivamente (habría que tratar a 3-4 pacientes con Cypher para evitar 1 reestenosis). La necesidad de nuevos procedimientos de revascularización se redujo del 18,5 al 3,6%, lo que supone una reducción absoluta y relativa del 14,9 y del 80,5%, respectivamente (sería necesario tratar a 6-7 pacientes con Cypher para evitar un nuevo procedimiento). Un hecho clave es que estos beneficios han sido consistentes en todos los subgrupos de pacientes incluidos tras estratificarlos por el diámetro del vaso, la longitud de la lesión, la presencia de diabetes, etc.
Hay otros estudios, algunos no publicados o incluso todavía en marcha. En el SVELTE y el SES-SMART se ha evaluado el Cypher en vasos pequeños. En el SES-SMART, 257 pacientes con vasos de ≤ 2,75 mm fueron aleatorizados para recibir Cypher o stent convencional, con una tasa respectiva de reestenosis del 9,8 y del 53,1%23. Recientemente se han comunicado los resultados del estudio SCANDSTENT, en el que 322 pacientes con lesiones complejas fueron aleatorizados para recibir Cypher o stent convencional y en el que se observó una reducción significativa en la tasa de reestenosis (el 2,0 frente al 31,1) y de nuevos procedimientos de revascularización de la lesión (el 2,4 frente al 29,6%). En el registro TROPICAL y en los estudios aleatorizados RIBS-II e ISAR-DESIRE se ha evaluado el Cypher en la RIS y se comentarán más adelante24,25. El ARTS-II es un registro de 607 pacientes con enfermedad multivaso tratados con Cypher. En comparación con el grupo quirúrgico del ARTS-I, los pacientes del ARTS-II tuvieron más reintervenciones (el 8,5 frente al 4,1%; p = 0,003), menos mortalidad (el 1,0 frente al 2,7%; p = 0,03) y una incidencia de eventos similar (el 10,4 frente al 11,6%). En el FREEDOM se aleatorizará a una población de diabéticos con enfermedad multivaso para recibir stent Cypher o cirugía coronaria. En el DIABETES, coordinado en nuestro centro, se ha demostrado que el stent Cypher reduce la reestenosis y la necesidad de nuevos procedimientos26.
Actualmente se encuentran en marcha varios registros con stent Cypher --RESEARCH, e-CYPHER, RECIPE, SECURE y otros-- en los que se analizan situaciones clínicas y características angiográficas muy variadas, por lo que responden a los resultados del stent Cypher en el «mundo real».
Stents liberadores de fármacos antiproliferativos de paclitaxel
El paclitaxel también reduce la hiperplasia intra-stent27. Se han desarrollado SLFA con paclitaxel tanto sin polímero como con polímero. Sin embargo, sólo el SLFA de liberación polimérica Taxus ha sido beneficioso en comparación con el stent convencional.
SLFA de paclitaxel no polimérico
Los SLFA de paclitaxel no polimérico reducen la proliferación neointimal, pero no mejoran la evolución clínica. Los estudios más importantes han sido el ASPECT, el DELIVER y el ELUTES. En el ASPECT se comparó el stent Supra-G stent (Cook Inc.) sin paclitaxel con el mismo stent pero con 2 dosis diferentes de paclitaxel (1,3 y 3,1 μg/mm²)28, con una tasa de reestenosis del 27, el 12 y el 4%, respectivamente. Sin embargo, no hubo diferencias significativas en la tasa de revascularización (el 8,6, el 6,9 y el 10%, respectivamente).
En el DELIVER-I, se aleatorizó a 1.043 pacientes para recibir stent Achieve (Cook Inc.) recubierto de 3 μg/mm² de paclitaxel o stent convencional (Multi-Link Penta). Se observó una tendencia hacia una menor tasa de reestenosis con el Achieve (el 14,9 frente al 20,6%; p = 0,076), pero no se obtuvieron beneficios clínicos significativos (nuevos procedimientos de revascularización en el 11,9 y el 14,5%, respectivamente; p = 0,12)29.
Por último, en el ELUTES se aleatorizó a 190 pacientes para recibir uno de lo s 5 siguientes tratamientos: stent convencional (V-Flex Plus, Cook Inc.) o stent recubierto de 0,2, 0,7, 1,2 o 2,7 μg/mm² de paclitaxel30. Se observó una relación dosis-respuesta con unas tasas de reestenosis del 21, el 20, el 12, el 14 y el 3%, mientras que las tasas de nuevos procedimientos fueron del 16, el 5, el 8, el 10 y el 5%, respectivamente (p = NS).
SLFA de paclitaxel con polímero
El primer SLFA de paclitaxel con polímero no sólo no aportó beneficios clínicos sino que se asoció con una mayor tasa de eventos, fundamentalmente por una incidencia de trombosis del stent muy elevada. Se trata del stent Quanam QuaDS-QP2, en el que se utilizaron dosis muy elevadas de paclitaxel y que tenía un diseño muy particular, con un polímero dispuesto en forma de «manguitos». En el estudio SCORE, este stent redujo la proliferación neointimal y la reestenosis, pero la tasa de trombosis fue > 10% en el primer año31.
El stent de paclitaxel polimérico Taxus sí ha demostrado reducir la reestenosis y la tasa de nuevos procedimientos de revascularización (fig. 5), y no se asocia con un incremento del riesgo de trombosis del stent, al menos cuando se sigue un tratamiento antiagregante con aspirina y tienopiridinas durante 6 meses. Los beneficios del Taxus han sido demostrados fundamentalmente en los estudios TAXUS-I, II, IV y VI32-34.
Fig. 5. Beneficio del stent Taxus en comparación con los stents convencionales.
En el TAXUS-I, 61 pacientes con lesiones de ≤ 12 mm en vasos de 3,0-3,5 mm fueron aleatorizados para recibir Taxus (1,0 μg/mm² de liberación lenta) o stent convencional (NIR, Boston Scientific Corp.), con una tasa de reestenosis del 0 y del 10%, respectivamente32. Fue un estudio de seguridad y el parámetro de valoración primario (muerte, infarto con onda Q, nueva revascularización o trombosis del stent a los 30 días) ocurrió en el 3 y el 10%, respectivamente (p = NS). Como dato importante, no hubo trombosis del stent en ninguno de los 2 grupos durante 12 meses. En el TAXUS II se distribuyó aleatoriamente a 536 pacientes similares a los del TAXUS-I en 3 grupos: stent NIR convencional, Taxus de liberación lenta y Taxus de liberación moderada. Las tasas de reestenosis fueron del 19, el 2,3 y el 4,7%, y las de nuevos procedimientos de revascularización del 16, el 7,7 y el 6,2%, respectivamente33. En el TAXUS-IV se aleatorizó a 1.314 pacientes con lesiones de 10-28 mm en vasos de 2,5-3,75 mm para recibir stent convencional (Express, Boston Scientific Corp.) o Taxus (1 μg/mm2 de liberación lenta). La tasa de reestenosis se redujo del 26,6 al 7,9%, y la de revascularización del 11,3 al 3,0%34. Teniendo en cuenta los estudios TAXUS-I, II y IV, la tasa de reestenosis se reduce del 23,5 al 6,9% (reducción absoluta y relativa del 16,6 y 70,6%, respectivamente, siendo necesario tratar 6 pacientes para evitar una reestenosis).
Hay otros estudios aún en marcha o no publicados con el stent Taxus. En el TAXUS-VI, 448 pacientes con lesiones largas (18-40 mm) fueron tratados aleatoriamente con Taxus de liberación moderada (liberación inicial del fármaco 8 veces superior a la liberación lenta) o stent convencional, asociándose el Taxus a una reducción significativa en la tasa de reestenosis (el 35,7 frente al 12,4%) y de nuevos procedimientos (el 19,4 frente al 9,1%). Recientemente se han comunicado los resultados del TAXUS-V, en el que se aleatorizó a 1.172 pacientes con lesiones largas y complejas para recibir Taxus o stent convencional. En este estudio, aunque los resultados fueron mejores con Taxus que con stent convencional, la reestenosis (el 18,9 frente al 33,9%) y la tasa de nuevos procedimientos de revascularización (el 12,1 frente al 17,3%) fueron elevadas. En el TAXUS-V US Randomized Pivotal ISR Trial se compararán el Taxus y la braquiterapia intracoronaria (BTI) en 488 pacientes con RIS. En el SYRTAX se aleatorizará a un grupo de pacientes con enfermedad multivaso para recibir cirugía o Taxus. También hay registros sobre la utilización del Taxus en el «mundo real», como el WISDOM, el T-RESEARCH, el MILESTONE, el TAXUS-Olympic y otros.
Stents de liberación de otros fármacos antiproliferativos
Actualmente se están evaluando SLFA con otros fármacos, como algunos macrólidos análogos del sirolimus (fig. 6). Algunos incluso han demostrado su seguridad y serán comercializados en los próximos meses en Europa.
Fig. 6. Estructura química de algunos análogos del sirolimus.
El everolimus es un macrólido inmunodepresor desarrollado para prevenir el rechazo del trasplante renal, cardíaco y pulmonar, e inhibe la proliferación de las células musculares lisas. Es absorbido por el tejido local con más rapidez que el sirolimus y permanece más tiempo en las células. Se han realizado varios estudios en los que se ha utilizado everolimus (FUTURE-I, FUTURE-II, y SPIRIT) y se ha demostrado que es seguro (no hubo trombosis del stent) y eficaz, al reducirse significativamente la pérdida tardía, la tasa de reestenosis y la necesidad de nuevos procedimientos. No obstante, en estos 3 estudios se incluyó un número escaso de pacientes y en contextos angiográficos y clínicos favorables, por lo que este beneficio debe ser confirmado en otros estudios.
Los SLFA de tacrolimus (FK-506) fueron evaluados en primer lugar en los estudios EVIDENT y PRESENT I y II, en puentes de safena y en vasos nativos, respectivamente, sin que se observaran beneficios en los pacientes tratados con tacrolimus. El stent Janus (Sorin) tiene un diseño particular, con microrreservorios para conseguir un depósito local del tacrolimus que se libera directamente a la pared vascular. En el estudio JUPITER-I se evaluó este stent en una pequeña población de pacientes. No se documentaron trombosis del stent, pero la pérdida tardía fue elevada, especialmente en los diabéticos. Por ello, el estudio aleatorizado JUPITER-II (stent Janus frente a stent Tecnic) se ha realizado con una dosis superior de tacrolimus (2,3 μg/mm²); sus resultados se conocerán durante el año 2005.
Aunque son varios los SLFA de ABT-578 que se han desarrollado (Endeavor, TriMaxx, ZoMaxx), el Endeavor es el que por el momento ha sido evaluado en un mayor número de pacientes. Es un stent de cromo-cobalto (Driver, Medtronic Inc.) cubierto de un polímero con ABT-578 (10 μg/mm) que libera el 70-80% del fármaco en las primeras 48 h tras su implantación y el resto durante los siguientes 30 días aproximadamente. En el estudio no aleatorizado ENDEAVOR-I se ha evaluado este stent con resultados clínicos favorables (trombosis del 0%, reestenosis del 3%, eventos clínicos del 2%), pero con una pérdida tardía relativamente elevada (0,61 mm a los 12 meses). En el estudio aleatorizado ENDEAVOR-II (n = 1.197), los pacientes tratados con Endeavor tuvieron menores tasas de reestenosis (el 9,5 frente al 32,7%) y de nuevos procedimientos (el 5,7 frente al 12,8%) que los tratados con el stent Driver. En los estudios ENDEAVOR-III y IV se compararán de forma aleatorizada el Endeavor con el Cypher y el Taxus, respectivamente.
Con biolimus A9, en el estudio STEALTH-I se ha comparado de forma aleatoria (2:1) el stent BioMatrix (Biosensors) con un stent convencional en 120 pacientes, obteniéndose una reducción significativa en la pérdida tardía (de 0,74 a 0,25 mm).
Además de estos análogos del sirolimus, se han evaluado otros fármacos antiproliferativos: dexametasona, 17β-estradiol, batimastat, actinomicina-D, metotrexato, angiopeptina, temsirolimus (CCI-779), vincristina, ciclosporina, etc. (tabla 2). Sin embargo, sus resultados han sido negativos o se encuentran aún en fases muy preliminares de investigación. Por otra parte, habitualmente se considera que los «stents recubiertos» son los que liberan sustancias antiproliferativas, dado que son los que han demostrado reducir la tasa de reestenosis y la necesidad de nuevos procedimientos de revascularización. No obstante, el concepto de «stent recubierto» es más amplio e incluye stents recubiertos de otros fármacos. Los stents recubiertos de heparina surgieron para intentar reducir la tasa de trombosis, cuya incidencia global fue < 0,5% pero no ha sido significativamente menor que la de los stents convencionales, y tampoco se ha demostrado una reducción en la tasa de reestenosis, por lo que la utilización de este tipo de stents ha sido muy escasa. Otros recubrimientos para intentar reducir la trombogenicidad de los stents son la fosforilcolina (stent Biodivysio) y el Carbide silicona (stent Tenas). Estos stents tampoco reducen el riesgo de reestenosis y trombosis.
Limitaciones actuales de los stents liberadores de fármacos antiproliferativos
Stents liberadores de fármacos antiproliferativos en escenarios no favorables
En algunos grupos de pacientes no se han realizado estudios aleatorizados, pero los datos obtenidos a partir de registros permiten asumir por el momento que probablemente los SLFA también son más eficaces que los stents convencionales.
Las lesiones bifurcadas constituyen un contexto desfavorable, no sólo por el riesgo de pérdida de vasos secundarios, sino también por la elevada tasa de reestenosis, especialmente del vaso secundario. En el SIRIUS-Bifurcations, 86 pacientes con lesiones bifurcadas fueron aleatorizados para recibir Cypher en el vaso principal y balón en el secundario frente a Cypher en ambos vasos35. Sus resultados se resumen en: a) la tasa de crossover de Cypher-balón a Cypher-Cypher fue elevada (51%); b) la reestenosis fue escasa en el vaso principal ( ~ 5% en ambos grupos), dato favorable respecto al de series clásicas de stent convencional, y c) el tratamiento con Cypher en ambos vasos no proporcionó ventajas en comparación con el tratamiento inicial con balón del vaso secundario (nuevos procedimientos de revascularización en el 11 y el 10%, y reestenosis en el vaso secundario del 22 y el 14%, respectivamente). Además, todas las trombosis ocurrieron en pacientes tratados con Cypher-Cypher. Con los SLFA ha surgido una nueva técnica para tratar las bifurcaciones (crushing), que básicamente consiste en la implantación de un SLFA primero en la rama secundaria pero situado a unos 4 mm en el vaso principal, para implantar posteriormente otro SLFA en el vaso principal, el cual se habrá situado con anterioridad a la implantación del stent del vaso secundario. Idealmente, esta técnica debe finalizarse con una dilatación simultánea de ambos vasos con balón (kissing balloon).
Debido a la preocupación que suscita la posibilidad de un incremento del riesgo de trombosis tras la implantación de SLFA, hasta hace poco la utilización de SLFA en los síndromes coronel infarto con elevación del segmento ST. Sin embargo, datos recientes han mostrado que los resultados del tratamiento con Cypher en estos pacientes, en cuanto a reestenosis y trombosis del stent, son comparables a los obtenidos en la cardiopatía isquémica estable36.
Los datos sobre los stents Cypher y Taxus en puentes de safena están basados en estudios con pocos pacientes, en los que se ha obtenido una tasa de nuevos procedimientos de revascularización del 2,5-6,5%. En un estudio reciente se ha obtenido una menor tasa de reestenosis (el 10,0 frente al 26,7%; p = 0,03) y de nuevos procedimientos de revascularización (el 4,9 frente al 23,1%; p = 0,01) en un grupo de pacientes tratados con SLFA (Cypher o Taxus) que en un grupo control con stents convencionales37. En otro estudio se obtuvieron unos resultados similares (nueva revascularización en el 6,4 frente al 17,3%, respectivamente)38. En un análisis reciente del registro SECURE, la necesidad de nuevos procedimientos de revascularización en los pacientes que recibieron stent Cypher en puentes de safena fue del 17%; aunque esta cifra es elevada, es similar a la hallada en los pacientes con lesiones en vasos nativos de ese mismo registro (18%), pues se incluyó a pacientes especialmente desfavorables (gran parte eran fracasos de la BTI).
Clásicamente, la enfermedad del tronco ha sido una indicación quirúrgica. Sin embargo, el stent puede ser una alternativa, en especial en pacientes con un elevado riesgo quirúrgico. Dada la gran trascendencia clínica que puede tener una reestenosis en el tronco, los SLFA son especialmente atractivos en este contexto. Se han descrito series de pacientes con enfermedad del tronco tratados con Cypher o Taxus con una tasa de reestenosis ~ 5%39,40. Los dos problemas más importantes tras el tratamiento de la enfermedad del tronco con SLFA son la reestenosis del origen de la circunfleja cuando la lesión del tronco es distal, y la trombosis del stent; ésta es la causa de algunos episodios de muerte súbita que han tenido lugar tras el tratamiento del tronco mediante SLFA. No obstante, probablemente el riesgo de trombosis de un SLFA implantado en el tronco no es superior al de los stents convencionales.
Un problema del tratamiento de las oclusiones crónicas es que, aunque se consiga pasar la guía, dilatar la lesión e implantar un stent, la tasa de reestenosis es muy elevada. En algunas series de oclusiones crónicas tratadas con SLFA41 se ha comunicado una tasa de reestenosis del 0-11% (reoclusión del 0-3%) y una necesidad de nuevos procedimientos de revascularización en el 0-7,5% de los casos, datos que son favorables respecto a las series con stents convencionales.
Efectos secundarios sistémicos de los stents liberadores de fármacos antiproliferativos
En estudios experimentales, por vía sistémica y con dosis elevadas, la rapamicina puede tener efectos secundarios graves, como necrosis miocárdica, infartos retinianos, necrosis de las mucosas y vasculitis. En dosis terapéuticas, los posibles efectos secundarios de la rapamicina cuando se administra por vía sistémica son: cefalea, poliartralgia, epistaxis, diarrea, mielosupresión y otros42. Además, en humanos, a largo plazo se pueden incrementar las concentraciones plasmáticas de colesterol y triglicéridos43. No se han comunicado efectos secundarios sistémicos de la rapamicina cuando se administra en forma de SLFA, y su riesgo es virtualmente nulo. En el estudio SIROLIMUS PK, tras la implantación de SLFA de sirolimus, la concentración plasmática máxima de rapamicina alcanzada fue 0,80 ± 0,37 ng/ml, con una vida media de 213 h y la presencia de concentraciones detectables en el plasma durante una semana.
Con paclitaxel, administrado como agente antineoplásico por vía sistémica, se han descrito: infarto de miocardio, insuficiencia cardíaca, arritmias, hipotensión, muerte súbita, alteraciones de la repolarización, disfunción sinusal y bloqueos auriculoventriculares44. Sin embargo, en estas situaciones, las concentraciones sistémicas son 100-1.000 veces superiores que las alcanzadas con la utilización de SLFA. Como en el caso de la rapamicina, la implantación de SLFA de paclitaxel no se ha asociado con efectos secundarios sistémicos, aunque deberá confirmarse en series amplias de pacientes con un seguimiento a largo plazo.
Efectos secundarios de los stents liberadores de fármacos antiproliferativos locales
Desde que se empezaron a utilizar los SLFA hubo preocupación por un posible incremento del riesgo de trombosis del stent. Esto estuvo justificado por los siguientes hechos: a) paralelismo con la BTI, ya que los fármacos antiproliferativos podrían retrasar la endotelización del stent; b) la rapamicina puede incrementar la agregación plaquetaria in vitro45; c) en algunos estudios, los SLFA se han asociado con una mayor frecuencia de malaposición tardía del stent. Tras la implantación del stent Cypher, este hecho se documentó en el 9% de los pacientes del SIRIUS y en el 21% del RAVEL. En el TAXUS-II, por el contrario, el riesgo de malaposición tardía del Taxus fue similar al del stent convencional; d) en algunos estudios iniciales con SLFA, la incidencia de trombosis del stent fue muy elevada: > 10% al año en el SCORE31 y > 3% en el ASPECT28.
Sin embargo, en el SCORE, la elevada tasa de trombosis es probable que esté justificada por el particular diseño del stent y la dosis extremadamente elevada de paclitaxel31. En el ASPECT, todas las trombosis ocurrieron en pacientes que no recibieron aspirina y tienopiridinas, sino aspirina y cilostazol28. En los estudios con Cypher o Taxus no se ha objetivado un incremento del riesgo de trombosis. En un metaanálisis reciente de 10 estudios aleatorizados, la tasa de trombosis del stent fue similar con SLFA y con stents convencionales (el 0,58 frente al 0,54%). En estos estudios, la duración del tratamiento con tienopiridinas fue de 1-6 meses46.
También se pueden producir otros posibles efectos secundarios cuya implicación clínica no ha sido definida, como hipersensibilidad e inflamación local, probablemente debidas al polímero más que al fármaco antiproliferativo. Al contrario de lo que ocurre con la BTI, no se ha podido demostrar que los SLFA produzcan efecto borde o más reestenosis del borde del stent que los stents convencionales. Tras la implantación de SLFA también se ha descrito la formación de aneurismas coronarios a largo plazo, pero parece infrecuente y clínicamente poco relevante. En el TAXUS II, por ejemplo, se desarrollaron aneurismas coronarios con una frecuencia similar con Taxus que con stent convencional (1,5%).
Por último, desde el comienzo de la utilización de los SLFA se ha temido la posibilidad de que éstos produjeran más un retraso que una disminución de la hiperplasia intimal. Sin embargo, el beneficio de los SLFA se mantiene al menos durante 2-3 años. En el TAXUS-II, el diámetro luminal mínimo no disminuyó a los 6 meses y 2 años en los pacientes tratados con Taxus, y el número de nuevos procedimientos de revascularización tras 1-2 años fue incluso superior con stent convencional. Algo similar ocurrió en el TAXUS-IV, en el que se precisaron nuevas revascularizaciones tras 1-2 años en el 3,7 y el 4,2% de los pacientes tratados con Taxus y stent convencional, respectivamente. Hace poco se han publicado los resultados del RAVEL, en el que se utilizó Cypher, a 3 años47. Entre 1 y 3 años hubo mayor frecuencia de fracaso del vaso tratado en los pacientes del grupo Cypher, pero las diferencias no fueron significativas (el 5,9 frente al 4,3%; p = 0,77) y la diferencia en la tasa de eventos se mantuvo a los 3 años (el 16,7 frente al 34,5%; p = 0,002). También se han conocido recientemente los datos del SIRIUS a 3 años. En este estudio no sólo se mantuvieron las diferencias en la incidencia de nuevos procedimientos entre los grupos Cypher y control a los 9 meses y 3 años, sino que incluso estas diferencias se incrementaron (el 18,9 frente al 6,4% a los 9 meses [reducción absoluta del 12,5%]; el 27,2 frente al 11,6% a los 3 años [reducción absoluta del 15,6%]). El único aspecto que aún no está resuelto es si la tasa de trombosis del stent a largo plazo, una vez suspendida la doble antiagregación y transcurrido más de 1 año desde su implantación, es superior en los pacientes tratados con SLFA que con stents convencionales. Con Taxus, en un análisis conjunto de los estudios TAXUS-I, II, III y IV, la incidencia de trombosis del stent entre los 6 meses y los 2 años fue significativamente superior que en los grupos control (el 1,2 frente al 0,7%). Por el contrario, en el SIRIUS, la tasa de trombosis a los 3 años fue del 0,8% en ambos grupos. Por tanto, la necesidad de administrar tienopiridinas en conjunción con la aspirina durante un tiempo más prolongado que en los estudios aleatorizados aún no se ha demostrado.
Comparación entre Cypher y Taxus
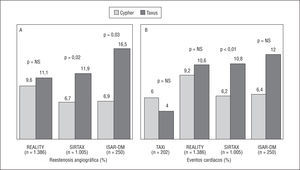
Ya hemos mencionado con anterioridad el estudio ISAR-DESIRE, en el que la recurrencia de RIS tras el tratamiento de ésta fue del 14,3% con Cypher y del 21,7% con Taxus25. En varios estudios se han comparado aleatoriamente los stents Cypher y Taxus en lesiones de novo (fig. 7)48-52. En el TAXi no hubo diferencias significativas en la evolución clínica con ambos (no se realizó seguimiento angiográfico). En los estudios REALITY, SIRTAX e ISAR-DIABETES, la pérdida tardía fue significativamente inferior con Cypher y la reestenosis por lesión fue significativamente menos frecuente con Cypher en el SIRTAX y el ISAR-DIABETES. No obstante, estas diferencias sólo se tradujeron en diferencias clínicas en el SIRTAX. Los resultados preliminares del estudio del grupo CORPAL concuerdan con estos datos, pero tiene la limitación de que el seguimiento angiográfico se realizó en una proporción baja de pacientes.
Fig. 7. Tasa de reestenosis (A) y de nuevos procedimientos de revascularización (B) en los estudios que han comparado aleatoriamente los stents Cypher y Taxus.
Con respecto a su seguridad, sólo en el REALITY se ha documentado una tasa de trombosis superior con Taxus (el 1,8 frente al 0,4% en un análisis por tratamiento administrado), pero las diferencias no fueron estadísticamente significativas en un análisis por «intención de tratar» (el 1,6 frente al 0,6%; p = 0,07). En los demás estudios, la incidencia de trombosis fue similar en ambos grupos (en el SIRTAX fue del 1,6 y del 2,0% con Taxus y Cypher, respectivamente). En nuestro metaanálisis, aunque en los estudios en los que se utilizó SLFA de paclitaxel hubo una tendencia hacia una mayor duración del tratamiento con tienopiridinas (4,4 ± 2,3 frente a 2,0 ± 0,0 meses, respectivamente; p = 0,08) y, por tanto, no podemos descartar que esto haya podido enmascarar una posible mayor trombogenicidad del SLFA de paclitaxel, la tasa de trombosis no fue significativamente diferente entre SLFA de rapamicina y paclitaxel (el 0,56 frente al 0,66%) y tampoco hubo diferencias significativas en la tasa de trombosis tardía (el 0,11 frente al 0,33%)46.
Coste de los stents liberadores de fármacos antiproliferativos
En nuestro medio, el precio de los SLFA es un 60-80% superior al de los stents convencionales. Además, hay que sumar el coste indirecto derivado de la administración de tienopiridinas durante un período más prolongado. La magnitud del beneficio clínico de los SLFA posiblemente no sea suficiente como para justificar tanta diferencia de precios (no debemos olvidar que los SLFA no reducen la mortalidad y la tasa de infarto). Con los precios actuales, nosotros no recomendamos el empleo sistemático de SLFA sino preferentemente en contextos en los que la reducción de la reestenosis conlleve mayor beneficio clínico.
A pesar de las consideraciones anteriores, en análisis económicos de los estudios SIRIUS y TAXUS-IV se ha mostrado que gran parte del coste «extra» de los SLFA se compensa con al ahorro derivado de la reducción en la necesidad de nuevos procedimientos de revascularización. El «precio neutro» de un dispositivo (en este caso, el SLFA) es aquel en el que el coste extra inicial es totalmente compensado por la reducción de los gastos derivados de su beneficio clínico (en este caso, reducción del gasto por nuevos procedimientos de revascularización). Recientemente se ha realizado en nuestro país un estudio económico en el que se ha estimado que el precio neutro de un SLFA sería algo menor de 1.500 euros53.
Tratamiento de la reestenosis intra-stent mediante stents liberadores de fármacos antiproliferativos
Conceptualmente, la utilización de dispositivos en lesiones de novo es una estrategia de «prevención primaria» de la reestenosis, mientras que su uso en lesiones reestenóticas (especialmente RIS) correspondería a estrategias de «prevención secundaria». La RIS ha sido clasificada en cuatro tipos angiográficos con implicaciones pronósticas (tabla 4)54. El riesgo de RIS está inversamente relacionado con el diámetro luminal mínimo tras la implantación del stent, y es mayor en diabéticos, lesiones largas, vasos pequeños, lesiones reestenóticas, puentes de safena y lesiones ostiales55. Algunas características relacionadas con el tipo de stent también podrían tener relación con la reestenosis56. Además, algunos factores genéticos también pueden estar relacionados con la RIS, como el polimorfismo PIA de la glucoproteína IIIa y una forma mutante de la metilentetrahidrofolato reductasa, mientras que el alelo 2 de la interleucina 1 parece asociarse con un riesgo menor. Por otra parte, la positividad de las pruebas alérgicas al níquel y al molibdeno (componentes de los stents coronarios) también se ha relacionado con la RIS57.
Con la mayoría de los dispositivos, el tratamiento percutáneo de la RIS se asocia con una tasa de éxito inicial muy elevada ( ~ 100% en la mayor parte de las series) y una tasa de complicaciones baja. Esto se debe a que en la RIS, la pared vascular está «protegida» por la malla metálica del stent, disminuyendo así su grado de lesión y el riesgo de disección. Sin embargo, como contrapartida, el tratamiento de la RIS se asocia con una tasa de reestenosis más elevada que la de las lesiones de novo. Aunque son muchos los dispositivos que se han evaluado en el tratamiento de la RIS, sólo los SLFA y la BTI han sido más eficaces que el balón.
Aunque en algunos registros iniciales de RIS tratadas con SLFA la incidencia de eventos fue relativamente elevada, los resultados angiográficos han sido consistentemente favorables, con bajas tasas de pérdida tardía y reestenosis24,25,58-60. En la experiencia de São Paulo, con 25 pacientes con RIS tratados con stent Cypher, no hubo trombosis del stent y sólo hubo una recurrencia de la RIS85. En el TAXUS III, con 28 pacientes con RIS tratados con Taxus, la tasa de recurrencia de RIS fue del 16% (4/25) y a 12 meses 6 pacientes (21%) recibieron una nueva revascularización (3 por reestenosis y 3 por hallazgos de la ecografía intracoronaria)59. En otra serie de 16 pacientes con RIS, en este caso complejas, se ha comunicado una tasa de reestenosis superior (el 19% a los 4 meses)58.
En el registro TROPICAL, 162 pacientes con RIS fueron tratados con Cypher y comparados con el grupo control de los estudios GAMMA-1 y 2, con unas tasas de reestenosis del 9,7 frente al 40,3%, respectivamente. En el TROPICAL, el beneficio del Cypher puede estar magnificado, pues la longitud de la RIS era significativamente superior en el grupo control. En el estudio RIBS-2 se ha aleatorizado a 150 pacientes con RIS para recibir tratamiento con Cypher o balón24. Los resultados provisionales han mostrado una recurrencia de RIS del 11 y del 39% (p < 0,01), y la necesidad de nuevos procedimientos de revascularización en el 9 y el 30% (p < 0,01), respectivamente. En el ISAR-DESIRE, de reciente publicación, 300 pacientes con RIS fueron distribuidos aleatoriamente a 3 grupos: angioplastia con balón, stent Cypher y stent Taxus; hubo recurrencia de la RIS en el 44,6, el 14,3 y el 21,7%, respectivamente25.
En el tratamiento de la RIS mediante SLFA, los pacientes en los que ha fracasado la BTI con anterioridad constituyen un subgrupo de mayor riesgo. En una actualización reciente del registro SECURE, con 193 pacientes con RIS tratados con Cypher (142 de ellos tras fracaso de BTI), la necesidad de nuevos procedimientos fue del 17%, pero fue superior tras fracaso de la BTI (19%) que en el resto de los pacientes (12%)61. Lo mismo ocurrió con las trombosis, que sólo ocurrieron (1,4%) en los pacientes con fracaso previo de la BTI. En un estudio de Waksman et al62, el tratamiento con SLFA en pacientes con RIS en los que ya había fracasado la BTI se asoció con un riesgo de eventos incluso superior al de los pacientes tratados con una nueva BTI.
Reestenosis tras la implantación de stents liberadores de fármacos antiproliferativos
Los predictores de RIS de los SLFA son similares a los de la RIS de los stents convencionales. En un análisis del RESEARCH, los predictores de reestenosis tras la implantación de Cypher fueron el tratamiento de RIS, la localización ostial, una mayor longitud cubierta por stent, los vasos pequeños, la diabetes y la localización en la descendente anterior63.
Aunque la RIS de los SLFA se localiza generalmente dentro del stent, la reestenosis situada en los bordes es frecuente (el 20-30% de las RIS de SLFA), y también en la zona de solapamiento de 2 stents (fig. 8). La incidencia de reestenosis en los márgenes del stent puede reducirse intentando cubrir con el stent toda la longitud dilatada con el balón. La RIS de los SLFA tiene generalmente un patrón focal y la RIS difusa es poco frecuente, tanto con rapamicina64 como con paclitaxel65. Como posibles explicaciones a este patrón predominantemente focal de la RIS tras la implantación de SLFA se encuentran una infraexpansión del stent, una distribución no homogénea del fármaco o un cubrimiento incompleto de la lesión por parte del stent.
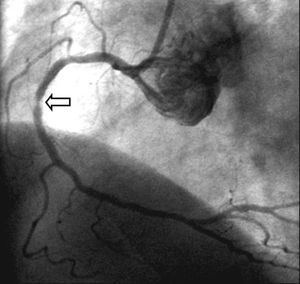
Fig. 8. Reestenosis focal localizada en una zona de solapamiento de 2 stents Cypher implantados en la coronaria derecha.
Hay muy pocos datos sobre el tratamiento de la RIS de los SLFA. Probablemente, el mejor tratamiento sea otro SLFA. En el RESEARCH se trató con procedimiento percutáneo a 24 pacientes (27 lesiones) con RIS de stent Cypher64. El 85% fue tratado con otro SLFA (Cypher o Taxus) y el 15% con balón o un stent convencional. La recurrencia de la RIS se produjo en el 43% de los casos, pero sólo en el 18% de los pacientes tratados con otro SLFA. La BTI también podría ser una alternativa terapéutica en estos pacientes66, pero sus dispositivos han sido retirados del mercado muy recientemente.
OTROS DISPOSITIVOS PARA LA PREVENCIÓN Y EL TRATAMIENTO DE LA REESTENOSIS
Los SLFA han revolucionado la cardiología intervencionista. No obstante, el comienzo de la era de los SLFA es reciente y otros dispositivos habían sido ya evaluados en la prevención de la reestenosis (tabla 5).
En el tratamiento de lesiones de novo, ningún dispositivo diferente de los stents ha demostrado reducir la reestenosis. En la RIS, sólo los SLFA y la BTI han demostrado reducir la recurrencia de la RIS en comparación con el tratamiento convencional. La angioplastia con balón es el tratamiento convencional de la RIS y ha sido la estrategia utilizada con más frecuencia en la era pre-SLFA, en especial en centros sin BTI. Este tratamiento es técnicamente sencillo y con pocas complicaciones, pero la recurrencia de RIS se acerca al 50% y la necesidad de nuevos procedimientos de revascularización se encuentra en el 14-46%; estas cifras son especialmente elevadas en RIS de tipo III-IV, diabéticos, puentes de safena y cuando la RIS es precoz (antes de los 4 meses tras la implantación del stent)67-69. Inicialmente, la implantación de un nuevo stent en la RIS se reservó para pacientes con resultados subóptimos o complicaciones tras el fracaso de otros dispositivos, pero con posterioridad se valoró la posibilidad de implantar un nuevo stent de forma electiva. La mayor parte de los datos sobre el tratamiento de la RIS mediante stent intra-stent se han obtenido del estudio RIBS, en el que 450 pacientes con RIS fueron aleatorizados para recibir stent intra-stent o balón. No hubo diferencias significativas en la reestenosis y en la necesidad de nuevos procedimientos, pero este estudio ha demostrado que la implantación electiva de un stent intra-stent es segura e incluso se asocia con una menor tasa de eventos periprocedimiento que la dilatación con balón70. Esto es importante en el momento actual, en el que se está vislumbrando que los SLFA pueden ser el mejor tratamiento de la RIS tras la implantación de un stent convencional.
Dispositivos de modificación, reducción y eliminación de placa (tabla 4)
La aterectomía direccional (AD) produce unos resultados angiográficos inmediatos favorables, pero en los estudios aleatorizados no se ha mostrado una reducción de la tasa de reestenosis y de nuevos procedimientos de revascularización. Además, la AD puede incrementar las complicaciones periprocedimiento71. En los estudios AMIGO y DESIRE se ha demostrado que la AD antes de la implantación de stent tampoco reduce la reestenosis ni la necesidad de nuevos procedimientos de revascularización. En gran parte de los estudios, la AD se utilizó con una estrategia relativamente conservadora, pero algunos trabajos posteriores han demostrado que una estrategia más agresiva no sólo produce mejores resultados inmediatos, sino también una menor tasa de reestenosis72. Sin embargo, la utilización de la AD es en la actualidad minoritaria. En la RIS, la AD es capaz de eliminar tejido neointimal intra-stent y obtener mayor ganancia luminal inmediata que el balón. Sin embargo, la tasa relativamente elevada de complicaciones en lesiones de novo y la posibilidad de deterioro de los struts del stent han impedido la utilización de este dispositivo en el tratamiento de la RIS.
En el tratamiento de lesiones de novo, la aterectomía rotacional (AR) consigue mejores resultados iniciales que el balón en lesiones calcificadas, y es especialmente útil en las lesiones no dilatables con balón. En algunos estudios, como el ERBAC y el COBRA, la AR obtuvo una tasa de éxito angiográfico inicial superior al balón en lesiones complejas, pero no redujo la reestenosis73,74. En la actualidad se utiliza en casos seleccionados, en especial en lesiones no dilatables con balón o severamente calcificadas en las que es previsible que el balón no consiga un buen resultado. Actualmente, en la era de los SLFA, esta técnica tiene aún su papel, al facilitar su implantación y favorecer una correcta expansión del SLFA en este tipo de lesiones. La AR en el tratamiento de la RIS actúa eliminando tejido neointimal y, si es seguida de dilatación con balón, se produce una expansión adicional del stent y la extrusión de tejido neointimal fuera del stent. Aunque la AR en el tratamiento de la RIS se asocia a una tasa elevada de éxito angiográfico inicial y pocas complicaciones75, en 2 estudios aleatorizados se han obtenido resultados contradictorios. En el ROSTER (n = 150), la tasa de recurrencia clínica de la RIS fue significativamente menor con AR76. Sin embargo, en el ARTIST (n = 298), la tasa de recurrencia de RIS angiográfica fue mayor con AR77. Aunque se ha argumentado que el fracaso de la AR en el ARTIST pudo ser debida a una estrategia demasiado conservadora (utilización de presiones bajas en la dilatación con balón tras AR y ausencia de control mediante ecografía intracoronaria), la utilización de la AR en la RIS es actualmente muy escasa.
En varios estudios aleatorizados se ha comparado el balón de corte (BC) con el balón convencional. En algunos, los resultados fueron favorables al BC, pero en la mayoría no se redujo la tasa de nuevos procedimientos de revascularización78-80. En el REDUCE-3 se evaluó el beneficio del BC en comparación con el balón convencional antes de la implantación de un stent; aunque la tasa de reestenosis angiográfica fue menor con BC, la incidencia de nuevos procedimientos de revascularización no se redujo de forma significativa81. Las ventajas teóricas del BC en el tratamiento de la RIS son dos. En primer lugar, las pequeñas incisiones pueden facilitar la extrusión de la neoíntima fuera de la luz del stent. En segundo lugar, pueden ayudar a evitar la «pepita de sandía» (desplazamiento del balón durante su inflado), fenómeno que puede producir daño de los segmentos del vaso adyacentes al stent. Esta última ventaja hace que el BC sea especialmente utilizado cuando se aplica BTI, con objeto de evitar el fenómeno del geographic miss y, por tanto, la aparición de reestenosis del borde. En varios estudios observacionales se han obtenido resultados favorables82, pero los estudios aleatorizados no han demostrado disminuir de forma significativa la recurrencia de RIS83-86. En un estudio aleatorizado piloto, la recurrencia de la RIS fue menos frecuente con BC (el 4 frente al 28%; p = 0,047)83. En otro estudio piloto aleatorizado se obtuvo una tasa de recurrencia de RIS inferior en el grupo tratado con BC, aunque sin diferencias significativas (el 12 frente al 20%; p = NS)84. Sin embargo, en otros estudios con mayor número de pacientes, el BC no fue superior al balón convencional. En el RESCUT, en el grupo tratado con BC hubo una tendencia hacia una menor necesidad de implantar un nuevo stent por disección (el 4 frente al 8%; p = 0,07), pero la tasa de recurrencia de RIS (el 29 frente al 31%) y la tasa de nuevos procedimientos (el 17 frente al 16%) fue similar85. En el REDUCE II, la recurrencia de RIS también fue similar con ambos tratamientos (el 24 frente al 22%).
El láser excimer ha sido evaluado en varios estudios aleatorizados73,87,88, pero además de no reducir la incidencia de nuevos procedimientos de revascularización se asoció a un aumento del infarto periprocedimiento. En la RIS, el láser produce expansión adicional del stent y ablación y extrusión del tejido neointimal. Los estudios preliminares mostraron la eficacia y seguridad de este dispositivo, pero la recurrencia de RIS es elevada, sin que se produzca un beneficio en comparación con el balón89.
La aplicación de ultrasonidos puede reducir la viabilidad celular y la producción de cavitaciones mediante la utilización de alta energía puede inhibir in vivo la migración y adhesión de las células musculares lisas. Los ultrasonidos también pueden directamente inhibir in vitro la proliferación de células musculares lisas. En algunos estudios realizados en animales, la aplicación intravascular de sonoterapia disminuyó la hiperplasia intimal tras la implantación de stents90. Sin embargo, en humanos, la sonoterapia no ha sido eficaz en lesiones de novo. En el estudio Euro-SPAH, 403 pacientes tratados con stent fueron aleatorizados para recibir tratamiento o no con sonoterapia intracoronaria, sin que se observara mejoría en los eventos clínicos y en la reestenosis91.
Braquiterapia intracoronaria
Las radiaciones ionizantes inhiben la proliferación celular y han sido utilizadas en diferentes procesos patológicos tumorales y no tumorales. Dado el paralelismo entre la proliferación neointimal de la reestenosis (especialmente en la RIS) y los procesos tumorales, la utilización de isótopos radiactivos en la prevención de la reestenosis fue relativamente precoz. La aplicación local de radioterapia tiene efecto antiproliferativo y antimigratorio sobre las células musculares lisas, y de esa forma reduce la proliferación neointimal92. El efecto positivo de la BTI sobre el remodelado vascular también contribuye a reducir la reestenosis93.
Hay 2 formas de aplicar BTI: a través de un catéter y por medio de stents radiactivos, siendo la radioterapia a través de catéter la técnica estándar. Se dispone de 2 tipos diferentes de BTI: β y γ (tabla 6). Básicamente, la β es de alta energía y baja penetración tisular y, por tanto, no precisa medidas adicionales de protección radiológica. Por el contrario, la γ tiene una baja energía, pero una penetración tisular mayor y unos tiempos de permanencia superiores, y expone al operador a una radiación significativamente superior que la β. En comparación con la γ, la β podría, en teoría, tener menos eficacia por presentar una menor penetración en la pared vascular y una exposición menos homogénea, pero en los estudios clínicos con BTI β se ha obtenido una eficacia similar a la de la γ y, dado que su aplicación ofrece menos problemas, es la que se ha utilizado habitualmente en los centros que disponen de BTI.
Aunque la BTI se ha utilizado sobre todo en la RIS, en primer lugar se aplicó en lesiones de novo94-100. En éstas, la BTI inhibe la proliferación neointimal, pero no es eficaz (tabla 4). Ello se debe fundamentalmente al efecto borde y la trombosis tardía, que son más evidentes cuanto se implanta un stent coronario. En el estudio BETA-CATH se aleatorizó a 1.455 pacientes con lesiones de novo para recibir BTI β o placebo tras el tratamiento convencional (se implantó un stent en . 50% de los pacientes) y la tasa de eventos no fue estadísticamente significativa (el 15,6% frente al 17,4%, respectivamente). En el BRIDGE, con 112 pacientes tratados con stent y aleatorizados para recibir o no BTI, la reestenosis y la necesidad de nuevos procedimientos de revascularización del segmento tratado fue más frecuente en los pacientes tratados con BTI96. En un estudio realizado en nuestro centro con 92 diabéticos, la BTI tras la implantación de un stent se asoció con una reducción significativa de la RIS, pero la tasa de nuevos procedimientos de revascularización fue similar y la tasa de muerte o infarto fue superior en el grupo de BTI100.
La BTI fue el primer dispositivo útil para el tratamiento de la RIS, y hasta el desarrollo de los SLFA ha sido su tratamiento más eficaz98,101-108 (tabla 7).
Mediante el empleo de radiación γ, en los estudios GAMMA-I y WRIST se aleatorizó, respectivamente, a 252 y 130 pacientes con RIS para recibir tratamiento con 132Ir o placebo101,103. En el SCRIPPS se aleatorizó a 55 pacientes para recibir 132Ir o placebo tras la implantación de un stent en el tratamiento de lesiones reestenóticas, 62% de las cuales eran RIS102. En estos 3 estudios se observó una tasa de recurrencia de RIS significativamente inferior con BTI. Con posterioridad se han llevado a cabo estudios en subgrupos de pacientes (lesiones largas, puentes de safena, etc.) con resultados similares105.
La mayor parte de los estudios con radiación β son posteriores a los de radiación γ. En el Beta-WRIST, con 90Y, se utilizó como grupo control el mismo que el del estudio original WRIST92 y sus resultados fueron similares a los de éste106. En el START107, la tasa de recurrencia de RIS fue significativamente inferior en los pacientes tratados con 90Sr. En el INHIBIT, con 332 pacientes, la BTI también redujo la recurrencia de RIS104. Por último, en el PREVENT, aunque la mayor parte de sus pacientes tenía lesiones de novo, el 24% tenía RIS y, en ellos, se observó una reducción de la recurrencia de RIS con BTI98.
Una de las limitaciones de la BTI en el tratamiento de la RIS es la pérdida parcial de su beneficio con el paso de los años. En el estudio GAMMA-1, por ejemplo, la reducción en la tasa de revascularización de la lesión tratada con respecto al grupo de pacientes tratados sólo con balón fue del 34, el 23, el 14 y el 11% a los 1, 2, 3 y 4 años, respectivamente. En un seguimiento de 5 años del SCRIPPS, el número de nuevos procedimientos entre 1 y 5 años fue también mayor en el grupo de BTI106.
Hay algunos estudios en marcha en los que se están comparando de forma aleatoria los SLFA y la BTI en la RIS. En un estudio, 97 RIS difusas fueron aleatorizadas para recibir tratamiento con Cypher o BTI (188Re). Tanto la recurrencia de RIS (el 2 frente al 27%; p = 0,003) como la tasa de eventos (el 4 frente al 13%; p = 0,145) fueron favorable al stent Cypher (Park SJ. Sesiones científicas de la American Heart Association, 2004). En el SISR se compara el Cypher y la BTI (β o γ) en 400 pacientes con RIS y sus resultados se conocerán durante 2005. En el TAXUS-V-ISR se está aleatorizando a 488 pacientes con RIS para recibir stent Taxus o BTI β. A pesar de estos estudios, el surgimiento de los SLFA como una estrategia eficaz en el tratamiento de la RIS, así como la disminución de la incidencia de RIS que se avecina con la utilización de los SLFA en lesiones de novo, ha hecho que los dispositivos para la aplicación de BTI de los que disponíamos en nuestro medio hayan sido recientemente retirados del mercado.
A continuación se describen de forma más detallada los problemas asociados con la BTI en el tratamiento de lesiones de novo y de la RIS:
- Efectos secundarios locales: a) la BTI retrasa la endotelización del stent, lo que puede incrementar el riesgo de trombosis tardía. En las primeras series el riesgo fue > 5%, pero estuvo asociado sobre todo a la retirada precoz (30 días) de las tienopiridinas y con la implantación de un nuevo stent100. Con la instauración de tratamiento prolongado con aspirina y tienopiridinas se ha conseguido reducir de forma importante esta complicación; b) en segundo lugar, la BTI puede asociarse a un remodelado positivo y malaposición tardía del stent, y esto también puede favorecer la trombosis tardía109; c) en tercer lugar, la BTI puede asociarse a reestenosis en los bordes o extremos de la zona irradiada (efecto borde o candy wrapper). En la fisiopatología de este fenómeno se encuentran la posibilidad de un daño vascular producido en los extremos del segmento irradiado y la heterogeneidad en la dosis recibida, con menor dosis aplicada en los extremos (geographic miss)110, y d) por último, debido a múltiples factores (tortuosidad y modificaciones del calibre del vaso, movimientos de la fuente durante el ciclo cardíaco, etc.), la dosis administrada de radiación no es homogénea en todo el segmento tratado, lo que puede contribuir a limitar parcialmente el efecto antirreestenótico de la BTI.
- Limitaciones logísticas: la utilización de BTI precisa la colaboración y coordinación con personal no dependiente del laboratorio de hemodinámica (servicio de radiofísica, etc.). Por otra parte, cuando se aplica radiación γ es necesario acondicionar la sala de hemodinámica. Todo ello ha contribuido a que el número de centros en los que se ha desarrollado esta técnica sea muy escaso.
- Eliminación frente a retraso de la reestenosis. Dado que la radioterapia produce una despoblación de células musculares lisas, teóricamente sólo se precisaría un mayor número de divisiones celulares (y, por tanto, más tiempo) para producir al final el mismo grado de proliferación intimal. Esto realmente no es así, pues el proceso de la reestenosis puede agotarse antes de que esto ocurra. Lo que sí se produce con los años es una pérdida parcial del beneficio obtenido con la BTI. En algunos estudios se ha observado una disminución significativa del diámetro luminal mínimo y un aumento del número de nuevos procedimientos de revascularización entre 6 meses y 2-3 años102,103.
- Coste. La BTI supone un incremento significativo del coste del ICP, no sólo por el precio del material utilizado, sino también por el coste derivado de organizar la infraestructura necesaria para realizar esta técnica. Aunque parte de este coste es compensado por la disminución en la necesidad de nuevos procedimientos de revascularización del vaso tratado, el coste final sigue siendo superior al de las técnicas convencionales.
Todas estas limitaciones han llevado a que el uso de la BTI haya sido minoritario, incluso en el tratamiento de la RIS. Esto ha hecho que, junto con la aparición de los SLFA, los dispositivos de BTI de los que disponíamos hayan sido retirados por los fabricantes y, por tanto, que desde el punto de vista práctico haya desaparecido la BTI del arsenal terapéutico del cardiólogo intervencionista, al menos en nuestro medio.
La utilización de stents radiactivos reduce la hiperplasia intra-stent en comparación con los stents convencionales. Sin embargo, la tasa de reestenosis de los bordes es muy elevada ( ~ 40%) debido a que, por definición, la zona irradiada (el stent) no llega a cubrir la totalidad de la zona dañada por el balón111. Esto ha impedido que hayan llegado a utilizarse en la práctica clínica.
CONCLUSIONES Y PERSPECTIVAS DE FUTURO
Los stents Cypher y Taxus han demostrado reducir de forma importante la reestenosis y la necesidad de nuevos procedimientos de revascularización. Este beneficio se mantiene al menos durante 3 años. No obstante, para que la utilización de estos stents se generalice a todo tipo de lesiones y pacientes deberá reducirse su coste. Por otra parte, si los resultados de los estudios en los que se comparan los SLFA con la cirugía en pacientes con enfermedad multivaso son favorables a los SLFA, probablemente se reducirá la proporción de pacientes revascularizados mediante procedimientos quirúrgicos.
Hay otros SLFA recientemente comercializados o que lo serán en breve, pero se deberá demostrar su eficacia en estudios aleatorizados de equivalencia en comparación con los stents Cypher o Taxus. En los próximos años se evaluarán SLFA con polímeros o incluso plataformas biodegradables, con objeto de minimizar el riesgo de trombosis tardía del stent y eliminar la posibilidad de que ocurran reacciones alérgicas o de hipersensibilidad tardía. Hay estudios en marcha con stents cubiertos de anticuerpos monoclonales que atraen células precursoras de las células endoteliales, con objeto de acelerar la endotelización del stent. Otras líneas son los stents con combinación de fármacos (antiproliferativos y fármacos que mejoran la función endotelial, etc.). Por otra parte, la terapia génica también se está evaluando en la prevención de la reestenosis, aunque la demostración de su eficacia y su posible aplicación clínica probablemente están aún lejanas.
A pesar de que la BTI ha demostrado ser más eficaz que el balón en la RIS, su utilización ha sido minoritaria. La reciente aparición de los SLFA ha hecho que el número de pacientes tratados con BTI haya sido mínimo en los últimos 2 años. Ello ha hecho que los fabricantes hayan decidido retirar los dispositivos de BTI por lo que, desde el punto de vista práctico, la BTI ha desaparecido en nuestro medio.
En cuanto al resto de los dispositivos, el BC y la AR pueden tener todavía un papel en la era de los SLFA, al facilitar la implantación de estos stents en lesiones especialmente complejas y/o calcificadas.
AGRADECIMIENTOS
Agradezco a los Dres. Fernando Alfonso, Manuel Sabaté, Rosana Hernández y Carlos Macaya la revisión crítica de este artículo.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. R. Moreno.
Unidad de Cardiología Intervencionista. Hospital Clínico San Carlos.
Martín Lagos, s/n. 28040 Madrid. España.
Correo electrónico: raulmorenog@terra.es