Clásicamente, la sobrecarga oral de glucosa ha diagnosticado la diabetes desconocida. Recientemente, la American Diabetes Association ha aceptado un valor de glucohemoglobina ≥ 6,5% como criterio de diabetes desconocida. Pretendemos conocer la rentabilidad que tiene la glucohemoglobina para la detección de diabetes desconocida y validar un modelo que permita ajustar la realización de la sobrecarga oral de glucosa en enfermos coronarios.
MétodosSe estudia el perfil glucémico de 338 enfermos coronarios sin diabetes conocida. Se usan los criterios de la American Diabetes Association de 2010 y, mediante regresión logística, se construye un modelo predictor de diabetes desconocida. Se valida el modelo en otra cohorte.
ResultadosSe diagnosticó diabetes desconocida a 26 enfermos mediante glucohemoglobina y/o glucemia basal. Los demás presentaban, tras realizar sobrecarga oral de glucosa: diabetes desconocida, 53 (17%); prediabetes, 144 (46,2%), y normoglucemia, 115 (36,8%). Método diagnóstico de diabetes desconocida: glucemia basal, 25,3%; glucohemoglobina, 7,6%, y sobrecarga oral de glucosa, 67,1%. Un modelo que incluye glucemia basal, glucohemoglobina, fracción de eyección de ventrículo izquierdo, edad y enfermedad vascular no coronaria resultó eficaz como predictor de diabetes desconocida tras sobrecarga oral de glucos: área bajo la curva ROC, 0,8 (intervalo de confianza del 95%, 0,74-0,87). Realizando sobrecarga oral de glucosa sólo a la población con puntuación del modelo > 6 (el 31% del total), podemos localizar al 83% de los casos de diabetes desconocida reales (sensibilidad, 75%; especificidad, 73%; valor predictivo positivo, 40%; valor predictivo negativo, 93%). El modelo se validó correctamente en otra cohorte de 115 pacientes (área bajo la curva ROC, 0,84 [intervalo de confianza del 95%, 0,74-0,95]).
ConclusionesLa glucohemoglobina diagnostica aisladamente pocos casos de diabetes desconocida. Sin embargo, su incorporación a un modelo de riesgo permite optimizar la indicación de la sobrecarga oral de glucosa, con un aprovechamiento óptimo.
Palabras clave
La incidencia de la diabetes está aumentando en la población general1 y este incremento tiene repercusiones negativas en varias enfermedades, con lo que da lugar a un grave problema de salud pública. Por consiguiente, en los últimos años se han presentado muchos estudios que describen la relación entre la hiperglucemia y la enfermedad coronaria, desde su valor pronóstico en el síndrome coronario agudo2, 3 hasta su elevada prevalencia, no siempre bien diagnosticada, en pacientes con enfermedad coronaria4, 5.
Dada la alta prevalencia de un metabolismo de la glucosa anormal en los pacientes coronarios, es de sumo interés el diagnóstico de la diabetes desconocida (DD). Se ha demostrado que la DD es predictor de mal pronóstico en los pacientes con enfermedad coronaria6. El diagnóstico precoz de la DD sería útil, ya que los datos existentes indican que un inicio inmediato del tratamiento antidiabético mejora el pronóstico7.
Para intentar abordar este problema no resuelto, la Sociedad Europea de Cardiología y la European Society for the Study of Diabetes publicaron conjuntamente unas guías8 en las que se recomendaba realizar una prueba de sobrecarga oral de glucosa (SOG) a todos los pacientes sin una diabetes conocida a los que se diagnosticara una enfermedad cardiovascular (recomendación de clase I, nivel de evidencia B). Sin embargo, el empleo de la SOG no está ampliamente difundido en la práctica médica cotidiana actual. Hay varias razones que podrían explicar este hecho: la carga económica, los posibles efectos secundarios, la variabilidad técnica9 e incluso la diferente fiabilidad en función de diferentes escenarios clínicos10, 11.
En 2010, como consecuencia del uso generalizado de la glucohemoglobina (A1C) estandarizada a través del National Glycohemoglobin Standardization Program (NGSP)12, la American Diabetes Association (ADA) aceptó finalmente un valor de A1C ≥ 6,5% como un criterio diagnóstico adicional para la diabetes13.
Hasta esta reciente inclusión de la A1C, la SOG era el mejor método disponible para el diagnóstico de la DD. Así pues, desde el punto de vista del beneficio diagnóstico, tanto la extensión del uso de la prueba a todos los pacientes con enfermedad coronaria como el momento en que conviene realizarla pueden ser cuestiones controvertidas, sobre todo cuando no estamos seguros del valor añadido que aporta la inclusión de la A1C como criterio diagnóstico en esta población.
Nuestro grupo ha publicado ya un estudio sobre la detección de la DD tras la realización de una SOG a 338 pacientes coronarios a los que se practicó un intervencionismo coronario percutáneo (ICP)14. Los objetivos del presente estudio, mediante un nuevo análisis de la mencionada serie, son los siguientes: a) evaluar el valor añadido de la A1C para el diagnóstico de la DD en nuestra población, y b) validar un modelo que utilice variables clínicas y analíticas para optimizar el rendimiento de la SOG en los pacientes con el riesgo más elevado de sufrir una DD.
MÉTODOSPoblación de pacientesLa metodología básica del estudio se ha descrito ya con anterioridad14. De modo resumido, se trata de un estudio prospectivo observacional, llevado a cabo mediante el empleo de SOG en una serie de pacientes consecutivos tratados con revascularización mediante ICP entre el 1 de noviembre de 2005 y el 31 de mayo de 2006. Se excluyó del estudio a los pacientes con un diagnóstico previo de una diabetes conocida, a los que fueron tratados con ICP primaria debido a un síndrome coronario agudo con elevación del ST y a los que no firmaron el consentimiento informado (Figura 1).
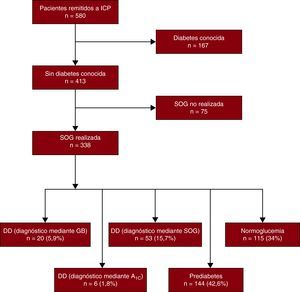
Figura 1. Distribución de la población remitida a un intervencionismo coronario percutáneo. A1C: glucohemoglobina; DD: diabetes desconocida; GB: glucemia basal; ICP: intervencionismo coronario percutáneo; SOG: sobrecarga oral de glucosa.
Durante el ingreso, se recogió una serie de datos clínicos y de exploración física en una entrevista clínica. A las 2 semanas del alta, se determinó un panel metabólico completo, que incluía una SOG con 75 g de glucosa, valores basales de insulinemia, A1C (Adams A1C; Nichols Institute Diagnostics, San Clemente, California, Estados Unidos), microalbuminuria y perfiles lipídico, hepático y renal. Los análisis de laboratorio se realizaron según la práctica habitual del departamento de bioquímica. La A1C, que se determinó inicialmente con el método japonés, se convirtió luego a unidades NGSP con el empleo de ecuaciones de conversión validadas15 utilizando un sistema informático de nuestro laboratorio.
Todos los pacientes incluidos firmaron el formulario de consentimiento informado, y el estudio fue aprobado por el comité de investigación de nuestro centro.
Estratificación del estado glucometabólicoEl diagnóstico de diabetes conocida se estableció en función del diagnóstico previo del médico encargado del paciente. Los demás pacientes, sin diabetes conocida, fueron candidatos a la realización de la SOG. Se extrajeron muestras para la determinación de la glucemia basal (GB) y se volvió a obtener muestras a las 2 h de la toma de 75 g de glucosa (Glu-2h); en ambos casos la determinación se realizó en mg/dl.
Se utilizaron los criterios de la ADA de 201013 para la estratificación del estado glucometabólico; los pacientes se clasifican de la siguiente forma:
• Normoglucemia: GB<100+Glu-2h<140.
• Glucemia basal alterada: GB≥100 y<126+Glu-2h<140.
• Intolerancia a la glucosa: GB<126+Glu-2h≥140 y<200.
• Diabetes: GB≥126 o Glu-2h≥200 o A1C≥6,5%.
• Prediabetes: incluye la glucemia basal alterada y la intolerancia a la glucosa.
Definición de los métodos de diagnóstico de la DD:
• Diagnóstico de la DD mediante la GB, definida como de GB≥126.
• Diagnóstico de la DD mediante la A1C, definida como GB<126 y A1C≥6,5%.
• Diagnóstico de DD mediante SOG, definida como GB<126, A1C<6,5% y Glu-2h≥200.
Para elaborar un modelo de predicción de la DD basándose en la SOG, se excluyó a los pacientes con GB≥126mg/dl o A1C≥6,5%, dado que en estos casos la diabetes podía diagnosticarse sin los resultados proporcionados por la SOG.
Tras la elaboración de un modelo de predicción de la DD, se estudió el beneficio aportado por diferentes valores de corte. Además, se evaluó la exactitud diagnóstica de los otros dos modelos, en los que se limita el uso de la SOG a los pacientes con una glucemia basal alterada según los criterios de la ADA y la Organización Mundial de la Salud (OMS) (GB>100 y GB>110mg/dl, respectivamente).
Análisis estadísticoLas variables categóricas se presentan mediante las frecuencias absolutas y relativas, y las variables continuas se presentan con la media±desviación estándar. La significación de las diferencias basales se determinó con la prueba de χ2, la prueba exacta de Fisher o la prueba no paramétrica, según fuera apropiado. Se consideró que un valor de p bilateral < 0,05 indica significación estadística. Se utilizaron modelos de regresión logística binarios univariables y multivariables para determinar la contribución de las diversas variables al parámetro de valoración final (diabetes desconocida). Si la significación estadística de la regresión univariable era de p<0,2, solamente la variable que se consideraba clínicamente significativa se introducía en el modelo multivariable escalonado y de eliminación retrógrada. Las variables incluidas en el modelo multivariable fueron las siguientes: edad, presencia de síndrome coronario agudo, extensión de la enfermedad coronaria, fracción de eyección ventricular izquierda, A1C, resistencia a la insulina, GB, enfermedad vascular no coronaria, hipertensión, tabaquismo actual e índice de masa corporal.
Para desarrollar una puntuación pronóstica práctica, asignamos una puntuación ponderada proporcional a los valores de odds ratio (OR) (con un redondeo al número entero más próximo) a los factores de riesgo identificados mediante el análisis multivariable. Se calculó entonces una puntuación de riesgo para cada paciente, y se dividió a la población en tres categorías de riesgo de DD: riesgo bajo (0 a 5 puntos), riesgo intermedio (6 a 10 puntos) y riesgo alto (11 puntos o más). Calculamos también la sensibilidad, la especificidad y los valores predictivos positivo y negativo de nuestra puntuación para diferentes valores de corte, con objeto de compararla con otros métodos diagnósticos de la diabetes.
Entre el 15 de enero y el 15 de junio de 2008, se registró una segunda serie de pacientes con enfermedad coronaria ingresados consecutivamente, aunque a diferencia de la primera cohorte, no todos los pacientes fueron tratados con revascularización. Esta serie se utilizó como cohorte de validación; se determinaron los mismos parámetros clínicos y analíticos. Por último, evaluamos el rendimiento de la puntuación para la predicción de la DD en la cohorte de desarrollo y en nuestra cohorte de validación independiente de 115 pacientes. Con objeto de evaluar la capacidad de discriminación, se determinó el área bajo la curva ROC (AUC). Comparamos el AUC de la cohorte inicial con la de la cohorte de validación utilizando una distribución asintótica.
RESULTADOSCaracterísticas y estado glucometabólico de la poblaciónDurante el periodo de estudio, se practicó una ICP a 580 pacientes, de los que 167 tenían un diagnóstico previo de una diabetes conocida. De los pacientes sin diagnóstico previo de diabetes conocida, se realizó una SOG al 82% (338/413) (Figura 1). En 26 de estos 338 pacientes, la DD pudo diagnosticarse sin la prueba de SOG a las 2 h (20 tenían GB≥126mg/dl y 6, A1C≥6,5%). Se clasificó a los 312 pacientes restantes de la siguiente forma: DD, 17%; glucemia basal alterada, 9%; intolerancia a la glucosa, 37,2%, y normoglucemia, 36,8%. Las características clínicas y analíticas de esta población se muestran en las Tabla 1, Tabla 2.
Tabla 1. Perfil clínico de los pacientes incluidos en las cohortes de desarrollo de la puntuación y de validación
| Cohorte de desarrollo de la puntuación, 2005-2006 (n=312) | Cohorte de validación, 2008 (n=108) | p | |
| Edad (años) | 66±18,1 | 63±22,7 | 0,06 |
| Sexo masculino n (%) | 251 (80,5) | 86 (79,6) | 0,9 |
| Obesidad n (%) | 115 (36,8) | 42 (38,9) | 0,5 |
| Antecedentes familiares de diabetes n (%) | 80 (25,6) | 15 (13,9) | 0,01 |
| Perímetro de cintura (cm) | 97,5±10,5 | 100±10,5 | 0,2 |
| Dislipemia n (%) | 149 (47,7) | 60 (55,6) | 0,16 |
| Hipertensión n (%) | 155 (49,7) | 43 (39,8) | 0,08 |
| Tabaquismo actual n (%) | 86 (27,5) | 32 (29,6) | 0,7 |
| Enfermedad vascular no coronaria n (%) | 50 (16) | 11 (10,2) | 0,14 |
| IM previo n (%) | 118 (37,8) | 33 (30,6) | 0,18 |
| Revascularización coronaria previa n (%) | 47 (15,1) | 43 (39,8) | < 0,001 |
| SCA n (%) | 240 (76,9) | 58 (53,7) | < 0,001 |
| FEVI | 62±8,3 | 60±12 | 0,3 |
| Tratamiento al incorporarse al estudio | |||
| Bloqueadores beta n (%) | 236 (75,6) | 84 (78,5) | 0,51 |
| IECA/ARA n (%) | 120 (38,5) | 60 (55,5) | 0,01 |
| Estatinas n (%) | 253 (81,1) | 100 (92,6) | 0,01 |
ARA: antagonistas del receptor AT1 de la angiotensina II; FEVI: fracción de eyección ventricular izquierda; IECA: inhibidor de la enzima de conversión de la angiotensina; IM; infarto de miocardio; SCA: síndrome coronario agudo.
Las variables categóricas se expresan en forma de valores absolutos y porcentajes y las variables numéricas, en forma de media±desviación estándar. Obesidad: índice de masa corporal > 30. La enfermedad vascular no coronaria incluye la enfermedad vascular periférica y la cerebrovascular.
Tabla 2. Perfil analítico de los pacientes incluidos en las cohortes de desarrollo de la puntuación y de validación
| Cohorte de desarrollo de la puntuación, 2005-2006 (n=312) | Cohorte de validación, 2008 (n=108) | p | |
| DD | 53 (17) | 24 (22,2) | 0,3 |
| Prediabetes | 144 (46,2) | 38 (35,2) | 0,07 |
| Normoglucemia | 115 (36,8) | 46 (42,5) | 0,23 |
| Bioquímica | |||
| A1C (NGSP) (%) | 5,5±0,5 | 5,6±0,5 | 0,02 |
| cLDL (mg/dl) | 88,9±38,7 | 96,7±46,4 | 0,02 |
| Triglicéridos (mg/dl) | 106,3±70,8 | 106,3±88,6 | 0,45 |
A1C (NGSP): glucohemoglobina determinada con el método del National Glycohemoglobin Standardization Program; cLDL: colesterol unido a lipoproteínas de baja densidad; DD: diabetes desconocida.
La prediabetes incluye la glucemia basal alterada y la intolerancia a la glucosa.
Las variables categóricas se expresan en valores absolutos y porcentajes y las variables numéricas, en forma de media±desviación estándar.
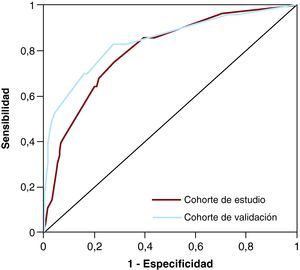
Los factores independientes que predecían DD se indican en la Tabla 3. Los factores más potentes en nuestro modelo fueron una A1C>6,1% (6 puntos en la puntuación) y la GB > 100mg/dl (5 puntos). Se asignaron 3 puntos a los demás factores predictivos (edad > 65 años, presencia de enfermedad vascular no coronaria y fracción de eyección ventricular izquierda<45%). Según el riesgo de presentar DD, clasificamos a los pacientes de la siguiente forma: < 6 puntos, probabilidad de DD baja (8%); 6-11 puntos, probabilidad de DD intermedia (30%); > 11 puntos, probabilidad de DD alta (63%) (AUC: 0,8; intervalo de confianza [IC] del 95%, 0,74-0,87) (Figura 2).
Tabla 3. Análisis multivariable para la predicción del riesgo de diabetes desconocida diagnosticada mediante la prueba de sobrecarga oral de glucosa
| p | OR | IC del 95% | Puntos | |
| GB>100 mg/dl | < 0,001 | 4,74 | 2,4-9,5 | 5 |
| Edad>65 años | 0,015 | 2,85 | 1,2-5,2 | 3 |
| Enfermedad vascular no coronaria | 0,018 | 2,65 | 1,2-5,9 | 3 |
| A1C (NGSP)>6,1% | 0,009 | 5,8 | 1,5-21,7 | 6 |
| FEVI < 45% | 0,04 | 2,7 | 1,03-7 | 3 |
A1C (NGSP), glucohemoglobina determinada con el método del National Glycohemoglobin Standardization Program; FEVI: fracción de eyección ventricular izquierda; GB: glucemia basal; IC: intervalo de confianza; OR: odds ratio.
La enfermedad vascular no coronaria incluye la enfermedad vascular periférica y la cerebrovascular.
Todas las variables se analizaron como variables categóricas. Se asigna una puntuación a cada uno según su odds ratio.
Figura 2. Curvas ROC de los modelos utilizados para determinar la puntuación de riesgo de diabetes desconocida en la cohorte de desarrollo de la puntuación (AUC=0,8) y en la cohorte de validación (AUC=0,84). Se observa que no hay diferencias en las curvas del comportamiento ROC para la cohorte de desarrollo de la puntuación respecto a la cohorte de validación (p=0,49). AUC: área bajo la curva; ROC: receiver operating characteristic.
Utilidad diagnóstica de los diferentes modelosEn la Tabla 4 se muestra cómo el AUC de nuestro modelo es superior a otros que limitarían la SOG a los pacientes que presenten GB alterada, ya sea definida con criterios de la OMS o con criterios ADA. En nuestro modelo, un valor de corte > 6 proporciona una sensibilidad del 75%, una especificidad del 73%, un valor predictivo positivo del 40% y un valor predictivo negativo del 93%.
Tabla 4. Rendimiento de los diferentes modelos para la detección sistemática de la diabetes desconocida mediante la prueba de sobrecarga oral de glucosa
| Riesgo alto, % | Sensibilidad, % | Especificidad, % | VPP, % | VPN, % | Índice de Youden | AUC (IC del 95%) | |
| Modelo de la ADA (si GB>100 mg/dl) | 37,9 | 69 | 69 | 33 | 91 | 38 | 0,69 a (0,62-0,76) |
| Modelo de la OMS (si GB>110 mg/dl) | 13,4 | 42 | 93 | 13 | 84 | 35 | 0,67 a (0,58-0,75) |
| Puntuación del modelo>6 | 33,7 | 75 | 73 | 40 | 93 | 48 | 0,8 a (0,74-0,87) |
| Puntuación del modelo>2 | 69,5 | 96 | 29 | 25 | 95 | 25 | 0,8 a (0,74-0,87) |
| Puntuación del modelo>11 | 2,9 | 11 | 99 | 81 | 14 | 10 | 0,8 a (0,74-0,87) |
ADA: American Diabetes Association; AUC: área bajo la curva; GB: glucemia basal; IC: intervalo de confianza; OMS: Organización Mundial de la Salud; Riesgo alto: porcentaje de la población que cumple el criterio; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
a p<0,001.
La validación de la puntuación se llevó a cabo con una nueva serie de 115 pacientes sin diabetes conocida. A 6 de estos pacientes se les diagnosticó DD mediante la GB; a 1 paciente, mediante la A1C, y los otros 108 pacientes constituyeron la cohorte de validación. Las características de esta cohorte se muestran en las Tabla 1, Tabla 2.
En la cohorte de validación, los modelos de la ADA (sensibilidad, 68%; especificidad, 73%; AUC=0,69 [IC del 95%, 0,57-0,82]) y de la OMS (sensibilidad, 25%; especificidad, 89%; AUC=0,57 [IC del 95%, 0,44-0,71]) no proporcionan una buena discriminación. En cambio, en nuestro modelo, los pacientes con un resultado < 6 puntos presentaron una probabilidad de DD del 13%; los que tenían 6-11 puntos, del 32%, y los que tenían > 11 puntos, del 83%. En esta población, el AUC fue de 0,84 (IC del 95%, 0,74-0,95). En la Figura 2 se muestra la capacidad predictiva positiva del modelo, tanto en la cohorte de determinación de la puntuación como en la cohorte de validación. No se observan diferencias entre las AUC de ambas curvas (p=0,49).
DISCUSIÓNEn este estudio se han obtenido algunos resultados interesantes: a) la A1C carece de utilidad por sí sola para determinar la DD en una población con enfermedad coronaria previa; b) la mayoría de los diagnósticos de DD se establecieron mediante SOG, y c) una puntuación de riesgo basada en variables clínicas y analíticas resulta útil para delimitar una población de riesgo alto en que la SOG es más efectiva.
En total, se identificó a 79 pacientes con DD. El diagnóstico se obtuvo mediante la SOG en 53 pacientes (67,1%), mediante la GB en 20 (25,3%) y mediante la A1C en 6 (7,6%). Así pues, si aplicamos un examen de detección sistemático de la DD a la población coronaria empleando únicamente la GB y la A1C, no identificaremos a la inmensa mayoría de los pacientes que han sido diagnosticados mediante la SOG. La adición de la A1C a la GB no proporciona un aumento significativo del número de diagnósticos.
¿Por qué nos centramos en el diagnóstico de la DD en vez del diagnóstico tanto de la DD como de la prediabetes? Un diagnóstico de prediabetes no modificará significativamente la prevención secundaria, ya que el cambio del estilo de vida se incluye ya en las recomendaciones que se dan a esos pacientes16 y, además, su valor pronóstico no está confirmado17. En cambio, y según las guías europeas8, un diagnóstico de DD haría necesaria la prescripción de metformina e inhibidores de la enzima de conversión de la angiotensina y modificaría sustancialmente los objetivos de control de la presión arterial y de colesterol de las lipoproteínas de baja densidad. Además, la DD tiene una repercusión pronóstica a 1 año ya demostrada6, y hay datos que indican que si estos pacientes iniciaran un tratamiento antidiabético, podría observarse una diferencia de evolución a corto plazo7.
La SOG ha sido considerada el mejor método de detección precoz de las anomalías del proceso de regulación de la glucosa, y en especial de la DD8. En este sentido, el trabajo de Tabak et al.18 ilustra, de una forma muy académica, que la glucemia posprandial sufre una alteración varios años antes que la GB en una serie de pacientes que finalmente sufrieron diabetes. En la población general, la SOG dobla el número de diagnósticos de diabetes en comparación con la GB (el 3,5 frente al 7,3%)19, mientras que en la población coronaria esta diferencia puede aumentar en 5 veces (el 5,3 frente al 26,9%)5. Sin embargo, a pesar de su utilidad evidente, la SOG no es aún un instrumento de uso frecuente para la detección de la DD en la población coronaria. Esto se debe a múltiples factores, como ya se ha comentado. El posible valor añadido de la A1C en el diagnóstico de la DD en esta población continúa sin conocerse.
El objetivo de nuestro grupo ha sido optimizar, y en ningún momento cuestionar, la idoneidad de la SOG para identificar a los pacientes con DD. Hemos elaborado una puntuación sencilla, que va de 0 a 20 y que incluye variables tanto analíticas como clínicas. Cada variable incluida en la puntuación se ponderó con el empleo del entero más próximo a su OR. Las variables predictivas más potentes en nuestra puntuación fueron las que indican un escenario de regulación anormal de la glucosa (A1C y GB); la edad avanzada aportaría información acerca de la mayor resistencia a la insulina existente en este grupo de edad18. La presencia de una enfermedad vascular no coronaria puede estar relacionada con el hecho de que hasta el 50% de los diabéticos presentan algún tipo de complicación en el momento del diagnóstico20, mientras que una fracción de eyección ventricular izquierda baja correspondería a una mayor extensión de la enfermedad coronaria en esos pacientes14.
Si realizáramos la SOG únicamente a los pacientes con una puntuación > 6 (el 31% de la población total) y añadiéramos esto a la DD identificada mediante la GB y la A1C, estaríamos diagnosticando de manera efectiva al 83% del total de casos de DD en nuestra población. Esta puntuación ha sido validada en una segunda cohorte, y se ha demostrado que constituye un modelo igual de útil y reproducible. Es evidente que esta puntuación no es perfecta, ya que no detecta un 17% de la DD, pero sólo sería necesario realizar la SOG a una tercera parte de la población en un momento en el que esta prueba es claramente infrautilizada. Además, si deseáramos identificar todos los casos de DD, bastaría con reducir el valor de corte a 2, con lo que se alcanzaría un valor predictivo negativo del 95%. Sin embargo, en este caso, el precio a pagar sería la realización de la SOG al 64% de la población.
Nuestra puntuación pretende tan sólo optimizar la idoneidad de la SOG en la población coronaria, de la misma manera que otros grupos de científicos limitan su uso en la población general debido a la presencia de factores de riesgo21, 22.
LimitacionesLa A1C utilizada cuando se llevó a cabo el estudio no fue la estandarizada (NGSP), que nuestro laboratorio adoptó en una fecha posterior. Una conversión validada internacionalmente, realizada después por nuestro laboratorio, nos permitió calcular la equivalencia.
Aunque las guías de práctica clínica13 recomiendan la repetición de la SOG para la confirmación de la DD, en nuestro estudio, como en muchos otros4, 5, esto no se aplicó por razones de logística. La cohorte de validación es similar, aunque no exactamente idéntica, a la cohorte original. Aunque este hecho podría considerarse una limitación, no creemos que lo sea, dado que no todas las poblaciones de pacientes coronarios tienen que ser iguales. En nuestro caso, la población original incluía a pacientes a los que se habían practicado ICP, y la cohorte de validación incluía a pacientes ingresados en nuestro servicio de cardiología. Así pues, aunque es indudable que hay algunas diferencias, la puntuación continúa siendo válida en ambos grupos. A pesar de que se prevé que el AUC en la cohorte de validación será inferior al AUC de la cohorte de desarrollo de la puntuación, de hecho es ligeramente superior, aunque sin diferencias significativas.
Nuestro estudio describe la experiencia de un solo centro y utiliza una serie de pacientes relativamente pequeña, si bien los resultados concuerdan con los de otros estudios publicados en series más amplias. Es precisamente en este tipo de series donde esta puntuación debería validarse, y ello debe considerarse por el momento una propuesta.
CONCLUSIONESAñadir sistemáticamente la A1C al uso de la GB permite diagnosticar tan sólo unos pocos casos de DD en la población coronaria. Sin embargo, cuando se añade la A1C a un modelo de riesgo que combina el valor de la GB con otras variables clínicas, puede ser útil para optimizar el uso de la SOG. De esta forma, la realización de la SOG a tan sólo una tercera parte de la población total nos permite identificar al 83% de los pacientes con DD.
FINANCIACIÓNEste estudio fue financiado por una beca de investigación clínica de la Sociedad Española de Cardiología.
CONFLICTO DE INTERESESNinguno
Agradecimientos
Queremos dar las gracias a Pablo Martínez-Crespo e Itziar Gómez-Salvador por su apoyo estadístico.
Recibido 10 Diciembre 2010
Aceptado 17 Marzo 2011
Autor para correspondencia: Departamento de Cardiología, Hospital Universitario Central de Asturias, Julián Clavería s/n, 33006 Oviedo, Asturias, España. jesusdelahera@gmail.com