Actualmente, más del 85% de los pacientes que nacen con una cardiopatía congénita alcanzan la vida adulta, muchos de ellos gracias a procedimientos quirúrgicos o hemodinámicos realizados durante la infancia. De los pacientes mayores de 18 años con cardiopatías congénitas, se estima que casi un 20% necesitan en algún momento de su evolución un procedimiento intervencionista, la mayor parte de las veces quirúrgico, debido bien a diagnósticos fuera de la edad infantil en el caso de las cardiopatías más benignas, bien a la existencia de lesiones residuales, secuelas y/o complicaciones en el caso de las formas más complejas intervenidas en etapas precoces de la vida. La intervención o la reintervención de estos pacientes durante la edad adulta, excluido el grupo más sencillo de las comunicaciones interauriculares con o sin drenaje venoso pulmonar anómalo asociado, constituyen una nueva subespecialidad de la cirugía cardiovascular, con tendencia general a que las realicen cirujanos cardiacos que habitualmente operan cardiopatías congénitas. Cuando estas afecciones alcanzan un estadio final debido a la disfunción severa de uno o ambos ventrículos, problemas técnicos quirúrgicos que impliquen alto riesgo para una cirugía convencional o la presencia de hipertensión pulmonar secundaria a enfermedad vascular pulmonar, todavía restan como armas terapéuticas los trasplantes de órganos intratorácicos: corazón y pulmones, sea en bloque o por separado.
El objeto de este artículo es la revisión retrospectiva del subgrupo más complejo de congénitos adultos intervenidos en la Unidad de Cardiopatías Congénitas del Adulto del Hospital La Paz, aquellos que habían sufrido operaciones previas, bien para reparar una cardiopatía sólo paliada, bien para tratar lesiones residuales o secuelas de una cardiopatía previamente corregida, así como reflejar la experiencia del Hospital Puerta de Hierro en el trasplante de órganos intratorácicos en adultos con cardiopatías congénitas.
Palabras clave
Desde mayo de 1991 hasta mayo de 2009 se han realizado 364 cirugías cardiotorácicas mayores en la Unidad de Cardiopatías Congénitas del Adulto (UCA) del Hospital La Paz, con baja mortalidad (4,3%). El número de pacientes operados anualmente permanece casi constante entre 20 y 25, probablemente debido al auge de procedimientos hemodinámicos intervencionistas, a pesar del continuo aumento de enfermos en seguimiento cardiológico1–3.
Una gran parte de los pacientes operados de cardiopatías congénitas en la edad adulta tienen intervenciones previas. Concretamente en nuestra serie, 117 de las 364 cirugías (casi 1/3 del total) eran en pacientes que habían sido ya operados. Si nos ceñimos a los últimos 5 años, este grupo supone el 45% de las cirugías que estamos realizando.
Son pocos los artículos que tratan específicamente sobre reintervenciones de pacientes con operaciones congénitas previas4–6 y creemos que nunca se han publicado resultados de series nacionales. En este trabajo se analizan retrospectivamente estas 117 cirugías, aplicando análisis estadístico para identificar factores de riesgo de mortalidad hospitalaria7–9, se describen detalles de técnica quirúrgica en los grupos diagnósticos más frecuentes y de mayor riesgo y se aportan datos de seguimiento tardío.
Pacientes y métodosDesde 1991 se han realizado 117 cirugías mayores, 113 con circulación extracorpórea (CEC), en 108 pacientes ya operados previamente. Estudiamos los resultados de estas 117 intervenciones, aplicando análisis estadístico con SPSS 15.0.
Del total, 114 fueron intervenciones primarias, mientras que 3 fueron secundarias, definidas estas últimas como las que se realizaron antes del alta (el 2,8% de necesidad de reintervención durante un mismo ingreso hospitalario).
De todos los casos, 73 tenían una cirugía previa, 35 tenían dos, 6 tenían tres, 2 tenían cuatro y 1 se había operado hasta en cinco ocasiones anteriormente.
Había 62 varones (el 53% de las cirugías) y 55 mujeres. La media ± desviación estándar (DE) de edad en el momento de la reintervención fue 31,8 ± 11,4 años; mediana, 30,2 años (intervalo intercuartílico [IQR], 12,3). La media de intervenciones previas fue 1,49 ± 0,75.
Son múltiples las formas de clasificar a este grupo tan heterogéneo de pacientes, ya que el diagnóstico de su cardiopatía original en pocos casos coincide con el motivo de su presentación para cirugía después de la primera intervención10. En la tabla 1 hemos recogido los diagnósticos, agrupados según una escala de riesgo quirúrgico, la RACHS-1 (risk adjustment for congenital heart surgery)11, con los que los pacientes fueron llevados a nuestra sesión medicoquirúrgica. Ésta es una escala fruto de un estudio multicéntrico en clínicas de primer nivel de Estados Unidos, que predice la mortalidad hospitalaria de distintas técnicas quirúrgicas aplicadas a pacientes congénitos menores de 18 años, estratificándolos en 6 categorías de riesgo, desde el 0,4% de la categoría 1 a la que pertenece, por ejemplo, la reparación de una comunicación interauricular, hasta el 47,7% de la categoría 6, a la que pertenece una cirugía tipo Norwood como primer tiempo de la paliación de un corazón izquierdo hipoplásico.
Diagnósticos según categoría de RACHS-1 en las 117 reoperaciones
| Categoría RACHS-1 | Pacientes (n) | Enfermedades concomitantes |
| Categoría 1 | 5 | |
| CIA | 3 | + BAV (1 pac) |
| Ductus | 1 | |
| Ligadura de vena vertical | 1 | |
| Categoría 2 | 34 | |
| Ventrículo único | 5 | |
| CIV | 5 | + EP (2 pac), IAo (1 pac) |
| Lesiones del VD | ||
| EP, fallo conducto VD-AP | 8 | + CIA (1 pac), CIV (2 pac) |
| IP | 10 | + CIA (2 pac), CIV (1 pac) |
| Tetralogía de Fallot | 3 | |
| VD bicameral | 1 | |
| Lesiones del VI | ||
| EAo | 1 | |
| IAo | 1 | |
| Categoría 3 | 78 | |
| Ventrículo único | 4 | |
| AP-CIV | 2 | |
| Lesiones del VD | ||
| IT | 15 | + CIA (6 pac), CIV (1 pac), EP (3 pac), IP (5 pac) |
| Ebstein | 2 | + CIA (2 pac) |
| EP, fallo conducto VD-AP | 8 | + Ductus (1 pac), CIV (2 pac) |
| IP | 1 | |
| Tetralogía de Fallot | 2 | + IAo (1 pac), IT (1 pac) |
| Lesiones del VI | ||
| EAo | 10 | + EAo subvalvular (3 pac), EAo supravalvular (2 pac), aneurisma de aorta (1 pac), IM (1 pac) |
| IAo | 12 | + CIA (1 pac), CIV (2 pac), ventrículo único (1 pac), EP (1 pac), IP (2 pac), IT (1 pac), IM (2 pac), aneurisma de aorta (4 pac) |
| Aneurisma de aorta | 12 | |
| IM | 9 | + CIA (1 pac), IT (1 pac), EAo subvalvular (1 pac), endocarditis (1 pac) |
| EM | 1 | |
AP: arteria pulmonar; AP-CIV: atresia pulmonar con CIV; BAV: bloqueo auriculoventricular; CIA: comunicación interauricular; CIV: comunicación interventricular; EAo: estenosis aórtica; EM: estenosis mitral; EP: estenosis pulmonar; IAo: insuficiencia aórtica; IM: insuficiencia mitral; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea; pac: paciente; VD: ventrículo derecho; VI: ventrículo izquierdo.
Las categorías más altas se corresponden con cirugías neonatales muy complejas, por lo que no aparecen en series de pacientes adultos reintervenidos.
Las indicaciones para la nueva intervención se recogen en la tabla 2.
Indicaciones por las que se decidió reintervenir a los pacientes
| Indicación de cirugía | Cirugías (n) |
| Cortocircuito residual (DAP/CIA/CIV) significativo | 7 |
| CIA residual + IT | 7 |
| CIA residual + IAo | 1 |
| CIA residual + IP | 2 |
| CIA residual + DAP + IT + disección crónica tipo A | 1 |
| CIV residual + EP | 5 |
| CIV residual + EP + IAo | 1 |
| CIV residual + IP | 4 |
| CIV residual + IAo | 2 |
| CIV residual + IP + IT | 1 |
| IM | 7 |
| IAo | 2 |
| IT | 1 |
| IP | 9 |
| IM + IT | 1 |
| IM + IAo + IT | 1 |
| IM + IAo + IP | 1 |
| IP + IT | 6 |
| IP + IAo | 1 |
| DLAo | 7 |
| EAo (supravalvular, subvalvular) | 3 |
| EM | 1 |
| EAo + IM | 2 |
| EP (incluidos conductos estenóticos) | 10 |
| Aneurismas de aorta | 5 |
| Aneurismas de aorta + IAo/DLAo | 5 |
| Seudoaneurismas de aorta | 4 |
| Segundo tiempo de vía univentricular (2 casos con endocarditis activa) | 6 |
| Conversión de Fontan | 3 |
| Reparación de CC con paliación previa | 8 |
| Nueva paliación de CC no reparable | 2 |
CC: cardiopatía congénita; CIA: comunicación interauricular; CIV: comunicación interventricular; DAP: ductus; DLAo: doble lesión aórtica; EAo: estenosis aórtica; EM: estenosis mitral; EP: estenosis pulmonar; IAo: insuficiencia aórtica; IM: insuficiencia mitral; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea.
La media de tiempo de CEC fue 135 ± 67,4min y la de pinzado aórtico, 68 ± 49,4. Se realizó parada circulatoria en hipotermia profunda en 4 casos, con una media de 30 ± 4,3min.
Las técnicas quirúrgicas utilizadas se reflejan en la tabla 3.
Procedimientos quirúrgicos empleados en las 117 reoperaciones
| Cirugía de mayor importancia según categoría RACHS-1 | Pacientes (n) | Cirugía asociada |
| Categoría 1 | 5 | |
| Cierre CIA | 3 | Marcapasos (1) |
| Ligadura ductus | 1 | |
| Ligadura vena vertical | 1 | |
| Categoría 2 | 34 | |
| Anastomosis cavopulmonar (Glenn) | 5 | Marcapasos (1) |
| Cierre CIV | 5 | Cirugía de EP (3), plastia VAo (1) |
| Bioprótesis pulmonar | 13 | Cierre CIA/CIV (4), plastia RRPP (1), bypass a ADA (1) |
| Cirugía de EP | 6 | Resección bandas VD (4), plastia VP (1), ampliación AP (2), cierre CIV (2) |
| Reparación completa Fallot | 3 | |
| Valvuloplastia VAo | 2 | Resección de membrana subaórtica (1) |
| Categoría 3 | 78 | |
| Fontan | 4 | |
| Fístula sistémico-pulmonar | 2 | |
| Plastia tricuspídea | 15 | Cierre de CIA/CIV (9), bioprótesis pulmonar (7), marcapasos (1), plastia RRPP (1), reparación DSVD (1) |
| Bioprótesis tricúspide | 3 | Cierre CIA (1), bioprótesis pulmonar (1) |
| Cambio conducto VD-AP | 10 | Cierre CIV (3), marcapasos (1), Glenn (1), prótesis Ao (1), ligadura de ductus (1) |
| Prótesis Ao mecánica | 14 | Cierre CIA/CIV (2), cirugía E sub/supra Ao (3), Glenn (1), reparación Fallot (1), bioprótesis pulmonar (1) |
| Recambio Ao ascendente | 13 | Bentall (3), David (2), cierre CIA/CIV (2), ligadura de ductus (1), prótesis Ao (1), plastia tricuspídea (1) |
| Recambio Ao torácica | 4 | |
| Prótesis mitral mecánica | 10 | Prótesis Ao (2), bioprótesis pulmonar (1), plastia tricuspídea (2) |
| Plastia mitral | 3 | Cierre CIA (2), resección de membrana subaórtica (2), plastia VAo (1) |
ADA: arteria descendente anterior; Ao: aorta; AP: arteria pulmonar; CIA: comunicación interauricular; CIV: comunicación interventricular; DSVD: doble salida del ventrículo derecho; EP: estenosis pulmonar; RRPP: ramas pulmonares; VAo: válvula aórtica; VD: ventrículo derecho; VP: válvula pulmonar.
Participaron 9 cirujanos, 5 de cardiopatías adquiridas, que realizaron 30 operaciones (máximo de 26 y mínimo de 1) y 4 de congénitas, con 87 cirugías (máximo de 75, mínimo de 2).
Se aplicó análisis univariable (prueba de la t de Student para variables cuantitativas y la de la χ2 para variables cualitativas) para analizar los siguientes factores de riesgo de mortalidad hospitalaria: edad, sexo, superficie corporal, tiempo de circulación extracorpórea, tiempo de isquemia, complejidad (escalas RACHS-1, Aristóteles12 y EuroSCORE13) y si el cirujano desarrollaba habitualmente su actividad en el ámbito de las cardiopatías congénitas o de las adquiridas. Las variables que resultaron significativas y aquellas con una p < 0,20 se incluyeron en el análisis multivariable (regresión logística) para determinar también factores predictores de mortalidad hospitalaria.
Aunque no hay escalas de riesgo quirúrgico para esta nueva subespecialidad de congénitos adultos, desde 2007 se clasifica a todos los operados según una escala propia de congénitos menores de 18 años (RACHS-1) y otra escala propia de la cardiopatía adquirida del adulto (EuroSCORE), comparando la mortalidad real con la prevista por cada una de estas escalas, en un intento de determinar cuál resulta más útil para estratificar el riesgo perioperatorio de este grupo de pacientes.
Detalles de técnica quirúrgica y manejo hematológicoDestacamos en este apartado dos grupos de pacientes, los cianóticos severos, que llegan paliados, y el de los reoperados por secuela o lesión residual del corazón derecho, que suelen presentar dilatación severa del ventrículo derecho, la aurícula derecha o ambas cámaras y, en algunas ocasiones, conductos ventrículo derecho-arteria pulmonar retroesternales.
Los cianóticos extremos con hematocritos elevados de hasta el 70% suponen alto riesgo de sangrado perioperatorio. Todos cursan con disfunción plaquetaria y déficit de factores de coagulación.
En estos pacientes, se suspenden los anticoagulantes orales y antiagregantes 4 y 10 días, respectivamente, antes de la intervención e ingresan 5 días antes de ésta. De acuerdo con el servicio de hematología se les hace un estudio completo de factores plasmáticos y funcionalidad plaquetaria, se valora la sangría preoperatoria con o sin autotransfusión y se los trata con ácido tranexámico intravenoso (i.v.) (50mg/kg) pre-CEC y post-CEC, y factor VII recombinante activado post-CEC, (entre 80 y 100μg/kg); este último se puede repetir cada 2h según el ritmo de sangrado y la recomendación del hematólogo.
Como por fortuna no es un grupo numeroso, no hay diferencias significativas en cuanto a mortalidad desde que se usa este protocolo, pero la necesidad de transfusión de hemoderivados ha disminuido en un 40%. En dos ocasiones hubo que cambiar urgentemente durante la CEC el oxigenador por obstrucción de la membrana (probablemente por la hiperviscosidad sanguínea) y realizar una parada circulatoria total de corta duración; como consecuencia, recomendamos intervenir a estos pacientes con un grado de hipotermia moderada para poder solventar estos accidentes sin consecuencias neurológicas indeseables. La hipotermia también protege de la hipoperfusión en el lecho arterial al derivarse el flujo al pulmón durante la CEC por las frecuentes y múltiples colaterales sistemicopulmonares que poseen los cianóticos. Siempre que sea posible, se intenta no parar el corazón para mantener onda de pulso durante la CEC.
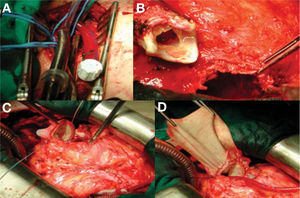
En cuanto al grupo de pacientes con lesiones de corazón derecho que tienen adherencias retroesternales severas, o conductos calcificados a veces incluidos en el esternón, en los que con frecuencia el uso del electrobisturí desencadena episodios de fibrilación ventricular durante la disección, se individualiza cuidadosamente cada caso, con estudios de imagen (cortes de angiografía por resonancia magnética/tomografía computarizada [angio-RM/TC], proyecciones laterales de angiografías) y valoración de accesos vasculares disponibles, por si consideramos necesario iniciar la CEC antes de abordar la reesternotomía (se ha procedido de esta manera en un 70% de las ocasiones), para evitar, en la medida de lo posible, roturas de cámaras cardiacas en situación no controlable (fig. 1).
Posteriormente, si no hay un defecto septal concomitante o no hay que actuar sobre la parte izquierda del corazón, la intervención se realiza sin isquemia miocárdica, latiendo o fibrilando. En los primeros dos supuestos, se pinza la aorta y el corazón se para y se protege mediante cardioplejía hemática fría.
El común denominador de estos enfermos es la presencia de insuficiencia o doble lesión pulmonar con o sin otras lesiones asociadas, que resolvemos mediante el implante de una bioprótesis porcina de tamaño grande, con técnica de peel operation como propone el grupo de la Clínica Mayo14.
ResultadosLa mortalidad hospitalaria ha sido del 8,4%. Diez pacientes fallecieron, 9 en procedimientos primarios y 1 tras otra nueva reintervención durante el mismo ingreso en asistencia circulatoria esperando un trasplante cardiaco. Los diagnósticos primarios, la indicación de reintervención, el procedimiento realizado y la causa de fallecimiento se recogen en la tabla 4.
Indicación de reintervención y técnica quirúrgica en los fallecidos
| Diagnóstico inicial | Motivo reintervención | N.° de cirugías previas | Técnica quirúrgica | Causa de fallecimiento | |
| 1 | DPSAV | IM + IAo + IT residuales | 1 | SVM + SVA + AT | Bajo gasto postoperatorio |
| 2 | CoA | Aneurisma arco aórtico y aorta descendente | 1 | Aneurismectomía + prótesis tubular | Hemoptisis en postoperatorio |
| 3 | EP + hipoplasia de VD | IP residual + hipoplasia de VD | 1 | Reparación 1 + 1/2 conducto VD-AP heterólogo + Glenn | TEP posquirúrgico |
| 4 | Ventrículo único | Fontan auriculopulmonar fracasado | 1 | Conversión Fontan | Sepsis en ECMO en espera de Tx cardiaco |
| 5 | Fallot + pectus excavatum | DLP + CIA residuales | 1 | SVP + cierre CIA | IAM perioperatorio |
| 6 | DPSAV | Disfunción bioprótesis mitral | 2 | RSPM | Neumonía nosocomial + sepsis |
| 7 | AP + CIV | IP + IAo + CIV residuales | 2 | SVA + cierre CIV + conducto heterólogo VD-AP | Sangrado postoperatorio + fracaso multisistémico |
| 8 | CIA | Seudoaneurisma micótico de Ao ascendente | 3 | Resección seudoaneurisma | Sangrado en quirófano |
| 9 | L-TGA + AP + CIV | Cianosis severa por disfunción paliativas | 3 | Fístula SP entre Ao-APD con CEC | Déficit neurológico + fracaso multisistémico |
| 10 | CIV | Aneurisma de raíz aórtica + IAo + CIV residuales | 3 | Bentall + cierre de CIV | ACVA perioperatorio |
ACVA: accidente cerebrovascular; Ao: aorta; AP + CIV: atresia pulmonar con comunicación interventricular; AP: arteria pulmonar; APD: arteria pulmonar derecha; AT: anuloplastia tricuspídea; CEC: circulación extracorpórea; CIA: comunicación interauricular; CIV: comunicación interventricular; CoA: coartación de aorta; DLP: doble lesión pulmonar; DPSAV: defecto parcial del septo auriculoventricular; ECMO: asistencia circulatoria con oxigenador; EP: estenosis pulmonar; IAM: infarto agudo de miocardio; IAo: insuficiencia aórtica; IM: insuficiencia mitral; IP: insuficiencia pulmonar; IT: insuficiencia tricuspídea; L-TGA: L-transposición de grandes arterias; RSPM: recambio de prótesis mitral; SP: sistémico-pulmonar; SVA: sustitución valvular aórtica; SVM: sustitución valvular mitral; SVP: sustitución valvular pulmonar; TEP: tromboembolia pulmonar; Tx: trasplante; VD: ventrículo derecho.
De los factores de riesgo analizados en modo univariable para mortalidad hospitalaria resultaron significativos el tiempo de CEC: media de 196 ± 127min para los fallecidos frente a los 129 ± 50min de los vivos (p = 0,002) y la complejidad según la categoría RACHS-1: media de 2,9 ± 0,3 para los fallecidos y 2,6 ± 0,6 para los no fallecidos (p = 0,02).
Se aplicó análisis multivariable a los factores estudiados con valor p < 0,2, que fueron la superficie corporal, el número de cirugías previas, la complejidad según el RACHS, el tiempo de CEC y si el cirujano trabajaba habitualmente en cardiopatías congénitas; resultó como factor predictivo de mortalidad hospitalaria el tiempo de CEC con una odds ratio (OR) = 1,017 (intervalo de confianza [IC] del 95%, 1,007-1,028; p = 0,001). Las intervenciones realizadas por cirujanos con principal actividad en cardiopatías adquiridas tenían un mayor riesgo de mortalidad hospitalaria (OR = 4,88; IC del 95%, 0,79-30,3; p = 0,088), sin alcanzar la significación estadística, probablemente por un pequeño tamaño muestral. El modelo obtenido tiene una capacidad predictiva (área bajo la curva) de 0,837 (IC del 95%, 0,715-0,958; p = 0,001).
En cuanto a la predicción del riesgo quirúrgico que hace una u otra escala para los pacientes operados desde 2007 en adelante (fecha desde la que se calcula sistemáticamente el EuroSCORE), el RACHS pronostica una mortalidad del 6,1%, dos puntos por debajo de la real (mortalidad ajustada > 1). El EuroSCORE, sin embargo, predice un riesgo hospitalario del 10,6%, dos puntos por encima (mortalidad ajustada < 1).
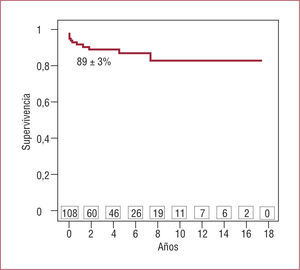
Con respecto a la supervivencia a medio-largo plazo, se consiguió un seguimiento mediano de 3 años (máximo de 17 años) y se obtuvo una supervivencia actuarial del 89% a 3 años, el 87% a 6 años y el 83% a 9 años (fig. 2).
ConclusionesLas reintervenciones de este heterogéneo grupo de pacientes mayores de 18 años por secuelas, complicaciones o lesiones residuales de cardiopatías congénitas operadas durante la edad pediátrica, o la reparación de otras sólo paliadas, constituyen actualmente casi la mitad de las cirugías que realizamos en la UCA del Hospital La Paz. En ausencia de publicaciones de series nacionales, consideramos aceptables nuestros resultados, en consonancia con lo revisado internacionalmente. Se han identificado como factores de riesgo de mortalidad hospitalaria el tiempo de CEC y la complejidad según la escala RACHS-1. Quedó al borde de la significación como factor protector el hecho de que el cirujano desarrollase su actividad predominante en el ámbito de la congénita15. Al no ser cirugías exentas de riesgo, se debe sopesar al máximo el momento de su indicación, con ánimo de mejorar la cantidad y la calidad de vida.
Las lesiones del corazón derecho son las más numerosas en el grupo de los reintervenidos. La mortalidad más elevada se ha producido en el grupo situación univentricular/cianosis severa16 y en el de aneurisma/seudoaneurisma de aorta. El seguimiento de estos enfermos es prácticamente completo, con excelente supervivencia a medio y largo plazo y muy baja necesidad de nuevas reintervenciones.
EL TRASPLANTE DE ÓRGANOS TORÁCICOS EN ADULTOS CON CARDIOPATÍAS CONGÉNITASLos pacientes con cardiopatías congénitas del adulto (CCA) en fase terminal no susceptibles de otros abordajes terapéuticos (sea mediante fármacos, intervencionismo percutáneo o cirugía con vencional) son un pequeño porcentaje de los receptores de trasplante de órganos torácicos (TOT). Así, el Registro de la International Society for Heart and Lung Transplantation (ISHLT), que engloba la mayoría de los TOT realizados en el mundo desde 1982, muestra que la CCA ha motivado un 2% de los trasplantes cardiacos, un 0,8% de los trasplantes pulmonares y un 34% de los trasplantes cardiopulmonares17,18.
Los criterios derivados de la experiencia de más de 2 décadas en TOT, en cuanto a evaluación de los receptores, indicaciones, contraindicaciones, manejo clínico postrasplante a corto y largo plazo, y posibles complicaciones en la evolución, son los mismos para estos pacientes que para los que acceden al trasplante por cardiopatías adquiridas, y se pueden consultar en obras recientes19,20. En los apartados siguientes haremos referencia a las características particulares de este subgrupo de pacientes.
La indicación del trasplante de órganos torácicos en las cardiopatías congénitas del adulto. Grupos de cardiopatías susceptibles de trasplante. Momento óptimo de la indicaciónSiguiendo la clasificación de Hosseinpour et al21, 3 grupos de CCA pueden llevar a la indicación habitual de TOT. De ellos, los dos últimos están integrados por pacientes con una o más cirugías previas, cuyas dificultades han quedado reflejadas en la primera parte de este artículo.
- 1.
Defectos congénitos no corregidos en la edad pediátrica, habitualmente por su presentación clínica tardía, como es el caso de cortocircuitos no diagnosticados que llegan a situación de Eisenmenger, o por decisión de no intervenir ante un riesgo quirúrgico elevado, como es el caso de la anomalía de Ebstein y la transposición corregida de grandes vasos con septo interventricular íntegro. En los casos en que la función ventricular esté preservada y no se hayan desarrollado cambios irreversibles en los vasos pulmonares, puede plantearse la cirugía correctora convencional aun en edades avanzadas. En caso contrario, deberá recurrirse al TOT, que será trasplante cardiaco en los pacientes con disfunción ventricular severa, trasplante cardiopulmonar o bipulmonar con corrección del defecto cardiaco en caso de hipertensión pulmonar irreversible (típicamente en pacientes con síndrome de Eisenmenger) y trasplante cardiopulmonar si hay disfunción ventricular e hipertensión pulmonar concomitantes.
- 2.
CCA con cirugía correctora previa. Las técnicas correctoras que dejen el ventrículo derecho como bomba sistémica (caso de la reparación clásica de la transposición de grandes vasos mediante técnicas de Senning y Mustard) llevan a medio-largo plazo a una disfunción ventricular que puede requerir trasplante cardiaco. También en la reparación de tetralogía de Fallot que deja insuficiencia pulmonar importante acabará desarrollándose disfunción ventricular derecha.
Habitualmente será el trasplante cardiaco la opción indicada en los pacientes de este grupo que alcanzan la fase terminal.
- 3.
CCA con cirugía paliativa y evolución desfavorable. Es el caso de corazones con un solo ventrículo funcionante, en los que diversos tipos de paliación, bien sea tipo Fontan o con derivación arterial sistémico-pulmonar, ofrecen mejoría a corto-medio plazo. No obstante, la evolución tardía muestra tasas elevadas de mortalidad y complicaciones que hacen plantear el trasplante cardiaco en individuos seleccionados.
Determinar el momento apropiado para incluir a un paciente en lista de espera puede ser particularmente difícil en las CCA, especialmente en el caso de intervenciones de alto riesgo, como el trasplante cardiopulmonar. La «ventana» de indicación (tiempo en que el deterioro de la cardiopatía justifica la necesidad del trasplante, pero en que el estado del resto del organismo no incrementa sustancialmente el riesgo) es más estrecha en las CCA que en otras indicaciones.
El requisito de una expectativa de vida inferior a 1-2 años, más fácil de estimar en las cardiopatías adquiridas, es difícil de evidenciar en las CCA, especialmente en pacientes con síndrome de Eisenmenger, en los que es común observar supervivencias prolongadas a pesar de una restricción severa de la capacidad funcional. La indicación en estos casos debe llegar cuando el paciente tiene una calidad de vida muy deficiente, en general reflejada por incapacidad para llevar a cabo de forma autónoma actividades básicas de la vida diaria, falta de respuesta o intolerancia a otros tratamientos e ingresos hospitalarios repetidos.
Por otro lado, el trasplante debe indicarse antes de que el deterioro del estado general o de la función de otros órganos (especialmente riñón e hígado) suponga un incremento inaceptable de riesgo para el trasplante. Particularmente difícil es la decisión en sujetos con derivación tipo Fontan y enteropatía pierdeproteínas, en los que la «ventana» de indicación puede ser prácticamente inexistente. En la decisión final, debe tenerse en cuenta que la mayoría de los pacientes pasarán meses en la lista de espera antes de que se disponga de un órgano apropiado para ellos.
Evaluación del paciente candidato a trasplante de órganos torácicos. ContraindicacionesEl estudio del paciente con CCA candidato a TOT debe incluir tres aspectos:
- 1.
El estudio funcional irá dirigido a dos fines: confirmar la severidad e irreversibilidad de la cardiopatía, normalmente debida a disfunción miocárdica severa de uno o ambos ventrículos, con datos concomitantes de congestión y bajo gasto cardiaco anterógrado. En general, se llevará a cabo mediante ecocardiografía, otras técnicas de imagen y, en la mayoría de los casos, cateterismo cardiaco. El segundo objetivo es el estudio de las resistencias pulmonares. Los pacientes con resistencias inferiores a 5 unidades Wood o gradiente transpulmonar inferior a 12mmHg habitualmente serán dirigidos al trasplante cardiaco, que presenta unos riesgos muy inferiores al trasplante cardiopulmonar. En caso de valores superiores a los citados, habitualmente se hará un test de vasodilatación con oxígeno en alta concentración, óxido nítrico, prostaglandinas, sildenafilo u otros vasodilatadores pulmonares. Si se produce una reducción significativa de las resistencias pulmonares y se alcanzan las cifras señaladas, el paciente podría ser dirigido al trasplante cardiaco, aunque persiste un riesgo aumentado de fracaso ventricular derecho. Los pacientes con resistencias superiores a 9 unidades Wood o gradiente transpulmonar superior a 15mmHg son dirigidos habitualmente a trasplante cardiopulmonar. Como alternativa, algunos pacientes con cardiopatías sencillas pueden ser tratados mediante trasplante bipulmonar y corrección del defecto cardiaco.
- 2.
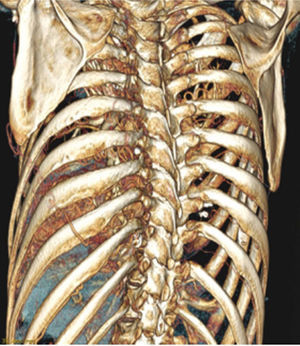
El estudio anatómico incluirá el situs, los drenajes venosos pulmonar y sistémico y las arterias aorta y pulmonar. Se han descrito numerosas técnicas para solventar las dificultades impuestas por las distintas variantes anatómicas de las CCA, que deben ser planificadas siempre antes de la intervención. En cualquier caso, las variantes técnicas llevan aparejado un incremento de la morbimortalidad. Otros aspectos particularmente importantes en la evaluación de candidatos a TOT son las distorsiones anatómicas y adherencias causadas por cirugías previas, y la circulación colateral sistemicopulmonar. Ambas entidades son causa ocasional de contraindicación del trasplante en determinados individuos, especialmente en el trasplante cardiopulmonar. Los avances en diversas técnicas de imagen cardiovascular, especialmente la tomografía computarizada y la resonancia magnética, han supuesto una ayuda de inapreciable valor (fig. 3).
- 3.
El estado general de salud de los candidatos a TOT requiere un estudio detallado, especialmente en lo referido a función renal, hepática y parámetros de coagulación. La disfunción significativa e irreversible de estos órganos supone una contraindicación para el TOT, aunque en casos muy seleccionados puede resolverse con el trasplante combinado del riñón o hígado disfuncionante. La enteropatía pierdeproteínas de pacientes con Fontan fracasado es especialmente problemática, pues tiende a causar desnutrición severa, tendencia a infecciones y pobre cicatrización de heridas, características que aumentan considerablemente los riesgos del trasplante cardiaco.
Además, hay una serie de contraindicaciones comunes a todos los trasplantes, como las enfermedades sistémicas, disfunción de otros órganos vitales, neoplasias actuales o recientes, enfermedades mentales, adicciones no resueltas y ausencia del soporte psicosocial mínimo para permitir la recuperación del paciente tras la intervención y un cumplimiento terapéutico apropiado.
Resultados del trasplante de órganos torácicos en las cardiopatías congénitas del adulto. Comparación con otras indicacionesAunque algunos centros individuales han comunicado sus resultados en el TOT indicado por CCA22,23, el Registro de la ISHLT17,18,24 es la mejor fuente de información sobre la evolución de estos pacientes, al menos en lo relativo a supervivencia. Desglosamos los resultados según el órgano trasplantado:
- 1.
Trasplante cardiaco: un 2% del total de las indicaciones se debieron a CCA, porcentaje que parece ir en aumento, pues entre 2004 y 2007 fue el 3% de las causas de trasplante cardiaco. En las curvas de supervivencia (fig. 4), se observa una mortalidad quirúrgica en torno al 20%, superior a la del resto de las indicaciones de trasplante cardiaco; sin embargo, la mortalidad a largo plazo de los supervivientes quirúrgicos parece algo menor que en los portadores de otras cardiopatías, algo probablemente relacionado con la menor edad de los pacientes con CCA. A los 5 años, la supervivencia de este subgrupo se acerca al 70%, similar a la de los pacientes trasplantados por cardiopatías adquiridas. En el Hospital Universitario Puerta de Hierro, hemos realizado 14 trasplantes por CCA (un 2% de los 734 realizados), en receptores de 12 a 54 años de edad (media, 28 ± 16 años), con fracción de eyección del ventrículo izquierdo de 27% ± 14%. Un 28% tenía antecedente de corrección quirúrgica de la cardiopatía. La supervivencia al mes, al año y a los 5 años fue el 72, el 64 y el 57%, respectivamente. Cabe destacar la realización de 4 trasplantes en pacientes con cirugía de Fontan previa y enteropatía pierdeproteínas, con mortalidad precoz en 1 paciente y supervivencia mayor de 5 años en 2 pacientes.
Fig. 4.Trasplante cardiaco en adultos. Supervivencia según la cardiopatía que llevó al trasplante. Datos del Registro de la International Society for Heart and Lung Transplantation 2008 (datos correspondientes a los trasplantes realizados entre enero de 2000 y junio de 2005)17.
(0.11MB). - 2.
Resultados del trasplante pulmonar por CCA: se trata de una indicación muy inhabitual (el 0,8% del total), que parece ir en disminución. El artículo de Waddell et al24, que analiza los resultados del trasplante pulmonar en 605 sujetos con síndrome de Eisenmenger del mismo registro, muestra hallazgos de gran interés: 430 pacientes (71%) fueron sometidos a trasplante cardiopulmonar, mientras que 106 (18%) recibieron trasplante bipulmonar y 69 (11%), trasplante unipulmonar. La mortalidad quirúrgica en estos pacientes fue claramente mayor en el trasplante pulmonar (en torno al 35%, algo mayor en el trasplante unipulmonar que en el bilateral) frente al cardiopulmonar (poco más del 20%). Pasado el periodo operatorio, la mortalidad en el trasplante pulmonar disminuye, con supervivencias a 1 y 3 años del 55 y el 45%, aproximadamente. En el Hospital Puerta de Hierro no se han realizado trasplantes pulmonares por CCA, probablemente debido a la disponibilidad de trasplante cardiopulmonar.
- 3.
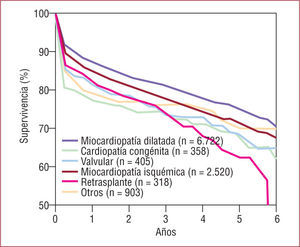
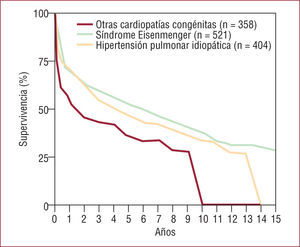
Trasplante cardiopulmonar: las CCA causan un tercio de las indicaciones de este tipo de trasplante. En el registro de la ISHLT, la mortalidad quirúrgica en el trasplante cardiopulmonar es superior al 30%; cuando se desglosa esta mortalidad según la cardiopatía que motivó el trasplante (fig. 5), los pacientes con síndrome de Eisenmenger e hipertensión pulmonar primaria muestran menor mortalidad precoz (alrededor del 25%), en comparación con otros tipos de cardiopatía congénita (el 40% aproximadamente). A 1 y 3 años la supervivencia es del 65 y el 50%, respectivamente, cifras superiores a las obtenidas con el trasplante pulmonar. En el Hospital Puerta de Hierro hemos realizado 28 trasplantes cardiopulmonares, de los que 9 (32%) se debieron a cardiopatías congénitas, distribuidas de la siguiente forma: 7 síndromes de Eisenmenger (2 comunicaciones interventriculares, 2 truncus arteriosos, 1 comunicación interauricular, 1 ductus arterioso persistente, 1 cardiopatía compleja) y 2 corazones univentriculares con hipertensión pulmonar. La supervivencia a 1 mes, 1 y 3 años es del 66, el 55 y el 44%, respectivamente, resultados comparables con la experiencia internacional.
Fig. 5.Trasplante cardiopulmonar en adultos con cardiopatía congénita. Supervivencia según la enfermedad que llevó al trasplante. Datos del Registro de la International Society for Heart and Lung Transplantation 2008 (datos correspondientes a los trasplantes realizados entre 1992 y 2007)18.
(0.09MB).
Los pacientes con CCA muy sintomáticas y no susceptibles de otros abordajes terapéuticos son frecuentemente remitidos a centros con programas de TOT para valorar la posibilidad de trasplante de corazón, pulmones o ambos órganos en bloque. En contraste con los pacientes afectos de cardiopatías adquiridas, este subgrupo presenta características particulares que, con frecuencia, suponen un reto para los equipos de trasplante, como su relativa infrecuencia, las dificultades adicionales para la cirugía (sea por el antecedente de una o varias intervenciones previas o por anomalías anatómicas de las estructuras implicadas en el implante del injerto) y las enfermedades concomitantes (deformidades torácicas, coagulopatía, disfunción de otros órganos, etc.). Como dato a favor, estos pacientes tienen una edad promedio más joven. En conjunto, los resultados del TOT son algo inferiores a los obtenidos en otras indicaciones, especialmente en lo que se refiere a mortalidad operatoria. Sin embargo, los supervivientes quirúrgicos obtienen una marcada mejora en la expectativa y la calidad de vida, lo que justifica la realización de TOT en pacientes seleccionados. En este subgrupo es especialmente necesario que un equipo multidisciplinario con experiencia en este campo individualice la indicación y el momento del trasplante.