Existe escasa evidencia acerca del impacto de las actuales recomendaciones sobre la utilización del tratamiento antitrombótico durante el periodo perioperatorio y periprocedimiento en el «mundo real». El objetivo de este estudio es analizar la utilización de los fármacos antitrombóticos en una población de pacientes que van a someterse a una cirugía/procedimiento, así como evaluar la implicación que tiene su retirada o mantenimiento en la incidencia de eventos adversos trombóticos y/o hemorrágicos.
MétodosEstudio observacional prospectivo, multicéntrico y multiespecialidad de pacientes en tratamiento antitrombótico que precisen alguna intervención. El objetivo principal fue la incidencia de eventos trombóticos y hemorrágicos a 30 días en función del uso periintervención de los fármacos antitrombóticos.
ResultadosSe incluyó a un total de 1.266 pacientes (el 63,5% varones; media de edad, 72,6 años). El 48,6% de ellos se encontraban anticoagulados (la mayoría por fibrilación auricular; CHA2DS2-VASC, 3,7) y el 53,3%, antiagregados, con mayor frecuencia por cardiopatía isquémica. El 66,7% tenía un riesgo isquémico bajo y el 51,9%, un riesgo hemorrágico de la intervención bajo. El tratamiento antitrombótico periprocedimiento según las recomendaciones actuales fue idóneo únicamente en el 57,3% de los casos. Los pacientes con un uso inadecuado de los fármacos antitrombóticos periprocedimiento presentaron una incidencia de eventos adversos trombóticos y hemorrágicos significativamente mayor.
ConclusionesA pesar de las recomendaciones actuales acerca de la utilización de fármacos antitrombóticos en el periodo perioperatorio/periprocedimiento, su implementación en el «mundo real» continúa siendo baja. Un uso inadecuado se asocia con un aumento de la incidencia de eventos adversos, tanto trombóticos como hemorrágicos.
Palabras clave
En los últimos años, el número de pacientes que requieren una intervención quirúrgica ha aumentado, y se estima en más de 300 millones anuales1. Además, el aumento de la esperanza de vida hace que sea frecuente que los pacientes que se someten a algún procedimiento invasivo ya estén en tratamiento antitrombótico antes de este2. Cerca de un millón de personas viven anticoaguladas en España, fundamentalmente por fibrilación auricular (FA), una cifra en aumento debido al envejecimiento de la población y el incremento de los factores de riesgo3. Además, el uso del tratamiento antiagregante plaquetario como prevención secundaria de la enfermedad aterotrombótica se ha multiplicado, dados el aumento de procedimientos de intervención coronaria percutánea (ICP) y los estudios que recomiendan su prolongación4–7. Para evitar eventos adversos periprocedimiento, es importante conocer la idoneidad de interrumpir el tratamiento antitrombótico y el momento exacto, en caso de que se requiera, de suspenderlo. De hecho, la decisión de retirar o mantener dicho tratamiento está determinada por la interacción entre el riesgo trombótico del paciente y el riesgo hemorrágico de la intervención8–10.
Se han publicado varios documentos y posicionamientos acerca de la utilización de fármacos antitrombóticos en el periodo perioperatorio en diferentes situaciones clínicas que han intentado simplificar la toma de decisiones en la práctica clínica11–18. Entre ellos, un documento de consenso nacional coordinado por el Grupo de Trabajo de Trombosis Cardiovascular de la Sociedad Española de Cardiología y certificado por más de 20 sociedades científicas españolas acerca del uso perioperatorio/periprocedimiento de los fármacos antitrombóticos19. A pesar de estas recomendaciones, se desconoce cuál es el impacto en el «mundo real» de los pacientes tratados con fármacos anticoagulantes y antiagregantes plaquetarios que precisan una intervención. El objetivo del presente estudio es analizar la utilización del tratamiento antitrombótico en una población de pacientes que van a someterse a una cirugía/procedimiento, así como evaluar la implicación que tiene su retirada o mantenimiento en la incidencia de eventos adversos cardiovasculares y/o hemorrágicos.
MÉTODOSEl registro REQXAA (Registro Español acerca del manejo periCirugia/periprocedimiento de los fármacos Anticoagulantes y Antiagregantes) es un estudio observacional, prospectivo, multicéntrico y multiespecialidad con seguimiento clínico de pacientes en tratamiento antitrombótico (antiagregación plaquetaria y/o anticoagulación) que precisen una cirugía/procedimiento.
Población del estudioSe incluyó a pacientes con edad ≥ 18 años sometidos a cualquier tipo de intervención (cirugía o procedimiento) en tratamiento crónico con al menos 1 fármaco antitrombótico oral: antiagregante plaquetario (ácido acetilsalicílico, clopidogrel, prasugrel, ticagrelor) o anticoagulante, bien un antagonista de la vitamina K (AVK) como acenocumarol o warfarina, bien un anticoagulante oral de acción directa (ACOD) como dabigatrán, rivaroxabán, apixabán o edoxabán. Los criterios de exclusión fueron la ausencia de consentimiento informado y/o la imposibilidad de seguimiento durante los 30 días posteriores a la intervención.
Los datos demográficos, antecedentes clínicos, valores de laboratorio y medicación concomitante se obtuvieron de la anamnesis y la historia clínica de los pacientes antes de la intervención. El riesgo trombótico del paciente y el riesgo hemorrágico de la intervención se definieron según las recomendaciones del documento de consenso español ya descrito19. En resumen, se definió el riesgo tromboembólico del paciente en función de las características clínicas (CHA2DS2-VASC para la FA, localización de las prótesis valvulares y comorbilidades asociadas), datos angiográficos (tipo de stent) y tiempo desde el evento agudo previo (síndrome coronario, ictus, enfermedad tromboembólica venosa) que indicó el tratamiento antitrombótico. Respecto al riesgo hemorrágico, se consideró en función de las consecuencias que una eventual hemorragia pudiera acarrear: alto si comprometiera la vida del paciente o el resultado de la cirugía; moderado si pudiera aumentar el riesgo de transfusión o reintervención, y bajo si fuera potencialmente controlable (tablas 1 y 2 del material adicional). Se registró si se continuaba o no con el fármaco antitrombótico, así como el tiempo de suspensión hasta el procedimiento, el uso o no de un tratamiento puente, así como el momento de la reintroducción. El uso perioperatorio del fármaco antitrombótico quedó a discreción del facultativo responsable del paciente, sin que los investigadores realizaran ningún tipo de intervención en la decisión de suspender, mantener y reintroducir el tratamiento. Se llevó a cabo un seguimiento clínico durante los primeros 30 días tras la cirugía recogiendo la incidencia de eventos adversos. El estudio fue diseñado para reclutar durante 1 año a todos los pacientes consecutivos que cumplieran los criterios de inclusión/exclusión. Sin embargo, debido a las dificultades que la pandemia por COVID-19 supuso para la inclusión y el seguimiento de pacientes, el comité de coordinación decidió prolongar el registro 2 años.
El estudio se realizó de acuerdo con la Declaración de Helsinki, fue aprobado por el Comité Ético del Hospital Clínico San Carlos de Madrid y fue autorizado por el resto de los centros participantes. Todos los pacientes aceptaron su participación por escrito mediante la firma del consentimiento informado para la participación del estudio.
Objetivos del estudioEl objetivo principal del estudio fue la incidencia del evento adverso clínico neto a 30 días tras la intervención, definido como el combinado de: mortalidad por cualquier causa, infarto de miocardio no fatal, trombosis del stent, ictus isquémico no fatal (focalidad neurológica causada por evento isquémico), embolia periférica, enfermedad tromboembólica venosa y/o complicaciones hemorrágicas de grado> 2 según la clasificación BARC20. El objetivo secundario del estudio fue la incidencia de eventos adversos en función de la idoneidad del tratamiento antitrombótico perioperatorio/periprocedimiento, definido según las recomendaciones del documento de consenso español19. En resumen, el documento de consenso propone, entre otras cosas, suspender el tratamiento anticoagulante el mínimo tiempo posible según la farmacocinética del antitrombótico, limitar la utilización de terapia puente a pacientes con alto riesgo tromboembólico, mantener el ácido acetilsalicílico periprocedimiento en la casi totalidad de las intervenciones (a excepción prácticamente de neurocirugías) y valorar que se mantenga el tratamiento antiagregante plaquetario doble en cirugías de bajo riesgo hemorrágico. El uso apropiado/inadecuado del tratamiento antitrombótico fue valorado por investigadores independientes mediante la aplicación webQXAApp, desarrollada para aplicar las recomendaciones del documento de consenso español21.
Análisis estadísticoSe comprobó la distribución normal de las variables mediante la prueba de Kolmogorov-Smirnov. Las variables categóricas se expresaron mediante frecuencias y porcentajes. Las variables cuantitativas se expresaron mediante la media±desviación estándar si cumplían la condición de normalidad o mediante mediana [intervalo intercuartílico] en caso contrario. La asociación entre variables categóricas se comprobó mediante el test de la χ2 o el test exacto de Fisher cuando al menos el 25% de los valores presentaban una frecuencia esperada <5. Se utilizó la prueba de la t de Student para comparar variables cuantitativas con dicotómicas. Se consideraron significativas las diferencias encontradas con una probabilidad de error <5% (p <0,05). Para identificar todas las variables que tuvieran una asociación independiente de que ocurriera el evento adverso combinado definido como objetivo principal, se construyó un modelo de regresión logística de efectos mixtos que incluía como efectos aleatorios el centro investigador y como covariables, las que resultaron estadísticamente significativas (con una significación de p <0,20) y se consideraron clínicamente relevantes, evitando aquellas que pudieran producir colinealidad. Los datos se expresaron mediante la odds ratio (OR) y su intervalo de confianza del 95%. Para el análisis de los datos se utilizó el programa STATA versión 17.0 (Stata Corp, Estados Unidos).
RESULTADOSCaracterísticas basalesDurante el periodo de mayo de 2020 a mayo de 2022, el total de pacientes con datos válidos completos durante el periodo pericirugía/periprocedimiento fue de 1.266 (figura 1 del material adicional). Se obtuvieron datos del seguimiento durante los primeros 30 días tras la intervención de 1.152 pacientes (91,0%). La tabla 1 resume las características basales de la población. La mayoría de los pacientes eran varones (63,5%), con una media de edad de 72,6 años y, en general, presentaban importantes comorbilidades: hipertensión arterial (74,7%), diabetes mellitus (36,6%), antecedente de cardiopatía isquémica (31,8%), FA (43,0%), insuficiencia cardiaca (20,9%) o ictus (16,8%). En cuanto al tratamiento antitrombótico previo a la intervención, 615 pacientes (48,6%) se encontraban anticoagulados, la mayoría por FA (CHA2DS2-VASC, 3,7±1,6; HASBLED, 2,1±1,1) y el 57,4% de estos con un ACOD. El 53,3% (676) de los pacientes tomaban antiagregantes plaquetarios, principalmente por cardiopatía isquémica (597 con ácido acetilsalicílico, en más del 95% con una dosis <150mg). Además, 103 pacientes (8,1%) se encontraban en el momento de la inclusión en tratamiento antiagregante plaquetario doble (la gran mayoría con ácido acetilsalicílico y clopidogrel) y 24 (1,9%) tomaban tratamientos antiagregante plaquetario y anticoagulante concomitantes.
Análisis demográfico de los pacientes incluidos (n=1.266)
| Variable | |
| Edad (años) | 72,6±21,7 |
| Varones | 804 (63,5) |
| Factores de riesgo cardiovascular | |
| Fumador activo | 245 (19,4) |
| Hipertensión | 946 (74,7) |
| Dislipemia | 799 (63,1) |
| Diabetes mellitus | 463 (36,6) |
| Comorbilidades | |
| Cardiopatía isquémica | 403 (31,8) |
| Ictus | 213 (16,8) |
| Enfermedad vascular periférica | 202 (16,0) |
| Insuficiencia cardiaca | 265 (20,9) |
| Fibrilación auricular | 545 (43,0) |
| Portador de válvula mecánica | 61 (4,8) |
| Enfermedad tromboembólica venosa | 104 (8,2) |
| Enfermedad renal crónica | 213 (16,8) |
| EPOC | 173 (13,7) |
| Cáncer | 242 (19,1) |
| Hepatopatía | 57 (4,5) |
| Enolismo activo | 81 (6,4) |
| Anemia | 183 (14,5) |
| Hemorragia previa | 87 (6,9) |
| Diátesis hemorrágica | 4 (0,3) |
| Tratamiento antitrombótico | |
| Ácido acetilsalicílico | 597 (47,2) |
| Clopidogrel | 145 (11,5) |
| Prasugrel | 2 (0,2) |
| Ticagrelor | 25 (2,0) |
| Acenocumarol/warfarina | 262 (20,7) |
| Dabigatrán | 49 (3,9) |
| Rivaroxabán | 71 (5,6) |
| Apixabán | 152 (12,0) |
| Edoxabán | 81 (6,4) |
| Datos de laboratorio | |
| Hemoglobina (g/dl) | 13,3±2,4 |
| Plaquetas (1.000/μl) | 225,2±80,7 |
| ClCr (ml/min) | 66,4±22,3 |
ClCr: aclaramiento de creatinina; EPOC: enfermedad pulmonar obstructiva crónica.
Los valores expresan n (%) o media±desviación estándar.
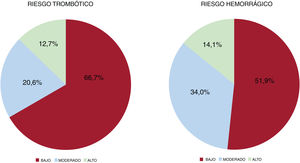
Respecto al tipo de intervención según la especialidad (tabla 3 del material adicional), los procedimientos relacionados con cardiología intervencionista y cirugía cardiovascular representaron el 35,1%; el resto de las cirugías incluidas mantenían una distribución más homogénea. El 66,7% tenían un riesgo trombótico bajo y el 51,9%, un riesgo hemorrágico de la intervención bajo (figura 1).
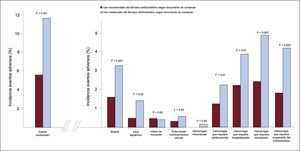
Tratamiento antitrombótico perioperatorio/periprocedimientoÚnicamente en el 57,3% de los pacientes intervenidos fue idóneo el tratamiento antitrombótico (el 62,1% de los pacientes antiagregados y el 49,1% de los anticoagulados). Se dio tratamiento puente periprocedimiento a 238 pacientes (18,8%), la mayoría en tratamiento anticoagulante: 231 (97,1%) con heparina de bajo peso molecular, 5 (2,1%) con heparina no fraccionada y solo a 2 pacientes con antiagregación plaquetaria doble (0,8%) se les administró un antiplaquetario endovenoso (tirofibán). De los 541 pacientes con un uso inadecuado, a 282 (52,1%) se les retiró el fármaco más precozmente de lo recomendado y a 13 (2,4%) de manera más tardía; el fármaco no se retiró cuando así estaba recomendado a 76 (14,0%) y se utilizó terapia puente de manera inapropiada en 170 (31,4%). Los pacientes cuyo tratamiento antitrombótico periprocedimiento se consideró inapropiado tenían con mayor frecuencia antecedentes de insuficiencia cardiaca, FA, anemia y hemorragia; además, estaban en tratamiento crónico con medicación anticoagulante y presentaron mayor utilización de terapia puente (tabla 4 del material adicional). La incidencia del evento adverso combinado fue significativamente mayor en el grupo de pacientes con utilización inadecuada (el 11,7 frente al 5,6%; p <0,001), al igual que los eventos trombóticos y hemorrágicos analizados por separado (figura 2).
Eventos isquémicos y hemorrágicos durante los primeros 30 días tras la intervención, en función del uso recomendado o inadecuado del fármaco antitrombótico según el documento de consenso español19.*Evento combinado de muerte por cualquier causa, infarto de miocardio no fatal, trombosis del stent, ictus isquémico no fatal, embolia periférica, enfermedad tromboembólica venosa y/o complicaciones hemorrágicas de grado> 2 según la clasificación BARC (Bleeding Academic Research Consortium)20.
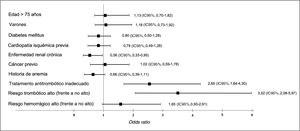
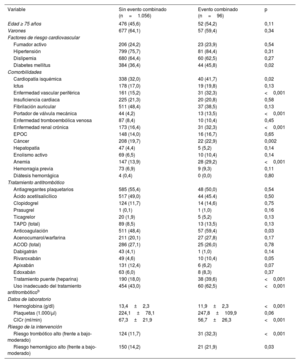
La incidencia del evento combinado definido como objetivo primario del estudio durante los primeros 30 días tras la intervención fue del 7,6% (96 pacientes) (tabla 2). Se valoraron las características epidemiológicas de los pacientes que sufrieron el evento adverso combinado definido en el objetivo principal a 30 días (tabla 3). Estos pacientes presentaron mayor frecuencia de DM, cardiopatía isquémica, insuficiencia cardiaca, enfermedad renal crónica, cáncer previo y anemia. Además, estaban anticoagulados con mayor frecuencia y tenían mayores riesgos trombótico y hemorrágico, mayor uso de terapia puente y peor utilización del fármaco antitrombótico periprocedimiento. Respecto al tratamiento antitrombótico perioperatorio, 60 de los 541 pacientes con uso inadecuado sufrieron el evento combinado. De estos, 31 (51,7%) pertenecían al grupo de tratamiento puente (inapropiado); 18 (30%), al de retirada antes de tiempo/reintroducción tardía y 11 (18,3%), al de falta de retirada (no hubo eventos entre los pacientes con retirada tardía). Para valorar el impacto individual de estos factores, se construyó un modelo de regresión logística de efectos mixtos que incluyó como efectos aleatorios el centro investigador y como covariables, las que resultaron estadísticamente significativas y clínicamente relevantes del análisis univariado (figura 3). Así, tanto el riesgo trombótico alto (odds ratio [OR]=3,52; intervalo de confianza del 95% [IC95%], 2,08-5,97) como un uso inadecuado del fármaco antitrombótico periprocedimiento (OR=2,65; IC95%, 1,64-4,30) resultaron factores independientes de la aparición del evento adverso combinado definido como objetivo principal.
Eventos adversos durante los primeros 30 días tras la intervención (n=1.266)
| Evento adverso | n (%) |
|---|---|
| Objetivo principal* | 96 (7,6) |
| Objetivos secundarios | |
| Muerte | 27 (2,1) |
| Muerte cardiovascular | 6 (0,5) |
| Ictus isquémico | 10 (0,8) |
| Embolia periférica | 4 (0,3) |
| Infarto de miocardio | 5 (0,4) |
| Trombosis del stent | 0 (0,0) |
| Enfermedad tromboembólica venosa | 5 (0,4) |
| Hemorragia intracraneal | 1 (0,1) |
| Hemorragia que requiere reintervención | 20 (1,6) |
| Hemorragia que requiere hospitalización | 34 (2,7) |
| Hemorragia que requiere transfusión | 41 (3,2) |
| Hemorragia que requiere suspensión del tratamiento | 32 (2,5) |
| Suspensión/retraso de la intervención | 14 (1,1) |
| Hemorragia BARC> 2 | 58 (4,6) |
BARC: Bleeding Academic Research Consortium.
Objetivo principal definido como la combinación de muerte de cualquier causa, infarto de miocardio no fatal, trombosis del stent, ictus isquémico no fatal, embolia periférica, enfermedad tromboembólica venosa y/o complicaciones hemorrágicas de grado ≥ 2 según la clasificación BARC20.
Análisis en función de la incidencia del evento combinadoa durante los primeros 30 días tras la intervención
| Variable | Sin evento combinado (n=1.056) | Evento combinado (n=96) | p |
|---|---|---|---|
| Edad ≥ 75 años | 476 (45,6) | 52 (54,2) | 0,11 |
| Varones | 677 (64,1) | 57 (59,4) | 0,34 |
| Factores de riesgo cardiovascular | |||
| Fumador activo | 206 (24,2) | 23 (23,9) | 0,54 |
| Hipertensión | 799 (75,7) | 81 (84,4) | 0,31 |
| Dislipemia | 680 (64,4) | 60 (62,5) | 0,27 |
| Diabetes mellitus | 384 (36,4) | 44 (45,8) | 0,02 |
| Comorbilidades | |||
| Cardiopatía isquémica | 338 (32,0) | 40 (41,7) | 0,02 |
| Ictus | 178 (17,0) | 19 (19,8) | 0,13 |
| Enfermedad vascular periférica | 161 (15,2) | 31 (32,3) | <0,001 |
| Insuficiencia cardiaca | 225 (21,3) | 20 (20,8) | 0,58 |
| Fibrilación auricular | 511 (48,4) | 37 (38,5) | 0,13 |
| Portador de válvula mecánica | 44 (4,2) | 13 (13,5) | <0,001 |
| Enfermedad tromboembólica venosa | 87 (8,4) | 10 (10,4) | 0,45 |
| Enfermedad renal crónica | 173 (16,4) | 31 (32,3) | <0,001 |
| EPOC | 148 (14,0) | 16 (16,7) | 0,65 |
| Cáncer | 208 (19,7) | 22 (22,9) | 0,002 |
| Hepatopatía | 47 (4,4) | 5 (5,2) | 0,14 |
| Enolismo activo | 69 (6,5) | 10 (10,4) | 0,14 |
| Anemia | 147 (13,9) | 28 (29,2) | <0,001 |
| Hemorragia previa | 73 (6,9) | 9 (9,3) | 0,11 |
| Diátesis hemorrágica | 4 (0,4) | 0 (0,0) | 0,80 |
| Tratamiento antitrombótico | |||
| Antiagregantes plaquetarios | 585 (55,4) | 48 (50,0) | 0,54 |
| Ácido acetilsalicílico | 517 (49,0) | 44 (45.4) | 0,50 |
| Clopidogrel | 124 (11,7) | 14 (14,6) | 0,75 |
| Prasugrel | 1 (0,1) | 1 (1,0) | 0,16 |
| Ticagrelor | 20 (1,9) | 5 (5,2) | 0,13 |
| TAPD (total) | 89 (8,5) | 13 (13,5) | 0,13 |
| Anticoagulación | 511 (48,4) | 57 (59,4) | 0,03 |
| Acenocumarol/warfarina | 211 (20,1) | 27 (27,8) | 0,17 |
| ACOD (total) | 286 (27,1) | 25 (26,0) | 0,78 |
| Dabigatrán | 43 (4,1) | 1 (1,0) | 0,14 |
| Rivaroxabán | 49 (4,6) | 10 (10,4) | 0,05 |
| Apixabán | 131 (12,4) | 6 (6,2) | 0,07 |
| Edoxabán | 63 (6,0) | 8 (8,3) | 0,37 |
| Tratamiento puente (heparina) | 190 (18,0) | 38 (39,6) | <0,001 |
| Uso inadecuado del tratamiento antitrombóticob | 454 (43,0) | 60 (62,5) | <0,001 |
| Datos de laboratorio | |||
| Hemoglobina (g/dl) | 13,4±2,3 | 11,9±2,3 | <0,001 |
| Plaquetas (1.000/μl) | 224,1±78,1 | 247,8±109,9 | 0,06 |
| ClCr (ml/min) | 67,3±21,9 | 56,7±26,3 | <0,001 |
| Riesgo de la intervención | |||
| Riesgo trombótico alto (frente a bajo-moderado) | 124 (11,7) | 31 (32,3) | <0,001 |
| Riesgo hemorrágico alto (frente a bajo-moderado) | 150 (14,2) | 21 (21,9) | 0,03 |
ClCr: aclaramiento de creatinina; EPOC: enfermedad pulmonar obstructiva crónica; TAPD: tratamiento antiagregante plaquetario doble.
Evento combinado de muerte por cualquier causa, infarto de miocardio no fatal, trombosis del stent, ictus isquémico no fatal, embolia periférica, enfermedad tromboembólica venosa y/o complicaciones hemorrágicas de grado> 2 según la clasificación BARC (Bleeding Academic Research Consortium)20.
Los resultados del registro REQXAA muestran que, en pacientes en tratamiento anticoagulante y/o antiagregante plaquetario crónico que precisaron algún tipo de cirugía o procedimiento, la adherencia en el «mundo real» a las recomendaciones y los consensos actuales acerca de su uso perioperatorio es baja. Es interesante que los pacientes con una utilización inadecuada del tratamiento antitrombótico periprocedimiento tengan más del doble de riesgo de sufrir algún evento adverso (isquémico o hemorrágico) tras la intervención (figura 4).
El incremento de pacientes en tratamiento crónico con anticoagulantes y/o antiagregantes plaquetarios que podrían requerir a lo largo de su vida un procedimiento o cirugía ha hecho que muchas sociedades científicas hayan coordinado diferentes posicionamientos sobre el uso de estos tratamientos publicados en los últimos años11-18. Sin embargo, muchas de las recomendaciones de estos documentos de consenso están limitadas por la falta de evidencia científica, por lo que su aplicación puede resultar heterogénea. De ahí la importancia de evaluar no solo su adherencia, sino también si dicho cumplimiento se asocia con una menor incidencia de eventos adversos tras la intervención.
Existen pocos registros en la literatura que hayan estudiado la implementación local de protocolos de uso perioperatorio del tratamiento antitrombótico. En el estudio de Rossini et al., se evaluó el impacto de un documento de consenso italiano para la utilización periprocedimiento del tratamiento antiagregante plaquetario13,22. En este registro, la adherencia al consenso italiano alcanzó el 85%, aunque el estudio no fue diseñado para valorar si la aplicación de su consenso se asociaba con menos eventos cardiovasculares. Este porcentaje contrasta con el obtenido en nuestro registro, en el que solo el 57,3% de los pacientes recibió un tratamiento acorde con las recomendaciones del documento de consenso español. Este porcentaje varía en función del tratamiento antitrombótico, puesto que la tasa de adherencia es menor en pacientes anticoagulados (49,1%) que en los antiagregados (62,1%). El hecho de que para casi la mitad de los pacientes el tratamiento antitrombótico no fuera apropiado según las recomendaciones resulta más llamativo, dado que globalmente el riesgo de los pacientes incluidos en nuestro registro se consideró bajo. El 12,7 y el 14,1% de los pacientes tenían riesgos trombótico y hemorrágico altos, respectivamente, y es para ellos que en general los posicionamientos publicados presentan recomendaciones más controvertidas que requieren individualizar el tratamiento antitrombótico. Son varias las razones que pueden explicar esta diferencia. Entre ellas, hay que considerar una mayor dificultad en el ajuste de los fármacos anticoagulantes (cifras de INR previas con acenocumarol o warfarina, función renal con los ACOD, etc.), en comparación con los pacientes antiagregados. Para estos, sobre todo pacientes en monoterapia con ácido acetilsalicílico a dosis <150mg/día (la mayoría de los pacientes incluidos en nuestro registro) y antecedentes de ICP, la mayoría de los posicionamientos coinciden en mantener este tratamiento durante el periodo perioperatorio23,24.
Una de las principales causas del uso inapropiado de los fármacos antitrombóticos perioperatorio y periprocedimiento es la sobreutilización del tratamiento puente, que además se ha relacionado con mayor incidencia de eventos adversos, fundamentalmente hemorrágicos25. Así, en el estudio de Ferrandis et al. en pacientes en tratamiento crónico con ACOD que precisaron una cirugía mayor, la administración de tratamiento puente alcanzó al 35% de los pacientes, lo que se asoció con una mayor incidencia de eventos hemorrágicos, sin diferencias en los eventos trombóticos26. Estos datos se confirman en el trabajo de Douketis et al. que incluyó a más de 3.000 pacientes con FA no valvular en tratamiento con ACOD sometidos a un procedimiento o intervención27. En ese estudio, una estrategia sin tratamiento puente se asoció con menores tasas de eventos hemorrágicos o tromboembólicos. La evidencia acerca de la falta de eficacia del tratamiento puente se ha objetivado en algunas intervenciones que en principio podrían suponer mayor controversia sobre el tratamiento antitrombótico periprocedimiento, como la ablación de venas pulmonares en pacientes con FA o en otras situaciones fuera del perioperatorio, como por ejemplo tras un ictus antes de iniciar un ACOD28,29. En nuestro registro, el 18,8% de los pacientes recibieron tratamiento puente durante el periodo perioperatorio (porcentaje que alcanza el 35,3% entre los pacientes anticoagulados).
En nuestro estudio, y a pesar de que los pacientes presentaron en su gran mayoría un riesgo trombótico y hemorrágico bajos, la incidencia a 30 días del evento combinado principal fue del 7,6%, no tan baja como se podría esperar. Hay que destacar este hallazgo, considerando la gran cantidad de pacientes en tratamiento antitrombótico que requieren cirugía en algún momento de su vida. Tras realizar el ajuste estadístico, el uso inadecuado del tratamiento antitrombótico perioperatorio y un riesgo trombótico alto son los 2 factores independientes de riesgo de que se produzca algún tipo de evento durante los primeros 30 días tras la intervención. Este hallazgo refuerza la importancia de una correcta adherencia a las recomendaciones, y no solo con los pacientes en alto riesgo, para reducir la incidencia de eventos adversos.
LimitacionesEste estudio tiene una serie de limitaciones; la principal de ellas es inherente a cualquier análisis observacional: el estudio no es de un diseño experimental con el que aleatorizar a los pacientes a un determinado uso perioperatorio del tratamiento antitrombótico, por lo que los resultados acerca de la incidencia de eventos adversos y la implicación de suspender o mantener el tratamiento han de tomarse con cautela. Por otro lado, puesto que el estudio se realizó durante la pandemia de la COVID-19, en ocasiones hubo dificultades para conseguir todos los datos y las variables de los pacientes, así como su seguimiento a 30 días. A pesar de estas limitaciones, refuerzan los resultados del estudio el hecho de que sea un registro multicéntrico, en el que profesionales de múltiples especialidades han contribuido al reclutamiento de pacientes, y que la recogida de la información fue prospectiva y sistemática.
CONCLUSIONESLos resultados del registro REQXAA demuestran que, a pesar de las recomendaciones de las diferentes sociedades científicas para el tratamiento antitrombótico perioperatorio, la implementación en el «mundo real» es escasa. Además, un uso inapropiado en este contexto se asocia con un aumento de la incidencia de eventos adversos, tanto isquémicos como hemorrágicos. Es fundamental insistir en una correcta utilización de los tratamientos antiagregante plaquetario y anticoagulante implementando protocolos locales para reducir las complicaciones perioperatorias.
FINANCIACIÓNEstudio sin financiación.
CONTRIBUCIÓN DE LOS AUTORESD. Vivas y M. Anguita-Gámez han contribuido de igual manera al manuscrito. Todos los autores cumplen con los siguientes requisitos: a) contribuyeron sustancialmente a la concepción y el diseño del estudio, adquisición de datos o su análisis e interpretación; b) redactaron el artículo y/o hicieron una revisión crítica de su contenido intelectual; c) dieron la aprobación final a la versión que se publicará, y d) accedieron a asumir responsabilidades sobre todos los aspectos del artículo y a investigar y resolver cualquier cuestión relacionada con la exactitud y la veracidad de cualquier parte del trabajo.
CONFLICTO DE INTERESESD. Vivas: honorarios por ponencias de Daiichi Sankyo, AstraZeneca, Bayer, Pfizer, Abbott, Boehringer Ingelheim, Bristol-Myers-Squibb y Ferrer. R. Ferrandis: honorarios por ponencias de LFB, CSL Behring y Octapharma. M. Anguita: honorarios por ponencias de Eli Lilly & Co, Daiichi Sankyo, AstraZeneca, Bayer, Pfizer, Boehringer Ingelheim, Bristol-Myers-Squibb y Novartis; labores de consultoría para Eli Lilly & Co, Daiichi Sankyo, AstraZeneca, Bayer, Pfizer, Boehringer Ingelheim, Bristol-Myers-Squibb y Novartis. I. Egocheaga: honorarios por ponencias de Boehringer Ingelheim, AstraZeneca; labores de consultoría para AstraZeneca; apoyo para asistencia a congresos de Novartis. A. Abad-Motos: apoyo para asistencia a congresos de Vifor, Edwards. E. Figuero: honorarios por ponencias de Oral-B, Colgate, Johnsson & Johnsson, Sociedad Española de Periodoncia (SEPA), Sociedad Irlandesa de Periodoncia, Asociación Ucraniana de Periodoncia, Asociación Dental Francesa de Periodoncia; becas de investigación de Dentaid, Lacer, Universidad de Bristol; apoyo para asistencia a congresos de SEPA, Federación Europea de Periodoncia, Sociedad Irlandesa de Periodoncia y Asociación Dental Francesa de Periodoncia. N. Bouzó-Molina: apoyo para asistencia a congresos de MSD. J. Torres: honorarios por ponencias de Amgen, AstraZeneca, Bayer, Boehringer Ingelheim, Daiichi Sankyo, Eli Lilly & Co, Novartis, Pfizer y Rovi. M.J. Descalzo: honorarios por ponencias de GlaxoSmithKline; apoyo para asistencia a congresos de Daiichi Sankyo. E. Martín-Rioboo: honorarios por ponencias de Servier, Ferrer, Boehringer Ingelheim. F. Marín: honorarios por ponencias de AstraZeneca y Boehringer Ingelheim; labores de consultoría para Boehringer Ingelheim; becas de investigación de AstraZeneca, Ferrer y BMS; apoyo para asistencia a congresos de Esteve y Novo Nordisk; participación en comités de asesoramiento o monitorización de datos de seguridad de AFNET. Los demás autores declaran no tener conflictos de intereses.
- –
Cada vez es mayor el número de pacientes en tratamiento crónico con anticoagulantes y/o antiagregantes plaquetarios que en algún momento de su vida requieren una intervención.
- –
Existen multitud de documentos avalados por sociedades científicas con recomendaciones acerca del uso perioperatorio del tratamiento antitrombótico, pero se desconoce su impacto en el «mundo real».
- –
La implementación de recomendaciones acerca del tratamiento antitrombótico perioperatorio en el «mundo real» es escasa.
- –
Un uso inadecuado del tratamiento antitrombótico perioperatorio/periprocedimiento se asocia con un incremento de eventos adversos tanto trombóticos como hemorrágicos.
- –
Es fundamental incidir en el conocimiento y la utilización correcta del tratamiento antitrombótico durante el periodo perioperatorio/periprocedimiento para reducir complicaciones tras la intervención.
El Comité Coordinador del registro REQXAA quiere agradecer a todos los investigadores (material adicional) que han participado en la inclusión de pacientes en el estudio.
Los autores garantizan que los siguientes investigadores se hacen responsables de los datos contenidos en este trabajo:
Hospital Clínico San Carlos, Madrid. David Vivas (IP).
Hospital Universitari i Politècnic La Fe, Valencia. Raquel Ferrandis (IP).
Hospital Clínico Universitario Virgen de la Arrixaca, El Palmar, Murcia. Francisco Marín (IP).
Hospital Universitario Infanta Leonor, Madrid. Beatriz Nozal-Mateo (co-IP), Ane Abad-Motos (co-IP).
Facultad de Odontología, Universidad Complutense, Madrid. Elena Figuero (IP).
Facultad de Odontología, Universidad Rey Juan Carlos, Madrid. Rafael Gómez de Diego (IP).
Hospital Universitario Reina Sofía, Córdoba. Manuel Anguita (IP).
Hospital Universitario 12 Octubre, Madrid. Nuria Bouzó-Molina (IP).
Hospital General Universitario Doctor Balmis, Alicante. Teresa Lozano (IP).
Hospital Universitario La Paz, Madrid. Carlos Álvarez (IP).
Hospital Universitario de Jaén. Javier Torres (IP).
Hospital Costa del Sol, Marbella, Málaga. María José Descalzo-Pulido (IP).
Hospital General Universitario, Valencia. Juan Carlos Catalá (co-IP), Francisco Ridocci (co-IP).
Unidad de Gestión Clínica de Atención Primaria Poniente, Córdoba. Enrique Martín-Rioboo (IP).
Centro de Salud Isla de Oza, Madrid. Isabel Egocheaga (IP).
Centro de Salud Palma Norte, Madrid. Francisco Javier Torres-Martínez (IP).
Hospital Marina Baixa, Villajoyosa, Alicante. Alejandra Molines-Cantó (IP).
Hospital Universitario Torrecárdenas, Almería. Rocío Rodríguez-Contreras (IP).
Hospital Universitario La Zarzuela, Madrid. Juan José Sánchez-Palomo (IP).