El artículo «Diferenciación entre aleteo y fibrilación auricular en los electrogramas bipolares de aurícula derecha», de Isa et al1, puede plantear una cuestión muy sorprendente para muchos lectores. ¿Es realmente tan difícil distinguir el aleteo de la fibrilación auricular (FA)? o ¿es que a los electrofisiólogos les gusta rizar el rizo?
Siendo riguroso se podría criticar el planteamiento del trabajo, por un sesgo inherente a la selección de los pacientes, de modo que si se eligió a pacientes con FA que tuvieran «patrón eléctrico organizado», no es sorprendente que la variación de los intervalos entre electrogramas no fuera un identificador de FA en ese grupo. También se echa en falta la cuantificación de la incidencia de este patrón tan organizado de FA en la aurícula derecha (AD) que permita valorar la aplicabilidad general de los valores de sensibilidad y especificidad calculados sobre el grupo estudiado. Pero, aparte de discusiones metodológicas, siempre posibles, el trabajo aborda un problema de fondo que tiene un gran interés teórico y práctico y que podríamos resumir en la pregunta que expresa el título de este comentario: ¿qué es y cómo se diagnostica una fibrilación auricular?
Por sorprendente que parezca, no hay una definición electrofisiológica precisa y sencilla de la FA. Basta revisar la definición ofrecida por las guías de la American Heart Association/American College of Cardiology/European Society of Cardiology en su edición de agosto de 20062, que se limita a la descripción de un patrón de ondas auriculares irregulares en el electrocardiograma (ECG), con una referencia al libro de Bellet del año 19713. Así se define también la FA en muchos trabajos de la literatura electrofisiológica. Es cierto que, al menos, las nuevas guías hacen hincapié en que una frecuencia ventricular irregular no es diagnóstica de FA y que el aleteo puede producir esta irregularidad por patrones irregulares de conducción auriculoventricular pero, ¿es que no hemos avanzado nada en 35 años, para seguir centrándonos en un patrón del ECG como único criterio diagnóstico de FA, ¿y hasta qué punto entendemos lo que subyace a ese patrón irregular del ECG?
La FA se ha considerado siempre reflejo de la fragmentación de la activación auricular en múltiples frentes de anchura y recorrido variables. En los años cincuenta se defendió un origen focal de esta activación durante la FA, lo que significaría que la fragmentación de la activación sería debida a la incapacidad del miocardio auricular para conducir regularmente a frecuencias muy altas4 (fig. 1). La conducción de los impulsos se encontraría con zonas de refractariedad y anisotropía que producirían bloqueos funcionales de localización variable, fragmentando la activación en múltiples frentes u ondas. Es lo que se conoce como conducción fibrilatoria. Esta hipótesis del origen focal de la FA fue arrinconada poco después por la hipótesis de la reentrada autosostenida de múltiples ondas enunciada por Moe et al5 y confirmada por Allessie en 1985 por medio de cartografía endocárdica auricular avanzada6. Según esta hipótesis, la FA es una reentrada caótica (determinismo complejo) con múltiples frentes activos simultáneamente (fig. 1), que se mantiene de manera indefinida siempre que el tamaño de la preparación o el órgano que fibrila sea suficientemente grande, que el período refractario sea corto y desigual (dispersión del período refractario) y que la velocidad de conducción sea lenta. Allessie encontró que para que la FA se mantuviese indefinidamente era precisa la coexistencia de un mínimo de 6 frentes de activación. En la cartografía de FA aparecían de manera ocasional frentes de activación nuevos que indicaban la presencia de focos6,7, pero estas aparentes anomalías se explicaron como resultado de la reentrada tridimensional8.
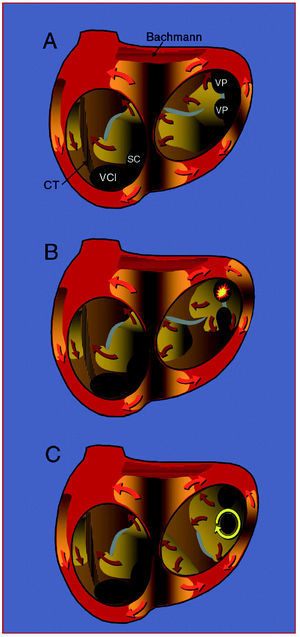
Fig. 1. Representación esquemática de los tres mecanismos descritos en la fibrilación auricular. La superficie endocárdica de las aurículas se representa a través de las válvulas mitral y tricúspide, mostrándose los orificios de la vena cava inferior (VCI), el seno coronario (SC) y las venas pulmonares izquierdas (VP). Las superficies de color anaranjado representan los frentes de activación y las flechas indican la dirección de propagación del frente, con un borde de avance claro y una estela de refractariedad oscura. Las zonas grises representan líneas de bloqueo funcional. Las zonas rayadas en negro representan haces anisotrópicos: la cresta terminal (CT) en la aurícula derecha y el haz de Bachmann en la izquierda. A: activación por múltiples ondas, sin un punto localizado de origen, que se mantiene por la propia dinámica de los frentes de activación. B: mecanismo focal en el que la activación irregular (fibrilatoria) tiene su origen en un foco automático de alta frecuencia (estrella amarilla) en una vena pulmonar. C: rotor anclado en torno a la VP inferior izquierda como motor de la activación, que también produce conducción fibrilatoria.
Los estudios de la activación auricular durante FA en el hombre han mostrado una complejidad notable que hace difícil una definición simple por medio de registros intracavitarios. Ya en 1978, Wells et al9 publicaron un estudio en pacientes con FA tras una cirugía cardiaca y registraron electrogramas auriculares aislados durante períodos de hasta 15 min, por medio de electrodos suturados en un punto indeterminado del «epicardio auricular». Los intervalos entre electrogramas iban desde muy organizados, con espacios isoeléctricos bien definidos entre los electrogramas (1/3 de los casos), a registros completamente desorganizados en los que era imposible definir electrogramas individuales (actividad fragmentada continua). Pero, en todos los casos, el análisis de un gran número de electrogramas, a lo largo del tiempo, demostraba variación de intervalos entre electrogramas de hasta 100 ms con cambios de electrogramas muy organizados a patrón desorganizado, y viceversa. Esto contrastaba con la exquisita organización y regularidad de los registros obtenidos por este mismo grupo durante episodios de aleteo en el mismo contexto clínico10. En la misma línea van las observaciones de Konnings et al11 con el mapeo localizado de la activación de la AD anterior con alta densidad de electrodos, realizadas sobre FA inducida en el curso de la cirugía cardiaca. Estos autores encontraron una activación relativamente uniforme en esta localización, con 1 o 2 frentes de activación en un 72% de los pacientes, aunque había una variación del intervalo entre ciclos > 40 ms. La presencia de múltiples frentes de activación (ondas) sólo se podía demostrar en un 28% de los casos, mientras que en la mayoría los patrones señalaban activación pasiva, más o menos irregular, con su origen en algún punto remoto de la estructura auricular. Una limitación de este estudio era el corto tiempo de análisis de 12 s, por cierto muy parecido al empleado en el trabajo de Iza et al1. Un período de registro más prolongado probablemente aumentaría las posibilidades de detectar una mayor variación de los intervalos locales9. La organización de la activación de la AD anterior está favorecida por la barrera que supone para la conducción la presencia de la cresta terminal12-14 y los agujeros de las venas cavas y la válvula tricúspide, por lo que probablemente ésta es una zona poco representativa del mecanismo global de la FA. La organización de la actividad eléctrica de la AD puede ser extrema en casos de FA con trastornos de la conducción interauricular15.
Es ya muy conocido el reciente renacimiento de la hipótesis focal de la fibrilación auricular tras los trabajos de Haïssaguerre et al16, confirmadas por otros autores17, que demuestran la inducción de FA por las descargas rápidas desde las venas pulmonares y, con menos frecuencia, desde otras estructuras venosas y auriculares18. Pero esta observación se complementa con otras relacionadas, no con el inicio, sino con el mantenimiento de la FA. En 1992, Schuessler et al19 demostraron en perros que una reentrada localizada podía provocar una activación irregular (fibrilatoria) de las aurículas, indistinguible de la FA si no se realiza una cartografía muy detallada del punto de origen de la activación. Más tarde, el grupo de Jalife demuestra, por medio de un mapeo óptico en ovejas, cómo un rotor estable puede ser un mantenedor de la FA20 (fig. 1). Estos rotores se localizaban principalmente en la aurícula izquierda, mientras que la AD tendía a activarse pasivamente, de forma irregular, por la aparición de líneas o zonas de bloqueo ante las altas frecuencias de activación. La ablación local del punto de «anclaje» del rotor puede impedir la inducción de FA en algunos modelos experimentales21; sin embargo, en otros modelos de reentrada auricular funcional se ha podido comprobar la capacidad de migración de los rotores de una zona a otra de ambas aurículas22, lo que hace el enfoque «focal» de la ablación de estos puntos de anclaje muy debatible.
Volviendo al diagnóstico de la FA, encontramos que los registros intracavitarios en pacientes con actividad auricular irregular, de configuración cambiante en el ECG, pueden mostrar patrones muy variables. Es fácil registrar electrogramas de múltiples puntos de la AD con catéteres multielectrodo, pero la actividad de la aurícula izquierda generalmente se registra sólo desde el seno coronario. En algunos casos se registra, tanto en la AD como en el seno coronario, una actividad relativamente organizada, pero con secuencias en continuo cambio (fig. 2); sin embargo, en otros casos con actividad muy fragmentada en toda la AD y en los registros del seno coronario se puede registrar una actividad regular muy rápida en un punto muy localizado, quizá indicando la presencia de un pequeño circuito reentrante (rotor) con conducción fibrilatoria a ambas aurículas (fig. 3).
Fig. 2. Registros de electrocardiograma (ECG) y endocavitarios en fibrilación auricular 1. De arriba abajo se muestran derivaciones II, III y V1, que registran ondas auriculares desorganizadas de bajo voltaje, y a continuación registros bipolares de aurícula derecha (AD) que cubren la pared anterior desde el techo (techo A) a la porción más inferior (A4) de centímetro en centímetro, y la pared septal desde su porción más inferior (S4) a la más superior (techo P), de centímetro en centímetro. En la parte inferior se representan los registros de seno coronario desde el ostium (SCo) al seno coronario distal (SC4), de centímetro en centímetro. Los números muestran los intervalos entre electrogramas. Las flechas muestran los cambios en la dirección de la activación. Se puede apreciar que, aunque hay espacios isoeléctricos amplios entre los electrogramas, los intervalos y las secuencias cambian continuamente.
Fig. 3. Registros de electrocardiograma (ECG) y endocavitarios en fibrilación auricular 2. Arriba se observan las derivaciones II y V1 muestran actividad auricular desorganizada. Todos los registros de la aurícula derecha (AD) y el seno coronario (SC) muestran desorganización total, con deflexiones múltiples y líneas de base inexistentes en muchos puntos, con la excepción del SC más distal (SC 7) que muestra electrogramas perfectamente regulares a muy alta frecuencia (ciclo 140 ms equivalente a 430/min), compatible con actividad reentrante regular (rotor) muy localizada en la aurícula izquierda, como motor de la activación.
Los fármacos antiarrítmicos tenderían a aumentar la organización de la FA, ya sea por una prolongación del período refractario, ya por una ampliación del radio de giro de la reentrada23, con disminución del número de rotores pequeños. Los fármacos también pueden aumentar el bloqueo a través de la cresta terminal24, lo que acentuaría aún más la organización de la activación. De hecho, la aparición de FL en pacientes con FA en tratamiento con fármacos antiarrítmicos no es más que una consecuencia de esta organización de la reentrada.
¿Con qué nos podemos quedar al final para establecer el diagnóstico diferencial entre FA y aleteo, de modo que pudiéramos dar entrada a un diagnóstico automático? Cuando contamos con un electrograma aislado, la respuesta está en el tiempo de registro. Si se hacen registros suficientemente largos, ≥ 30 s de duración, es muy excepcional que no se registre una variación ≥ 50 ms entre los electrogramas de la FA, mientras que en el aleteo ocurre lo contrario. El uso de un tiempo largo de detección es perfectamente posible en esta situación, ya que estas arritmias rara vez plantean un riesgo vital; además, evitaría la intervención innecesaria y potencialmente arritmogénica en episodios autolimitados de taquicardia. El tiempo suficiente de registro y examen es la clave también para el diagnóstico diferencial del aleteo y la FA en el laboratorio, donde las transiciones entre una y otra arritmia son, además, posibles y el uso de varios puntos de registro durante un período largo revelará más pronto o más tarde la irregularidad y el cambio de secuencia propios de la FA. De un modo parecido, el estudio detallado del patrón de ondas auriculares en el ECG permite descubrir la irregularidad y el cambio de morfología de éstas en la FA, en los casos en que su relativa organización plantea el posible diagnóstico de aleteo.
Y, por último, ¿cómo llamamos a un ritmo que produce actividad organizada en una aurícula y desorganizada en la otra? ¿Tenemos que acuñar términos como «aleteo localizado con conducción fibrilatoria» o «FA de origen localizado»? No hay respuestas a estas preguntas y el estudio de cada caso tendrá que llevar a una definición descriptiva del mecanismo observado. Si la conducción fibrilatoria es índice de trastorno difuso de la conducción auricular, la distinción entre ésta y la reentrada múltiple sería poco útil en la práctica, porque ambas serían índice de una profunda disfunción eléctrica. Hoy por hoy, sólo la perfecta organización de la activación de ambas aurículas que caracteriza el aleteo25 nos abre el camino de su tratamiento de cardioversión por estimulación programada y/o el tratamiento «curativo» por medio de la ablación con catéter de un istmo críticamente localizado en el circuito.
Correspondencia: Dr. F. García-Cosío.
Servicio de Cardiología. Hospital Universitario de Getafe.
Ctra. de Toledo, km. 12,5. 28905 Getafe. Madrid. España.