Siempre que se publican unas nuevas guías de práctica clínica surgen aspectos controvertidos. Son documentos de consenso y frecuentemente sus conclusiones no satisfacen a todos los profesionales involucrados en el manejo de una determinada patología. En estas guías sobre revascularización miocárdica se intenta conciliar las evidencias existentes sobre las diferentes técnicas de revascularización con los avances en las diferentes modalidades de intervencionismo. La principal aportación de estas guías es reconocer que los resultados de las diferentes técnicas de revascularización están determinados en gran medida por cada operador y cada centro. En muchas situaciones existen varias posibilidades, todas aceptables, y la opinión del paciente debe considerarse preferentemente ofreciéndole una opinión sin sesgos. Las guías proponen la creación del Heart Team, o equipo cardiaco, en cada centro para poder adoptar las mejores estrategias según los resultados locales y resolver situaciones predefinidas para las que la evidencia actual no es clara. Intentan evitar la improvisación, especialmente en situaciones clínicamente estables. En este artículo se repasan en detalle las aportaciones más importantes de estas guías en los diferentes escenarios clínicos y anatómicos de la práctica clínica diaria. Otra aportación, en este caso cuestionada, son las recomendaciones sobre el tratamiento farmacológico asociado a la revascularización, especialmente la percutánea. Posiblemente estas recomendaciones excedan el ámbito de estas guías, aunque su incorporación se puede justificar por las novedades surgidas en cuanto al tratamiento antitrombótico óptimo asociado al intervencionismo. Algunos de estos aspectos se han corregido y aclarado en guías posteriores, dirigidas específicamente a cada una de las situaciones clínicas concretas.
Palabras clave
En general, se considera que las guías de práctica clínica (GPC) son la mejor aproximación para trasladar a la clínica diaria los diferentes avances en los conocimientos sobre una determinada materia. En ellas, determinados expertos revisan la evidencia científica existente y la sintetizan en diferentes recomendaciones. El Instituto de Medicina define las GPC como «declaraciones desarrolladas sistemáticamente para ayudar a las decisiones de médicos y pacientes sobre la atención médica apropiada en circunstancias clínicas específicas»1. Si las GPC son de calidad, se difunden y se aplican debidamente, ofrecen muchos beneficios potenciales, como menos variabilidad en la práctica clínica2, mejores resultados en la salud de los pacientes3, contención de costes y una transferencia rápida de la investigación a la práctica clínica diaria. Sin embargo, es frecuente que existan GPC sobre un mismo tema elaboradas por diferentes colectivos que, analizando la misma evidencia científica, lleguen a recomendaciones diferentes. Con frecuencia, estas diferencias han generado cierta controversia y dudas acerca de la calidad y la independencia de las diferentes GPC. Como respuesta a esta creciente preocupación, se ha publicado una variedad de instrumentos de evaluación para juzgar la calidad de las GPC2,4–9. El presente artículo revisa las aportaciones de las nuevas GPC de la Sociedad Europea de Cardiología (ESC) y la European Association for Cardio-Thoracic Surgery (EACTS) sobre revascularización miocárdica10, con especial énfasis en las diferencias con las recientes GPC del American College of Cardiology y la American Heart Association sobre intervencionismo coronario percutáneo (ICP)11 y cirugía coronaria12.
Características generales de las guías de práctica clínica de la sociedad europea de cardiología sobre revascularización miocárdicaIdealmente, la calidad de una GPC debe medirse por una evaluación prospectiva de su eficacia en el logro de los resultados en salud esperados. El Instituto de Medicina define una GPC como válida si «cuando se siguen sus recomendaciones, se obtienen logros en la salud y los costes previstos por ella»13. Sin embargo, la mayoría de las GPC carecen de esta información. Por lo tanto, una evaluación de una GPC a menudo implica una evaluación de la metodología utilizada en la elaboración de la guía y el contenido del documento resultante. Existen tres principios fundamentales que sustentan el desarrollo de unas guías de calidad: a) deben ser multidisciplinarias; b) deben estar basadas en una revisión sistemática de los trabajos publicados, y c) de manera expresa, deben vincular sus recomendaciones con la evidencia en que se apoyan. Actualmente estos aspectos están considerados en mayor o menor grado en casi todas las GPC de las diferentes sociedades de cardiología, lo que constituye un cambio de planteamiento con respecto a las GPC previas, no redactadas por un equipo multidisciplinario14. Una de las aportaciones de las nuevas GPC sobre revascularización es que, por primera vez, se intenta englobar todas las modalidades de revascularización, tanto percutánea como quirúrgica, en un mismo documento. Las guías europeas previas solamente incluían la revascularización percutánea14 y las guías norteamericanas, a pesar de un importante esfuerzo de integración para evitar discrepancias, siguen manteniendo la estructura de unas guías independientes para la revascularización percutánea11 y la revascularización quirúrgica12.
Otra de las características diferenciadoras entre las GPC europeas y las estadounidenses es la constitución del comité designado para su elaboración. Ambas son multidisciplinarias, pero en las estadounidenses, la mayoría de los representantes que participaron en su elaboración eran cardiólogos, muchos de ellos intervencionistas, pero también radiólogos y de otras especialidades. Sin embargo, en un intento de evitar sesgos de interpretación de las diferentes publicaciones, en las GPC de la ESC y la EACTS, el comité que las redactó estaba formado por 8 cardiólogos no intervencionistas, 8 cirujanos cardiacos y 9 cardiólogos intervencionistas. Esto ha permitido que las GPC de la ESC y la EACTS sean las primeras guías conjuntas de ambas sociedades de cardiólogos y cirujanos. Con esta constitución se intenta acreditar que, ante una indicación de clase I, todos los profesionales de diferentes especialidades están de acuerdo en la utilidad de una recomendación y que, en las indicaciones de clase III, todos están de acuerdo en su inutilidad. Se resaltan también situaciones en las que no hay acuerdo entre los diferentes especialistas, que son las indicaciones de clase II. Se intentó evitar el sesgo que pudiera generar una especialidad determinada. Sin embargo, también se ha criticado que no se haya incluido a otros profesionales en el comité de redacción, como se recomienda en las guías NICE15. En ellas se discute en profundidad la necesidad y la forma de proporcionar al paciente la información de manera mucho más exigente que la habitual en la práctica diaria, y se incluye un apéndice con un modelo de información para ofrecer al paciente.
Estratificación del riesgoAl igual que en otras guías, especialmente las del síndrome coronario agudo (SCA), en las guías actuales se aconseja que debe establecerse el riesgo de la enfermedad y el riesgo de cada procedimiento para la toma de decisiones. Si bien es cierto que, a pesar de que nadie ha demostrado que el empleo de los diferentes scores ayude a obtener mejores resultados, resulta obvio que los riesgos de un procedimiento no pueden exceder los riesgos de una determinada situación clínica, lo cual no siempre se evalúa con suficiente rigor, ya que en ocasiones se realizan procedimientos no exentos de riesgo en enfermos de bajo riesgo. Por otra parte, permite un control de la calidad y facilita la comparación de los resultados entre diferentes centros y operadores. El principal inconveniente de la estrategia propuesta es que con ninguno de los scores recomendados por las GPC hay acuerdo sobre su utilidad tanto en la revascularización quirúrgica como en la percutánea.
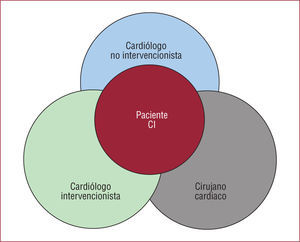
Heart Team o equipo cardiacoProbablemente la aportación más innovadora de estas guías sea hacer gran hincapié en que, para seleccionar la mejor estrategia para los pacientes, es necesario constituir el denominado Heart Team, o equipo cardiaco, en cada centro (fig.). Este concepto surge básicamente por dos aspectos:
- •
En los ensayos clínicos aleatorizados realizados en la última década sobre las diferentes estrategias de revascularización, todos los pacientes incluidos fueron evaluados por cardiólogos intervencionistas y cirujanos, y la distribución aleatoria sólo pudo producirse en los casos en que ambos especialistas consideraron que ambas técnicas de revascularización podían ofrecer buenos resultados. Por lo tanto, la superioridad de una técnica sobre otra sólo se ha establecido en los ensayos donde ambas técnicas eran factibles y con elevadas posibilidades de éxito.
- •
El éxito de todos los procedimientos intervencionistas depende, en gran medida, de los resultados de quien realiza el procedimiento y de los medios y la experiencia del equipo que lo va a realizar. Por lo tanto, los resultados de muchos ensayos clínicos de técnicas intervencionistas no son extrapolables a todos los centros ni a todos los operadores, por lo que debe existir un comité local para facilitar la toma de decisiones.
Esquema propuesto para el Heart Team, donde la parte central del proceso de decisión sobre la revascularización coronaria está en el deseo del paciente. Los cardiólogos clínicos, intervencionistas y cirujanos deben ofrecer al paciente la información sobre la experiencia de los resultados en su centro para que tome una decisión libre.
CI: cardiopatía isquémica.
Este concepto también apareció después en las nuevas GPC estadounidenses, pero en estas sólo se considera necesario para situaciones especiales. En las guías europeas, el eje central es el paciente, y se reconoce que existe un número importante de situaciones en que pueden establecerse varias alternativas, todas ellas adecuadas. La decisión final debe tomarla el paciente cuando se le ofrece una información adecuada y libre de sesgos de todas las posibilidades. Si bien conceptualmente esta recomendación resulta atractiva, y probablemente sea el aspecto más novedoso de estas GPC, a nadie se le escapa que su aplicación en la práctica clínica resulta difícil, y habitualmente sólo se lleva a cabo durante sesiones clínicas con pacientes seleccionados para los que se ha planteado una revascularización quirúrgica. En muchos casos, la elección de ICP se realiza durante el mismo cateterismo diagnóstico, sin discutir la conveniencia y el tipo de revascularización de manera reglada. Este tipo de práctica clínica no sería apropiado para los pacientes estables, para quienes se hace especial énfasis en la necesidad de tomar decisiones conjuntas y obtener la opinión del paciente después de un tiempo de meditación. Últimamente se han incrementado las sentencias en contra de profesionales que, según las GPC, han implantado stents en pacientes que no lo necesitaban16. Probablemente la única vía de aproximación al seguimiento de esta recomendación es establecer en cada centro, entre clínicos, hemodinamistas y cirujanos, unas pautas generales de actuación y reservar para la discusión por el Heart Team solamente situaciones previamente establecidas. Obtener el consentimiento informado de los procedimientos es una necesidad legal y ética. Idealmente, el consentimiento informado se debe obtener con un tiempo suficiente antes del procedimiento, y el paciente puede considerar plenamente las cuestiones de consentimiento informado y discutir en familia o con los profesionales, evitando cualquier coacción. El intervencionismo ad-hoc presenta problemas especiales. Cuando el consentimiento para el intervencionismo se obtiene antes del cateterismo diagnóstico, es imposible predecir los niveles de riesgo y las posibilidades terapéuticas. Es responsabilidad de los cardiólogos intervencionistas actuar en el mejor interés del paciente y favorecer las circunstancias en que sea posible meditar la decisión colegiada. Las GPC definen las situaciones donde resulta adecuado el IPC ad-hoc (sin abandonar la sala de cateterismos), frente al procedimiento programado, cuando se realiza en otra sesión. Aunque el ICP ad-hoc puede resultar más cómodo para el paciente, se asocia a menos complicaciones vasculares y puede ser una buena opción para muchos pacientes, no lo es para todos, por lo que no se lo debe adoptar como estrategia sistemática, especialmente en pacientes con enfermedad coronaria grave y compleja. Los protocolos hospitalarios diseñados por el equipo multidisciplinario deben definir criterios anatómicos específicos y subgrupos clínicos que permitan diferenciar entre los pacientes a los que se puede tratar ad-hoc y los que no. En general, la revascularización ad-hoc sobre el vaso «culpable» parece ser la más adecuada en el seno del SCA y puede ser más cuestionable en pacientes estables o sobre vasos distintos del causal en el seno del SCA. Los ensayos clínicos recientes, como el COURAGE17 o el SYNTAX18, han generado cierta preocupación sobre el uso generalizado del ICP en muchos pacientes con enfermedad coronaria estable, cuando se ha demostrado que el ICP no mejora la supervivencia en comparación con el tratamiento médico óptimo. Para los pacientes con enfermedad coronaria más grave, el ICP tiene la misma supervivencia a 1 año que la cirugía, pero conlleva la necesidad de tratamiento antiagregante más prolongado y mayor frecuencia de repetición de procedimientos por recurrencia de síntomas. En algún estudio curioso, se ha observado que, cuando la angiografía se realiza en centros sin capacidad de realizar un procedimiento ad-hoc, la probabilidad de que los pacientes sean revascularizados mediante cirugía es muy superior a la de los centros con capacidad de realizar procedimientos ad-hoc y, además, tienen una mayor adherencia a las recomendaciones19. En el otro extremo están los pacientes que son revascularizados y realmente podrían haber sido tratados satisfactoriamente con tratamiento farmacológico20. Una pequeña pausa para meditar la decisión puede reducir el número de pacientes que eligen finalmente la revascularización, como se demostró en un pequeño ensayo clínico canadiense21. Además, una pausa permite la optimización del tratamiento médico, incluidos los antiagregantes plaquetarios y las estatinas previos al procedimiento.
Consideraciones específicas sobre la revascularizaciónAl analizar estas guías, debemos recordar que tras su introducción, hace ya 35 años, el ICP ha sido la estrategia terapéutica más analizada a la luz de la evidencia generada por los ensayos clínicos aleatorizados10. A diferencia de las GPC estadounidenses11,12, en las guías europeas las recomendaciones sobre revascularización se realizan de manera general, y sólo en casos muy aislados se diferencia el beneficio esperable desde el punto de vista pronóstico del beneficio sintomático10. En general, y como ya se ha explicado, el Heart Team debe permitir realizar recomendaciones individualizadas basadas en la evidencia disponible y, en general, sopesar la mayor disponibilidad y la menor agresividad del ICP con respecto a la eficacia más duradera de la revascularización quirúrgica10. Las guías señalan que esta decisión multidisciplinaria no es necesaria para el tratamiento de las lesiones causales de los pacientes con SCA sin elevación del segmento ST (SCASEST)10. Además, como ya hemos mencionado, localmente el Heart Team debe generar protocolos institucionales que faciliten la toma de decisiones en la práctica clínica habitual de una forma dinámica y la adecuada realización de procedimientos de ICP ad-hoc10.
La importancia de la presentación y de los aspectos clínicosLos síntomas y la presentación clínica de los pacientes determinan las indicaciones de revascularización. Las actuales GPC repasan con intención didáctica la rentabilidad diagnóstica de las distintas pruebas no invasivas en la detección de isquemia y resaltan que, en situaciones especiales, la valoración invasiva —en la propia sala de hemodinámica— de la gravedad de las lesiones desde el punto de vista anatómico y, sobre todo, funcional (reserva fraccional de flujo) (I-A), puede ayudar a definir mejor la necesidad de revascularización en pacientes con lesiones dudosas y en aquellos sin previa demostración objetiva de isquemia (I-A)10. Este concepto se repite en diferentes apartados de estas guías.
En pacientes estables con enfermedad coronaria no demasiado grave ni extensa, el grado de isquemia miocárdica puede ayudar a tomar decisiones terapéuticas, ya que, si es limitada, se debe reconsiderar la posibilidad de optimizar el tratamiento médico asociado antes de proponer la revascularización10. En pacientes con cardiopatía isquémica estable o estabilizados tras un SCA, es importante analizar la gravedad y la extensión de la enfermedad coronaria para decidir entre la cirugía coronaria y el ICP18. Como luego veremos, el score SYNTAX ha adquirido un importante protagonismo en estos pacientes10.
En estas GPC se hace especial referencia a la importancia de la diabetes mellitus, y se propone que, en caso de duda, la presencia de este factor debe inclinar la balanza hacia la revascularización quirúrgica. Se cuestionan, sin embargo, algunas prácticas clásicamente recomendadas en diabéticos, como la necesidad de suspender la metformina antes del procedimiento (actualmente IIb-C), aunque se insiste en la necesidad de prehidratación y de una adecuada monitorización de la función renal tras el ICP.
En cuanto a la prevención de la nefropatía por contraste, las GPC resaltan la importancia (I-A) de un tratamiento médico óptimo (estatinas, bloqueadores beta e inhibidores de la enzima de conversión de la angiotensina [IECA]) y de la prehidratación con suero salino isotónico, comenzando 12h antes del procedimiento y manteniéndola hasta 24h tras la intervención. Sin embargo, la progresiva información sobre la falta de utilidad de la N-acetilcisteína o del bicarbonato sódico hace que estos tratamientos preventivos obtengan actualmente sólo una recomendación IIb-A.
Las GPC también discuten nuevos aspectos sobre la revascularización en pacientes con insuficiencia cardiaca crónica y en pacientes con enfermedad carotídea o vascular asociada. Aunque se explican los resultados del estudio STICH (negativo en su objetivo primario)22,23, se señala que, en los pacientes con disfunción ventricular grave (fracción de eyeccion ≤ 35%) cuya clínica fundamental es la insuficiencia cardiaca y que tienen miocardio viable, se debe considerar la posibilidad de revascularización, bien quirúrgica (IIa-B) o por ICP (IIb-C)10. También es interesante que estas GPC analicen en profundidad la evidencia existente para guiar la toma de decisiones clínicas en pacientes con revascularizaciones previas fallidas, tras ICP o cirugía, que frecuentemente vemos en la práctica clínica diaria.
Por otro lado, las guías hacen hincapié en los beneficios de una estrategia invasiva en los pacientes con SCA, especialmente en aquellos con datos clínicos de mayor riesgo10. En el contexto del SCA con elevación persistente del segmento ST (SCACEST), estas GPC proponen un interesante algoritmo terapéutico que resalta la importancia de que los servicios médicos de emergencia trasladen al paciente directamente a un centro hospitalario con programa de angioplastia primaria. En este algoritmo, la fibrinolisis quedaría relegada exclusivamente a pacientes que acuden por sus propios medios a un centro sin capacidad para angioplastia primaria, siempre y cuando el traslado a un centro con esta posibilidad conlleve un retraso hasta la intervención > 2h10. Además, el algoritmo también propone que todos los pacientes a los que se somete a fibrinolisis se trasladen posteriormente a la unidad coronaria de un centro con disponibilidad de angioplastia. En esta unidad se procederá a una angioplastia de rescate en caso de trombolisis fallida o a una coronariografía (entre 3 y 24h tras el primer contacto médico), con angioplastia diferida en su caso, en los pacientes con éxito de la trombolisis10. Durante la angioplastia primaria, estas GPC aconsejan la realización de una revascularización completa (de todas las lesiones críticas en arterias importantes, no sólo la causal) únicamente en pacientes en shock cardiogénico24. De forma similar, el uso de balón de contrapulsación intraaórtico sólo se recomienda en estos pacientes cuando haya deterioro hemodinámico10. Finalmente, con respecto a ediciones anteriores, estas guías aumentan el grado de evidencia (IIa-A) sobre el beneficio de la aspiración manual del trombo intracoronario con catéteres dedicados en la lesión casual en los pacientes con infarto de miocardio con elevación del segmento ST10.
Importancia de los escenarios anatómicos y selección de dispositivosUna de las novedades introducidas por estas GPC es acoger, con rango de recomendación (IIa-B), la utilización de la puntuación (score) SYNTAX en el proceso de toma de decisiones10,18. Esta recomendación es más alta que la obtenida por otras escalas de riesgo más clásicas. Es preciso recordar, no obstante, que la puntuación SYNTAX se desarro-lló específicamente para «cuantificar» la complejidad anatómica desde el punto de vista de la ICP. De hecho, esta puntuación se ha demostrado muy útil para predecir la evolución desfavorable (fundamentalmente por la necesidad de nueva revascularización) tras el ICP, mientras que su valor en el caso del paciente sometido a cirugía coronaria parece ser escaso y no está bien definido. Por eso, es fundamental recordar —de nuevo— la importancia de las variables clínicas (p. ej., edad, diabetes mellitus, etc.) en la toma clínica de decisiones para elegir entre ambas estrategias de revascularización. De hecho, muchos investigadores proponen la incorporación de variables clínicas a la puntuación SYNTAX o el desarrollo de modelos combinados que incluyan tanto los datos del SYNTAX como los del EuroSCORE25,26.
Aunque una simple puntuación anatómica difícilmente puede sustituir la valoración de un cardiólogo intervencionista experimentado de las posibles dificultades anatómicas y técnicas que pueden presentarse durante el ICP, estas guías enfatizan el valor adicional de utilizar sistemáticamente esta nueva herramienta diagnóstica para cuantificar la complejidad de la anatomía coronaria. Aunque pensamos que globalmente esta recomendación es positiva y obliga a revisar la anatomía coronaria de manera sistemática y rigurosa, desde el punto de vista práctico también debemos tener en cuenta algunas consideraciones. Por una parte, la reproducibilidad de la puntuación SYNTAX es relativamente limitada. Además, en la propia aplicación electrónica basada en la web que permite acceder a esta herramienta, se recuerda que no está diseñada para la toma de decisiones en pacientes individuales. Finalmente, hay que recordar que en la puntuación SYNTAX deben incluirse todas las lesiones con estenosis > 50% en vasos > 1,5mm, incluso si se considera que su repercusión funcional podría no justificar una revascularización o cuando se decide no tratarlas. Precisamente, las lesiones en vasos pequeños y la presencia de bifurcaciones condicionan, en gran medida, la limitada concordancia interobservador de esta puntuación.
En la revascularización de pacientes con enfermedad coronaria grave (tres vasos o tronco coronario izquierdo), estas GPC conceden especial importancia al estudio SYNTAX18. Se resalta que en estos pacientes el estudio SYNTAX no logró demostrar la no inferioridad del ICP frente a la cirugía en su objetivo primario de valoración (variable combinada de muerte, infarto de miocardio, ictus y nueva revascularización) y que, por lo tanto, se debe interpretar con suma cautela los análisis adicionales de los resultados (incluidos los análisis de subgrupos)10,18. Sin embargo, la puntuación de SYNTAX entra ya «de lleno» en las tablas de las guías en los diferentes subgrupos. Así, un paciente con enfermedad de tres vasos con lesiones sencillas, con una puntuación SYNTAX ≤ 22 (tercil inferior), en el que sea razonable esperar obtener una adecuada revascularización funcional, tiene una recomendación I-A para cirugía y IIa-B para ICP.
Otro aspecto novedoso de estas GPC es que, por primera vez y de forma oficial, se «abre la puerta» al tratamiento con ICP de pacientes con tronco coronario izquierdo no protegido que sean buenos candidatos quirúrgicos10. En las previas GPC europeas y estadounidenses, la ICP no estaba recomendada (recomendación clase III) para pacientes que podían beneficiarse de la cirugía27. Las actuales GPC, sin embargo,
Diferencias de recomendaciones en el tratamiento antitrombótico en el SCASEST de las guías de práctica clínica de revascularización de la ESC, el ACC y las guías sobre el manejo del SCASEST de la ESC
| SCA | EMV estable | Estable con indicación de ICP ad-hoc | ||||
| Shock | SCACEST | SCASEST | Otros SCA | |||
| Necesidad de decisión multidisciplinaria | No | No | No para la lesión «culpable», sí para «no culpables» | Sí | Sí | Sí según protocolos predefinidos |
| Realización de la revascularización | Sin retraso | Sin retraso | Urgente: < 72h | Urgente: con restricciones de tiempo | Electiva: sin restricciones de tiempo | Electiva: sin restricciones de tiempo |
| Procedimiento | Proceder según evidencia/disponibilidad | Proceder según evidencia/disponibilidad | Proceder según evidencia/disponibilidad. Las lesiones «no culpables», según el protocolo del centro | Proceder según evidencia/disponibilidad. Las lesiones «no culpables», según el protocolo del centro | Planificar la intervención requerida con tiempo suficiente para realizar pruebas diagnósticas antes de la intervención | Proceder según el protocolo del Heart Team del centro |
ACC: American College of Cardiology; EMV: enfermedad multivaso; ESC: European Society of Cardiology; ICP: intervencionismo coronario percutáneo; SCA: síndrome coronario agudo; SCASEST: SCA sin elevación del segmento ST.
Desde el punto de vista de los dispositivos, estas GPC apoyan claramente el uso de stents farmacoactivos (STF). Esto concuerda con la creciente utilización de estos nuevos stents en nuestro país33. Literalmente se menciona «… los STF con eficacia probada deberán ser considerados como el tratamiento de primera elección en prácticamente la totalidad de los posibles escenarios clínicos y anatómicos, excepto cuando exista una preocupación sobre el adecuado mantenimiento de una doble antiagregación prolongada o cuando esta terapia esté contraindicada». Sin embargo, también se resalta la evidencia limitada que apoya la utilización de STF en caso de infarto agudo de miocardio y en pacientes con puentes de safena degenerados10.
Se discute el reto que representan las bifurcaciones, donde se aconseja utilizar STF y la clasificación de Medina34, y se recomienda realizar técnicas sencillas (stent provisional) evitando, siempre que sea posible, técnicas complejas (doble stent). Incluso se indica confirmar la repercusión funcional de las ramas cubiertas por un stent antes de proceder a su tratamiento10.
En cuanto a las oclusiones totales, se insiste en la importancia de demostrar la presencia de angina o isquemia en el territorio afecto, así como en que los resultados en estas lesiones están fuertemente ligados a la experiencia del operador. Existen técnicas especiales (vía retrograda) y nuevos avances tecnológicos especialmente diseñados para el tratamiento de las oclusiones crónicas que ayudan a mejorar la tasa de éxito del procedimiento, pero se recuerda también el riesgo de altas dosis de radiación.
En los puentes de safena se recuerda la falta de evidencia sobre la superioridad de STF y se recomienda el uso de sistemas de protección distal (I-B) para prevenir las consecuencias de la embolización de material friable (IIb-B para los sistemas de protección proximal). Los stents con efecto «malla» para la prevención de fenómenos embólicos en safenas tan sólo reciben una recomendación IIb-B. Para las lesiones no dilatables por calcificación grave, se recomienda (I-C) la utilización de aterectomía rotacional. El abciximab (IIa-B) y el nitroprusiato o la adenosina (ambos IIb-C) se recomiendan para el tratamiento de pacientes en que no se restablece el flujo miocárdico (fenómeno de no-reflow).
En estas guías se resalta por primera vez el posible beneficio de utilizar balones liberadores de fármacos y se resalta su utilidad (IIa-B) en el tratamiento de reestenosis de stents convencionales10. En este contexto, también se apunta el posible beneficio (IIb-C) de los balones de corte o similares (scoring) para evitar fenómenos de deslizamiento, con el consiguiente traumatismo de los segmentos adyacentes a la reestenosis en el stent.
Desde un punto de vista algo más técnico, quizá se eche de menos una mención específica a las implicaciones derivadas de la elección de la vía de acceso vascular (radial o femoral) y sobre el empleo de dispositivos de cierre vascular10.
Tratamiento farmacológico asociado a la revascularizaciónUno de los aspectos más criticados en las GPC sobre la revascularización coronaria es que intentan ir más allá de la revascularización en un documento específicamente orientado a los procedimientos. En las GPC, por ejemplo, se incluyen recomendaciones sobre las estrategias para el diagnóstico o sobre el tratamiento farmacológico asociado a la revascularización y prevención secundaria. Los detractores de este planteamiento argumentan que un documento excesivamente extenso puede considerarse demasiado ambicioso e imposible de abarcar en su complejidad, lo que puede generar múltiples conflictos con muchas de las otras guías publicadas previamente.
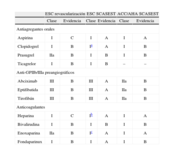
Entre los elementos más controvertidos están las recomendaciones del tratamiento antitrombótico asociado a la revascularización. Estas recomendaciones chocan con las de la ESC sobre el manejo del SCASEST, publicadas solamente un año después35, y con las GPC estadounidenses36. Las diferencias entre ellas son difíciles de explicar, especialmente si se tiene en cuenta que entre las tres guías no ha habido ningún nuevo ensayo clínico que ofrezca información que justifique muchas de las diferencias. Resulta indudable que desde la publicación de las guías de intervencionismo de 200514, SCACEST de 200837 y SCASEST de 200738, se han publicado numerosos ensayos clínicos que han aportado información relevante, perfilando mejor el régimen antitrombótico asociado especialmente a la revascularización percutánea. Estos ensayos han estudiado el empleo de antagonistas de la glucoproteína IIb/IIIa (ACUITY39, EARLY-ACS40), anticoagulación (ACUITY39 y HORIZONS41) o nuevos antiagregantes plaquetarios orales (TRITON-TIMI 3842, PLATO43 y CURRENT-OASIS 744). Parecía necesaria cierta actualización sobre estos aspectos después de la publicación de ensayos clínicos de gran relevancia. Las principales diferencias en el manejo del tratamiento antitrombótico asociado a la revascularización son las referentes al SCASEST (tabla 2). Se han destacado estas diferencias, pero no se ha tenido en cuenta que la principal aportación es el manejo antitrombótico en la angina estable sometida a revascularización y en las diversas formas de SCA, donde las recomendaciones existentes se habían quedado desfasadas tras los nuevos ensayos de antiagregantes plaquetarios y anticoagulantes. Indudablemente, las GPC de manejo del SCASEST35 resultan más adecuadas para su seguimiento en esta situación que las guías de revascularización, ya que, aunque no hubo nuevos estudios, se han conocido más análisis de los estudios existentes y se contemplan muchas más situaciones particulares que el planteamiento general recomendado en las guías de revascularización no advierte. La diferencia más llamativa es la del grado de recomendación del clopidogrel, el prasugrel y el ticagrelor, especialmente cuando este no estaba disponible en ninguno de los mercados cuando se elaboraron las GPC. Es necesario tener en cuenta que las GPC sobre revascularización sólo hacen una recomendación general y las demás se centran en cada uno de los escenarios concretos, por lo que tienen mayor validez.
Tratamiento antitrombótico recomendado por las diferentes guías de práctica clínica sobre la revascularización en el SCASEST
| ESC revascularización | ESC SCASEST | ACC/AHA SCASEST | ||||
| Clase | Evidencia | Clase | Evidencia | Clase | Evidencia | |
| Antiagregantes orales | ||||||
| Aspirina | I | C | I | A | I | A |
| Clopidogrel | I | B | Ia | A | I | B |
| Prasugrel | IIa | B | I | B | I | B |
| Ticagrelor | I | B | I | B | – | – |
| Anti-GPIIb/IIIa preangiográficos | ||||||
| Abciximab | III | B | III | A | IIa | B |
| Eptifibatida | III | B | III | A | IIa | B |
| Tirofibán | III | B | III | A | IIa | B |
| Anticoagulantes | ||||||
| Heparina | I | C | Ib | A | I | A |
| Bivalirudina | I | B | I | B | I | B |
| Enoxaparina | IIa | B | Ic | A | I | A |
| Fondaparinux | I | B | I | A | I | B |
ACC: American College of Cardiology; AHA: American Heart Association; Anti-GPIIb/IIIa: antagonistas de la glucoproteína IIb/IIIa; ESC: European Society of Cardiology; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Las medidas de prevención secundaria, si bien se podrían haber omitido, ya que no hacen ninguna aportación novedosa sobre las guías de prevención45, probablemente deben considerarse un recordatorio sobre unas medidas también imprescindibles asociadas a la revascularización. Este recordatorio, posiblemente sea más necesario en los pacientes sometidos a revascularización quirúrgica.
Posibles mejorasUn aspecto que convendría considerar en el futuro es que se debe reducir al mínimo las recomendaciones de clase II (evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento) y las recomendaciones basadas exclusivamente en el consenso de los autores (nivel de evidencia C), ya que son las más influidas por la composición del comité de redacción y en las que hay mayor divergencia entre las diferentes versiones. Deben centrarse en las recomendaciones de clase I (evidencia y/o acuerdo general de que determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo) o una recomendación clase III (evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial), con un nivel de evidencia A (datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis). Otro aspecto importante es evitar documentos excesivamente extensos y fomentar los estudios que avalen que el seguimiento de determinada GPC conlleva mejores resultados. En las presentes GPC, de las 287 recomendaciones, sólo 144 son de clase I y 45 son de clase III, mientras que el nivel de evidencia en que se sustentan es de nivel A sólo en 76, y 79 son de nivel C.
En conclusión, las GPC de la ESC sobre revascularización aportan nuevos enfoques a la revascularización, especialmente en el caso del enfermo estable, centrado en la decisión del Heart Team y el paciente. Las principales críticas se centran en un gran número de recomendaciones insuficientemente sustentadas por la evidencia científica.
Conflicto de interesesNinguno.