Los desfibriladores automáticos modernos incluyen entre sus funciones la estimulación antibradicardia, la cardioversión de baja energía y la desfibrilación de alta energía. Tienen, además, criterios adicionales de detección para discriminar en lo posible las arritmias ventriculares de las de origen supraventricular. Son multiprogramables y pueden ser programados para actuar en diferentes zonas de frecuencia de taquicardia, lo que permite tratar de forma diferente cada taquicardia ventricular (TV) que pueda tener un paciente. Esto es particularmente útil en pacientes que presentan TV con ciclos diferentes. La estimulación antitaquicardia disminuye la necesidad de cardioversión o desfibrilación en pacientes con TV. Se han comparado diferentes algoritmos de estimulación con resultados similares. En este capítulo de la monografía se analizan dichos algoritmos y su mejor programación, la necesidad de estimulación antibradicardia y la selección del modo de estimulación, y cómo evitar en lo posible las terapias inapropiadas debidas a arritmias supraventriculares.
Palabras clave
taquiarritmias ventriculares.
desfibrilador automático implantable.
estimulación antibradicardia.
estimulación antitaquicardia.
fibrilación auricular.
fibrilación ventricular.
insuficiencia cardiaca.
longitud de ciclo.
taquicardia ventricular.
La función fundamental del desfibrilador automático implantable (DAI), para la que fue concebido, es el correcto reconocimiento y la terminación de las taquiarritmias ventriculares (AV) sostenidas1. La tecnología ha avanzado de forma muy rápida desde los primeros modelos, de forma que los desfibriladores modernos presentan la posibilidad de terminar las AV mediante sobreestimulación, de una forma indolora, o mediante choques eléctricos, y presentan cada vez criterios de detección más sofisticados con el fin de aumentar al máximo la sensibilidad (detectar todas las AV) sin perder especificidad (no tratar las taquiarritmias supraventriculares). Presentan, además, la posibilidad de estimulación antibradicardia (función marcapasos) y esto en sus versiones monocameral, bicameral o tricameral; finalmente, presentan múltiples posibilidades de programación. Un repaso a la correcta realización de ésta para obtener el mejor rendimiento del dispositivo es el motivo del presente capítulo de la monografía. En la tabla 1 se recogen las funciones más importantes del DAI.
Resumen de las funciones más importantes del desfibrilador automático implantable
Detección
|
El primer criterio de detección es, lógicamente, la frecuencia ventricular a partir de la cual el DAI debe considerar una taquiarritmia. Es la llamada «frecuencia de corte». La mayoría de los modelos de las distintas casas comerciales ofrece en la actualidad la posibilidad de programar hasta 3 zonas de frecuencia, en cada una de las cuales se pueden también programar distintos tipos de terapia con más o menos agresividad según la necesidad. En la actualidad se habla de zona de fibrilación ventricular (FV, la más rápida), zona de taquicardia ventricular (TV) rápida (la intermedia) y zona de TV (la más lenta). Según la indicación del DAI podremos seleccionar una, 2 o las 3 zonas y, como hemos mencionado, programar dentro de cada una diferentes terapias o incluso ninguna (p. ej., dejar la zona más lenta como registro únicamente, es decir, como Holter).
Dentro de cada zona de detección hay 3 fases de ésta: detección inicial, confirmación y redetección. La detección inicial es el reconocimiento de un nuevo episodio de arritmia en una zona determinada según la frecuencia detectada. Además, se debe programar el tiempo de duración, o bien el número de intervalos R-R, o bien el porcentaje de estos (según las firmas comerciales) que se deben cumplir para que el dispositivo decida que ha detectado una taquiarritmia. Lógicamente, se decidirá antes (menos tiempo o menos intervalos R-R) en las zonas más rápidas. La confirmación evita la administración de una descarga si durante la carga de la energía por los condensadores la arritmia se ha terminado (arritmia no sostenida). Ello evita choques desagradables innecesarios, aunque no que la energía cargada pero no administrada se pierda. Por ello, múltiples arritmias no sostenidas pueden acortar de forma significativa la duración del dispositivo. Aunque no sea lo ideal, hay firmas comerciales que permiten programar la terapia como obligada: una vez hecha la carga se administra la energía sin confirmar que persiste la taquicardia. La redetección se produce para evaluar el efecto de una terapia una vez ésta se ha administrado, pudiendo ser que la arritmia se haya terminado, que persista sin cambios significativos o que se haya acelerado. Dado que la persistencia de la arritmia no es lo ideal, el tiempo de redetección suele programarse más corto que el de la detección inicial, aunque una redetección demasiado corta podría pasar por alto una terminación diferida (muchas taquiarritmias ceden tras unos complejos de aceleración). Si la arritmia se acelera, el DAI pasa a una terapia más agresiva, independientemente de que la nueva frecuencia pertenezca a la misma zona de frecuencia o a una zona superior. Así, si la aceleración se ha producido por una estimulación antitaquicardia (EAT), pasará a la siguiente terapia (cardioversión o desfibrilación), a pesar de que el número de terapias de estimulación no se haya agotado.
CRITERIOS ADICIONALES DE DETECCIÓNLa administración de terapias ante taquiarritmias supraventriculares es un problema serio y todavía frecuente con los DAI, que llega a suceder en un 11-41% de los pacientes, según diferentes series2-8, y es la causa más común de terapias inapropiadas. Se programan de forma opcional para aumentar la especificidad en el reconocimiento de la arritmia evitando al máximo que el DAI actúe ante taquiarritmias de origen supraventricular, no sólo por su carácter desagradable, en el caso de las descargas, sino también por el riesgo de inducir AV, tanto con éstas como con la sobreestimulación. Lógicamente, se programan en zonas de detección que tengan la suficiente lentitud para que pueda tratarse de una taquiarritmia supraventricular y siempre con la máxima seguridad de no dejar pasar sin diagnóstico una AV. No pueden programarse en la zona de FV donde se requiere una sensibilidad máxima. Aunque la programación de estas opciones mejora la especificidad, lo hace a expensas de prolongar el tiempo de detección o, incluso, de dejar sin detectar algún episodio ventricular (pérdida de sensibilidad), por lo que deberían reservarse para la detección de taquicardias ventriculares monomórficas sostenidas con buena tolerancia hemodinámica. Se usan en la zona de TV más lenta.
Criterio de estabilidad de la frecuencia cardiacaConsiste en la medición de la estabilidad de los intervalos R-R una vez alcanzado el criterio de frecuencia programado. Se usa para el diagnóstico de fibrilación auricular (FA), dado que la mayor parte de las TV tienen un ciclo bastante estable y, desde luego, casi siempre, mucho más que el de una FA. Si se activa, se programa en milisegundos, marcando un límite de variación entre el ciclo más largo y el más corto detectados. El número de ciclos que se comparan, es decir, la forma de aplicar este criterio varía, como en todos estos criterios, según las casas comerciales. Una variabilidad en el ciclo por encima del número de milisegundos programado clasifica a ese ritmo como inestable. La sensibilidad y la especificidad de este criterio en la detección de AV varían de forma inversa, y la especificidad será mayor cuanto menor sea el valor en milisegundos programado. La evaluación clínica ha demostrado que su empleo adecuado puede ser muy útil en el tratamiento de los pacientes que presentan FA además de AV. Así, se ha observado que un valor de 35ms tiene una sensibilidad del 100% y una especificidad del 35% en la detección de AV4. En este mismo estudio, cuando se analizó el grupo con frecuencia ventricular menor de 160 lat/min, un valor de 24ms se asoció con una sensibilidad del 100% y una especificidad del 81,8% (frente a un 71,2% para el grupo completo). Ello se explica por la tendencia a que, a medida que la FA es más rápida, tiende a disminuir la irregularidad entre los intervalos RR. Otro trabajo muestra que una estabilidad programada en 40ms disminuye la detección de FA paroxística o inducida un 95% y la de la FA crónica un 99%9. El mismo grupo publica el mismo año que ese criterio disminuye la sensibilidad para detectar AV un 0,4%10.
Criterio de inicio súbito (sudden onset)Mide el R-R del primer latido de taquicardia con respecto a los anteriores a éste. Su función es clasificar una taquicardia como sinusal cuando su inicio es progresivo, puesto que así suele serlo en ésta, en contraste con una AV que suele empezar de forma brusca y con acoplamiento más corto. Puede programarse en tiempo absoluto o en porcentaje de la longitud de ciclo (LC), según modelos de DAI. A pesar de que seamos cautos con su programación (valores más bajos, es decir, más sensibles para la detección de AV), la posibilidad de no detectar una AV existe. Neuzner et al encontraron este problema en un 5-13% de las TV, aunque evitaron, por otro lado, la detección de 65,4-69,7% de las taquiarritmias auriculares4. Swerdlow et al comunican un subdiagnóstico menor (0,5%), con un 52% de falsos positivos9.
Nuestra opinión, y con arreglo a ella actuamos en la práctica clínica, es que el uso de estos criterios adicionales de detección debe restringirse y antes de usarlos debemos valorar con cuidado el riesgo-beneficio de la falta de detección de una AV frente al tratamiento inapropiado de taquiarritmias supraventriculares. Nosotros dejamos siempre inactivo inicialmente el criterio de inicio súbito, ya que con éste hay un riesgo adicional de subdetección de una TV que empieza durante una taquicardia sinusal, y el de estabilidad tampoco lo activamos de entrada salvo en pacientes en FA crónica o con episodios demostrados de FA paroxística. Lo haremos con más tranquilidad si conocemos su TV y ésta es estable o si la inducimos y confirmamos que el DAI la detecta rápidamente. En los no activados de entrada es la evolución clínica la que nos hace decidir su uso. Y es que los DAI actuales proporcionan la estabilidad y el onset de las arritmias detectadas por el dispositivo, aunque estos criterios no se hayan activado, lo que nos puede ayudar en la mejoría de la programación en cada paciente según las necesidades. Así, puede recomendarse la activación del onset en pacientes en los que observamos que las terapias antitaquicardia por una taquicardia sinusal inducen AV y en los que no hay forma de controlar esta taquicardia sinusal de otro modo, por ejemplo, farmacológicamente.
Duración de frecuencia sostenida (sustained rate duration)Algunos DAI tienen la posibilidad de activar este criterio, que consiste en que si el criterio de frecuencia se mantiene durante un tiempo determinado, que es programable, los criterios de estabilidad e inicio súbito se anulan y se entregan las terapias programadas para esa zona. Así, la posibilidad de subdetección de TV disminuye. Brugada et al, en 82 pacientes consecutivos, programaron una estabilidad de < 40ms, un inicio súbito de > 9% y activaron la duración de frecuencia sostenida en 30-120s en una zona de TV, que en ningún caso era más rápida de 210 lat/min5. En 59 de los pacientes se produjo algún episodio de TV dentro de esa zona durante el tiempo de seguimiento. Se analizaron los 690 episodios y 193 fueron clasificados como supraventriculares. El inicio súbito permitió detectar 65 de los 67 episodios de taquicardia sinusal y la estabilidad, 31 de las 32 FA. Sin embargo, la sensibilidad en la detección de TV fue del 90% (451 de los 497 episodios). La aplicación del criterio de duración de frecuencia sostenida permitió el correcto tratamiento de todas ellas, es decir, aumentó la sensibilidad al 100%, aun a expensas de perder especificidad (del 96 al 83%), es decir, no tratar taquiarritmias supraventriculares. El análisis de diferentes algoritmos permite a estos autores recomendar estos valores de 40ms para la estabilidad y del 9% para el inicio súbito como los más sensibles y específicos en TV de estas características (no más rápidas de 210 lat/min) y la asociación de la duración de frecuencia sostenida permite programarlos con seguridad.
Criterio de morfologíaAlgunos dispositivos comparan el complejo QRS basal del paciente, que lo tienen memorizado, con el de una taquicardia, buscando cambios en su morfología (eje, anchura, etc.) que pueden orientar hacia un origen ventricular o supraventricular del mecanismo que sea11-13. Como en los otros criterios, el método de análisis varía según la firma comercial. En algunos trabajos se demuestra una buena sensibilidad y especificidad con este criterio y una clara mejoría en la especificidad sin empeorar la sensibilidad cuando se asocia con los 2 criterios: estabilidad e inicio súbito12. Sin embargo, y sin una razón clara, no es ampliamente utilizado. En algunas marcas, para sacarle el máximo partido requiere la actuación del médico que lo programa. Puede que la inseguridad sea un motivo para no hacerlo.
Detección bicameralLa aparición del DAI con estimulación y detección de doble cámara permite el análisis de la frecuencia auricular y ventricular durante una taquiarritmia y de la relación entre ambas. El análisis que hacen de la relación AV durante ésta difiere también entre unas casas y otras. Sin embargo, como concepto, si el ritmo es más rápido en la zona ventricular entregará la terapia, con independencia del cumplimiento de los demás criterios programados. De entrada supuso un avance importante y se esperaba una drástica reducción en las terapias inapropiadas por taquiarritmias auriculares con respecto a los modelos monocamerales. Sin embargo, esto no ha sido así y diferentes motivos, como fallos o dificultades en el propio algoritmo de discriminación o en su programación14,15, o la mala detección del canal auricular16, han hecho que estas expectativas no se hayan cumplido en muchos trabajos. Ello ha llevado a que el implante de dispositivos bicamerales con idea de mejorar la especificidad, como se creyó que ocurriría en un principio, por ejemplo en pacientes con TV muy lentas o en pacientes con taquiarritmias auriculares, no se haya extendido, dado que, además, se requiere el implante de un electrodo adicional con lo que ello conlleva, tanto en el implante como en el seguimiento. La mayoría de nosotros implantamos un DAI bicameral, y con sus propios algoritmos de discriminación, cuando el paciente requiere además estimulación auricular. Sin embargo, en un estudio multicéntrico reciente, en el que se implantan 400 dispositivos bicamerales a pacientes con indicación de DAI y se aleatorizan de forma ciega a detección monocameral o bicameral, evitando al máximo la estimulación ventricular, se demuestra una clara reducción en la detección inapropiada17. El DATAS es un estudio multicéntrico en el que se analiza de forma prospectiva si un DAI bicameral implantado en pacientes que no requieren estimulación es capaz de reducir los eventos clínicos adversos en el seguimiento con respecto al monocameral. Los pacientes son aleatorizados a DAI monocameral o a DAI bicameral con posibilidad de terapias auriculares, y los que tienen DAI bicameral se aleatorizan a su vez para recibir estimulación verdaderamente bicameral o estimulación monocameral. La estimulación monocameral es en VVI a menos de 50 lat/min y la bicameral, a 70 lat/min para prevenir arritmias auriculares, pero con un A-V largo (AV detectado de 200 y AV estimulado de 230ms) para evitar al máximo la estimulación ventricular. En los monocamerales se activan los criterio de estabilidad y en los bicamerales verdaderos, los de detección bicameral. A los 8 meses, en los bicamerales se invierte el modo de estimulación y detección18. El estudio no ha sido publicado, pero los datos preliminares obtenidos en 334 pacientes analizados de los 354 aleatorizados (1/3 de cada grupo) encuentran un 33% menos de eventos adversos (muertes, intervenciones invasivas, hospitalizaciones, descargas inapropiadas y arritmias auriculares de larga duración) en el seguimiento en el grupo bicameral verdadero. Como dato de interés, el porcentaje de terapias inapropiadas fue del 12% en los pacientes con DAI monocameral, del 6% en el monocameral simulado (el de 2 electrodos pero en VVI) y tan sólo del 3% en el bicameral19. Los resultados de este estudio, en el que participamos, nos han hecho variar nuestra práctica e indicar más bicamerales, por ejemplo, en pacientes con TV lentas no solucionables con ablación. Y en nuestra opinión, el diferente análisis que cada firma comercial utiliza en cada uno de estos criterios adicionales de detección hace que su eficacia pueda variar de unas a otras. Ello implica que debemos conocer a fondo la utilización de cada uno de ellos en los dispositivos que implantamos y, por otro lado, que no debemos extrapolar los resultados de los estudios realizados con DAI de una marca determinada a los DAI de otra.
TERAPIAS ANTITAQUICARDIAUna vez se cumplen los criterios de detección para AV, el DAI inicia las terapias que han sido programadas para esa zona de frecuencia determinada. Y estas terapias pueden ser la desfibrilación, la cardioversión y la EAT.
DesfibrilaciónEs la terapia fundamental que caracteriza a estos dispositivos y es la que los hizo nacer. De hecho, los primeros desfibriladores tan sólo tenían la posibilidad de desfibrilación1. El concepto de la desfibrilación y sus mecanismos no son motivo de este capítulo. Lo que sí es importante mencionar es que, con el perfeccionamiento de los DAI, la eficacia de ésta ha aumentado drásticamente, y que la introducción de la onda bifásica, en la que la polaridad de los electrodos se invierte durante la descarga del condensador, ha sido un factor fundamental en este sentido. Con ello se ha conseguido disminuir la cantidad de energía necesaria para desfibrilar y poder colocar a casi todos los pacientes únicamente DAI con electrodos endocárdicos20-22. En la zona de FV sólo se puede programar la terapia de desfibrilación.
Los parámetros que se programan en esta terapia son:
- 1.
Energía almacenada por el condensador: el grado de energía es programable en la primera descarga y en algunas marcas también en la segunda. Las demás descargas (habitualmente hasta 6, aunque en algunos modelos llegan hasta 8) son de máxima energía (que también varía entre 28 y 40 julios según las marcas).
- 2.
Forma de la onda: puede programarse monofásica o bifásica (en general se programa ésta por su habitual mayor eficacia).
- 3.
Polaridad de la descarga: podemos variar cuál de los electrodos es el ánodo y cuál el cátodo, dado que la eficacia puede variar. Nosotros introducimos dentro de la secuencia de descargas alguna de la polaridad invertida porque si descargas previas han fallado puede ocurrir que este cambio aporte más eficacia
- 4.
Descarga obligada o no obligada. No todas las firmas comerciales presentan este criterio, ya mencionado previamente en este capítulo. Incluso algunos dispositivos tienen la posibilidad de programar descargas semiobligadas. En este caso, sólo la primera descarga es no obligada y el resto son obligadas. Es un mecanismo de seguridad para la posibilidad de que, por la prolongación de la FV (con isquemia miocárdica secundaria) o por el efecto del propio choque, la señal que detecte el dispositivo empeore y deje de detectar dicha arritmia2,3.
Es la posibilidad de administrar descargas sincronizadas con la activación ventricular para terminar una TV23,24. Las TV pueden ser terminadas muchas veces con choques de baja energía (incluso menos de 2 julios), que con respecto a las de alta energía consumen menos batería y son, teóricamente, menos dolorosas. También es menor el tiempo de carga de los condensadores, por lo que pueden administrarse en menos tiempo. Su efectividad en la conversión de TV inducidas es similar a la EAT (el 75 frente al 63% de eficacia, respectivamente) y puede haber pacientes o TV que responden mejor a una u otra terapia25. Además del dolor que produce una descarga, el principal problema de esta terapia es la posibilidad de aceleración de la taquicardia a otra más rápida o incluso su degeneración en FV, que varía entre un 6 y un 31% de los episodios, según las series26-29. Bardy et al25, en un estudio prospectivo cruzado, encontraron un porcentaje similar de aceleración para la EAT (21%) y la cardioversión (17%). Además, en cuanto a la eficacia para terminar la TV, la respuesta a una de estas terapias en cuanto a posible aceleración no predice la respuesta a la otra. El riesgo de esta complicación se correlaciona con la frecuencia de la TV, el grado de disfunción ventricular izquierda o los umbrales de desfibrilación, y es más frecuente en TV más rápidas30, funciones más deprimidas y peores umbrales31. Otro problema es la posible inducción de taquiarritmias auriculares por choques de baja energía. Su incidencia en la clínica se ha descrito en hasta el 6% de los episodios y el 29% de los pacientes32,33. Por seguridad, si la cardioversión no es eficaz o la TV se acelera, el dispositivo debe suministrar una descarga de alta energía.
Estimulación antitaquicardiaEsta función de los DAI permite terminar las AV mediante su sobreestimulación, es decir, estimulando más rápido que la propia taquicardia con el fin de bloquear el circuito de reentrada que la produce. La reentrada es el mecanismo habitual de las TV en pacientes con cardiopatía estructural. Las ventajas sobre la cardioversión son su carácter indoloro y que inducen muchas menos arritmias auriculares34. Pero al igual que la cardioversión, como hemos visto, pueden acelerar la TV o incluso inducir una FV35. Entre los diferentes métodos disponibles para sobreestimular una taquicardia, los más utilizados, y que son los que ofrecen los DAI, son los trenes (o ráfagas) y las rampas de estimulación. Los trenes son regulares, es decir, que tienen un ciclo constante. En las rampas, el ciclo se va acelerando impulso a impulso36,37. Pueden programarse en milisegundos, tanto el acoplamiento con la TV como la frecuencia de estimulación, pero lo más habitual es programarlos en un porcentaje del ciclo de la arritmia y así se adaptan para cualquier TV que tenga el paciente, con independencia de su frecuencia. En algunos modelos podemos cambiar la energía de salida con respecto a la de la estimulación antibradicardia para asegurar la captura a frecuencias a veces muy rápidas.
En varios estudios se ha comparado la eficacia y la seguridad de ambas modalidades de estimulación (trenes y rampas), tanto en TV espontáneas como inducidas38-44, sin que se hayan observado diferencias estadísticamente significativas entre ellas. La eficacia oscila entre el 50 y el 84% en TV bien toleradas inducidas en el laboratorio de electrofisiología. Un dato relevante que se repite en estos trabajos es la relación entre eficacia y la longitu de ciclo (LC) de la TV tratada: la eficacia es mayor en TV más lentas y decrece a partir de TV de más de 200 lat/min (LC por debajo de 300ms). En cuanto a la seguridad de estas terapias, la incidencia de aceleración fue relativamente baja, con un rango entre 0 y 21% según las series mencionadas, y de nuevo sin diferencias estadísticamente significativas entre trenes y rampas38-40,42,43.
En cuanto a las TV espontáneas, la eficacia de estas terapias es mayor, en torno al 90%, menor de nuevo en TV a más de 200 lat/min, y con un índice de aceleración también bajo (entre el 2 y el 18%). En estas TV más rápidas, los trenes parecen tener una eficacia mayor que las rampas y una menor incidencia de aceleración39,45. Hay modelos de DAI que memorizan si una terapia ha sido eficaz y podemos programar que, en caso de que la primera (p. ej., un tren) no haya sido eficaz en 4 episodios, el dispositivo la anula y utiliza en el siguiente la segunda terapia (p. ej., una rampa).
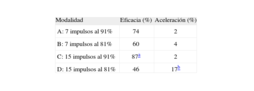
Otro aspecto es el número de impulsos y la frecuencia de estimulación. En un estudio retrospectivo, Nasir et al46 observaron que la eficacia de los trenes era mayor cuando el número de impulsos se situaba entre 6 y 15 (intervalo de eficacia del 94-96%; incidencia de aceleración del 1%) que cuando era de 16 o más (eficacia del 77 y el 6% de aceleraciones). En un trabajo en el que participamos se analizaron de forma aleatorizada 4 modalidades diferentes de EAT compuesta por trenes (7 o 15 impulsos acoplados al 81 o 91% de la LC da la TV). Tras analizar 602 TV ocurridas en 30 pacientes portadores de DAI encontramos una mayor eficacia en los trenes de 15 impulsos (78%) que en los compuestos por 7 (68%; p = 0,01), con una incidencia de aceleraciones que tendía a ser mayor en los trenes de 15 impulsos (el 5 frente al 3%; p = 0,24)47. Hay que tener en cuenta que hablamos de la eficacia de un solo tren de estimulación, por lo que estos resultados no son comparables con los de otros estudios en los que se analiza la eficacia de un mayor número de secuencias de estimulación. En cuanto al ciclo de estimulación, observamos que con ciclos del 91% con respecto al ciclo de la TV la eficacia era mayor que con ciclos del 81% (el 80 frente al 56%; p < 0.001), y que la incidencia de aceleración era menor (el 2 frente al 8%; p = 0,004). En este estudio se volvió a encontrar que el ciclo de las TV tratadas eficazmente era mayor (379 ± 50 frente a 347 ±36ms; p < 0,001)47. Además, la eficacia de la EAT fue significativamente mayor en TV con un ciclo superior a 330ms (el 84 frente a 67%; p = 0,003). En la tabla 2 se detalla la eficacia de las diferentes modalidades de EAT estudiadas, denominadas A, B, C y D, observándose que la modalidad C (15 impulsos al 91%) presentó la mayor eficacia (87%; p < 0,001 con respecto a las otras 3). Nosotros, a raíz de este estudio, utilizamos 15 impulsos con un acoplamiento del 91% como terapia inicial de EAT.
Por otro lado, la programación empírica de EAT parece ser igual de eficaz y segura que si se prueba ésta en TV inducidas en un estudio electrofisiológico. Schaumann et al así lo demostraron, en este caso programando 3 rampas de 8 a 10 impulsos acoplados un 81% a la LC de la TV y con un decremento intrasecuencia de 8ms. La eficacia fue del 95% en las TV inducidas frente al 89,5% en las TV espontáneas (p = NS), con un porcentaje de aceleración del 2,4 y el 5,1%, respectivamente (p = NS)45.
En resumen, la EAT en pacientes portadores de un DAI permite terminar un 85-90% de los episodios de TV con una LC superior a 320ms, con una incidencia de aceleración baja (1-5%). Además, estos resultados son aplicables a diferentes tipos de cardiopatía (isquémica o no) y confirman la reentrada como el mecanismo más probable de estas arritmias.
Entre el 10 y el 25% de los pacientes portadores de un DAI presentan episodios de TV con una LC inferior a 320 ms45,47,48. Aunque, como hemos mencionado, la eficacia de la EAT es menor en TV rápidas, hay datos que apoyan el uso de EAT en esta zona y que no se programen choques de entrada. Así, Wathen et al49 analizaron la eficacia de la EAT compuesta por 2 trenes consecutivos de 8 impulsos al 88% de la LC de la taquicardia en el tratamiento de TV con LC entre 240 y 320ms. De 442 episodios de arritmia ocurridos en 52 pacientes con cardiopatía isquémica de 220 estudiados, el 85% se terminó con esta terapia y, de ellos, el 90% con el primer tren administrado. Y además, una tercera ráfaga programada en algunos pacientes a criterio del médico responsable del paciente (no necesario en el estudio) terminó 18 TV más, consiguiéndose una eficacia global del 89%. Y este protocolo de estimulación se acompañó de un porcentaje de aceleración de tan sólo el 4%. Tras los resultados de este trascendente estudio, también Wathen et al50 realizan otro, llamado Pain-FREE Rx II, en el que compararon la EAT (un tren de 8 impulsos al 88% de la LC de la taquicardia) con las descargas de alta energía en una zona de 188 a 250 lat/min. Incluyeron a 634 pacientes, el 85% con cardiopatía isquémica, de los que 313 se aleatorizaron a EAT y 321 a choques. Tras un seguimiento medio de 11 ± 3 meses se registraron 4.230 episodios y, de ellos, se pudo analizar 1837. De los episodios analizados, el 73% (431 episodios en 98 pacientes) correspondieron a TV monomórficas rápidas. La eficacia de la EAT en la terminación de las TV de más de 188 lat/min fue del 81% (> 90% para TV más lentas), con una incidencia de aceleración de nuevo de tan sólo el 2%. En el caso de los episodios ocurridos en el grupo de choques, el 34% finalizó de forma espontánea y el 66% requirió la descarga. En consecuencia, la EAT redujo la necesidad de choques en un 70%. La duración media de los episodios fue menor en el grupo de EAT (10,7 ±0,7 frente a 12,7 ±0,8ms; p < 0,001). No hubo diferencias entre ambos grupos en la incidencia de síncopes debidos a los episodios. Otro hallazgo interesante de este estudio con respecto al inicial es que el hecho de esperar a que se cumplan 18 latidos de taquicardia (en el otro estudio eran 12) antes de tratarla redujo de forma significativa el número de episodios que requirieron tratamiento. Dado que sólo hubo síncope en un 1% de los episodios, quizás debería evaluarse un tiempo de espera incluso más prolongado.
Jiménez Candil et al, en este mismo sentido, han publicado que trenes de 5 y 8 latidos al 84% de la LC de la TV terminan el 88,9% de éstos, reduciendo del 9 al 1,5% el porcentaje de pacientes que reciben descarga y también el número de presíncopes y síncopes en pacientes con TV ≤ 320ms.
Por tanto, la EAT es bastante segura y eficaz en la terminación de TV rápidas. Algunos modelos de DAI ofrecen en la actualidad la posibilidad de administrarla durante la carga de condensadores para el choque. Esto es muy útil porque, si termina la TV, el choque no se produce y, además, no lo retrasa si al final sí que hace falta administrarla.
Un tema menos estudiado es el número de intentos (trenes o rampas) que cabe programar en cada terapia. De los resultados de algunos trabajos podemos extraer que la mayoría de las TV se terminan con el primero, pero que tampoco es desdeñable el número de TV que cesen al segundo o incluso tercer intento, y esto tanto en TV menos rápidas52 como en TV más rápidas49. La ventaja de programar más intentos es sacar el máximo partido a la EAT y evitar con ello el mayor número posible de cardioversiones. La contrapartida es prolongar en ocasiones la duración de la arritmia, lo cual puede ser peligroso en virtud de la tolerancia de ésta. Por ello, debemos individualizar y en cada paciente programar en la zona de TV un número de terapias de EAT según el ciclo y la tolerancia de la arritmia si conocemos ésta.
ESTIMULACIÓN ANTIBRADICARDIALos DAI actuales llevan incorporada la función marcapasos, ya que por un lado se ha demostrado que un 15-20% de los pacientes en los que se indica un DAI necesitan estimulación antibradicardia (EAB) y, por otro lado, pueden producirse bradiarritmias tras los choques que requieran estimulación, aunque sea de forma transitoria. Ello evita la necesidad de implantar dos dispositivos independientes que, por otro lado, pueden interferirse mutuamente en su funcionamiento en la FV53-55. La más grave sería que el paciente entre en FV, el marcapasos no detecte ésta y comience a estimular. El DAI sensaría las espículas del marcapasos y, a su vez, no detectaría la FV. La necesidad de estimulación queda demostrada por el hecho de que, si bien en los estudios iniciales la mortalidad súbita en pacientes portadores de DAI se debía a una bradiarritmia en un 18% de los casos, estudios más actuales atribuyen a esta causa sólo un 1%, seguramente debido a la incorporación de EAB56. La primera incorporación de EAB era sólo VVI, si bien desde el principio había la posibilidad de diferenciar la estimulación habitual de una poschoque, de duración programable, con mayor energía de salida con el fin de evitar pérdidas de captura por elevación transitoria de los umbrales de estimulación tras una o más descargas57,58. En la actualidad disponemos, como hemos visto, de la posibilidad de estimulación y detección bicameral, y también de la de estimulación biventricular para resincronización ventricular. También se puede programar actividad (VVIR o DDDR), si es necesaria.
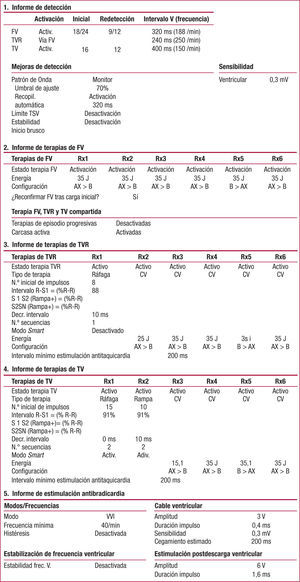
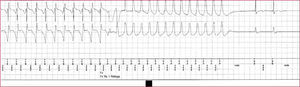
En estudios recientes se ha demostrado el impacto negativo de la estimulación ventricular. El estudio DAVID quería demostrar que un tratamiento farmacológico óptimo de la disfunción de VI asociada con estimulación bicameral en DDDR con una frecuencia mínima de 70 lat/min reduciría la mortalidad y la hospitalización por insuficiencia cardiaca (IC) con respecto a un tratamiento farmacológico similar pero con estimulación VVI a 40 lat/min59. Eran pacientes en ritmo sinusal con indicación de DAI pero no de marcapasos y con una fracción de eyección de VI menor del 40%. En total, 506 pacientes fueron aleatorizados al grupo VVI y 256 al DDDR. Este segundo grupo presentó una mayor incidencia de muerte u hospitalización por IC, lo que confirma los resultados previos existentes en la literatura científica. Así, se había observado que la estimulación AAI se asocia con una mayor supervivencia y un menor índice de IC grave que la estimulación VVI en pacientes con enfermedad del nódulo sinusal60, y que la estimulación ventricular durante más del 40% del tiempo se asocia con un mayor número de hospitalizaciones por IC61. Sin embargo, el beneficio de la estimulación DDDR sí es evidente en pacientes que necesitan estimulación de forma permanente62. Según estos datos, parece claro que la EAB en pacientes que reciben un DAI bicameral debe ser optimizada de una forma individual. La estimulación ventricular derecha puede ser deletérea en pacientes con disfunción ventricular izquierda en los que no está indicada la estimulación, por lo que debemos programar el dispositivo en ellos evitando al máximo dicha estimulación. En la actualidad hay dispositivos bicamerales con algoritmos que intentan, en este sentido, conservar el ritmo ventricular intrínseco del paciente. El análisis de la estimulación biventricular que ha demostrado evitar el empeoramiento, o incluso mejorar esa función sistólica deteriorada, no es motivo de este capítulo. En la figura 1 se recoge un ejemplo de programación de un DAI monocameral con los criterios de detección de taquicardias, 3 zonas de tratamiento antitaquicardia con sus diferentes terapias y la estimulación antibradicardia. En la figura 2 observamos que este dispositivo termina una TV con un tren de estimulación programado.
Programación de un desfibrilador automático implantable (DAI) monocameral (en este caso de la Compañía Medtronic) en un paciente con cardiopatía isquémica (necrosis inferior y disfunción sistólica de ventrículo izquierdo) y TV monomórficas sostenidas en el que la ablación con radiofrecuencia no fue eficaz. De arriba abajo vemos:
- 1.
La detección, con 3 zonas (TV a partir de 150 lat/min, TV rápida a partir de 188 lat/min y FV a partir de 250 lat/min). El patrón de morfología está en monitorización y tampoco están activados el inicio súbito y la estabilidad.
- 2.
Las terapias de FV, con todos los choques de máxima energía, en este caso 35 julios. La configuración del choque número 5 está invertida.
- 3.
Las terapias de TVR, con una ráfaga de 8 latidos acoplada en un 88% al ciclo de la TVa, seguida de un choque de 25 julios y el resto de máxima energía.
- 4.
Las terapias de TV, con 2 ráfagas de 15 impulsos acopladas en un 91% al ciclo de la TVb, 2 rampas de 10 impulsos al 91%, un choque de 15 julios y el resto de máxima energía. El modo smartestá activado, lo que hace que si una terapia falla en 4 episodios la desecha y en el siguiente episodio empieza con la siguiente terapia programada (v. texto).
- 5.
La estimulación antibradicardia, en VVI a 40 lat/min para evitar al máximo la estimulación11. La estimulación posdescarga ventricular presenta unos parámetros de energía de estimulación mucho más altos.
FV: fibrilación ventricular; TV: taquicardia ventricular; TVR: taquicardia ventricular rápida.
La tendencia general ha sido considerar a los pacientes de prevención primaria como un grupo diferente al de prevención secundaria, asumiendo que los primeros presentarían únicamente episodios de FV y TV rápida y que con una única zona de FV o a lo sumo 2 zonas (FV y TV rápida) sería suficiente. Sin embargo, un análisis posterior de los episodios registrados en el estudio PainFREE Rx II mostró que el 52% de los episodios registrados en los pacientes con DAI por prevención primaria eran TV con un ciclo superior a 320ms, por lo que seguramente deberíamos, al igual que en prevención secundaria, programar una tercera zona de TV63. Otra cosa diferente son los pacientes con miocardiopatía hipertrófica o con canalopatías (síndrome de Brugada, síndromes de QT largo y QT corto congénito y TV polimórfica catecolaminérgica) que presentan fundamentalmente episodios de TV polimórfica muy rápida o FV y que, por su joven edad, tienen una actividad física importante, con una alta posibilidad de presentar ritmos supraventriculares rápidos64,65. Nuestra política en estos casos es ser agresivos en la programación y marcar sólo una o a lo sumo 2 zonas rápidas, dado que la experiencia indica frecuentes terapias inapropiadas en estos pacientes.
CONCLUSIONESEl DAI posee en la actualidad una serie de funciones cuya intención final es el reconocimiento y la terminación de las taquiarritmias ventriculares (AV) sostenidas. A la hora de indicar un DAI no sólo es importante la correcta selección del tipo de éste y sobre todo del número de electrodos implantados, sino también la correcta programación del dispositivo. De la correcta selección del tipo de DAI y del buen uso de los diferentes criterios diagnósticos se derivará la eficacia diagnóstica y, sobre todo, la discriminación entre una taquiarritmia ventricular y por tanto tratable por el DAI y otra no ventricular y por tanto, que no requiere tratamiento. De la correcta programación de los diferentes métodos terapéuticos (estimulación antitaquicardia y choques) en las distintas zonas de frecuencia de la taquicardia y en las diferentes cardiopatías de base se derivará la eficacia terapéutica y su tolerancia por el paciente (los choques duelen). Y en la actualidad sabemos, además, que la correcta programación de la estimulación antibradicardia no sólo puede ayudar en la prevención de bradiarritmias asociadas que a veces presentan estos pacientes, sino que puede evitar el deterioro de la función ventricular debida a un exceso de estimulación única en ápex del ventrículo derecho o puede, por otro lado, ayudar a la mejoría de ésta en el caso de la resincronización ventricular.


 DAI) monocameral (en este caso de la Compañía Medtronic) en un paciente con cardiopatía isquémica (necrosis inferior y disfunción sistólica de ventrículo izquierdo) y TV monomórficas sostenidas en el que la ablación con radiofrecuencia no fue eficaz. De arriba abajo vemos:1.La detección, con 3 zonas (TV a partir de 150 lat/min, TV rápida a partir de 188 lat/min y FV a partir de 250 lat/min). El patrón de morfología está en monitorización y tampoco están activados el inicio súbito y la estabilidad.2.Las terapias de FV, con todos los choques de máxima energía, en este caso 35 julios. La configuración del choque número 5 está invertida.3.Las terapias de TVR, con una ráfaga de 8 latidos acoplada en un 88% al ciclo de la TVa, seguida de un choque de 25 julios y el resto de máxima energía.4.Las terapias de TV, con 2 ráfagas de 15 impulsos acopladas en un 91% al ciclo de la TVb, 2 rampas de 10 impulsos al 91%, un choque de 15 julios y el resto de máxima energía. El modo smartestá activado, lo que hace que si una terapia falla en 4 episodios la desecha y en el siguiente episodio empieza con la siguiente terapia programada (v. texto).5.La estimulación antibradicardia, en VVI a 40 lat/min para evitar al máximo la estimulación11. La estimulación posdescarga ventricular presenta unos parámetros de energía de estimulación mucho más altos. FV: fibrilación ventricular; TV: taquicardia ventricular; TVR: taquicardia ventricular rápida.' title='Programación de un desfibrilador automático implantable (
DAI) monocameral (en este caso de la Compañía Medtronic) en un paciente con cardiopatía isquémica (necrosis inferior y disfunción sistólica de ventrículo izquierdo) y TV monomórficas sostenidas en el que la ablación con radiofrecuencia no fue eficaz. De arriba abajo vemos:1.La detección, con 3 zonas (TV a partir de 150 lat/min, TV rápida a partir de 188 lat/min y FV a partir de 250 lat/min). El patrón de morfología está en monitorización y tampoco están activados el inicio súbito y la estabilidad.2.Las terapias de FV, con todos los choques de máxima energía, en este caso 35 julios. La configuración del choque número 5 está invertida.3.Las terapias de TVR, con una ráfaga de 8 latidos acoplada en un 88% al ciclo de la TVa, seguida de un choque de 25 julios y el resto de máxima energía.4.Las terapias de TV, con 2 ráfagas de 15 impulsos acopladas en un 91% al ciclo de la TVb, 2 rampas de 10 impulsos al 91%, un choque de 15 julios y el resto de máxima energía. El modo smartestá activado, lo que hace que si una terapia falla en 4 episodios la desecha y en el siguiente episodio empieza con la siguiente terapia programada (v. texto).5.La estimulación antibradicardia, en VVI a 40 lat/min para evitar al máximo la estimulación11. La estimulación posdescarga ventricular presenta unos parámetros de energía de estimulación mucho más altos. FV: fibrilación ventricular; TV: taquicardia ventricular; TVR: taquicardia ventricular rápida.' title='Programación de un desfibrilador automático implantable (