Aunque los avances en el tratamiento del infarto agudo de miocardio han provocado una reducción en el riesgo de muerte súbita a largo plazo, éste sigue siendo elevado en ciertos subgrupos de pacientes. Son importantes la identificación y tratamiento de estos pacientes. La fracción de eyección ventricular izquierda menor de 0,40, extrasistolia ventricular frecuente en la monitorización Holter, potenciales tardíos en el electrocardiograma con señal promediada, variabilidad reducida de la frecuencia cardíaca, sensibilidad barorrefleja anormal y taquicardia ventricular monomórfica sostenida inducible durante estudio electrofisiológico son predictores de muerte súbita. Aunque el valor predictivo negativo de cada factor es alto, el valor predictivo positivo es bajo. Varias pruebas pueden combinarse para mejorar el valor predictivo positivo. En algunos estudios se ha usado la combinación de pruebas no invasivas para seleccionar pacientes para estimulación ventricular.Algunos tratamientos preventivos pueden emplearse en estos pacientes. Los datos disponibles no justifican el uso profiláctico de amiodarona en supervivientes de alto riesgo tras infarto. El tratamiento betabloqueante a largo plazo ha reducido significativamente la mortalidad súbita y total. Por tanto, los betabloqueantes deben administrarse en todos los pacientes con infarto agudo de miocardio que no presenten contraindicaciones para su uso. El estudio MADIT ha demostrado efecto beneficioso del desfibrilador automático implantable en la reducción de mortalidad en pacientes con infarto de miocardio previo, fracción de eyección menor de 0,36, taquicardia ventricular no sostenida asintomática y taquicardia ventricular sostenida inducible, no suprimible con procainamida. Varios estudios están evaluando el desfibrilador implantable profiláctico para mejorar la supervivencia en pacientes de alto riesgo.
Palabras clave
Infarto de miocardio
Muerte súbita
Amiodarona
Betabloqueantes
Desfibrilador automático implantable
INTRODUCCIÓN
Los pacientes que han sufrido un infarto agudo de miocardio (IAM) tienen riesgo a largo plazo de morir súbitamente 1, sobre todo por taquiarritmias ventriculares. Aunque en ocasiones la isquemia aislada puede provocar arritmias ventriculares, en general se requiere un sustrato anatómico debido al IAM previo, constituido por células miocárdicas lesionadas con propiedades electrofisiológicas anormales, rodeadas por áreas de cicatriz y que generan zonas de conducción lenta. Sobre dicho sustrato actúan factores desencadenantes y moduladores, que favorecen la aparición de arritmias 2.
Los avances en la terapia del IAM con la introducción de la trombólisis, la angioplastia primaria y el tratamiento con IECA y betabloqueantes han provocado una reducción en la incidencia de muerte súbita (MS) y taquicardias ventriculares (TV) en la evolución posterior. Sin embargo, la MS sigue constituyendo un grave problema. Un 2-4% de pacientes tras IAM presentan MS o son reanimados tras fibrilación ventricular (FV) durante el año siguiente 3,4, siendo más frecuentes estas complicaciones en determinados subgrupos de pacientes. La estratificación de riesgo puede ayudar a identificar estos pacientes.
El objetivo de este artículo es revisar los métodos diagnósticos en la estratificación del riesgo de MS y arritmias ventriculares y los tratamientos más efectivos.
MÉTODOS DIAGNÓSTICOS
Antes de plantearse la estratificación del riesgo arrítmico, debe descartarse tras el IAM la presencia de angina postinfarto, insuficiencia cardíaca u otra complicación. Asimismo, debe completarse la valoración del paciente con ecocardiograma y técnicas de detección de isquemia como ergometría, ecocardiograma de esfuerzo o con dobutamina o estudios de perfusión con isótopos, seguidas de coronariografía si fuera preciso.
En cuanto al riesgo arrítmico tras IAM, quedan muchas dudas pendientes de resolver. Las pruebas diagnósticas (recogidas en la tabla 1)
tienen un alto valor predictivo negativo (VPN), siendo útiles para seleccionar pacientes de bajo riesgo arrítmico. Sin embargo, su valor predictivo positivo (VPP) es bajo, aunque la combinación de varios métodos diagnósticos mejora de forma significativa dicho VPP. Se ha propuesto el empleo de pruebas no invasivas en la selección de pacientes para estudio electrofisiológico (EEF). Cuando se valora iniciar un tratamiento con bajo riesgo de efectos adversos graves (por ejemplo, fármacos betabloqueantes), es importante una prueba con alta sensibilidad (S) que detecte, por tanto, el máximo número de pacientes de riesgo, aunque algunos pacientes tratados puedan obtener un menor beneficio. Por el contrario, si el tratamiento que se plantea resulta caro y no exento de complicaciones serias (por ejemplo, desfibrilador automático), la valoración diagnóstica debe ofrecer un alto VPP dentro de un rango aceptable de S. Se describen, a continuación, las distintas pruebas diagnósticas para la valoración del riesgo arrítmico post-IAM, su significado pronóstico y su aplicación clínica.
DETERMINACIÓN DE LA FUNCIÓN VENTRICULAR
La fracción de eyección ventricular izquierda (FEVI), determinada por ecocardiograma o ventriculografía con contraste o radioisótopos, es un importante predictor de mortalidad cardíaca (en un alto porcentaje, súbita) a largo plazo tras un IAM. Varios estudios publicados en la década de los 80 5-7 demostraron que el riesgo relativo (RR) de muerte, tras un seguimiento de 18-24 meses, era 2,5-3,5 en pacientes con FEVI < 0,40 comparados con pacientes con FEVI mayor. Además, se observó 8 que la relación entre FEVI y mortalidad cardíaca sigue una curva hiperbólica, con aumento brusco de la mortalidad a partir de 0,40. En estudios posteriores 9,10, ya en la era trombolítica, la FEVI mantenía su valor pronóstico, aunque con menores tasas de mortalidad. Así, Gosselink et al 10, analizando a pacientes con IAM tratados con trombólisis o angioplastia primaria, encontraron una mortalidad a los 30 ± 10 meses del 16% si la FEVI era < 0,40 frente al 2% si la FEVI era 0,40.
Cuando la FEVI deprimida se acompaña de signos clínicos y radiológicos de fallo cardíaco congestivo, el pronóstico es significativamente peor. En el estudio de Nicod et al 11, los pacientes con FEVI 0,40 y clínica de insuficiencia cardíaca durante el ingreso presentaron una mortalidad al año del 26%, frente al 12% en casos con la misma FEVI pero sin dicha clínica (p < 0,01). Estas diferencias también se cumplían si la FEVI era 0,41-0,50 o superior a 0,50 (19% frente al 6%; p < 0,01 y 8% frente al 3%; p < 0,02, respectivamente).
La FEVI también es predictor de eventos arrítmicos tras el IAM. De hecho, los pacientes con FEVI severamente deprimida mueren súbitamente en un tercio de los casos 12 y la incidencia de taquiarritmias ventriculares es mayor en dichos pacientes 11. Richards et al 13 observaron un RR de eventos arrítmicos tras IAM de 3,2 (p = 0,05) en pacientes con FEVI 0,40 respecto a casos con FEVI mayor. Por su parte, Pedretti et al 14 encontraron una FEVI < 0,40 en el 79% de pacientes con eventos arrítmicos, frente al 15% en ausencia de dicha complicación (p < 0,0001). Varios autores 13,15,16 han estudiado la S, especificidad (E), VPP y VPN de la FEVI para la detección de eventos arrítmicos, obteniendo cifras de 56-71%, 74-83%, 11-22% y 96-98%, respectivamente. Por tanto, dado el bajo VPP, la FEVI aislada es insuficiente para detectar a pacientes de alto riesgo arrítmico post-IAM, por lo que es necesario combinarla con otras pruebas diagnósticas.
MONITORIZACIÓN HOLTER
En las dos últimas décadas se ha empleado la monitorización Holter para tratar de identificar a pacientes con alto riesgo de MS tras IAM. Con esta técnica se analizan la frecuencia y complejidad de arritmias ventriculares: extrasístoles ventriculares (EV) y taquicardia ventricular no sostenida (TVNS).
Prevalencia de EV y TVNS tras IAM
Maggioni et al 17 observaron en 8.676 pacientes tratados con fibrinólisis 0 EV/h en 36%, 1-10 en el 44% y > 10/h en el 20% de los pacientes. Los episodios de TVNS, en general, son infrecuentes (9% de pacientes las presentaron en un estudio reciente 18). Existen varios factores que influyen en la prevalencia de arritmias ventriculares tras IAM:
1.Tiempo transcurrido tras el IAM: se produce un descenso progresivo en la frecuencia y complejidad de las arritmias en la primera semana después del episodio agudo. Posteriormente, aumenta su prevalencia en las 6 semanas siguientes, con un nuevo descenso a partir de ese momento.
2.Edad del paciente: EV y TVNS son más frecuentes en los pacientes de mayor edad: 0,4 EV/h en menores de 50 años y 4 EV/hora en pacientes entre 75 y 80 años; TV en el 7,3% de pacientes menores de 50 años y en el 15,3% si la edad oscila entre 75 y 80 años 19.
3.Características del IAM: se ha observado una relación entre la prevalencia y complejidad de las arritmias ventriculares y la FEVI 17,20,21. Además, dichas arritmias son más frecuentes en presencia de insuficiencia cardíaca 22, reinfarto de miocardio 22,23 o depresión del segmento ST 21.
4.Tratamiento trombolítico: Theroux et al 24 comprobaron una reducción de las EV/h en pacientes tratados con estreptocinasa o estreptocinasa y angioplastia percutánea comparados con un grupo control no reperfundido, independientemente de la FEVI. Sin embargo, esto no se evidenció en otros estudios 20,21, que relacionan la frecuencia de arritmias ventriculares con la FEVI y no con la permeabilidad de la arteria responsable.
Importancia pronóstica de EV y TVNS
En la era prefibrinolítica, varios estudios 6,8,25-27 demostraron que la EV frecuente y la TVNS se asocian a un incremento de 2 a 3 veces en el riesgo de MS y total tras un IAM. Tras la introducción del tratamiento trombolítico, varios estudios demostraron que la EV frecuente conserva su importancia pronóstica. Así, en el estudio de Maggioni et al 17 los pacientes con > 10 EV/h presentaron, tras 6 meses de seguimiento, una mortalidad cardíaca y súbita del 5,5 y del 2,1%, frente al 2,4 y el 0,7% en el resto de pacientes. En algunos estudios 15,28,29, sin embargo, la EV no tenía valor pronóstico.
En la tabla 2 se recogen algunos de los estudios más importantes en la década de los 90 14,17,28,30-33.
El concepto de arritmia ventricular de alto riesgo varía en los distintos trabajos publicados. Respecto al número de EV/h, la mayoría de autores considera de alto riesgo 10 EV. Otros como Bigger et al 8 y Petretta et al 34 consideran el punto de corte en 3 EV/h, mientras Andresen et al 33 definen EV de alto riesgo a partir de 20/h. Respecto a la morfología de las EV, se han analizado EV multiformes y repetitivas, bigeminismo y fenómenos de R sobre T 22,25,26.
El significado de la TVNS ha cambiado desde la introducción de la fibrinólisis. Como se indicó previamente, en los estudios de la era pretrombolítica, la TVNS era un factor de riesgo independiente de MS y total, incluso más importante que la EV frecuente. En trabajos más recientes se observan resultados contradictorios. En algunos estudios 14,32, la TVNS mantiene su utilidad pronóstica, pero en otros 17,18,20,28,34,35 no fue predictor independiente de mortalidad. Esto pudiera deberse a una modificación del sustrato arrítmico por el tratamiento trombolítico o a una menor frecuencia de TVNS, lo que provoca su menor utilidad como marcador pronóstico.
Dado que la disfunción ventricular izquierda es un importante predictor de mortalidad cardíaca tras IAM y se relaciona con la frecuencia y complejidad de las arritmias ventriculares 17, surge la duda de si las arritmias ventriculares predicen mortalidad independientemente de la disfunción ventricular. La mayoría de estudios 6,8,17,22,25,26 indican que la EV frecuente y la disfunción ventricular son predictores independientes de mortalidad cardíaca súbita y total. La EV frecuente sería, por tanto, marcador de inestabilidad eléctrica y de miocardio capaz de mantener un circuito de reentrada 28.
En la tabla 3 se indica la mortalidad cardíaca total observada por Maggioni et al 17 dependiendo de la presencia o no de disfunción ventricular izquierda y del número de EV/h.
Aplicaciones clínicas
La EV frecuente es, por tanto, predictor de eventos arrítmicos y mortalidad cardíaca en varios estudios, no en todos. El significado de la TVNS en la era trombolítica, sin considerar otros factores, es más dudoso. En general, se recomienda que el estudio Holter se realice previo al alta o entre 1 y 2 semanas después del IAM. Habitualmente se emplean registros de 24 h, aunque algunos autores 36 han defendido registros de 1 h frente a los de 6 y 24 h porque en estos últimos la mejoría de la S es modesta y la E disminuía.
En el análisis deben considerarse la frecuencia de EV y la complejidad de las mismas. Respecto a la frecuencia, cuanto mayor sea el número de EV/h que se defina como punto de corte, mayor será el número de pacientes de alto riesgo que entren en el grupo con menor frecuencia de EV. Esto conduce a una menor S a pesar del mayor VPP. Aunque la mayoría de estudios definen EV frecuente desde 10 EV/h, Statters et al 31, estudiando pacientes tratados o no con fibrinólisis, concluyeron que los puntos de corte más adecuados de frecuencia de EV para conseguir las mejores S y VPP en la predicción de eventos arrítmicos y mortalidad cardíaca eran 25/h en el grupo tratado con fibrinolíticos (S del 50%, VPP del 20-23%) y 10/h en el grupo no tratado (S del 60%, VPP del 12%). Observaron también que el VPP es mayor en los pacientes tratados con trombolíticos que en los no tratados en la mayoría de niveles de S. En cuanto a la complejidad de las arritmias ventriculares, Kostis et al 22 comprobaron un aumento de S, aunque con un descenso de E si se combinaba la frecuencia de EV con algún criterio de complejidad. Así, la S y E de un número de EV 10/h para la predicción de MS eran 25 y 87,7%, respectivamente, mientras que la S y E de un Holter con 10 o más EV/h o con dobletes o TV eran 43,4 y 75,4%. En el estudio de Farrell et al 30, la EV repetitiva tenía para la predicción de MS una S del 54%, una E del 81% y un VPP del 15%, cifras similares a las correspondientes a la EV frecuente.
Por tanto, la S y el el VPP de la monitorización Holter en la predicción de eventos arrítmicos son demasiado bajos. Como en el caso de la FEVI, es necesario combinar los resultados del Holter con otras pruebas diagnósticas.
ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
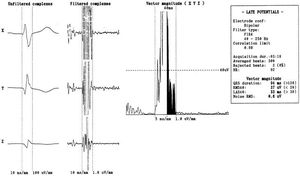
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1)
Fig. 1. Electrocardiograma con señal promediada de un individuo sano.
es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 199641:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. AELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRS f > 114 ms, aunque algunos autores 42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRS f con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRS f es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica 43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier 44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados 45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral 46,47 y wavelet analysis48 ).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A>ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRS f > 114 ms, aunque algunos autores 42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRS f con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRS f es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica 43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier 44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados 45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral 46,47 y wavelet analysis48 ).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2. Estos estudios se realizaron en la era prefibrinolítica. Como ya hemos comentado, el uso de fibrinólisis se relaciona con una disminución de prevalencia de PT y de incidencia de eventos arrítmicos en el postinfarto, mayor que la esperable por la porción de miocardio salvado en términos de FEVI. Así, Malik et al62 observaron una reducción en el VPP de los PT en pacientes tratados con trombólisis. Sin embargo, Denes et al56 encuentran que el uso de trombólisis o angioplastia primaria no disminuye la significación pronóstica de los PT en el postinfarto.
El VPP del ECG-PS se incrementa de forma significativa cuando se utiliza en combinación con otras pruebas de valoración del riesgo arrítmico (tabla 4).
La tasa de eventos arrítmicos mayores en un seguimiento a un año de pacientes postinfarto con ECG-PS anormal y FEVI por ventriculografía isotópica < 0,40 fue del 36%, frente al 0% en los pacientes con ambos test negativos ( o> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 199641:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2. Estos estudios se realizaron en la era prefibrinolítica. Como ya hemos comentado, el uso de fibrinólisis se relaciona con una disminución de prevalencia de PT y de incidencia de eventos arrítmicos en el postinfarto, mayor que la esperable por la porción de miocardio salvado en términos de FEVI. Así, Malik et al62 observaron una reducción en el VPP de los PT en pacientes tratados con trombólisis. Sin embargo, Denes et al56 encuentran que el uso de trombólisis o angioplastia primaria no disminuye la significación pronóstica de los PT en el postinfarto.
El VPP del ECG-PS se incrementa de forma significativa cuando se utiliza en combinación con otras pruebas de valoración del riesgo arrítmico (tabla 4). La tasa de eventos arrítmicos mayores en un seguimiento a un año de pacientes postinfarto con ECG-PS anormal y FEVI por ventriculografía isotópica < 0,40 fue del 36%, frente al 0% en los pacientes con ambos test negativos (odds ratio = 30)60. En un segundo estudio59, con seguimiento medio de 14 meses, la probabilidad de eventos arrítmicos siendo ambos test positivos fue del 34%. Utilizado de forma combinada con el Holter para detección de EV de alto grado y TVNS también mejora su capacidad pronóstica63. En el estudio de Farrell et al30, la combinación de la presencia de PT y de una variabilidad de la frecuencia cardíaca (VFC) reducida tenía una S del 58% con un VPP del 33% y fue superior a cualquier otra combinación de pruebas no invasivas, incluyendo FEVI, ECG de esfuerzo y ectopia ventricular.
MEDIDAS DE LA ACTIVIDAD DEL SISTEMA NERVIOSO AUTÓNOMO: VARIABILIDAD DE LA FRECUENCIA CARDÍACA Y SENSIBILIDAD BARORREFLEJA
En la actualidad, el papel que desempeña el sistema nervioso autónomo en la mortalidad cardíaca súbita es bien reconocido. Las alteraciones en el balance simpático-parasimpático, con un predominio del primero respecto al segundo, han sido claramente relacionadas con un aumento del riesgo para el desarrollo de arritmias ventriculares malignas 64-66. El demostrado efecto protector de los fármacos betabloqueantes en pacientes con cardiopatía estructural severa viene a reforzar dicha hipótesis.
De lo expuesto anteriormente se deduce el enorme interés que han suscitado diversas técnicas de medición de la actividad nerviosa autónoma en cuanto a su potencial clínico para la predicción de la muerte cardíaca súbita, entre las que cabe destacar la medición de la variabilidad de la frecuencia cardíaca y de la sensibilidad barorrefleja (SBR).
Variabilidad de la frecuencia cardíaca
En individuos normales, la frecuencia cardíaca viene determinada por el nodo sinusal, cuya frecuencia intrínseca de descarga es de 100 a 120 lat/min. Dicha estructura recibe una rica inervación por parte del sistema nervioso autónomo, que regula su frecuencia de descarga, de manera que la frecuencia cardíaca final es el resultado del efecto neto de la actividad eferente parasimpática o vagal, que tiende a enlentecerla, y de la simpática, que tiende a aumentarla. En condiciones de reposo, ambas están presentes de forma tónica, con predominio de la actividad vagal. Con el ejercicio y otras condiciones de estrés fisiológico, la actividad vagal disminuye, mientras que la simpática aumenta y, con ella, la frecuencia cardíaca. Por tanto, las variaciones de la frecuencia cardíaca a lo largo del día son consecuencia de las fluctuaciones en el tono autonómico, determinadas por la influencia de multitud de factores en los centros simpáticos y parasimpáticos del sistema nervioso autónomo como la respiración, el control vasomotor, los reflejos barorreceptores y quimiorreceptores, los procesos de termorregulación, el sistema renina-angiotensina, el ejercicio y el estrés psicológico-emocional.
La disponibilidad actual de equipos comerciales de análisis de registros Holter que llevan incorporados análisis automatizados de la VFC ha facilitado la obtención de este tipo de medidas para la realización de estudios clínicos y de investigación. Sin embargo, el significado y la interpretación de las múltiples y diferentes medidas de VFC es más complejo de lo que habitualmente se considera y una utilización inadecuada de las mismas puede llevar a conclusiones incorrectas y completamente infundadas. A este respecto, el grupo de expertos de la ESC (European Society of Cardiology) y de la NASPE (North American Society of Pacing and Electrophisiology) publicó en 1996 una serie de normas y recomendaciones que tienen como objetivo estandarizar los métodos de análisis de la VFC, así como su interpretación fisiopatológica y su aplicación clínica 67.
Hay dos formas fundamentales de analizar la VFC: en el dominio del tiempo y en el dominio de la frecuencia. La primera se basa en el análisis de los intervalos RR o ciclos cardíacos, mientras que la segunda analiza los ritmos intrínsecos de la señal de frecuencia cardíaca mediante la descomposición de la misma en sus componentes de frecuencia fundamentales. En las tablas 5 y 6 se recogen las medidas más utilizadas en cada método de análisis. La figura 2 muestra la forma de calcular el índice triangular, una medida geométrica basada en el histograma de intervalos RR.
Fig. 2. Cálculo del índice triangular de variabilidad (HRV index): en primer lugar, debe construirse la función de distribución de los intervalos RR, que asigna a cada valor de longitud de RR el número de intervalos observados que tienen dicha duración. La longitud de intervalo más frecuente (X) corresponde al valor máximo de la función de distribución (Y). El índice triangular se calcula dividiendo el área integral de la función de distribución por el máximo Y. Cuando la función de distribución es construida con una escala discreta en el eje horizontal (habitualmente usando una frecuencia de muestreo de 1/128 ms), el índice triangular se calcula dividiendo el número total de todos los intervalos RR por el máximo Y.
Dentro del grupo de medidas basadas en el dominio del tiempo, muchas están fuertemente correlacionadas, de manera que ofrecen información redundante. Por ello, el grupo de expertos de la ESC-NASPE ha recomendado el uso de cuatro de ellas: la SDNN y el índice triangular para estimar la variabilidad promedio o global, la SDANN para estimar la variabilidad a largo plazo y la rMSSD para estimar la variabilidad a corto plazo.
El análisis en el dominio de la frecuencia se basa en la descomposición de la señal de frecuencia cardíaca en sus componentes de frecuencia más relevantes, midiendo su intensidad relativa o potencia (fig. 3).
Fig. 3. Análisis espectral de la señal de frecuencia cardíaca. ULF: banda de ultrabaja frecuencia. VLF: banda de muy baja frecuencia. LF: banda de baja frecuencia. HF: banda de alta frecuencia. Log PSD: logaritmo de la densidad de potencia espectral.
Esto se realiza mediante métodos no paramétricos (FFT: algoritmo de la transformada rápida de Fourier) o paramétricos (AR: modelo autorregresivo). Estos métodos proporcionan una información fisiológica más detallada, pero son más difíciles de interpretar y más sensibles a los errores de medición y la calidad del registro. Cuando se analiza el espectro de potencia mediante estos métodos, pueden definirse 2 bandas de frecuencia características, con diferentes significados fisiológicos (fig. 3):
- Banda de alta frecuencia: centrada alrededor de la frecuencia respiratoria (usualmente entre 0,2 y 0,4 Hz en adultos) y relacionada con las fluctuaciones de la actividad parasimpática o vagal asociada a la respiración.
- Banda de baja frecuencia (0,04 a 0,2 Hz): peor definida y atribuida a los procesos termorreguladores, actividad vasomotora periférica y al sistema renina-angiotensina. Esta banda está modulada por ambos sistemas, simpático y parasimpático, aunque con predominio del primero. De hecho, el cociente entre la potencia de baja frecuencia y la de alta frecuencia se considera como una medida del balance simpático vagal.
- Además de las descritas, también pueden identificarse bandas de muy baja frecuencia (0,01 a 0,04 Hz) y de ultrabaja frecuencia (10 -5 a 10 -2 Hz), esta última en registros a largo plazo (de 24 h), cuyo significado fisiológico es poco conocido.
La presencia de una VFC disminuida se correlaciona con la existencia de un balance alterado en el sistema nervioso autónomo, con predominio de la actividad simpática respecto de la parasimpática. Diversos estudios publicados hasta la fecha han demostrado que una baja VFC es un potente predictor de la mortalidad por todas las causas, tanto en pacientes con un infarto previo 30,68-73 como en pacientes con miocardiopatía dilatada 74,75 y otras patologías extracardíacas 76-78. En pacientes con un infarto reciente, la disminución en los índices de la VFC es un predictor más potente que otras variables como la FEVI, la frecuencia y complejidad de la EV, los índices electrocardiográficos y ergométricos, y el hallazgo de PT en el ECG-PS 30 (ta-bla 7). Además de ser un predictor para la mortalidad global, la VFC disminuida también se ha confirmado en estos estudios como un potente predictor de FV y MS en pacientes que han sufrido un IAM. Aunque las medidas en el dominio del tiempo han sido las más estudiadas, el valor predictivo de la VFC también ha sido demostrado para las medidas en el dominio de frecuencia, siendo la potencia total, la potencia de muy baja frecuencia y la de ultrabaja frecuencia las que han demostrado una relación significativa con la mortalidad global 69,79. Además, la potencia de muy baja frecuencia parece relacionarse de una forma más estrecha con la muerte arrítmica 69.
Aunque la VFC disminuida es un potente predictor de MS independiente de otros marcadores de riesgo no invasivos, su VPP cuando es considerada por sí sola resulta todavía bastante modesto (próximo al 30%). Sin embargo, varios estudios 30,69,72,80 han demostrado una mejoría significativa en el VPP cuando se utiliza de forma combinada con otros predictores como la FEVI, los PT y la ectopia ventricular, llegando a alcanzar valores entre el 35 y el 50%. Por otro lado, la preselección de pacientes de alto riesgo utilizando la información combinada de los marcadores no invasivos puede mejorar de forma significativa la capacidad del EEF invasivo para identificar a los pacientes con un alto riesgo de muerte arrítmica 14.
En resumen, la disminución de la VFC es un predictor independiente de mortalidad cardíaca global y súbita en pacientes con infarto previo. Existe un consenso general en que la medición de la VFC debería hacerse una semana después del episodio de IAM 67. Aunque las medidas de VFC basadas en registros a corto plazo han demostrado ser útiles 68, el mayor poder predictivo corresponde a las mediciones sobre registros de 24 h. Diferentes medidas de la VFC basadas en el dominio del tiempo y de la frecuencia han demostrado ser útiles, pero ninguna de ellas parece proporcionar una información pronóstica mejor que la ofrecida por la SDNN y el índice triangular, que estiman la variabilidad promedio. Aunque los puntos de corte no han sido claramente establecidos, sobre la base de los estudios publicados puede considerarse que una SDNN < 50 ms o un índice triangular inferior a 15 identifican al grupo de pacientes con VFC severamente reducida, y valores de SDNN entre 50 y 100 ms o del índice triangular entre 15 y 20 identifican a un subgrupo con VFC moderadamente reducida. El valor predictivo de la VFC por sí solo es modesto, pero puede mejorar significativamente cuando se combina con otros marcadores no invasivos. Sin embargo, el conjunto de marcadores no invasivos a utilizar, así como los puntos de corte más óptimos para conseguir la máxima capacidad predictiva, están aún por definir.
Sensibilidad barorrefleja
Otra forma de estudiar la actividad del sistema nervioso autónomo consiste en valorar el efecto sobre la frecuencia cardíaca de la estimulación de los barorreceptores arteriales. Para ello se han utilizado tres técnicas diferentes: a) elevación de la presión arterial mediante agentes vasoconstrictores como la fenilefrina para examinar el tono vagal reflejo; b) disminución de la presión arterial con agentes vasodilatadores como el nitroprusiato para examinar el tono reflejo simpático, y c) estimulación directa de los barorreceptores carotídeos mediante succión en el cuello. De ellas, la más empleada en los diversos estudios ha sido la infusión de fenilefrina con representación de los cambios del intervalo RR en función de los cambios en la presión arterial, utilizándose la pendiente de la recta de regresión correspondiente como una medida de la actividad vagal refleja.
La SBR está disminuida en pacientes que han sufrido un IAM, y una disminución severa de la misma es capaz de identificar a un subgrupo de pacientes con alto riesgo de eventos arrítmicos 81-84. Farrell et al 81 encontraron que la SBR estaba significativamente disminuida en pacientes que presentaban taquicardia ventricular monomórfica sostenida (TVMS) después de un IAM que era inducible en el EEF. Los autores concluyeron que la realización de un EEF podía ser limitada únicamente a pacientes con un IAM que presentan una SBR disminuida sin pérdida de su valor predictivo. En un estudio de seguimiento durante 1 año, 122 pacientes con un IAM y SBR disminuida tenían un RR de eventos arrítmicos de 23,1 82.
Dado que el reflejo barorreceptor es un componente importante en la modulación de la frecuencia cardíaca, varios estudios han investigado la correlación entre las medidas de SBR y de VFC. Bigger et al encontraron una correlación positiva, aunque débil (0,57 a 0,63) 85. Sin embargo, Farrell et al 81 no encontraron correlación significativa entre ambos tipos de medidas de la actividad del sistema nervioso autónomo. Esto sugiere que la SBR y la VFC miden aspectos distintos de la actividad autonómica. La primera expresa la actividad fásica o barorrefleja y la segunda mide la actividad autonómica de una forma más global, incluyendo la actividad fásica o refleja y las influencias tónicas. El estudio ATRAMI 84, de carácter multicéntrico, incluyó a 1.284 pacientes con un infarto reciente para estudiar el posible valor pronóstico adicional de la SBR frente a la VFC. La presencia de una SBR disminuida (pendiente de la recta de regresión RR frente a presión arterial inferior a 3 ms/mmHg) se asociaba a un riesgo aumentado de mortalidad cardíaca global, de forma independiente a la VFC, cuya disminución (SDNN < 70 ms) también estaba asociada a una mayor mortalidad (riesgos relativos 2,8 y 3,2, respectivamente). Además, la combinación de una SBR y una VFC disminuidas ofrecía un valor pronóstico adicional (RR = 8,5). La asociación de una FEVI inferior a 0,35 con una SBR disminuida se asociaba a un RR de 8,7 y con una VFC baja de 6,7. La conclusión de dicho estudio fue que el examen de los reflejos vagales barorreceptores en pacientes con un infarto reciente aporta una información pronóstica independiente de la FEVI y adicional a la ofrecida por las medidas de la VFC.
ESTUDIO ELECTROFISIOLÓGICO. ESTIMULACIÓN VENTRICULAR
El objetivo de esta técnica es valorar la presencia o no de arritmias ventriculares inducibles mediante la estimulación del tejido miocárdico con catéteres-electrodo introducidos percutáneamente (fig. 4).
Fig. 4. Inducción de una TV mediante estimulación ventricular. La taquicardia es inducida mediante estimulación en el ventrículo derecho con un tren de 8 latidos seguido de 2 extraestímulos con intervalos de acoplamiento progresivamente más cortos.
Desde el ápex y el tracto de salida de ventrículo derecho se realiza estimulación con trenes a distintas frecuencias (600 y 400 ms, por ejemplo), introduciendo extraestímulos (EE) con intervalos de acoplamiento progresivamente menores. Si existen áreas de conducción lenta en el corazón, los EE introducidos durante el EEF provocan un mayor enlentecimiento de la conducción y bloqueo unidireccional, condiciones que conducen al inicio y mantenimiento de TV sostenida. Por tanto, el EEF informa de la presencia o no de un sustrato reentrante que, bajo la influencia de factores desencadenantes y moduladores, puede dar lugar a TV.
Prevalencia de arritmias inducibles
Depende de los siguientes factores:
1. Protocolo de estimulación. La probabilidad de inducir arritmias ventriculares es mayor si se estimula desde más de un punto 86 y con varios EE. Richards et al 13 comprobaron que la mayor S y VPP se conseguían al emplear 1 a 3 EE con pulsos al doble del umbral diastólico.
2. Tiempo transcurrido desde IAM. Comparando EEF realizados 2 días consecutivos, se ha observado que la reproducibilidad de la TV sostenida inducida de ciclo superior a 240 ms es alta (cercano a 100%). No sucede lo mismo con la FV inducida o la TV con ciclo menor de 240 ms (reproducibilidad del 44%) 87. Sin embargo, sí se observaron variaciones en la inducibilidad de TV cuando el intervalo temporal es mayor 88-90. Por tanto, el momento en que se realice el EEF influirá en las arritmias ventriculares sostenidas inducibles.
3. FEVI. Si es superior a 0,40, la inducibilidad de TV es baja (5-11%) 61,91, mientras que si es menor de 0,40, se inducen TV en 50-52%. Asimismo, la presencia de aneurisma ventricular izquierdo favorece la inducibilidad de arritmias ventriculares 92.
4. Características del IAM. La inducibilidad de arritmias es mayor en enfermedad multivaso y en IAM complicado con insuficiencia cardíaca o con arritmias ventriculares en las primeras 48 h, si bien la capacidad de discriminación de estos datos (aunque significativa) es modesta 93.
5. Tratamiento trombolítico. Algunos autores 94-96 han encontrado una menor inducibilidad de arritmias ventriculares en pacientes tratados con trombolíticos, sugiriendo que la reperfusión precoz reduce el sustrato arritmogénico al disminuir el tamaño del IAM. En cambio, McComb et al 97 no observaron diferencias en la permeabilidad de la arteria responsable del IAM en pacientes con TV inducible y sin ella.
6. Arritmias en estudio Holter. La inducción de TV es más frecuente en pacientes con EV frecuente 92. Asimismo, en casos de TVNS se induce TVMS en 40-50%, aunque las características electrocardiográficas de las TVNS espontáneas no predicen qué pacientes con enfermedad coronaria tendrán TV sostenida inducible 98.
Valor pronóstico de la estimulación ventricular
Analizando los distintos estudios se observan resultados contradictorios. Esto se debe al reducido tamaño de la muestra en cada estudio, los distintos protocolos de estimulación empleados, el tipo de pacientes incluidos, los diferentes períodos de seguimiento y el tratamiento no aleatorio con fármacos antiarrítmicos en algunos casos.
Los posibles resultados de la estimulación ventricular tras IAM son: no arritmias inducibles, TVNS, TVMS y FV. No todas las arritmias inducidas tienen importancia clínica. Los pacientes sin arritmias inducibles o con TVNS inducible tienen un riesgo bajo de eventos arrítmicos. Respecto a la FV, carece de significado pronóstico adverso a largo plazo 16,61,99,100. Así, Bourke et al 100 encontraron la misma incidencia de TV espontánea o MS tras 1 año de seguimiento en pacientes postinfarto con FV inducible y sin arritmias inducibles (0,6%). La mayoría de estudios concluyen que la inducción de TVMS con frecuencia menor de 270 lat/min en EEF realizado en el primer mes tras IAM es factor predictivo de eventos arrítmicos posteriores, aunque con alto número de falsos positivos 13,16,61,99. Por ejemplo, Richards et al 13 comprobaron que la TV inducida era el mejor predictor de MS o TV espontánea, con un riesgo de eventos arrítmicos 15,2 veces mayor que la ausencia de inducibilidad de TV. En este trabajo calcularon que de 1.000 pacientes sometidos a EEF, 39 tendrán eventos arrítmicos durante el primer año. El EEF identificará como de riesgo a 73 pacientes, 22 de los cuales presentarán eventos, mientras que será negativo en 927, de los cuales 17 tendrán eventos arrítmicos.
En la tabla 8 se resume el valor pronóstico de la estimulación ventricular en 4 estudios 13,16,92,99. Otros autores 89,94, sin embargo, observan escasa correlación entre arritmias inducibles tras IAM y episodios arrítmicos durante el seguimiento.
Dado que se trata de una prueba invasiva y con bajo VPP en la mayoría de trabajos, no está justificada la realización de EEF para estratificación de riesgo post-IAM sin tener en cuenta datos clínicos o el resultado de pruebas no invasivas. De hecho, aunque el EEF aislado tiene un VPN alto (por tanto, identifica a pacientes de bajo riesgo arrítmico), una combinación de pruebas no invasivas consigue VPN similares. Además, Cripps et al 16 demostraron que una combinación de pruebas no invasivas (PT, EV frecuente) con datos clínicos tenía S y VPP comparables a los obtenidos con EEF.
Combinación del EEF con pruebas no invasivas
Para mejorar el VPP se han seleccionado pacientes para EEF siguiendo criterios clínicos o resultados de pruebas no invasivas. Varios autores 101-103 han estudiado el valor pronóstico de la estimulación programada en casos de enfermedad coronaria y TVNS. Se conseguía inducción de TVMS en el 40-50% de los pacientes. Observaron una baja incidencia de eventos arrítmicos en ausencia de arritmia inducible y en casos de arritmia inducible suprimible con fármacos 103. Por el contrario, los pacientes con TV inducible no suprimible, que fueron dados de alta con tratamiento antiarrítmico empírico, tuvieron un mayor número de arritmias en el seguimiento, si bien no puede descartarse efecto proarrítmico de los fármacos.
Por su parte, Iesaka et al 92 y Richards et al 13 analizaron la capacidad predictiva de fenómenos arrítmicos si se combinaban EEF y FEVI deprimida. Se observó un mayor VPP de la combinación respecto al EEF aislado (el 46-50 frente al 30-36%).
Pedretti et al 14 proponen seleccionar para EEF pacientes que cumplan 2 o más de los siguientes criterios: FEVI menor de 0,40, duración del QRSf 106 ms y 2 o más rachas de TVNS. Con dichos criterios se identifican pacientes de riesgo con un VPP del 44% y un VPN del 99%.
En otros estudios 33,104-106, recogidos en la tabla 9, se han seleccionado pacientes para EEF combinando datos clínicos, FEVI deprimida, presencia de PT y arritmias ventriculares complejas en el Holter.
Bhandari et al 107, estudiando a pacientes con IAM Killip II o mayor y angina moderada o severa o TVNS (excluyendo insuficiencia cardíaca de difícil control o necesidad de revascularización), obtuvieron para la predicción de eventos arrítmicos con EEF un VPP > 30% y un VPN del 93%, siendo especialmente útil en IAM Killip III o IV. A pesar del alto VPN, se ha observado 108, no obstante, que un EEF negativo en pacientes con IAM previo y TVNS no implica necesariamente buen pronóstico si se asocian FEVI severamente deprimida y antecedentes de insuficiencia cardíaca congestiva.
Recientemente, Andresen et al 33 han comprobado que el uso combinado de pruebas no invasivas (ecocardiograma y Holter) y EEF identifica un grupo de pacientes con alto riesgo de eventos arrítmicos (el 18,2% tras 37 meses de seguimiento) tras IAM: FEVI 0,40 o > 20 EV/h o 10 dobletes/día o TV y TVMS inducible. No se analizó en estos trabajos el posible efecto beneficioso de un desfibrilador implantable. A este respecto, los estudios MADIT, CABG-Patch y otros se revisan en el apartado «Desfibrilador automático implantable profiláctico».
TRATAMIENTO PARA LA PREVENCIÓN DE MUERTE SÚBITA
Para prevenir a largo plazo la MS tras un IAM es fundamental actuar sobre los factores de riesgo cardiovascular del paciente, disminuyendo la progresión de la arteriosclerosis y el riesgo de trombosis coronaria. Además, deben tratarse, si las hubiera, la isquemia, mediante tratamiento médico o revascularización percutánea o quirúrgica según los casos, y la insuficiencia cardíaca y disfunción ventricular. Unido a estas medidas generales, se ha estudiado el papel de los fármacos antiarrítmicos y del desfibrilador automático en la prevención de MS tras IAM en pacientes de riesgo.
TRATAMIENTO FARMACOLÓGICO
Los estudios CAST 109 y SWORD 110 demostraron un aumento de mortalidad después del IAM tras tratamiento con fármacos I-C de la EV frecuente en el primero y con D-sotalol de pacientes con disfunción ventricular en el segundo estudio. Por ello, debe evitarse el uso de dichos fármacos en estos pacientes. Otros investigadores han analizado la utilidad de la amiodarona y de los betabloqueantes en los pacientes con alto riesgo arrítmico tras IAM, con los resultados que se exponen a continuación.
Amiodarona en la prevención de MS tras infarto
A principios de los años 90 se publicaron los estudios BASIS, PAT y SSSD. El estudio BASIS (Basel Antiarrhythmic Study of Infarct Survival) 111 incluyó a 312 pacientes menores de 71 años que presentaron durante la fase hospitalaria del IAM arritmias grado 3 o 4b de Lown. Fueron asignados aleatoriamente a fármacos antiarrítmicos clase I (guiados por EEF), amiodarona o ningún tratamiento antiarrítmico. Al año de seguimiento se observó una mortalidad global del 5% en el grupo con amiodarona frente a 13% en pacientes sin medicación antiarrítmica (p = 0,024). Sin embargo, este estudio presenta varias limitaciones: el tamaño de la muestra es reducido y no se trata de un estudio doble ciego ni controlado con placebo. Además, es llamativa la elevada mortalidad de los pacientes del grupo control con FEVI conservada (9%). En el estudio PAT (Polish Arrhythmia trial) 112 se estudiaron 613 pacientes menores de 75 años con infarto reciente y contraindicaciones para tratamiento betabloqueante, que fueron tratados con amiodarona o placebo. Aunque la mortalidad cardíaca fue menor en el grupo con amiodarona (el 6,2 frente al 10,7%; p = 0,048), no se encontraron diferencias estadísticamente significativas en la mortalidad global (el 6,9 frente al 10,7%; p = 0,095). Respecto al estudio SSSD (Spanish Study of Sudden Death) 113, 368 pacientes con FEVI 0,20-0,45 tras IAM y Holter con EV 3/h, dobletes o TVNS fueron asignados aleatoriamente a amiodarona, metoprolol o ningún tratamiento antiarrítmico. No hubo diferencias significativas en la mortalidad total entre los pacientes tratados con amiodarona y los que no recibieron ningún tratamiento (el 3,5 frente al 7,7%; p = 0,19).
En 1997 se publicaron los estudios EMIAT y CAMIAT, ambos aleatorizados, doble ciego y controlados con placebo, de tamaño muestral medio (tabla 10).
En el estudio EMIAT (European Myocardial Infarct Amiodarone Trial) 114 se incluyeron 1.486 pacientes entre 18 y 75 años, con IAM previo y FEVI (determinada a los 5-21 días del IAM) 0,40, asignándose 743 a cada grupo de tratamiento (placebo y amiodarona). Tras un seguimiento medio de 21 meses, en un análisis por intención de tratamiento, no se observaron diferencias significativas en la mortalidad total (objetivo principal del estudio): 13,86% en el grupo con amiodarona y 13,73% en el grupo control, p = ns, independientemente del grado de depresión de la FEVI ( 0,30 o 0,30-0,40). Tampoco se observaron diferencias en la mortalidad cardíaca total. Sin embargo, sí se observó una reducción del 35% (IC del 95%: 0-58; p = 0,05) en la mortalidad arrítmica, así como una reducción del 32% (IC 95%: 0-54, p = 0,05) en la combinación de muerte arrítmica y parada cardíaca reanimada. También se realizó un análisis de eficacia (por tratamiento recibido) con las mismas conclusiones, si bien la reducción en mortalidad por arritmias fue más marcado en este caso. Respecto a la suspensión del tratamiento, se produjo en el 38,5% de pacientes tratados con amiodarona y en el 21,4% del grupo placebo. En el 5,9% de los primeros, las causas fueron alteraciones endocrinas y en el 3,2%, alteraciones en la frecuencia y ritmo cardíacos.
En el estudio CAMIAT (Canadian Amiodarone Myocardial Infarction Arrhythmia Trial) 115 se analizaron pacientes mayores de 19 años con IAM 6-45 días antes y Holter con EV frecuente ( 10/h) y/o repetitiva ( 3 latidos a 100-120/min o 3-10 latidos a más de 120/min). Mil doscientos dos pacientes fueron asignados aleatoriamente a tratamiento con amiodarona (606 pacientes) o con placebo (596 pacientes). En la monitorización Holter, el 60,4% presentaban sólo EV frecuente, el 20% sólo EV repetitiva y el 18,6% ambas. Tras un seguimiento medio de 1,79 años, no se observaron diferencias significativas en la mortalidad global, cardíaca y arrítmica entre ambos grupos y sí en la combinación de muerte arrítmica y FV reanimada (objetivo principal del estudio): analizando intención de tratamiento, tasa media anual de 2,29% en el grupo tratado con amiodarona frente al 3,71% en los tratados con placebo (p = 0,029) y, considerando análisis de eficacia, el 1,77 y el 3,38%, respectivamente (p = 0,016). Al igual que en el estudio EMIAT, se analizó la suspensión del tratamiento, que se produjo en el 36,4% del grupo con amiodarona y en el 25,5% de pacientes tratados con placebo, sobre todo por efectos secundarios (el 26,1 y el 13,7%, respectivamente).
En resumen, considerando en conjunto estos estudios, especialmente EMIAT y CAMIAT, la amiodarona no mejora la supervivencia global en los pacientes analizados. Por tanto, no está indicado el uso sistemático de amiodarona en la prevención de MS tras IAM.
Algunos autores han estudiado en estos trabajos a subgrupos de pacientes. No obstante, estos análisis deben interpretarse con cautela dado que con frecuencia son posteriores al diseño del estudio. Además, se han observado resultados contradictorios. Así, en los estudios BASIS 111 y PAT 112,116, la amiodarona sólo reducía significativamente la mortalidad en pacientes con FEVI 0,40. Por el contrario, en un subestudio del EMIAT 117, la mortalidad global se reducía bajo tratamiento con amiodarona si FEVI < 0,30. Lamentablemente, en el estudio CAMIAT no se analizó la FEVI.
Otro subgrupo que ha sido objeto de análisis es el formado por pacientes con betabloqueantes. En el estudio EMIAT, los pacientes bajo tratamiento betabloqueante (el 44,28% del total) presentaron un notable descenso en la mortalidad cardíaca y arrítmica si recibían también amiodarona. Los investigadores del estudio CAMIAT sólo analizaron el porcentaje de pacientes con betabloqueantes al inicio del estudio y no durante el seguimiento, por lo que, como indican algunos autores 118, no se pueden extraer conclusiones de los efectos del tratamiento combinado a largo pla-zo. Recientemente 119, combinando datos de EMIAT y CAMIAT, se comprobó un menor riesgo de muerte cardíaca y arrítmica en los pacientes con ambos tratamientos al inicio del estudio comparados con aquellos sin betabloqueantes, independientemente de si recibían o no amiodarona. Estos autores recomiendan mantener los betabloqueantes cuando se inicia tratamiento con amiodarona. Sin embargo, se requieren estudios prospectivos para conocer el efecto de la combinación a largo plazo sobre la mortalidad.
Betabloqueantes y prevención de MS tras infarto
El uso de fármacos betabloqueantes en pacientes que han sufrido un IAM se asocia con una reducción de la mortalidad global, tanto durante la fase aguda como en su administración a largo plazo. Durante la fase aguda, los beneficios clínicos de la utilización de fármacos betabloqueantes han sido analizados en al menos 33 estudios comparativos con placebo 120. La administración al ingreso de una dosis intravenosa de betabloqueantes, seguida de su administración por vía oral, ha demostrado los siguientes beneficios clínicos 121,122:
- Disminución de la intensidad y duración del dolor.
- Reducción del área de infarto.
- Disminución de la incidencia de arritmias graves.
- Disminución del número de reinfartos y de la incidencia de rotura cardíaca.
- Reducción de la mortalidad a corto y largo plazo.
Un metaanálisis de 27 ensayos aleatorizados 123, con cerca de 27.000 pacientes incluidos, demostró que la administración de betabloqueantes durante la fase aguda de un infarto de miocardio se asociaba a una reducción significativa de la mortalidad global (13%; p < 0,02), del riesgo de reinfarto no fatal y de la incidencia de parada cardíaca intrahospitalaria. En el estudio ISIS-1 121, el mayor beneficio se concentra en los dos primeros días y parece debido, fundamentalmente, a una reducción de la rotura cardíaca.
La administración a largo plazo de fármacos betabloqueantes en pacientes que han sufrido un IAM, también ha sido valorada en varios estudios. Un meta-análisis de 25 ensayos aleatorizados, con más de 23.000 pacientes incluidos 123, encontró una reducción del 22% en la mortalidad cardíaca global, del 32% en el riesgo de MS y del 27% en la incidencia de reinfarto no fatal. El estudio Beta-Blocker Pooling Project (BBPP) 124 analizó los resultados de nueve ensayos aleatorizados, con un total de 13.679 pacientes. La mortalidad global se redujo en un 24% (p < 0,0001) en los enfermos tratados con betabloqueantes. Posteriormente, un metaanálisis de los cinco estudios realizados con metoprolol 125, con 5.474 pacientes, comprobó una reducción significativa del 19% en la mortalidad global y del 42% en la mortalidad súbita. Más recientemente, Gottlieb et al 126, en un registro de 201.752 pacientes con un IAM, encontraron una reducción significativa de la mortalidad global en todos los subgrupos de pacientes tratados con betabloqueantes (reducción entre el 28 y el 40%). No se analizó de forma específica la mortalidad súbita.
En resumen, los betabloqueantes han sido ensayados en pacientes que han sufrido un IAM, demostrando que son capaces de lograr una reducción de la mortalidad cardíaca global y de la MS cuando son administrados tanto en la fase aguda como a largo plazo. El beneficio parece ser la consecuencia de un efecto de grupo y ha sido constatado tanto para los cardioselectivos (atenolol 121, metoprolol 122,125,127-129, bisoprolol 130) como para los no selectivos (propanolol 131, timolol 132, carvedilol 133). Únicamente se tienen dudas acerca de los agentes betabloqueantes con actividad simpaticomimética intrínseca (pindolol, oxprenolol) que no han demostrado buenos resultados e incluso podrían ser perjudiciales 134. Sólo el acebutolol, que tiene una ASI modesta, ha demostrado un claro efecto beneficioso 135. En cuanto al sotalol, un fármaco betabloqueante con propiedades antiarrítmicas de clase III, no ha demostrado beneficio, lo que se atribuye a sus propiedades proarrítmicas. De hecho, el d-sotalol, con actividad principalmente antiarrítmica, se asoció con un aumento de la mortalidad en el estudio SWORD 110.
La mayoría de los estudios previos han valorado el efecto beneficioso de los fármacos betabloqueantes en la población general de pacientes con un IAM. Los análisis por subgrupos de algunos de dichos estudios han puesto de manifiesto que el beneficio clínico de los betabloqueantes se extiende a todos los subgrupos, independientemente de la edad, sexo, localización del infarto, FEVI y otras variables 124,126,132. Sin embargo, para un beneficio relativo similar, las poblaciones de mayor riesgo (mayor edad, arritmias ventriculares, historia de insuficiencia cardíaca, FEVI deprimida, etc.) obtendrían un beneficio absoluto de mayor cuantía. Al respecto, tres grandes estudios aleatorizados han valorado el efecto beneficioso de los betabloqueantes en pacientes con fallo cardíaco crónico y FEVI deprimida, de etiología isquémica o no isquémica. El estudio del carvedilol 133 incluyó a 1.094 pacientes con insuficiencia cardíaca crónica (el 47% de etiología isquémica), demostrando una reducción de la mortalidad global y de la MS (el 65 y el 55%, respectivamente). El beneficio fue independiente de la etiología del fallo cardíaco. Por su parte, el estudio CIBIS-II 130, utilizó el bisoprolol e incluyó a 2.647 pacientes con insuficiencia cardíaca crónica (el 50% de etiología isquémica). El tratamiento con bisoprolol se asoció con una reducción del 32% en la mortalidad global y del 42% en la incidencia de MS. Dicho beneficio era independiente de la etiología de la disfunción ventricular. Por último, el estudio MERIT-HF 127, con 3.991 pacientes incluidos (el 66% con cardiopatía isquémica), ha corroborado los hallazgos de los estudios previos, demostrando una reducción de la mortalidad global y de la incidencia de MS del 34 y del 41%, respectivamente. Igual que en los estudios previos, el beneficio fue independiente de la etiología y de la severidad de la insuficiencia cardíaca.
A modo de conclusión, los fármacos betabloqueantes deberían emplearse en todos los pacientes con un IAM que no presenten contraindicaciones para los mismos, ya que reducen la mortalidad cardíaca global y arrítmica. La administración debería comenzar en la fase aguda, en especial en pacientes de mayor riesgo, para ser mantenida, posteriormente, de forma indefinida. Los pacientes con un mayor riesgo de eventos adversos cardiovasculares son los que obtendrían un mayor beneficio de su utilización. La presencia de una FEVI deprimida no sólo no es una contraindicación, sino que este subgrupo de pacientes se beneficia claramente de este grupo de fármacos.
DESFIBRILADOR AUTOMÁTICO IMPLANTABLE PROFILÁCTICO
Los desfibriladores automáticos son dispositivos implantables para la detección y tratamiento de arritmias ventriculares (fig. 5).
Fig. 5. Imagen del generador de un desfibrilador autómatico implantable bicameral.
En los últimos años han experimentado un notable avance 136 con la incorporación de dispositivos bicamerales, terapias de estimulación antitaquicardia, funciones de marcapaso y sistemas de almacenamiento de electrogramas. Asimismo, las técnicas de implantación son más sencillas, colocándose en región pectoral de modo similar a un marcapaso (fig. 6).
Fig. 6. Radiografía de tórax de paciente portador de DAI bicameral de última generación.
Respecto a su aplicación clínica, los desfibriladores implantables han demostrado gran eficacia y seguridad como terapia frente a TV o FV. No obstante, los desfibriladores automáticos implantables (DAI) no están exentos de riesgo. Grimm et al 137, en un estudio prospectivo de 144 pacientes con DAI de tercera generación, encontraron alguna complicación en un 28% tras un seguimiento de 21 ± 15 meses. Un 16% tuvieron descargas inapropiadas, sobre todo por taquicardias supraventriculares, aunque también por TVNS y sobresensado de miopotenciales. En un 4% se observaron problemas relacionados con electrodos, especialmente por desplazamiento. Otras complicaciones fueron menos frecuentes. No se observaron muertes perioperatorias ni infecciones. Se describen, a continuación, los estudios MADIT, CABG-Patch y otros que evalúan el DAI profiláctico en pacientes de alto riesgo tras IAM.
Estudio MADIT (Multicenter Automatic Defibrillator Implantation Trial)
En la era prefibrinolítica se observó que los pacientes con IAM previo, disfunción ventricular y TVNS presentaban una alta mortalidad a los 2 años (en torno a 30%) 8. El estudio MADIT 138 incluyó a 196 pacientes menores de 75 años con IAM previo (3 o más semanas antes), en clase funcional I-III de la NYHA, que cumplían las siguientes condiciones: FEVI 0,35, TVNS asintomática y TV sostenida inducida monomórfica con 1-3 EE y ciclos de 600 y 400 ms o TV con ciclo < 230 ms, TVP o FV con 1-2 EE, no suprimibles tras tratamiento con procainamida. Estos pacientes fueron asignados aleatoriamente a DAI (95 pacientes) o tratamiento convencional (101 pacientes), observándose a los 27 meses una mejoría en la supervivencia del grupo con DAI: 15 muertes (11 cardíacas) en el grupo DAI (15,8%) frente a 39 muertes (27 cardíacas) en el grupo de tratamiento convencional (38,6%) (razón de riesgo = 0,46; intervalo de confianza 0,26-0,82; p = 0,009).
La interpretación y aplicación clínica del estudio MADIT ha sido motivo de controversia 139,140. Una limitación de este estudio es la ausencia de un verdadero grupo control, no pudiendo descartarse un efecto proarrítmico de algunos fármacos. Así, el 11-13% de los pacientes de cada grupo estaban bajo tratamiento con fármacos antiarrítmicos tipo I al mes de incluirse en el estudio, con el consiguiente riesgo de proarritmia y escaso efecto antiarrítmico al no ser la TV suprimible con procainamida 141. También se observan claras diferencias en la proporción de pacientes tratados con amiodarona (el 2% en el grupo DAI frente al 79,5%) o betabloqueantes (el 28% en grupo DAI frente al 8,6%). No obstante, los autores indican que el análisis de regresión de Cox no encontró influencia significativa de los fármacos antiarrítmicos en el riesgo.
Respecto a su aplicación clínica, el número de pacientes que cumplen sus criterios es reducido. Every et al 142, estudiando a 94.797 pacientes incluidos en el registro CAST, encontraron que sólo el 0,3-1,7% cumplían los criterios de inclusión del estudio MADIT. Por tanto, sería preciso estudiar un elevado número de pacientes para encontrar algún paciente MADIT.
Estudio CABG-Patch (Coronary Artery Bypass Graft Patch Trial)
Se incluyeron 900 pacientes 143 menores de 80 años pendientes de cirugía electiva de bypass, con FEVI < 0,36 y alteraciones en el ECG-PS (uno de los siguientes criterios: duración del QRS 114 ms, RMS40 < 20 mV o duración del QRS terminal por debajo de 40 mV > 38 ms). Se asignaron aleatoriamente a implantación de desfibrilador durante la cirugía (446 pacientes) y a un grupo control (454 pacientes). Tras un seguimiento medio de 32 meses, no se encontraron diferencias significativas en la mortalidad entre ambos grupos: 101 muertes (71 cardíacas) en el grupo DAI frente a 95 muertes (72 cardíacas) en el grupo control (razón de riesgo = 1,07; intervalo de confianza 0,81-1,42; p = no significativa). Para este estudio se seleccionaron pacientes de alto riesgo 144: el 83% había presentado un IAM previo, la mitad tenía antecedentes de insuficiencia cardíaca, la FEVI media era 0,27 ± 0,06 y el 55% tenía enfermedad de 3 vasos. De hecho, la mortalidad actuarial a 24 meses era alta (18%), aunque no tanto como en el estudio MADIT (32%).
Comparando la mortalidad global a los 48 días de la cirugía 145, no se encontraron diferencias significativas entre ambos grupos. Tampoco hubo diferencias en el desarrollo de arritmias postoperatorias 146, shock, sangrado o insuficiencia cardíaca, aunque en el grupo DAI fueron más frecuentes las infecciones y la insuficiencia respiratoria.
Bigger et al 147 analizaron los mecanismos de muerte considerando causas arrítmicas y no arrítmicas. Comparando la mortalidad acumulada a 42 meses, la mortalidad arrítmica fue del 4% en el grupo DAI frente al 6,9% en el grupo control (p = 0,057) y la mortalidad no arrítmica, del 13 y del 12,4%, respectivamente (p = 0,275). Los autores concluyen que el DAI reduce la muerte arrítmica en un 45%, sin efecto sobre la muerte no arrítmica. Dado que el 71% de las muertes fueron no arrítmicas, no se redujo significativamente la mortalidad total.
Otros estudios
Existen varios estudios pendientes de realización o publicación. Los más importantes son:
- SCD-HEFT: Sudden Cardiac Death in Heart Failure Trial 148, donde se trata de determinar si la amiodarona o el DAI reducen la mortalidad total en pacientes con enfermedad coronaria o miocardiopatía no isquémica, en clase II o III de la NYHA, con FEVI < 0,36.
- MADIT II: Multicenter Automatic Defibrillator Implantation Trial II 148, en el que se valorará el beneficio profiláctico del DAI en pacientes con enfermedad coronaria y al menos un IAM previo, con FEVI < 0,30.
- Beta-blocker Strategy plus Implantable Cardioverter Defibrillator Trial 149. Se incluyen pacientes con IAM reciente, FEVI 0,35 y una de las siguientes condiciones: 10 o más EV/h, variabilidad reducida o PT. Todos los incluidos deben tolerar al menos 25 mg de metoprolol al día. Este grupo de pacientes se asigna aleatoriamente a tratamiento convencional o EEF. En este caso, si se inducen arritmias, se implanta desfibrilador; en caso contrario, reciben tratamiento convencional.
- MUSTT: Multicenter Unsustained Tachycardia Trial 150. Se incluyen pacientes menores de 80 años con enfermedad coronaria, FEVI 0,40 y TVNS. Se realiza en todos ellos estimulación ventricular programada desde 2 puntos introduciendo 1 a 3 EE. En caso de inducción de TVMS con ciclo > 220 ms o FV (en este caso, con un máximo de 2 EE), se asignan aleatoriamente a no tratamiento o a tratamiento guiado con EEF, incluyendo DAI en ausencia de respuesta a fármacos.
El objetivo principal es la determinación del riesgo de MS en casos de FEVI deprimida, TVNS y arritmias inducibles y la utilidad del tratamiento guiado por EEF en la reducción de mortalidad. Los resultados (pendientes de publicación) indican un riesgo de MS de 32% a los 5 años en la población del estudio, una reducción de muerte arrítmica del 27% en los pacientes del grupo guiado por EEF y, cuando estos pacientes son tratados con DAI, una reducción de muerte arrítmica superior al 50% respecto a los pacientes no tratados con DAI.
En resumen, tras el estudio MADIT, está indicado DAI profiláctico en pacientes con IAM previo, FEVI 0,35, TVNS y TVMS inducible, no suprimible con procainamida. Dicho estudio confirma que se puede identificar a una población de pacientes de alto riesgo arrítmico tras un IAM mediante un EEF realizado a pacientes seleccionados mediante pruebas no invasivas. Los resultados de otros estudios que utilizan un planteamiento similar (pruebas no invasivas seguidas de EEF), actualmente pendientes de finalización, ayudarán a identificar, de forma más precisa, a pacientes de alto riesgo que podrían beneficiarse de un DAI profiláctico 151. AGRADECIMIENTOS
Al Dr. Aureliano Almazán por su contribución en la figura 1 y por sus comentarios sobre el manuscrito. A Medtronic Ibérica TM por la figura 5. A Guidant CPI TM por la figura 6 y por la información sobre el estudio MUSTT.
Los pacientes que han sufrido un infarto agudo de miocardio (IAM) tienen riesgo a largo plazo de morir súbitamente 1, sobre todo por taquiarritmias ventriculares. Aunque en ocasiones la isquemia aislada puede provocar arritmias ventriculares, en general se requiere un sustrato anatómico debido al IAM previo, constituido por células miocárdicas lesionadas con propiedades electrofisiológicas anormales, rodeadas por áreas de cicatriz y que generan zonas de conducción lenta. Sobre dicho sustrato actúan factores desencadenantes y moduladores, que favorecen la aparición de arritmias 2.
Los avances en la terapia del IAM con la introducción de la trombólisis, la angioplastia primaria y el tratamiento con IECA y betabloqueantes han provocado una reducción en la incidencia de muerte súbita (MS) y taquicardias ventriculares (TV) en la evolución posterior. Sin embargo, la MS sigue constituyendo un grave problema. Un 2-4% de pacientes tras IAM presentan MS o son reanimados tras fibrilación ventricular (FV) durante el año siguiente 3,4, siendo más frecuentes estas complicaciones en determinados subgrupos de pacientes. La estratificación de riesgo puede ayudar a identificar estos pacientes.
El objetivo de este artículo es revisar los métodos diagnósticos en la estratificación del riesgo de MS y arritmias ventriculares y los tratamientos más efectivos.
MÉTODOS DIAGNÓSTICOS
Antes de plantearse la estratificación del riesgo arrítmico, debe descartarse tras el IAM la presencia de angina postinfarto, insuficiencia cardíaca u otra complicación. Asimismo, debe completarse la valoración del paciente con ecocardiograma y técnicas de detección de isquemia como ergometría, ecocardiograma de esfuerzo o con dobutamina o estudios de perfusión con isótopos, seguidas de coronariografía si fuera preciso.
En cuanto al riesgo arrítmico tras IAM, quedan muchas dudas pendientes de resolver. Las pruebas diagnósticas (recogidas en la tabla 1)
tienen un alto valor predictivo negativo (VPN), siendo útiles para seleccionar pacientes de bajo riesgo arrítmico. Sin embargo, su valor predictivo positivo (VPP) es bajo, aunque la combinación de varios métodos diagnósticos mejora de forma significativa dicho VPP. Se ha propuesto el empleo de pruebas no invasivas en la selección de pacientes para estudio electrofisiológico (EEF). Cuando se valora iniciar un tratamiento con bajo riesgo de efectos adversos graves (por ejemplo, fármacos betabloqueantes), es importante una prueba con alta sensibilidad (S) que detecte, por tanto, el máximo número de pacientes de riesgo, aunque algunos pacientes tratados puedan obtener un menor beneficio. Por el contrario, si el tratamiento que se plantea resulta caro y no exento de complicaciones serias (por ejemplo, desfibrilador automático), la valoración diagnóstica debe ofrecer un alto VPP dentro de un rango aceptable de S. Se describen, a continuación, las distintas pruebas diagnósticas para la valoración del riesgo arrítmico post-IAM, su significado pronóstico y su aplicación clínica.
DETERMINACIÓN DE LA FUNCIÓN VENTRICULAR
La fracción de eyección ventricular izquierda (FEVI), determinada por ecocardiograma o ventriculografía con contraste o radioisótopos, es un importante predictor de mortalidad cardíaca (en un alto porcentaje, súbita) a largo plazo tras un IAM. Varios estudios publicados en la década de los 80 5-7 demostraron que el riesgo relativo (RR) de muerte, tras un seguimiento de 18-24 meses, era 2,5-3,5 en pacientes con FEVI < 0,40 comparados con pacientes con FEVI mayor. Además, se observó 8 que la relación entre FEVI y mortalidad cardíaca sigue una curva hiperbólica, con aumento brusco de la mortalidad a partir de 0,40. En estudios posteriores 9,10, ya en la era trombolítica, la FEVI mantenía su valor pronóstico, aunque con menores tasas de mortalidad. Así, Gosselink et al 10, analizando a pacientes con IAM tratados con trombólisis o angioplastia primaria, encontraron una mortalidad a los 30 ± 10 meses del 16% si la FEVI era < 0,40 frente al 2% si la FEVI era 0,40.
Cuando la FEVI deprimida se acompaña de signos clínicos y radiológicos de fallo cardíaco congestivo, el pronóstico es significativamente peor. En el estudio de Nicod et al 11, los pacientes con FEVI 0,40 y clínica de insuficiencia cardíaca durante el ingreso presentaron una mortalidad al año del 26%, frente al 12% en casos con la misma FEVI pero sin dicha clínica (p < 0,01). Estas diferencias también se cumplían si la FEVI era 0,41-0,50 o superior a 0,50 (19% frente al 6%; p < 0,01 y 8% frente al 3%; p < 0,02, respectivamente).
La FEVI también es predictor de eventos arrítmicos tras el IAM. De hecho, los pacientes con FEVI severamente deprimida mueren súbitamente en un tercio de los casos 12 y la incidencia de taquiarritmias ventriculares es mayor en dichos pacientes 11. Richards et al 13 observaron un RR de eventos arrítmicos tras IAM de 3,2 (p = 0,05) en pacientes con FEVI 0,40 respecto a casos con FEVI mayor. Por su parte, Pedretti et al 14 encontraron una FEVI < 0,40 en el 79% de pacientes con eventos arrítmicos, frente al 15% en ausencia de dicha complicación (p < 0,0001). Varios autores 13,15,16 han estudiado la S, especificidad (E), VPP y VPN de la FEVI para la detección de eventos arrítmicos, obteniendo cifras de 56-71%, 74-83%, 11-22% y 96-98%, respectivamente. Por tanto, dado el bajo VPP, la FEVI aislada es insuficiente para detectar a pacientes de alto riesgo arrítmico post-IAM, por lo que es necesario combinarla con otras pruebas diagnósticas.
MONITORIZACIÓN HOLTER
En las dos últimas décadas se ha empleado la monitorización Holter para tratar de identificar a pacientes con alto riesgo de MS tras IAM. Con esta técnica se analizan la frecuencia y complejidad de arritmias ventriculares: extrasístoles ventriculares (EV) y taquicardia ventricular no sostenida (TVNS).
Prevalencia de EV y TVNS tras IAM
Maggioni et al 17 observaron en 8.676 pacientes tratados con fibrinólisis 0 EV/h en 36%, 1-10 en el 44% y > 10/h en el 20% de los pacientes. Los episodios de TVNS, en general, son infrecuentes (9% de pacientes las presentaron en un estudio reciente 18). Existen varios factores que influyen en la prevalencia de arritmias ventriculares tras IAM:
1.Tiempo transcurrido tras el IAM: se produce un descenso progresivo en la frecuencia y complejidad de las arritmias en la primera semana después del episodio agudo. Posteriormente, aumenta su prevalencia en las 6 semanas siguientes, con un nuevo descenso a partir de ese momento.
2.Edad del paciente: EV y TVNS son más frecuentes en los pacientes de mayor edad: 0,4 EV/h en menores de 50 años y 4 EV/hora en pacientes entre 75 y 80 años; TV en el 7,3% de pacientes menores de 50 años y en el 15,3% si la edad oscila entre 75 y 80 años 19.
3.Características del IAM: se ha observado una relación entre la prevalencia y complejidad de las arritmias ventriculares y la FEVI 17,20,21. Además, dichas arritmias son más frecuentes en presencia de insuficiencia cardíaca 22, reinfarto de miocardio 22,23 o depresión del segmento ST 21.
4.Tratamiento trombolítico: Theroux et al 24 comprobaron una reducción de las EV/h en pacientes tratados con estreptocinasa o estreptocinasa y angioplastia percutánea comparados con un grupo control no reperfundido, independientemente de la FEVI. Sin embargo, esto no se evidenció en otros estudios 20,21, que relacionan la frecuencia de arritmias ventriculares con la FEVI y no con la permeabilidad de la arteria responsable.
Importancia pronóstica de EV y TVNS
En la era prefibrinolítica, varios estudios 6,8,25-27 demostraron que la EV frecuente y la TVNS se asocian a un incremento de 2 a 3 veces en el riesgo de MS y total tras un IAM. Tras la introducción del tratamiento trombolítico, varios estudios demostraron que la EV frecuente conserva su importancia pronóstica. Así, en el estudio de Maggioni et al 17 los pacientes con > 10 EV/h presentaron, tras 6 meses de seguimiento, una mortalidad cardíaca y súbita del 5,5 y del 2,1%, frente al 2,4 y el 0,7% en el resto de pacientes. En algunos estudios 15,28,29, sin embargo, la EV no tenía valor pronóstico.
En la tabla 2 se recogen algunos de los estudios más importantes en la década de los 90 14,17,28,30-33.
El concepto de arritmia ventricular de alto riesgo varía en los distintos trabajos publicados. Respecto al número de EV/h, la mayoría de autores considera de alto riesgo 10 EV. Otros como Bigger et al 8 y Petretta et al 34 consideran el punto de corte en 3 EV/h, mientras Andresen et al 33 definen EV de alto riesgo a partir de 20/h. Respecto a la morfología de las EV, se han analizado EV multiformes y repetitivas, bigeminismo y fenómenos de R sobre T 22,25,26.
El significado de la TVNS ha cambiado desde la introducción de la fibrinólisis. Como se indicó previamente, en los estudios de la era pretrombolítica, la TVNS era un factor de riesgo independiente de MS y total, incluso más importante que la EV frecuente. En trabajos más recientes se observan resultados contradictorios. En algunos estudios 14,32, la TVNS mantiene su utilidad pronóstica, pero en otros 17,18,20,28,34,35 no fue predictor independiente de mortalidad. Esto pudiera deberse a una modificación del sustrato arrítmico por el tratamiento trombolítico o a una menor frecuencia de TVNS, lo que provoca su menor utilidad como marcador pronóstico.
Dado que la disfunción ventricular izquierda es un importante predictor de mortalidad cardíaca tras IAM y se relaciona con la frecuencia y complejidad de las arritmias ventriculares 17, surge la duda de si las arritmias ventriculares predicen mortalidad independientemente de la disfunción ventricular. La mayoría de estudios 6,8,17,22,25,26 indican que la EV frecuente y la disfunción ventricular son predictores independientes de mortalidad cardíaca súbita y total. La EV frecuente sería, por tanto, marcador de inestabilidad eléctrica y de miocardio capaz de mantener un circuito de reentrada 28.
En la tabla 3 se indica la mortalidad cardíaca total observada por Maggioni et al 17 dependiendo de la presencia o no de disfunción ventricular izquierda y del número de EV/h.
Aplicaciones clínicas
La EV frecuente es, por tanto, predictor de eventos arrítmicos y mortalidad cardíaca en varios estudios, no en todos. El significado de la TVNS en la era trombolítica, sin considerar otros factores, es más dudoso. En general, se recomienda que el estudio Holter se realice previo al alta o entre 1 y 2 semanas después del IAM. Habitualmente se emplean registros de 24 h, aunque algunos autores 36 han defendido registros de 1 h frente a los de 6 y 24 h porque en estos últimos la mejoría de la S es modesta y la E disminuía.
En el análisis deben considerarse la frecuencia de EV y la complejidad de las mismas. Respecto a la frecuencia, cuanto mayor sea el número de EV/h que se defina como punto de corte, mayor será el número de pacientes de alto riesgo que entren en el grupo con menor frecuencia de EV. Esto conduce a una menor S a pesar del mayor VPP. Aunque la mayoría de estudios definen EV frecuente desde 10 EV/h, Statters et al 31, estudiando pacientes tratados o no con fibrinólisis, concluyeron que los puntos de corte más adecuados de frecuencia de EV para conseguir las mejores S y VPP en la predicción de eventos arrítmicos y mortalidad cardíaca eran 25/h en el grupo tratado con fibrinolíticos (S del 50%, VPP del 20-23%) y 10/h en el grupo no tratado (S del 60%, VPP del 12%). Observaron también que el VPP es mayor en los pacientes tratados con trombolíticos que en los no tratados en la mayoría de niveles de S. En cuanto a la complejidad de las arritmias ventriculares, Kostis et al 22 comprobaron un aumento de S, aunque con un descenso de E si se combinaba la frecuencia de EV con algún criterio de complejidad. Así, la S y E de un número de EV 10/h para la predicción de MS eran 25 y 87,7%, respectivamente, mientras que la S y E de un Holter con 10 o más EV/h o con dobletes o TV eran 43,4 y 75,4%. En el estudio de Farrell et al 30, la EV repetitiva tenía para la predicción de MS una S del 54%, una E del 81% y un VPP del 15%, cifras similares a las correspondientes a la EV frecuente.
Por tanto, la S y el el VPP de la monitorización Holter en la predicción de eventos arrítmicos son demasiado bajos. Como en el caso de la FEVI, es necesario combinar los resultados del Holter con otras pruebas diagnósticas.
ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1)
Fig. 1. Electrocardiograma con señal promediada de un individuo sano.
es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 199641:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. AELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRS f > 114 ms, aunque algunos autores 42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRS f con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRS f es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica 43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier 44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados 45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral 46,47 y wavelet analysis48 ).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A>ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRS f > 114 ms, aunque algunos autores 42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRS f con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRS f es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica 43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier 44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados 45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral 46,47 y wavelet analysis48 ).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2. Estos estudios se realizaron en la era prefibrinolítica. Como ya hemos comentado, el uso de fibrinólisis se relaciona con una disminución de prevalencia de PT y de incidencia de eventos arrítmicos en el postinfarto, mayor que la esperable por la porción de miocardio salvado en términos de FEVI. Así, Malik et al62 observaron una reducción en el VPP de los PT en pacientes tratados con trombólisis. Sin embargo, Denes et al56 encuentran que el uso de trombólisis o angioplastia primaria no disminuye la significación pronóstica de los PT en el postinfarto.
El VPP del ECG-PS se incrementa de forma significativa cuando se utiliza en combinación con otras pruebas de valoración del riesgo arrítmico (tabla 4).
La tasa de eventos arrítmicos mayores en un seguimiento a un año de pacientes postinfarto con ECG-PS anormal y FEVI por ventriculografía isotópica < 0,40 fue del 36%, frente al 0% en los pacientes con ambos test negativos ( o> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 199641:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRSf). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. A> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
<> ELECTROCARDIOGRAMA CON SEÑAL PROMEDIADA
Significado fisiopatológico
El electrocardiograma con promediación de señales (ECG-PS) (fig. 1) es una técnica de procesamiento del electrocardiograma (ECG) de superficie que permite registrar señales de baja amplitud y alta frecuencia, como son los potenciales tardíos (PT) 37.
Los PT obtenidos con promediación de señales se corresponden con la actividad fragmentada y retrasada registrada desde la superficie epicárdica y endocárdica 38. Estas señales representan actividad eléctrica lenta y no homogénea producida por grupos de células miocárdicas viables aisladas parcialmente por tejido conectivo. Dicha actividad eléctrica anómala facilita la existencia de circuitos de reentrada; por ello se considera la existencia de PT un marcador de sustrato arrítmico.
Técnicas de medida
Existen diferentes técnicas de análisis de la información electrocardiográfica cuya finalidad es potenciar la detección de potenciales y disminuir el ruido (producido principalmente por la actividad muscular). El método más utilizado de análisis y sobre el que se han realizado estudios pronósticos es la promediación temporal. Para ello se utiliza un sistema ortogonal de derivaciones bipolares 39. . Se obtiene señal electrocardiográfica de un número elevado de latidos (generalmente 200-300 o hasta reducir el ruido a < 5-2 mV) rechazando latidos prematuros, con conducción aberrante o con mucho ruido. El sistema promedia los latidos registrados en cada derivación y los somete a un filtro bidireccional (los más comúnmente usados son de 25-250 y 40-250 Hz). Las señales filtradas son promediadas, obteniéndose el complejo QRS filtrado (QRS f). En los estudios publicados se usan diferentes criterios de anormalidad. No hay un estándar aceptado internacionalmente, pero sí una recomendación del comité conjunto de la Sociedad Europea de Cardiología, la American Heart Association y el American College of Cardiology en 1991 40y del documento de consenso del American College of Cardiology de 1996 41:
- Duración del QRSf > 114 ms, aunque algunos autores42 han obtenido el mejor valor predictivo para una duración igual o superior a 120 ms.
- Valor de los últimos 40 ms del vector magnitud (RMS40) < 20 mV.
- Más de 38 ms de duración de señal final del QRSf con voltaje < 40 mV.
Estos tres criterios se proponen para la utilización de filtros de 40 Hz. Los valores obtenidos se pueden alterar al modificar el filtro utilizado (la duración del QRSf es el criterio que menos se modifica). La desventaja principal de este método es que sólo registra señales repetidas en el tiempo, y no puede detectar cambios latido a latido.
Otros métodos de procesamiento de la señal son:
- Análisis con promediado espacial, que permite registrar variaciones temporales en la señal electrocardiográfica43.
- Análisis de la frecuencia: se basa en la asunción de que los PT tienen diferentes características de frecuencia que los segmentos normales QRS y ST. Esta técnica procesa la señal mediante transformada rápida de Fourier44. Los resultados miden la contribución relativa de diferentes frecuencias a segmentos determinados del ECG (habitualmente porción terminal del QRS y segmento ST, de unos 150 ms). En un artículo reciente se ha comunicado una mejoría significativa del poder predictivo para MS arrítmica del ECG-PS utilizando análisis temporal y de frecuencia combinados45. En los últimos años se han propuesto otros métodos de estudio para tratar de obtener señales anómalas que ocurren durante el QRS normal y no son registradas por el análisis temporal (análisis de turbulencia espectral46,47 y wavelet analysis48).
Potenciales tardíos en el IAM: prevalencia y valor predictivo
La prevalencia de PT en sujetos sanos se estima del 0 al 2%. En pacientes postinfarto sin TV registradas es algo mayor (7-15%), mientras que en los pacientes con TV tras el IAM la prevalencia es del 70 al 92% 49,50. Cifras similares se han apreciado utilizando tanto análisis temporal como de frecuencia. Diversos factores modifican este índice:
- Cambios temporales: los PT pueden apreciarse desde el primer día del infarto y en general demuestran una tendencia creciente hasta estabilizarse en la segunda semana del IAM 51. Según El-Sherif et al 52, los datos aportados por el ECG-PS realizado en los 5 días siguientes al IAM no se relacionaron con los eventos arrítmicos posteriores; sin embargo, sí existía relación si el ECG-PS se registraba entre 6 y 30 días después del IAM. La aparición tardía de PT en un paciente que no los presentara en la fase inicial se ha relacionado con la existencia de nuevos eventos isquémicos y con la localización inferior del IAM 53.
- Localización del IAM: la prevalencia de PT es mayor en el IAM inferior 54.
- Existencia de aneurisma ventricular: los PT son particularmente prevalentes en estos pacientes 55, como es esperable de un marcador de sustrato arrítmico. Se ha demostrado que su presencia tras la aneurismectomía predice la recurrencia de TV.
- Fibrinólisis: la utilización de fibrinólisis disminuye la prevalencia de PT en el postinfarto 56,57 y se relaciona con permeabilidad de la arteria responsable del IAM 58.
La importancia pronóstica del ECG-PS realizado en el primer mes postinfarto ha sido remarcada en varios estudios prospectivos 14,16,59-61. En estos estudios, la prevalencia de PT positivos oscilaba en el conjunto de pacientes postinfarto del 24 al 42% (dependiendo del criterio utilizado, la localización del infarto, el momento del registro y otros factores). Los pacientes con ECG-PS anormal mostraron una incidencia de eventos arrítmicos mayores (TV sostenida o MS) del 17 al 27%, mientras que en pacientes con ECG-PS normal fue del 0,8 al 4%. El estudio de ECG-PS tiene una alta S pero baja E para la predicción de TV y MS arrítmica en el postinfarto. Este hecho y la relativa baja incidencia de estas patologías en la población general de postinfartos hacen que su VPP sea bajo y su VPN muy alto.
Dos aspectos fundamentales pueden modificar la utilidad del ECG-PS en la era actual:
1. Aunque en la bibliografía hay estudios que definen criterios de positividad para PT en presencia de bloqueo de rama o trastornos de conducción intraventriculares, los estudios prospectivos descritos excluyeron a dichos pacientes. El comité de expertos de la ACC no recomienda la utilización del ECG-PS en la valoración del riesgo arrítmico postinfarto en presencia de bloqueo de rama o trastornos de conducción intraventriculares.
2. Estos estudios se realizaron en la era prefibrinolítica. Como ya hemos comentado, el uso de fibrinólisis se relaciona con una disminución de prevalencia de PT y de incidencia de eventos arrítmicos en el postinfarto, mayor que la esperable por la porción de miocardio salvado en términos de FEVI. Así, Malik et al62 observaron una reducción en el VPP de los PT en pacientes tratados con trombólisis. Sin embargo, Denes et al56 encuentran que el uso de trombólisis o angioplastia primaria no disminuye la significación pronóstica de los PT en el postinfarto.
El VPP del ECG-PS se incrementa de forma significativa cuando se utiliza en combinación con otras pruebas de valoración del riesgo arrítmico (tabla 4). La tasa de eventos arrítmicos mayores en un seguimiento a un año de pacientes postinfarto con ECG-PS anormal y FEVI por ventriculografía isotópica < 0,40 fue del 36%, frente al 0% en los pacientes con ambos test negativos (odds ratio = 30)60. En un segundo estudio59, con seguimiento medio de 14 meses, la probabilidad de eventos arrítmicos siendo ambos test positivos fue del 34%. Utilizado de forma combinada con el Holter para detección de EV de alto grado y TVNS también mejora su capacidad pronóstica63. En el estudio de Farrell et al30, la combinación de la presencia de PT y de una variabilidad de la frecuencia cardíaca (VFC) reducida tenía una S del 58% con un VPP del 33% y fue superior a cualquier otra combinación de pruebas no invasivas, incluyendo FEVI, ECG de esfuerzo y ectopia ventricular.
MEDIDAS DE LA ACTIVIDAD DEL SISTEMA NERVIOSO AUTÓNOMO: VARIABILIDAD DE LA FRECUENCIA CARDÍACA Y SENSIBILIDAD BARORREFLEJA
En la actualidad, el papel que desempeña el sistema nervioso autónomo en la mortalidad cardíaca súbita es bien reconocido. Las alteraciones en el balance simpático-parasimpático, con un predominio del primero respecto al segundo, han sido claramente relacionadas con un aumento del riesgo para el desarrollo de arritmias ventriculares malignas 64-66. El demostrado efecto protector de los fármacos betabloqueantes en pacientes con cardiopatía estructural severa viene a reforzar dicha hipótesis.
De lo expuesto anteriormente se deduce el enorme interés que han suscitado diversas técnicas de medición de la actividad nerviosa autónoma en cuanto a su potencial clínico para la predicción de la muerte cardíaca súbita, entre las que cabe destacar la medición de la variabilidad de la frecuencia cardíaca y de la sensibilidad barorrefleja (SBR).
Variabilidad de la frecuencia cardíaca
En individuos normales, la frecuencia cardíaca viene determinada por el nodo sinusal, cuya frecuencia intrínseca de descarga es de 100 a 120 lat/min. Dicha estructura recibe una rica inervación por parte del sistema nervioso autónomo, que regula su frecuencia de descarga, de manera que la frecuencia cardíaca final es el resultado del efecto neto de la actividad eferente parasimpática o vagal, que tiende a enlentecerla, y de la simpática, que tiende a aumentarla. En condiciones de reposo, ambas están presentes de forma tónica, con predominio de la actividad vagal. Con el ejercicio y otras condiciones de estrés fisiológico, la actividad vagal disminuye, mientras que la simpática aumenta y, con ella, la frecuencia cardíaca. Por tanto, las variaciones de la frecuencia cardíaca a lo largo del día son consecuencia de las fluctuaciones en el tono autonómico, determinadas por la influencia de multitud de factores en los centros simpáticos y parasimpáticos del sistema nervioso autónomo como la respiración, el control vasomotor, los reflejos barorreceptores y quimiorreceptores, los procesos de termorregulación, el sistema renina-angiotensina, el ejercicio y el estrés psicológico-emocional.
La disponibilidad actual de equipos comerciales de análisis de registros Holter que llevan incorporados análisis automatizados de la VFC ha facilitado la obtención de este tipo de medidas para la realización de estudios clínicos y de investigación. Sin embargo, el significado y la interpretación de las múltiples y diferentes medidas de VFC es más complejo de lo que habitualmente se considera y una utilización inadecuada de las mismas puede llevar a conclusiones incorrectas y completamente infundadas. A este respecto, el grupo de expertos de la ESC (European Society of Cardiology) y de la NASPE (North American Society of Pacing and Electrophisiology) publicó en 1996 una serie de normas y recomendaciones que tienen como objetivo estandarizar los métodos de análisis de la VFC, así como su interpretación fisiopatológica y su aplicación clínica 67.
Hay dos formas fundamentales de analizar la VFC: en el dominio del tiempo y en el dominio de la frecuencia. La primera se basa en el análisis de los intervalos RR o ciclos cardíacos, mientras que la segunda analiza los ritmos intrínsecos de la señal de frecuencia cardíaca mediante la descomposición de la misma en sus componentes de frecuencia fundamentales. En las tablas 5 y 6 se recogen las medidas más utilizadas en cada método de análisis. La figura 2 muestra la forma de calcular el índice triangular, una medida geométrica basada en el histograma de intervalos RR.
Fig. 2. Cálculo del índice triangular de variabilidad (HRV index): en primer lugar, debe construirse la función de distribución de los intervalos RR, que asigna a cada valor de longitud de RR el número de intervalos observados que tienen dicha duración. La longitud de intervalo más frecuente (X) corresponde al valor máximo de la función de distribución (Y). El índice triangular se calcula dividiendo el área integral de la función de distribución por el máximo Y. Cuando la función de distribución es construida con una escala discreta en el eje horizontal (habitualmente usando una frecuencia de muestreo de 1/128 ms), el índice triangular se calcula dividiendo el número total de todos los intervalos RR por el máximo Y.
Dentro del grupo de medidas basadas en el dominio del tiempo, muchas están fuertemente correlacionadas, de manera que ofrecen información redundante. Por ello, el grupo de expertos de la ESC-NASPE ha recomendado el uso de cuatro de ellas: la SDNN y el índice triangular para estimar la variabilidad promedio o global, la SDANN para estimar la variabilidad a largo plazo y la rMSSD para estimar la variabilidad a corto plazo.
El análisis en el dominio de la frecuencia se basa en la descomposición de la señal de frecuencia cardíaca en sus componentes de frecuencia más relevantes, midiendo su intensidad relativa o potencia (fig. 3).
Fig. 3. Análisis espectral de la señal de frecuencia cardíaca. ULF: banda de ultrabaja frecuencia. VLF: banda de muy baja frecuencia. LF: banda de baja frecuencia. HF: banda de alta frecuencia. Log PSD: logaritmo de la densidad de potencia espectral.
Esto se realiza mediante métodos no paramétricos (FFT: algoritmo de la transformada rápida de Fourier) o paramétricos (AR: modelo autorregresivo). Estos métodos proporcionan una información fisiológica más detallada, pero son más difíciles de interpretar y más sensibles a los errores de medición y la calidad del registro. Cuando se analiza el espectro de potencia mediante estos métodos, pueden definirse 2 bandas de frecuencia características, con diferentes significados fisiológicos (fig. 3):
- Banda de alta frecuencia: centrada alrededor de la frecuencia respiratoria (usualmente entre 0,2 y 0,4 Hz en adultos) y relacionada con las fluctuaciones de la actividad parasimpática o vagal asociada a la respiración.
- Banda de baja frecuencia (0,04 a 0,2 Hz): peor definida y atribuida a los procesos termorreguladores, actividad vasomotora periférica y al sistema renina-angiotensina. Esta banda está modulada por ambos sistemas, simpático y parasimpático, aunque con predominio del primero. De hecho, el cociente entre la potencia de baja frecuencia y la de alta frecuencia se considera como una medida del balance simpático vagal.
- Además de las descritas, también pueden identificarse bandas de muy baja frecuencia (0,01 a 0,04 Hz) y de ultrabaja frecuencia (10 -5 a 10 -2 Hz), esta última en registros a largo plazo (de 24 h), cuyo significado fisiológico es poco conocido.
La presencia de una VFC disminuida se correlaciona con la existencia de un balance alterado en el sistema nervioso autónomo, con predominio de la actividad simpática respecto de la parasimpática. Diversos estudios publicados hasta la fecha han demostrado que una baja VFC es un potente predictor de la mortalidad por todas las causas, tanto en pacientes con un infarto previo 30,68-73 como en pacientes con miocardiopatía dilatada 74,75 y otras patologías extracardíacas 76-78. En pacientes con un infarto reciente, la disminución en los índices de la VFC es un predictor más potente que otras variables como la FEVI, la frecuencia y complejidad de la EV, los índices electrocardiográficos y ergométricos, y el hallazgo de PT en el ECG-PS 30 (ta-bla 7). Además de ser un predictor para la mortalidad global, la VFC disminuida también se ha confirmado en estos estudios como un potente predictor de FV y MS en pacientes que han sufrido un IAM. Aunque las medidas en el dominio del tiempo han sido las más estudiadas, el valor predictivo de la VFC también ha sido demostrado para las medidas en el dominio de frecuencia, siendo la potencia total, la potencia de muy baja frecuencia y la de ultrabaja frecuencia las que han demostrado una relación significativa con la mortalidad global 69,79. Además, la potencia de muy baja frecuencia parece relacionarse de una forma más estrecha con la muerte arrítmica 69.
Aunque la VFC disminuida es un potente predictor de MS independiente de otros marcadores de riesgo no invasivos, su VPP cuando es considerada por sí sola resulta todavía bastante modesto (próximo al 30%). Sin embargo, varios estudios 30,69,72,80 han demostrado una mejoría significativa en el VPP cuando se utiliza de forma combinada con otros predictores como la FEVI, los PT y la ectopia ventricular, llegando a alcanzar valores entre el 35 y el 50%. Por otro lado, la preselección de pacientes de alto riesgo utilizando la información combinada de los marcadores no invasivos puede mejorar de forma significativa la capacidad del EEF invasivo para identificar a los pacientes con un alto riesgo de muerte arrítmica 14.
En resumen, la disminución de la VFC es un predictor independiente de mortalidad cardíaca global y súbita en pacientes con infarto previo. Existe un consenso general en que la medición de la VFC debería hacerse una semana después del episodio de IAM 67. Aunque las medidas de VFC basadas en registros a corto plazo han demostrado ser útiles 68, el mayor poder predictivo corresponde a las mediciones sobre registros de 24 h. Diferentes medidas de la VFC basadas en el dominio del tiempo y de la frecuencia han demostrado ser útiles, pero ninguna de ellas parece proporcionar una información pronóstica mejor que la ofrecida por la SDNN y el índice triangular, que estiman la variabilidad promedio. Aunque los puntos de corte no han sido claramente establecidos, sobre la base de los estudios publicados puede considerarse que una SDNN < 50 ms o un índice triangular inferior a 15 identifican al grupo de pacientes con VFC severamente reducida, y valores de SDNN entre 50 y 100 ms o del índice triangular entre 15 y 20 identifican a un subgrupo con VFC moderadamente reducida. El valor predictivo de la VFC por sí solo es modesto, pero puede mejorar significativamente cuando se combina con otros marcadores no invasivos. Sin embargo, el conjunto de marcadores no invasivos a utilizar, así como los puntos de corte más óptimos para conseguir la máxima capacidad predictiva, están aún por definir.
Sensibilidad barorrefleja
Otra forma de estudiar la actividad del sistema nervioso autónomo consiste en valorar el efecto sobre la frecuencia cardíaca de la estimulación de los barorreceptores arteriales. Para ello se han utilizado tres técnicas diferentes: a) elevación de la presión arterial mediante agentes vasoconstrictores como la fenilefrina para examinar el tono vagal reflejo; b) disminución de la presión arterial con agentes vasodilatadores como el nitroprusiato para examinar el tono reflejo simpático, y c) estimulación directa de los barorreceptores carotídeos mediante succión en el cuello. De ellas, la más empleada en los diversos estudios ha sido la infusión de fenilefrina con representación de los cambios del intervalo RR en función de los cambios en la presión arterial, utilizándose la pendiente de la recta de regresión correspondiente como una medida de la actividad vagal refleja.
La SBR está disminuida en pacientes que han sufrido un IAM, y una disminución severa de la misma es capaz de identificar a un subgrupo de pacientes con alto riesgo de eventos arrítmicos 81-84. Farrell et al 81 encontraron que la SBR estaba significativamente disminuida en pacientes que presentaban taquicardia ventricular monomórfica sostenida (TVMS) después de un IAM que era inducible en el EEF. Los autores concluyeron que la realización de un EEF podía ser limitada únicamente a pacientes con un IAM que presentan una SBR disminuida sin pérdida de su valor predictivo. En un estudio de seguimiento durante 1 año, 122 pacientes con un IAM y SBR disminuida tenían un RR de eventos arrítmicos de 23,1 82.
Dado que el reflejo barorreceptor es un componente importante en la modulación de la frecuencia cardíaca, varios estudios han investigado la correlación entre las medidas de SBR y de VFC. Bigger et al encontraron una correlación positiva, aunque débil (0,57 a 0,63) 85. Sin embargo, Farrell et al 81 no encontraron correlación significativa entre ambos tipos de medidas de la actividad del sistema nervioso autónomo. Esto sugiere que la SBR y la VFC miden aspectos distintos de la actividad autonómica. La primera expresa la actividad fásica o barorrefleja y la segunda mide la actividad autonómica de una forma más global, incluyendo la actividad fásica o refleja y las influencias tónicas. El estudio ATRAMI 84, de carácter multicéntrico, incluyó a 1.284 pacientes con un infarto reciente para estudiar el posible valor pronóstico adicional de la SBR frente a la VFC. La presencia de una SBR disminuida (pendiente de la recta de regresión RR frente a presión arterial inferior a 3 ms/mmHg) se asociaba a un riesgo aumentado de mortalidad cardíaca global, de forma independiente a la VFC, cuya disminución (SDNN < 70 ms) también estaba asociada a una mayor mortalidad (riesgos relativos 2,8 y 3,2, respectivamente). Además, la combinación de una SBR y una VFC disminuidas ofrecía un valor pronóstico adicional (RR = 8,5). La asociación de una FEVI inferior a 0,35 con una SBR disminuida se asociaba a un RR de 8,7 y con una VFC baja de 6,7. La conclusión de dicho estudio fue que el examen de los reflejos vagales barorreceptores en pacientes con un infarto reciente aporta una información pronóstica independiente de la FEVI y adicional a la ofrecida por las medidas de la VFC.
ESTUDIO ELECTROFISIOLÓGICO. ESTIMULACIÓN VENTRICULAR
El objetivo de esta técnica es valorar la presencia o no de arritmias ventriculares inducibles mediante la estimulación del tejido miocárdico con catéteres-electrodo introducidos percutáneamente (fig. 4).
Fig. 4. Inducción de una TV mediante estimulación ventricular. La taquicardia es inducida mediante estimulación en el ventrículo derecho con un tren de 8 latidos seguido de 2 extraestímulos con intervalos de acoplamiento progresivamente más cortos.
Desde el ápex y el tracto de salida de ventrículo derecho se realiza estimulación con trenes a distintas frecuencias (600 y 400 ms, por ejemplo), introduciendo extraestímulos (EE) con intervalos de acoplamiento progresivamente menores. Si existen áreas de conducción lenta en el corazón, los EE introducidos durante el EEF provocan un mayor enlentecimiento de la conducción y bloqueo unidireccional, condiciones que conducen al inicio y mantenimiento de TV sostenida. Por tanto, el EEF informa de la presencia o no de un sustrato reentrante que, bajo la influencia de factores desencadenantes y moduladores, puede dar lugar a TV.
Prevalencia de arritmias inducibles
Depende de los siguientes factores:
1. Protocolo de estimulación. La probabilidad de inducir arritmias ventriculares es mayor si se estimula desde más de un punto 86 y con varios EE. Richards et al 13 comprobaron que la mayor S y VPP se conseguían al emplear 1 a 3 EE con pulsos al doble del umbral diastólico.
2. Tiempo transcurrido desde IAM. Comparando EEF realizados 2 días consecutivos, se ha observado que la reproducibilidad de la TV sostenida inducida de ciclo superior a 240 ms es alta (cercano a 100%). No sucede lo mismo con la FV inducida o la TV con ciclo menor de 240 ms (reproducibilidad del 44%) 87. Sin embargo, sí se observaron variaciones en la inducibilidad de TV cuando el intervalo temporal es mayor 88-90. Por tanto, el momento en que se realice el EEF influirá en las arritmias ventriculares sostenidas inducibles.
3. FEVI. Si es superior a 0,40, la inducibilidad de TV es baja (5-11%) 61,91, mientras que si es menor de 0,40, se inducen TV en 50-52%. Asimismo, la presencia de aneurisma ventricular izquierdo favorece la inducibilidad de arritmias ventriculares 92.
4. Características del IAM. La inducibilidad de arritmias es mayor en enfermedad multivaso y en IAM complicado con insuficiencia cardíaca o con arritmias ventriculares en las primeras 48 h, si bien la capacidad de discriminación de estos datos (aunque significativa) es modesta 93.
5. Tratamiento trombolítico. Algunos autores 94-96 han encontrado una menor inducibilidad de arritmias ventriculares en pacientes tratados con trombolíticos, sugiriendo que la reperfusión precoz reduce el sustrato arritmogénico al disminuir el tamaño del IAM. En cambio, McComb et al 97 no observaron diferencias en la permeabilidad de la arteria responsable del IAM en pacientes con TV inducible y sin ella.
6. Arritmias en estudio Holter. La inducción de TV es más frecuente en pacientes con EV frecuente 92. Asimismo, en casos de TVNS se induce TVMS en 40-50%, aunque las características electrocardiográficas de las TVNS espontáneas no predicen qué pacientes con enfermedad coronaria tendrán TV sostenida inducible 98.
Valor pronóstico de la estimulación ventricular
Analizando los distintos estudios se observan resultados contradictorios. Esto se debe al reducido tamaño de la muestra en cada estudio, los distintos protocolos de estimulación empleados, el tipo de pacientes incluidos, los diferentes períodos de seguimiento y el tratamiento no aleatorio con fármacos antiarrítmicos en algunos casos.
Los posibles resultados de la estimulación ventricular tras IAM son: no arritmias inducibles, TVNS, TVMS y FV. No todas las arritmias inducidas tienen importancia clínica. Los pacientes sin arritmias inducibles o con TVNS inducible tienen un riesgo bajo de eventos arrítmicos. Respecto a la FV, carece de significado pronóstico adverso a largo plazo 16,61,99,100. Así, Bourke et al 100 encontraron la misma incidencia de TV espontánea o MS tras 1 año de seguimiento en pacientes postinfarto con FV inducible y sin arritmias inducibles (0,6%). La mayoría de estudios concluyen que la inducción de TVMS con frecuencia menor de 270 lat/min en EEF realizado en el primer mes tras IAM es factor predictivo de eventos arrítmicos posteriores, aunque con alto número de falsos positivos 13,16,61,99. Por ejemplo, Richards et al 13 comprobaron que la TV inducida era el mejor predictor de MS o TV espontánea, con un riesgo de eventos arrítmicos 15,2 veces mayor que la ausencia de inducibilidad de TV. En este trabajo calcularon que de 1.000 pacientes sometidos a EEF, 39 tendrán eventos arrítmicos durante el primer año. El EEF identificará como de riesgo a 73 pacientes, 22 de los cuales presentarán eventos, mientras que será negativo en 927, de los cuales 17 tendrán eventos arrítmicos.
En la tabla 8 se resume el valor pronóstico de la estimulación ventricular en 4 estudios 13,16,92,99. Otros autores 89,94, sin embargo, observan escasa correlación entre arritmias inducibles tras IAM y episodios arrítmicos durante el seguimiento.
Dado que se trata de una prueba invasiva y con bajo VPP en la mayoría de trabajos, no está justificada la realización de EEF para estratificación de riesgo post-IAM sin tener en cuenta datos clínicos o el resultado de pruebas no invasivas. De hecho, aunque el EEF aislado tiene un VPN alto (por tanto, identifica a pacientes de bajo riesgo arrítmico), una combinación de pruebas no invasivas consigue VPN similares. Además, Cripps et al 16 demostraron que una combinación de pruebas no invasivas (PT, EV frecuente) con datos clínicos tenía S y VPP comparables a los obtenidos con EEF.
Combinación del EEF con pruebas no invasivas
Para mejorar el VPP se han seleccionado pacientes para EEF siguiendo criterios clínicos o resultados de pruebas no invasivas. Varios autores 101-103 han estudiado el valor pronóstico de la estimulación programada en casos de enfermedad coronaria y TVNS. Se conseguía inducción de TVMS en el 40-50% de los pacientes. Observaron una baja incidencia de eventos arrítmicos en ausencia de arritmia inducible y en casos de arritmia inducible suprimible con fármacos 103. Por el contrario, los pacientes con TV inducible no suprimible, que fueron dados de alta con tratamiento antiarrítmico empírico, tuvieron un mayor número de arritmias en el seguimiento, si bien no puede descartarse efecto proarrítmico de los fármacos.
Por su parte, Iesaka et al 92 y Richards et al 13 analizaron la capacidad predictiva de fenómenos arrítmicos si se combinaban EEF y FEVI deprimida. Se observó un mayor VPP de la combinación respecto al EEF aislado (el 46-50 frente al 30-36%).
Pedretti et al 14 proponen seleccionar para EEF pacientes que cumplan 2 o más de los siguientes criterios: FEVI menor de 0,40, duración del QRSf 106 ms y 2 o más rachas de TVNS. Con dichos criterios se identifican pacientes de riesgo con un VPP del 44% y un VPN del 99%.
En otros estudios 33,104-106, recogidos en la tabla 9, se han seleccionado pacientes para EEF combinando datos clínicos, FEVI deprimida, presencia de PT y arritmias ventriculares complejas en el Holter.
Bhandari et al 107, estudiando a pacientes con IAM Killip II o mayor y angina moderada o severa o TVNS (excluyendo insuficiencia cardíaca de difícil control o necesidad de revascularización), obtuvieron para la predicción de eventos arrítmicos con EEF un VPP > 30% y un VPN del 93%, siendo especialmente útil en IAM Killip III o IV. A pesar del alto VPN, se ha observado 108, no obstante, que un EEF negativo en pacientes con IAM previo y TVNS no implica necesariamente buen pronóstico si se asocian FEVI severamente deprimida y antecedentes de insuficiencia cardíaca congestiva.
Recientemente, Andresen et al 33 han comprobado que el uso combinado de pruebas no invasivas (ecocardiograma y Holter) y EEF identifica un grupo de pacientes con alto riesgo de eventos arrítmicos (el 18,2% tras 37 meses de seguimiento) tras IAM: FEVI 0,40 o > 20 EV/h o 10 dobletes/día o TV y TVMS inducible. No se analizó en estos trabajos el posible efecto beneficioso de un desfibrilador implantable. A este respecto, los estudios MADIT, CABG-Patch y otros se revisan en el apartado «Desfibrilador automático implantable profiláctico».
TRATAMIENTO PARA LA PREVENCIÓN DE MUERTE SÚBITA
Para prevenir a largo plazo la MS tras un IAM es fundamental actuar sobre los factores de riesgo cardiovascular del paciente, disminuyendo la progresión de la arteriosclerosis y el riesgo de trombosis coronaria. Además, deben tratarse, si las hubiera, la isquemia, mediante tratamiento médico o revascularización percutánea o quirúrgica según los casos, y la insuficiencia cardíaca y disfunción ventricular. Unido a estas medidas generales, se ha estudiado el papel de los fármacos antiarrítmicos y del desfibrilador automático en la prevención de MS tras IAM en pacientes de riesgo.
TRATAMIENTO FARMACOLÓGICO
Los estudios CAST 109 y SWORD 110 demostraron un aumento de mortalidad después del IAM tras tratamiento con fármacos I-C de la EV frecuente en el primero y con D-sotalol de pacientes con disfunción ventricular en el segundo estudio. Por ello, debe evitarse el uso de dichos fármacos en estos pacientes. Otros investigadores han analizado la utilidad de la amiodarona y de los betabloqueantes en los pacientes con alto riesgo arrítmico tras IAM, con los resultados que se exponen a continuación.
Amiodarona en la prevención de MS tras infarto
A principios de los años 90 se publicaron los estudios BASIS, PAT y SSSD. El estudio BASIS (Basel Antiarrhythmic Study of Infarct Survival) 111 incluyó a 312 pacientes menores de 71 años que presentaron durante la fase hospitalaria del IAM arritmias grado 3 o 4b de Lown. Fueron asignados aleatoriamente a fármacos antiarrítmicos clase I (guiados por EEF), amiodarona o ningún tratamiento antiarrítmico. Al año de seguimiento se observó una mortalidad global del 5% en el grupo con amiodarona frente a 13% en pacientes sin medicación antiarrítmica (p = 0,024). Sin embargo, este estudio presenta varias limitaciones: el tamaño de la muestra es reducido y no se trata de un estudio doble ciego ni controlado con placebo. Además, es llamativa la elevada mortalidad de los pacientes del grupo control con FEVI conservada (9%). En el estudio PAT (Polish Arrhythmia trial) 112 se estudiaron 613 pacientes menores de 75 años con infarto reciente y contraindicaciones para tratamiento betabloqueante, que fueron tratados con amiodarona o placebo. Aunque la mortalidad cardíaca fue menor en el grupo con amiodarona (el 6,2 frente al 10,7%; p = 0,048), no se encontraron diferencias estadísticamente significativas en la mortalidad global (el 6,9 frente al 10,7%; p = 0,095). Respecto al estudio SSSD (Spanish Study of Sudden Death) 113, 368 pacientes con FEVI 0,20-0,45 tras IAM y Holter con EV 3/h, dobletes o TVNS fueron asignados aleatoriamente a amiodarona, metoprolol o ningún tratamiento antiarrítmico. No hubo diferencias significativas en la mortalidad total entre los pacientes tratados con amiodarona y los que no recibieron ningún tratamiento (el 3,5 frente al 7,7%; p = 0,19).
En 1997 se publicaron los estudios EMIAT y CAMIAT, ambos aleatorizados, doble ciego y controlados con placebo, de tamaño muestral medio (tabla 10).
En el estudio EMIAT (European Myocardial Infarct Amiodarone Trial) 114 se incluyeron 1.486 pacientes entre 18 y 75 años, con IAM previo y FEVI (determinada a los 5-21 días del IAM) 0,40, asignándose 743 a cada grupo de tratamiento (placebo y amiodarona). Tras un seguimiento medio de 21 meses, en un análisis por intención de tratamiento, no se observaron diferencias significativas en la mortalidad total (objetivo principal del estudio): 13,86% en el grupo con amiodarona y 13,73% en el grupo control, p = ns, independientemente del grado de depresión de la FEVI ( 0,30 o 0,30-0,40). Tampoco se observaron diferencias en la mortalidad cardíaca total. Sin embargo, sí se observó una reducción del 35% (IC del 95%: 0-58; p = 0,05) en la mortalidad arrítmica, así como una reducción del 32% (IC 95%: 0-54, p = 0,05) en la combinación de muerte arrítmica y parada cardíaca reanimada. También se realizó un análisis de eficacia (por tratamiento recibido) con las mismas conclusiones, si bien la reducción en mortalidad por arritmias fue más marcado en este caso. Respecto a la suspensión del tratamiento, se produjo en el 38,5% de pacientes tratados con amiodarona y en el 21,4% del grupo placebo. En el 5,9% de los primeros, las causas fueron alteraciones endocrinas y en el 3,2%, alteraciones en la frecuencia y ritmo cardíacos.
En el estudio CAMIAT (Canadian Amiodarone Myocardial Infarction Arrhythmia Trial) 115 se analizaron pacientes mayores de 19 años con IAM 6-45 días antes y Holter con EV frecuente ( 10/h) y/o repetitiva ( 3 latidos a 100-120/min o 3-10 latidos a más de 120/min). Mil doscientos dos pacientes fueron asignados aleatoriamente a tratamiento con amiodarona (606 pacientes) o con placebo (596 pacientes). En la monitorización Holter, el 60,4% presentaban sólo EV frecuente, el 20% sólo EV repetitiva y el 18,6% ambas. Tras un seguimiento medio de 1,79 años, no se observaron diferencias significativas en la mortalidad global, cardíaca y arrítmica entre ambos grupos y sí en la combinación de muerte arrítmica y FV reanimada (objetivo principal del estudio): analizando intención de tratamiento, tasa media anual de 2,29% en el grupo tratado con amiodarona frente al 3,71% en los tratados con placebo (p = 0,029) y, considerando análisis de eficacia, el 1,77 y el 3,38%, respectivamente (p = 0,016). Al igual que en el estudio EMIAT, se analizó la suspensión del tratamiento, que se produjo en el 36,4% del grupo con amiodarona y en el 25,5% de pacientes tratados con placebo, sobre todo por efectos secundarios (el 26,1 y el 13,7%, respectivamente).
En resumen, considerando en conjunto estos estudios, especialmente EMIAT y CAMIAT, la amiodarona no mejora la supervivencia global en los pacientes analizados. Por tanto, no está indicado el uso sistemático de amiodarona en la prevención de MS tras IAM.
Algunos autores han estudiado en estos trabajos a subgrupos de pacientes. No obstante, estos análisis deben interpretarse con cautela dado que con frecuencia son posteriores al diseño del estudio. Además, se han observado resultados contradictorios. Así, en los estudios BASIS 111 y PAT 112,116, la amiodarona sólo reducía significativamente la mortalidad en pacientes con FEVI 0,40. Por el contrario, en un subestudio del EMIAT 117, la mortalidad global se reducía bajo tratamiento con amiodarona si FEVI < 0,30. Lamentablemente, en el estudio CAMIAT no se analizó la FEVI.
Otro subgrupo que ha sido objeto de análisis es el formado por pacientes con betabloqueantes. En el estudio EMIAT, los pacientes bajo tratamiento betabloqueante (el 44,28% del total) presentaron un notable descenso en la mortalidad cardíaca y arrítmica si recibían también amiodarona. Los investigadores del estudio CAMIAT sólo analizaron el porcentaje de pacientes con betabloqueantes al inicio del estudio y no durante el seguimiento, por lo que, como indican algunos autores 118, no se pueden extraer conclusiones de los efectos del tratamiento combinado a largo pla-zo. Recientemente 119, combinando datos de EMIAT y CAMIAT, se comprobó un menor riesgo de muerte cardíaca y arrítmica en los pacientes con ambos tratamientos al inicio del estudio comparados con aquellos sin betabloqueantes, independientemente de si recibían o no amiodarona. Estos autores recomiendan mantener los betabloqueantes cuando se inicia tratamiento con amiodarona. Sin embargo, se requieren estudios prospectivos para conocer el efecto de la combinación a largo plazo sobre la mortalidad.
Betabloqueantes y prevención de MS tras infarto
El uso de fármacos betabloqueantes en pacientes que han sufrido un IAM se asocia con una reducción de la mortalidad global, tanto durante la fase aguda como en su administración a largo plazo. Durante la fase aguda, los beneficios clínicos de la utilización de fármacos betabloqueantes han sido analizados en al menos 33 estudios comparativos con placebo 120. La administración al ingreso de una dosis intravenosa de betabloqueantes, seguida de su administración por vía oral, ha demostrado los siguientes beneficios clínicos 121,122:
- Disminución de la intensidad y duración del dolor.
- Reducción del área de infarto.
- Disminución de la incidencia de arritmias graves.
- Disminución del número de reinfartos y de la incidencia de rotura cardíaca.
- Reducción de la mortalidad a corto y largo plazo.
Un metaanálisis de 27 ensayos aleatorizados 123, con cerca de 27.000 pacientes incluidos, demostró que la administración de betabloqueantes durante la fase aguda de un infarto de miocardio se asociaba a una reducción significativa de la mortalidad global (13%; p < 0,02), del riesgo de reinfarto no fatal y de la incidencia de parada cardíaca intrahospitalaria. En el estudio ISIS-1 121, el mayor beneficio se concentra en los dos primeros días y parece debido, fundamentalmente, a una reducción de la rotura cardíaca.
La administración a largo plazo de fármacos betabloqueantes en pacientes que han sufrido un IAM, también ha sido valorada en varios estudios. Un meta-análisis de 25 ensayos aleatorizados, con más de 23.000 pacientes incluidos 123, encontró una reducción del 22% en la mortalidad cardíaca global, del 32% en el riesgo de MS y del 27% en la incidencia de reinfarto no fatal. El estudio Beta-Blocker Pooling Project (BBPP) 124 analizó los resultados de nueve ensayos aleatorizados, con un total de 13.679 pacientes. La mortalidad global se redujo en un 24% (p < 0,0001) en los enfermos tratados con betabloqueantes. Posteriormente, un metaanálisis de los cinco estudios realizados con metoprolol 125, con 5.474 pacientes, comprobó una reducción significativa del 19% en la mortalidad global y del 42% en la mortalidad súbita. Más recientemente, Gottlieb et al 126, en un registro de 201.752 pacientes con un IAM, encontraron una reducción significativa de la mortalidad global en todos los subgrupos de pacientes tratados con betabloqueantes (reducción entre el 28 y el 40%). No se analizó de forma específica la mortalidad súbita.
En resumen, los betabloqueantes han sido ensayados en pacientes que han sufrido un IAM, demostrando que son capaces de lograr una reducción de la mortalidad cardíaca global y de la MS cuando son administrados tanto en la fase aguda como a largo plazo. El beneficio parece ser la consecuencia de un efecto de grupo y ha sido constatado tanto para los cardioselectivos (atenolol 121, metoprolol 122,125,127-129, bisoprolol 130) como para los no selectivos (propanolol 131, timolol 132, carvedilol 133). Únicamente se tienen dudas acerca de los agentes betabloqueantes con actividad simpaticomimética intrínseca (pindolol, oxprenolol) que no han demostrado buenos resultados e incluso podrían ser perjudiciales 134. Sólo el acebutolol, que tiene una ASI modesta, ha demostrado un claro efecto beneficioso 135. En cuanto al sotalol, un fármaco betabloqueante con propiedades antiarrítmicas de clase III, no ha demostrado beneficio, lo que se atribuye a sus propiedades proarrítmicas. De hecho, el d-sotalol, con actividad principalmente antiarrítmica, se asoció con un aumento de la mortalidad en el estudio SWORD 110.
La mayoría de los estudios previos han valorado el efecto beneficioso de los fármacos betabloqueantes en la población general de pacientes con un IAM. Los análisis por subgrupos de algunos de dichos estudios han puesto de manifiesto que el beneficio clínico de los betabloqueantes se extiende a todos los subgrupos, independientemente de la edad, sexo, localización del infarto, FEVI y otras variables 124,126,132. Sin embargo, para un beneficio relativo similar, las poblaciones de mayor riesgo (mayor edad, arritmias ventriculares, historia de insuficiencia cardíaca, FEVI deprimida, etc.) obtendrían un beneficio absoluto de mayor cuantía. Al respecto, tres grandes estudios aleatorizados han valorado el efecto beneficioso de los betabloqueantes en pacientes con fallo cardíaco crónico y FEVI deprimida, de etiología isquémica o no isquémica. El estudio del carvedilol 133 incluyó a 1.094 pacientes con insuficiencia cardíaca crónica (el 47% de etiología isquémica), demostrando una reducción de la mortalidad global y de la MS (el 65 y el 55%, respectivamente). El beneficio fue independiente de la etiología del fallo cardíaco. Por su parte, el estudio CIBIS-II 130, utilizó el bisoprolol e incluyó a 2.647 pacientes con insuficiencia cardíaca crónica (el 50% de etiología isquémica). El tratamiento con bisoprolol se asoció con una reducción del 32% en la mortalidad global y del 42% en la incidencia de MS. Dicho beneficio era independiente de la etiología de la disfunción ventricular. Por último, el estudio MERIT-HF 127, con 3.991 pacientes incluidos (el 66% con cardiopatía isquémica), ha corroborado los hallazgos de los estudios previos, demostrando una reducción de la mortalidad global y de la incidencia de MS del 34 y del 41%, respectivamente. Igual que en los estudios previos, el beneficio fue independiente de la etiología y de la severidad de la insuficiencia cardíaca.
A modo de conclusión, los fármacos betabloqueantes deberían emplearse en todos los pacientes con un IAM que no presenten contraindicaciones para los mismos, ya que reducen la mortalidad cardíaca global y arrítmica. La administración debería comenzar en la fase aguda, en especial en pacientes de mayor riesgo, para ser mantenida, posteriormente, de forma indefinida. Los pacientes con un mayor riesgo de eventos adversos cardiovasculares son los que obtendrían un mayor beneficio de su utilización. La presencia de una FEVI deprimida no sólo no es una contraindicación, sino que este subgrupo de pacientes se beneficia claramente de este grupo de fármacos.
DESFIBRILADOR AUTOMÁTICO IMPLANTABLE PROFILÁCTICO
Los desfibriladores automáticos son dispositivos implantables para la detección y tratamiento de arritmias ventriculares (fig. 5).
Fig. 5. Imagen del generador de un desfibrilador autómatico implantable bicameral.
En los últimos años han experimentado un notable avance 136 con la incorporación de dispositivos bicamerales, terapias de estimulación antitaquicardia, funciones de marcapaso y sistemas de almacenamiento de electrogramas. Asimismo, las técnicas de implantación son más sencillas, colocándose en región pectoral de modo similar a un marcapaso (fig. 6).
Fig. 6. Radiografía de tórax de paciente portador de DAI bicameral de última generación.
Respecto a su aplicación clínica, los desfibriladores implantables han demostrado gran eficacia y seguridad como terapia frente a TV o FV. No obstante, los desfibriladores automáticos implantables (DAI) no están exentos de riesgo. Grimm et al 137, en un estudio prospectivo de 144 pacientes con DAI de tercera generación, encontraron alguna complicación en un 28% tras un seguimiento de 21 ± 15 meses. Un 16% tuvieron descargas inapropiadas, sobre todo por taquicardias supraventriculares, aunque también por TVNS y sobresensado de miopotenciales. En un 4% se observaron problemas relacionados con electrodos, especialmente por desplazamiento. Otras complicaciones fueron menos frecuentes. No se observaron muertes perioperatorias ni infecciones. Se describen, a continuación, los estudios MADIT, CABG-Patch y otros que evalúan el DAI profiláctico en pacientes de alto riesgo tras IAM.
Estudio MADIT (Multicenter Automatic Defibrillator Implantation Trial)
En la era prefibrinolítica se observó que los pacientes con IAM previo, disfunción ventricular y TVNS presentaban una alta mortalidad a los 2 años (en torno a 30%) 8. El estudio MADIT 138 incluyó a 196 pacientes menores de 75 años con IAM previo (3 o más semanas antes), en clase funcional I-III de la NYHA, que cumplían las siguientes condiciones: FEVI 0,35, TVNS asintomática y TV sostenida inducida monomórfica con 1-3 EE y ciclos de 600 y 400 ms o TV con ciclo < 230 ms, TVP o FV con 1-2 EE, no suprimibles tras tratamiento con procainamida. Estos pacientes fueron asignados aleatoriamente a DAI (95 pacientes) o tratamiento convencional (101 pacientes), observándose a los 27 meses una mejoría en la supervivencia del grupo con DAI: 15 muertes (11 cardíacas) en el grupo DAI (15,8%) frente a 39 muertes (27 cardíacas) en el grupo de tratamiento convencional (38,6%) (razón de riesgo = 0,46; intervalo de confianza 0,26-0,82; p = 0,009).
La interpretación y aplicación clínica del estudio MADIT ha sido motivo de controversia 139,140. Una limitación de este estudio es la ausencia de un verdadero grupo control, no pudiendo descartarse un efecto proarrítmico de algunos fármacos. Así, el 11-13% de los pacientes de cada grupo estaban bajo tratamiento con fármacos antiarrítmicos tipo I al mes de incluirse en el estudio, con el consiguiente riesgo de proarritmia y escaso efecto antiarrítmico al no ser la TV suprimible con procainamida 141. También se observan claras diferencias en la proporción de pacientes tratados con amiodarona (el 2% en el grupo DAI frente al 79,5%) o betabloqueantes (el 28% en grupo DAI frente al 8,6%). No obstante, los autores indican que el análisis de regresión de Cox no encontró influencia significativa de los fármacos antiarrítmicos en el riesgo.
Respecto a su aplicación clínica, el número de pacientes que cumplen sus criterios es reducido. Every et al 142, estudiando a 94.797 pacientes incluidos en el registro CAST, encontraron que sólo el 0,3-1,7% cumplían los criterios de inclusión del estudio MADIT. Por tanto, sería preciso estudiar un elevado número de pacientes para encontrar algún paciente MADIT.
Estudio CABG-Patch (Coronary Artery Bypass Graft Patch Trial)
Se incluyeron 900 pacientes 143 menores de 80 años pendientes de cirugía electiva de bypass, con FEVI < 0,36 y alteraciones en el ECG-PS (uno de los siguientes criterios: duración del QRS 114 ms, RMS40 < 20 mV o duración del QRS terminal por debajo de 40 mV > 38 ms). Se asignaron aleatoriamente a implantación de desfibrilador durante la cirugía (446 pacientes) y a un grupo control (454 pacientes). Tras un seguimiento medio de 32 meses, no se encontraron diferencias significativas en la mortalidad entre ambos grupos: 101 muertes (71 cardíacas) en el grupo DAI frente a 95 muertes (72 cardíacas) en el grupo control (razón de riesgo = 1,07; intervalo de confianza 0,81-1,42; p = no significativa). Para este estudio se seleccionaron pacientes de alto riesgo 144: el 83% había presentado un IAM previo, la mitad tenía antecedentes de insuficiencia cardíaca, la FEVI media era 0,27 ± 0,06 y el 55% tenía enfermedad de 3 vasos. De hecho, la mortalidad actuarial a 24 meses era alta (18%), aunque no tanto como en el estudio MADIT (32%).
Comparando la mortalidad global a los 48 días de la cirugía 145, no se encontraron diferencias significativas entre ambos grupos. Tampoco hubo diferencias en el desarrollo de arritmias postoperatorias 146, shock, sangrado o insuficiencia cardíaca, aunque en el grupo DAI fueron más frecuentes las infecciones y la insuficiencia respiratoria.
Bigger et al 147 analizaron los mecanismos de muerte considerando causas arrítmicas y no arrítmicas. Comparando la mortalidad acumulada a 42 meses, la mortalidad arrítmica fue del 4% en el grupo DAI frente al 6,9% en el grupo control (p = 0,057) y la mortalidad no arrítmica, del 13 y del 12,4%, respectivamente (p = 0,275). Los autores concluyen que el DAI reduce la muerte arrítmica en un 45%, sin efecto sobre la muerte no arrítmica. Dado que el 71% de las muertes fueron no arrítmicas, no se redujo significativamente la mortalidad total.
Otros estudios
Existen varios estudios pendientes de realización o publicación. Los más importantes son:
- SCD-HEFT: Sudden Cardiac Death in Heart Failure Trial 148, donde se trata de determinar si la amiodarona o el DAI reducen la mortalidad total en pacientes con enfermedad coronaria o miocardiopatía no isquémica, en clase II o III de la NYHA, con FEVI < 0,36.
- MADIT II: Multicenter Automatic Defibrillator Implantation Trial II 148, en el que se valorará el beneficio profiláctico del DAI en pacientes con enfermedad coronaria y al menos un IAM previo, con FEVI < 0,30.
- Beta-blocker Strategy plus Implantable Cardioverter Defibrillator Trial 149. Se incluyen pacientes con IAM reciente, FEVI 0,35 y una de las siguientes condiciones: 10 o más EV/h, variabilidad reducida o PT. Todos los incluidos deben tolerar al menos 25 mg de metoprolol al día. Este grupo de pacientes se asigna aleatoriamente a tratamiento convencional o EEF. En este caso, si se inducen arritmias, se implanta desfibrilador; en caso contrario, reciben tratamiento convencional.
- MUSTT: Multicenter Unsustained Tachycardia Trial 150. Se incluyen pacientes menores de 80 años con enfermedad coronaria, FEVI 0,40 y TVNS. Se realiza en todos ellos estimulación ventricular programada desde 2 puntos introduciendo 1 a 3 EE. En caso de inducción de TVMS con ciclo > 220 ms o FV (en este caso, con un máximo de 2 EE), se asignan aleatoriamente a no tratamiento o a tratamiento guiado con EEF, incluyendo DAI en ausencia de respuesta a fármacos.
El objetivo principal es la determinación del riesgo de MS en casos de FEVI deprimida, TVNS y arritmias inducibles y la utilidad del tratamiento guiado por EEF en la reducción de mortalidad. Los resultados (pendientes de publicación) indican un riesgo de MS de 32% a los 5 años en la población del estudio, una reducción de muerte arrítmica del 27% en los pacientes del grupo guiado por EEF y, cuando estos pacientes son tratados con DAI, una reducción de muerte arrítmica superior al 50% respecto a los pacientes no tratados con DAI.
En resumen, tras el estudio MADIT, está indicado DAI profiláctico en pacientes con IAM previo, FEVI 0,35, TVNS y TVMS inducible, no suprimible con procainamida. Dicho estudio confirma que se puede identificar a una población de pacientes de alto riesgo arrítmico tras un IAM mediante un EEF realizado a pacientes seleccionados mediante pruebas no invasivas. Los resultados de otros estudios que utilizan un planteamiento similar (pruebas no invasivas seguidas de EEF), actualmente pendientes de finalización, ayudarán a identificar, de forma más precisa, a pacientes de alto riesgo que podrían beneficiarse de un DAI profiláctico 151. AGRADECIMIENTOS
Al Dr. Aureliano Almazán por su contribución en la figura 1 y por sus comentarios sobre el manuscrito. A Medtronic Ibérica TM por la figura 5. A Guidant CPI TM por la figura 6 y por la información sobre el estudio MUSTT.
Bibliografía
[1]
Mechanism of death and prevalence of myocardial ischemic symptoms in the terminal event after acute myocardial infarction. Am J Cardiol 1988; 61: 8-15.
[2]
Arritmias después del infarto de miocardio. En: Delcán JL, editor. Cardiopatía isquémica. Madrid: Ene Ediciones, 1999; 713-748.
[3]
Risk of ventricular arrhythmias in survivors of myocardial infarction. Pacing Clin Electrophysiol 1997; 20: 2699-2705.
[4]
Myocardial infarction patients in the 1990s: their risk factors, stratification and survival in Canada: the Canadian Assessment of Myocardial Infarction (CAMI) Study. J Am Coll Cardiol 1996; 27: 1119-1127.
[5]
N Engl J Med 1983; 309: 331-336.
[6]
Risk factors for sudden death after acute myocardial infarction: two- year follow-up. Am J Cardiol 1984; 54: 31-36.
[7]
The Multicenter Diltiazem Postinfarction Trial Research Group. N Engl J Med 1988; 319: 385-392.
[8]
The relationships among ventricular arrhythmias, left ventricular dysfunction, and mortality in the 2 years after myocardial infarction. Circulation 1984; 69: 250-258.
[9]
Value of radionuclide rest and exercise left ventricular ejection fraction in assessing survival of patients after thrombolytic therapy for acute myocardial infarction: results of Thrombolysis in Myocardial Infarction (TIMI) phase II study. The TIMI Study Group. J Am Coll Cardiol 1995; 26: 73-79.
[10]
Prognostic value of predischarge radionuclide ventriculography at rest and exercise after acute myocardial infarction treated with thrombolytic therapy or primary coronary angioplasty. The Zwolle Myocardial Infarction Study Group. Clin Cardiol 1998; 21: 254-260.
[11]
Influence on prognosis and morbidity of left ventricular ejection fraction with and without signs of left ventricular failure after acute myocardial infarction. Am J Cardiol 1988; 61: 1165-1171.
[12]
Use of left ventricular ejection fraction or wall-motion score index in predicting arrhythmic death in patients following an acute myocardial infarction. The TRACE Study Group. Pacing Clin Electrophysiol 1997; 20: 2553-2559.
[13]
What is the best predictor of spontaneous ventricular tachycardia and sudden death after myocardial infarction? Circulation 1991; 83: 756-763.
[14]
Prediction of late arrhythmic events after acute myocardial infarction from combined use of noninvasive prognostic variables and inducibility of sustained monomorphic ventricular tachycardia. Am J Cardiol 1993; 71: 1131-1141.
[15]
Prognostic value of thrombolysis, coronary artery patency, signal- averaged electrocardiography, left ventricular ejection fraction, and Holter electrocardiographic monitoring for life-threatening ventricular arrhythmias after a first acute myocardial infarction. Am J Cardiol 1997; 80: 852-858.
[16]
Inducibility of sustained monomorphic ventricular tachycardia as a prognostic indicator in survivors of recent myocardial infarction: a prospective evaluation in relation to other prognostic variables. J Am Coll Cardiol 1989; 14: 289-296.
[17]
Prevalence and prognostic significance of ventricular arrhythmias after acute myocardial infarction in the fibrinolytic era. GISSI-2 results. Circulation 1993; 87: 312-322.
[18]
Prevalence, characteristics and prognostic value during long-term follow-up of nonsustained ventricular tachycardia after myocardial infarction in the thrombolytic era. J Am Coll Cardiol 1999; 33: 1895-1902.
[19]
Effect of age on postmyocardial infarction ventricular arrhythmias (Holter Registry data from CAST I and CAST II). Cardiovascular Arrhythmia Suppression Trials. Am J Cardiol 1995; 76: 710-713.
[20]
Frequency of predischarge ventricular arrhythmias in postmyocardial infarction patients depends on residual left ventricular pump performance and is independent of the occurrence of acute reperfusion. The GISSI-2 Investigators. J Am Coll Cardiol 1994; 23: 290-295.
[21]
Importance of ST-segment depression as a determinant of ventricular premature complex frequency after thrombolysis for acute myocardial infarction. Tissue Plasminogen Activator: Toronto (TPAT) Study Group. Am J Cardiol 1994; 74: 419-423.
[22]
Prognostic significance of ventricular ectopic activity in survivors of acute myocardial infarction. J Am Coll Cardiol 1987; 10: 231-242.
[23]
Prevalence, characteristics and significance of ventricular tachycardia detected by 24-hour continuous electrocardiographic recordings in the late hospital phase of acute myocardial infarction. Am J Cardiol 1986; 58: 1151-1160.
[24]
Influence of fibrinolysis and percutaneous transluminal coronary angioplasty on the frequency of ventricular premature complexes. Am J Cardiol 1989; 63: 797-801.
[25]
Ventricular premature beats and mortality after myocardial infarction. N Engl J Med 1977; 297: 750-757.
[26]
Ventricular ectopic beats and their relation to sudden and nonsudden cardiac death after myocardial infarction. Circulation 1979; 60: 998-1003.
[27]
Ventricular premature complexes and sudden death after myocardial infarction. Circulation 1981; 64: 297-305.
[28]
Value of signal-averaged electrocardiography, radionuclide ventriculography, Holter monitoring and clinical variables for prediction of arrhythmic events in survivors of acute myocardial infarction in the thrombolytic era. J Am Coll Cardiol 1993; 21: 1419-1427.
[29]
Risk stratification after myocardial infarction. A reappraisal in the era of thrombolysis. The Groupe d'Etude du Pronostic de l'Infarctus du Myocarde (GREPI). Eur Heart J 1997; 18: 99-107.
[30]
Risk stratification for arrhythmic events in postinfarction patients based on heart rate variability, ambulatory electrocardiographic variables and the signal-averaged electrocardiogram. J Am Coll Cardiol 1991; 18: 687-697.
[31]
Use of ventricular premature complexes for risk stratification after acute myocardial infarction in the thrombolytic era. Am J Cardiol 1996; 77: 133-138.
[32]
Distinction between arrhythmic and nonarrhythmic death after acute myocardial infarction based on heart rate variability, signal-averaged electrocardiogram, ventricular arrhythmias and left ventricular ejection fraction. J Am Coll Cardiol 1996; 28: 296-304.
[33]
Risk stratification following myocardial infarction in the thrombolytic era: a two-step strategy using noninvasive and invasive methods. J Am Coll Cardiol 1999; 33: 131-138.
[34]
Continuous electrocardiographic monitoring for more than one hour does not improve the prognostic value of ventricular arrhythmias in survivors of first acute myocardial infarction. Am J Cardiol 1994; 73: 139-142.
[35]
Nonsustained ventricular tachycardia in the setting of acute myocardial infarction: tachycardia characteristics and their prognostic implications. Circulation 1998; 98: 2030-2036.
[36]
Comparison of one-, six- and 24-hour ambulatory electrocardiographic monitoring for ventricular arrhythmia as a predictor of mortality in survivors of acute myocardial infarction. CAMIAT Pilot Study Group. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial. Am J Cardiol 1992; 69: 308-313.
[37]
Recording from the body surface of arrhythmogenic ventricular activity during the S-T segment. Am J Cardiol 1978; 41: 697-702.
[38]
Relation between late potentials on the body surface and directly recorded fragmented electrograms in patients with ventricular tachycardia. Am J Cardiol 1983; 51: 105-112.
[39]
Use of signals in the terminal QRS complex to identify patients with ventricular tachycardia after myocardial infarction. Circulation 1981; 64: 235-242.
[40]
Standards for analysis of ventricular late potentials using high- resolution or signal-averaged electrocardiography. A statement by a Task Force Committee of the European Society of Cardiology, the American Heart Association, and the American College of Cardiology. Circulation 1991; 83: 1481-1488.
[41]
J Am Coll Cardiol 1996; 27: 238-249.
[42]
Definition of the best prediction criteria of the time domain signal- averaged electrocardiogram for serious arrhythmic events in the postinfarction period. The Cardiac Arrhythmia Suppression Trial/Signal- Averaged Electrocardiogram (CAST/SAECG) Substudy Investigators. J Am Coll Cardiol 1995; 25: 908-914.
[43]
Appraisal of a Low Noise Electrocardiogram. J Am Coll Cardiol 1983; 1: 456-467.
[44]
Fast-Fourier transform analysis of signal-averaged electrocardiograms for identification of patients prone to sustained ventricular tachycardia. Circulation 1984; 69: 711-720.
[45]
Improved diagnostic value of combined time and frequency domain analysis of the signal-averaged electrocardiogram after myocardial infarction. J Am Coll Cardiol 1999; 33: 385-394.
[46]
Spectral turbulence versus time-domain analysis of signal-averaged ECG used for the prediction of different arrhythmic events in survivors of acute myocardial infarction. J Cardiovasc Electrophysiol 1996; 7: 583-593.
[47]
Comparison of the new acceleration spectrum analysis with other time- and frequency-domain analyses of the signal-averaged electrocardiogram. Eur Heart J 1998; 19: 628-637.
[48]
Predictive value of wavelet correlation functions of signal-averaged electrocardiogram in patients after anterior versus inferior myocardial infarction. J Am Coll Cardiol 1996; 27: 53-59.
[49]
Comparison of frequency and time domain analysis of the signal-averaged electrocardiogram in patients with ventricular tachycardia and coronary artery disease: methodologic validation and clinical relevance. J Am Coll Cardiol 1988; 12: 150-158.
[50]
Signal-averaged electrocardiogram in the assessment of cardiac arrhythmias. En: Podrid PJ, Kowey P, editores. Cardiac Arrhythmia mechanisms, diagnosis and management. Baltimore: Willian and Wilkins, 1995: 247-257.
[51]
Natural history of late potentials in the first ten days after acute myocardial infarction and relation to early ventricular arrhythmias. Am J Cardiol 1988; 61: 1187-1190.
[52]
Prognostic significance of the signal-averaged ECG depends on the time of recording in the postinfarction period. Am Heart J 1989; 118: 256-264.
[53]
Factors influencing changes in the signal-averaged electrocardiogram within the first year after a first myocardial infarction. Am Heart J 1994; 128: 263-270.
[54]
The prognostic significance of quantitative signal-averaged variables relative to clinical variables, site of myocardial infarction, ejection fraction and ventricular premature beats: a prospective study. J Am Coll Cardiol 1989; 13: 377-384.
[55]
Prevalence of late potentials in patients with and without ventricular tachycardia: correlation with angiographic findings. Am J Cardiol 1982; 49: 1932-1937.
[56]
Prognostic significance of signal-averaged electrocardiogram after thrombolytic therapy and/or angioplasty during acute myocardial infarction (CAST substudy). Cardiac Arrhythmia Suppression Trial (CAST) SAECG Substudy Investigators. Am J Cardiol 1994; 74: 216-220.
[57]
Effects of thrombolytic therapy administered 6 to 24 hours after myocardial infarction on the signal-averaged ECG. Results of a multicenter randomized trial. LATE Ancillary Study Investigators. Late Assessment of Thrombolytic Efficacy. Circulation 1994; 90: 746-752.
[58]
Late potentials on signal-averaged electrocardiograms and patency of the infarct-related artery in survivors of acute myocardial infarction. J Am Coll Cardiol 1991; 17: 330-337.
[59]
Prediction of serious arrhythmic events after myocardial infarction: signal-averaged electrocardiogram, Holter monitoring and radionuclide ventriculography. J Am Coll Cardiol 1987; 9: 531-538.
[60]
A new noninvasive index to predict sustained ventricular tachycardia and sudden death in the first year after myocardial infarction: based on signal-averaged electrocardiogram, radionuclide ejection fraction and Holter monitoring. J Am Coll Cardiol 1987; 10: 349-357.
[61]
Prognostic significance of ventricular tachycardia and fibrillation induced at programmed stimulation and delayed potentials detected on the signal-averaged electrocardiograms of survivors of acute myocardial infarction. Circulation 1986; 74: 731-745.
[62]
Effect of thrombolytic therapy on the predictive value of signal- averaged electrocardiography after acute myocardial infarction. Am J Cardiol 1992; 70: 21-25.
[63]
High gain signal averaged electrocardiogram combined with 24 hour monitoring in patients early after myocardial infarction for bedside prediction of arrhythmic events. Br Heart J 1988; 60: 181-187.
[64]
Neural activity and ventricular fibrillation. N Engl J Med 1976; 294: 1165-1170.
[65]
Roles of psychologic stress and autonomic nervous system changes in provocation of ventricular premature complexes. Am J Cardiol 1978; 41: 979-985.
[66]
Prognostic value of reduced heart rate variability after myocardial infarction: clinical evaluation of a new analysis method. Br Heart J 1991; 65: 14-19.
[67]
Standards of measurement, physiological interpretation, and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Eur Heart J 1996; 17: 354-381.
[68]
The ability of several short-term measures of RR variability to predict mortality after myocardial infarction. Circulation 1993; 88: 927-934.
[69]
Frequency domain measures of heart period variability and mortality after myocardial infarction. Circulation 1992; 85: 164-171.
[70]
Decreased heart rate variability and its association with increased mortality after acute myocardial infarction. Am J Cardiol 1987; 59: 256-262.
[71]
Comparison of the predictive characteristics of heart rate variability index and left ventricular ejection fraction for all-cause mortality, arrhythmic events and sudden death after acute myocardial infarction. Am J Cardiol 1991; 68: 434-439.
[72]
Multifactorial prediction of arrhythmic events after myocardial infarction. Combination of heart rate variability and left ventricular ejection fraction with other variables. Pacing Clin Electrophysiol 1991; 14: 1986-1991.
[73]
Sinus arrhythmia in acute myocardial infarction. Med J Aust 1978; 2: 52-53.
[74]
Heart rate variability in idiopathic dilated cardiomyopathy: characteristics and prognostic value. J Am Coll Cardiol 1997; 30: 1009-1014.
[75]
Prognostic value of heart rate variability for sudden death and major arrhythmic events in patients with idiopathic dilated cardiomyopathy. J Am Coll Cardiol 1999; 33: 1203-1207.
[76]
Heart rate variability in diabetes: relationship to age and duration of the disease. Diabetes Care 1985; 8: 64-68.
[77]
Assessment of cardiovascular effects in diabetic autonomic neuropathy and prognostic implications. Ann Intern Med 1980; 92: 308-311.
[78]
Mortality in alcoholics with autonomic neuropathy. J Neurol Neurosurg Psychiatry 1988; 51: 476-480.
[79]
Components of heart rate variability measured during healing of acute myocardial infarction. Am J Cardiol 1988; 61: 208-215.
[80]
Risk stratification following myocardial infarction: heart rate variability and other risk factors. En: Malik M, Camm AJ, editores. Heart rate variability. Armonk, NY: Futura, 1995; 369-392.
[81]
Baroreflex sensitivity and electrophysiological correlates in patients after acute myocardial infarction. Circulation 1991; 83: 945-952.
[82]
Prognostic value of baroreflex sensitivity testing after acute myocardial infarction. Br Heart J 1992; 67: 129-137.
[83]
Baroreflex sensitivity, clinical correlates, and cardiovascular mortality among patients with a first myocardial infarction. A prospective study. Circulation 1988; 78: 816-824.
[84]
Baroreflex sensitivity and heart-rate variability in prediction of total cardiac mortality after myocardial infarction. ATRAMI (Autonomic Tone and Reflexes After Myocardial Infarction) Investigators. Lancet 1998; 351: 478-484.
[85]
Comparison of baroreflex sensitivity and heart period variability after myocardial infarction. J Am Coll Cardiol 1989; 14: 1511-1518.
[86]
Comparison of the results of programmed ventricular stimulation from the right ventricular apex and outflow tract: a randomized, prospective study. Eur Heart J 1995; 16: 1234-1243.
[87]
Day to day reproducibility of electrically inducible ventricular arrhythmias in survivors of acute myocardial infarction. J Am Coll Cardiol 1990; 15: 1075-1081.
[88]
Significance of timing programmed electrical stimulation after acute myocardial infarction. J Am Coll Cardiol 1986; 8: 1279-1288.
[89]
Long-term reproducibility and significance of provokable ventricular arrhythmias after myocardial infarction. J Am Coll Cardiol 1986; 8: 32-39.
[90]
Usefulness of early versus late programmed ventricular stimulation in acute myocardial infarction. Am J Cardiol 1991; 68: 13-20.
[91]
Influence of ventricular function and presence or absence of coronary artery disease on results of electrophysiologic testing for asymptomatic nonsustained ventricular tachycardia. Am J Cardiol 1990; 65: 722-728.
[92]
Prognostic significance of sustained monomorphic ventricular tachycardia induced by programmed ventricular stimulation using up to triple extrastimuli in survivors of acute myocardial infarction. Am J Cardiol 1990; 65: 1057-1063.
[93]
Prediction of sustained ventricular tachycardia inducible by programmed stimulation in patients with coronary artery disease. Utility of clinical variables. Circulation 1999; 99: 1843-1850.
[94]
Effects of early reperfusion in acute myocardial infarction on arrhythmias induced by programmed stimulation: a prospective, randomized study. J Am Coll Cardiol 1986; 7: 1234-1242.
[95]
Reduction in incidence of inducible ventricular tachycardia after myocardial infarction by treatment with streptokinase during infarct evolution. J Am Coll Cardiol 1990; 16: 1703-1710.
[96]
Effect of thrombolysis on heart rate variability and life-threatening ventricular arrhythmias in survivors of acute myocardial infarction. J Am Coll Cardiol 1994; 23: 19-26.
[97]
Electrically induced ventricular arrhythmias in acute myocardial infarction treated with thrombolytic agents. Am J Cardiol 1988; 62: 186-191.
[98]
Nonsustained ventricular tachycardia in coronary artery disease: relation to inducible sustained ventricular tachycardia. MUSTT Investigators. Ann Intern Med 1996; 125: 35-39.
[99]
Ventricular stimulation in survivors of acute myocardial infarction. Br Heart J 1989; 61: 410-416.
[100]
Does the induction of ventricular flutter or fibrillation at electrophysiologic testing after myocardial infarction have any prognostic significance? Am J Cardiol 1995; 75: 431-435.
[101]
Nonsustained ventricular tachycardia in patients with coronary artery disease: role of electrophysiologic study. Circulation 1987; 75: 1178-1185.
[102]
Use of electrophysiologic testing in patients with nonsustained ventricular tachycardia: prognostic and therapeutic implications. J Am Coll Cardiol 1989; 14: 155-161.
[103]
Value of programmed ventricular stimulation in the evaluation and management of patients with nonsustained ventricular tachycardia associated with coronary artery disease. Am J Cardiol 1990; 65: 201-205.
[104]
Value of programmed ventricular stimulation in predicting sudden death and sustained ventricular tachycardia in survivors of acute myocardial infarction. Am J Cardiol 1996; 77: 673-680.
[105]
Prognostic significance of programmed ventricular stimulation in survivors of acute myocardial infarction. Br Heart J 1989; 61: 410-416.
[106]
Electrophysiological testing and nonsustained ventricular tachycardia. Use and limitations in patients with coronary artery disease and impaired ventricular function. Circulation 1990; 82: 350-358.
[107]
Prognostic significance of programmed ventricular stimulation in patients surviving complicated acute myocardial infarction: a prospective study. Am Heart J 1992; 124: 87-96.
[108]
Outcome of patients with nonsustained ventricular tachycardia and severely impaired ventricular function who have negative electrophysiologic studies. Am Heart J 1995; 129: 492-496.
[109]
Mortality and morbidity in patients receiving encainide, flecainide, or placebo. The Cardiac Arrhythmia Suppression Trial. N Engl J Med 1991; 324: 781-788.
[110]
Effect of d-sotalol on mortality in patients with left ventricular dysfunction after recent and remote myocardial infarction. The SWORD Investigators. Survival with oral d-sotalol. Lancet 1996; 348: 7-12.
[111]
Effect of antiarrhythmic therapy on mortality in survivors of myocardial infarction with asymptomatic complex ventricular arrhythmias: Basel Antiarrhythmic Study of Infarct Survival (BASIS). J Am Coll Cardiol 1990; 16: 1711-1718.
[112]
Effect of amiodarone on mortality after myocardial infarction: a double- blind, placebo-controlled, pilot study. J Am Coll Cardiol 1992; 20: 1056-1062.
[113]
Comparison of the effects of amiodarone versus metoprolol on the frequency of ventricular arrhythmias and on mortality after acute myocardial infarction. SSSD Investigators. Spanish Study on Sudden Death. Am J Cardiol 1993; 72: 1243-1248.
[114]
Randomised trial of effect of amiodarone on mortality in patients with left-ventricular dysfunction after recent myocardial infarction: EMIAT. European Myocardial Infarct Amiodarone Trial Investigators [published errata appear in Lancet 1997 Apr 19; 349 (9059): 1180 and 1997 Jun 14; 349 (9067): 1776]. Lancet 1997; 349: 667-674.
[115]
Randomised trial of outcome after myocardial infarction in patients with frequent or repetitive ventricular premature depolarisations: CAMIAT. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial Investigators [published erratum appears in Lancet 1997 Jun 14; 349 (9067): 1776]. Lancet 1997; 349: 675-682.
[116]
Lack of effect of amiodarone on survival after extensive infarction. Polish Amiodarone Trial. Coron Artery Dis 1996; 7: 315-319.
[117]
Identification of post acute myocardial infarction patients with potential benefit from prophylactic treatment with amiodarone. A substudy of EMIAT (the European Myocardial Infarct Amiodarone Trial). Eur Heart J 1998; 19: 85-95.
[118]
Amiodarone and «primary» prevention of sudden death: critical review of a decade of clinical trials. Am J Cardiol 1999; 83: 55D-63D.
[119]
Amiodarone interaction with beta-blockers: analysis of the merged EMIAT (European Myocardial Infarct Amiodarone Trial) and CAMIAT (Canadian Amiodarone Myocardial Infarction Trial) databases. The EMIAT and CAMIAT Investigators. Circulation 1999; 99: 2268-2275.
[120]
Myocardial infarction. En: Beta-Blockers in clinical practise. Londres: Churchill Livingtone, 1987; 559-629.
[121]
First International Study of Infarct Survival Collaborative Group Lancet 1986; 2: 57-66.
[122]
Immediate versus deferred beta-blockade following thrombolytic therapy in patients with acute myocardial infarction. Results of the Thrombolysis in Myocardial Infarction (TIMI) II-B Study. Circulation 1991; 83: 422-437.
[123]
Overview of results of randomized clinical trials in heart disease. I. Treatments following myocardial infarction. JAMA 1988; 260: 2088-2093.
[124]
The Beta-Blocker Pooling Project Research Group Eur Heart J 1988; 9: 8-16.
[125]
Metoprolol-induced reduction in postinfarction mortality: pooled results from five double-blind randomized trials. Eur Heart J 1992; 13: 28-32.
[126]
Effect of beta-blockade on mortality among high-risk and low-risk patients after myocardial infarction. N Engl J Med 1998; 339: 489-497.
[127]
Effect of metoprolol CR/XL in chronic heart failure: Metoprolol CR/XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF) Lancet 1999; 353: 2001-2007.
[128]
A randomised placebo- controlled international trial. The MIAMI Trial Research Group Eur Heart J 1985; 6: 199-226.
[129]
Effect on mortality of metoprolol in acute myocardial infarction. A double-blind randomised trial. Lancet 1981; 2: 823-827.
[130]
The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial Lancet 1999; 353: 9-13.
[131]
I. Mortality results JAMA 1982; 247: 1707-1714.
[132]
Timolol-induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction N Engl J Med 1981; 304: 801-807.
[133]
The effect of carvedilol on morbidity and mortality in patients with chronic heart failure. N Engl J Med 1996; 334: 1349-1355.
[134]
A secondary prevention study with slow release oxprenolol after myocardial infarction: morbidity and mortality Eur Heart J 1984; 5: 189-202.
[135]
Efficacy of acebutolol after acute myocardial infarction (the APSI trial). The APSI Investigators. Am J Cardiol 1990; 66: C24-C31.
[136]
Estado actual de los desfibriladores automáticos implantables. Rev Esp Cardiol 1997; 50: 675-681.
[137]
Complications of third-generation implantable cardioverter defibrillator therapy. Pacing Clin Electrophysiol 1999; 22: 206-211.
[138]
Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med 1996; 335: 1933-1940.
[139]
Prevención de la muerte súbita postinfarto de miocardio: ¿debe generalizarse la estrategia «MADIT»? Argumentos a favor. Rev Esp Cardiol 1997; 50: 459-463.
[140]
Prevención de la muerte súbita postinfarto de miocardio: ¿debe generalizarse la estrategia «MADIT»? Argumentos en contra. Rev Esp Cardiol 1997; 50: 464-466.
[141]
The response to procainamide during electrophysiologic study for sustained ventricular tachyarrhythmias predicts the response to other medications. Circulation 1983; 67: 30-37.
[142]
Estimating the proportion of post-myocardial infarction patients who may benefit from prophylactic implantable defibrillator placement from analysis of the CAST registry. Cardiac Arrhythmia Suppression Trial. Am J Cardiol 1998; 82: 683-685.
[143]
Prophylactic use of implanted cardiac defibrillators in patients at high risk for ventricular arrhythmias after coronary-artery bypass graft surgery. Coronary Artery Bypass Graft (CABG) Patch Trial Investigators. N Engl J Med 1997; 337: 1569-1575.
[144]
Baseline characteristics of patients in the coronary artery bypass graft (CABG) Patch Trial. Am Heart J 1997; 134: 787-798.
[145]
Effect of implantable cardioverter-defibrillator implantation on surgical morbidity in the CABG Patch Trial. Surgical Investigators of the Coronary Artery Bypass Graft Patch Trial. Circulation 1998; 98: II77-II80
[146]
Epicardial cardioverter-defibrillators do not cause postoperative arrhythmias. The CABG Patch Trial Investigators. Coronary Artery Bypass Graft. Am J Cardiol 1998; 82: 1114-1117.
[147]
Mechanisms of death in the CABG Patch trial: a randomized trial of implantable cardiac defibrillator prophylaxis in patients at high risk of death after coronary artery bypass graft surgery. Circulation 1999; 99: 1416-1421.
[148]
New primary prevention trials of sudden cardiac death in patients with left ventricular dysfunction: SCD-HEFT and MADIT-II. Am J Cardiol 1999; 83: 91D-97D.
[149]
Which strategy is «best» after myocardial infarction? The Beta-blocker Strategy plus Implantable Cardioverter Defibrillator Trial: rationale and study design. Am J Cardiol 1999; 83: 104D-111D.
[150]
Prevention of sudden death in patients with coronary artery disease: the Multicenter Unsustained Tachycardia Trial (MUSTT). Prog Cardiovasc Dis 1993; 36: 215-226.
[151]
Treatment and prevention of sudden cardiac death: effect of recent clinical trials. Arch Intern Med 1999; 159: 1281-1287.