La hipertrofia ventricular izquierda tiene implicaciones pronósticas. El electrocardiograma, la técnica recomendada con mayor frecuencia para su diagnóstico, está limitado en presencia de bloqueo de rama izquierda.
MétodosSe ha realizado un electrocardiograma y un ecocardiograma a 1.875 pacientes consecutivos (media de edad, 56±16 años) estudiados para descartar cardiopatía y/o hipertensión arterial, definiendo la hipertrofia ventricular izquierda mediante ecocardiografía. Los electrocardiogramas fueron interpretados por la plataforma digital asistida por ordenador ELECTROPRES. Se determinaron sensibilidad, especificidad, valores predictivos y razones de verosimilitud de los criterios electrocardiográficos clásicos y de algunos algoritmos diagnósticos de hipertrofia en los pacientes con bloqueo de rama izquierda, y se comparó esos valores con los obtenidos en los sujetos sin él.
ResultadosSe observó bloqueo de rama izquierda en 233 (12%) pacientes. La hipertrofia ventricular izquierda fue más frecuente en pacientes con bloqueo de rama izquierda (el 60 frente al 31%). En estos, las sensibilidades fueron bajas pero similares a las halladas en pacientes sin bloqueo (del 6,4 al 70,9%), mientras que las especificidades fueron altas (del 57,6 al 100%). Las razones de verosimilitud fueron: positivas (1,33-4,94) y negativas (0,50-0,98). Los algoritmos diagnósticos, los productos duración-voltaje y algunos criterios compuestos tuvieron las mejores sensibilidades.
ConclusionesSe puede diagnosticar hipertrofia del ventrículo izquierdo en presencia de bloqueo de rama izquierda con una precisión diagnóstica al menos similar a la obtenida en los pacientes sin este trastorno de conducción. La interpretación del electrocardiograma asistida por ordenador puede ser útil al facilitar el uso de algoritmos diagnósticos más precisos.
Palabras clave
La hipertrofia ventricular izquierda (HVI) aumenta la morbilidad y la mortalidad de los pacientes con hipertensión arterial1, 2, 3, por lo que su detección es importante para estratificar el riesgo. El electrocardiograma (ECG) es la técnica de mayor disponibilidad para el diagnóstico de HVI y, por lo tanto, las guías de práctica clínica recomiendan su uso sistemático en la hipertensión arterial4, 5, 6, 7. Sin embargo, el bloqueo de rama izquierda (BRI) dificulta el diagnóstico de HVI mediante ECG, aunque la información disponible sobre el efecto de este trastorno de conducción es contradictoria y basada en pocos pacientes8, 9, 10.
Mientras algunos autores han demostrado que no pueden utilizarse los criterios de voltaje para diagnosticar HVI en el BRI11 y recomiendan el uso de datos complementarios12, otros no han hallado limitaciones significativas13, 14, 15, 16. La sensibilidad y la especificidad del ECG en pacientes con BRI pueden variar dependiendo de las derivaciones consideradas, y las precordiales son las que tienen una sensibilidad reducida17. Por ello se ha propuesto que un criterio que combine derivaciones precordiales y de los miembros puede ser más preciso en el BRI, al igual que la combinación del voltaje y la duración del QRS con el crecimiento de la aurícula izquierda14, 18.
El uso del ECG está también limitado por dificultades al medir manualmente el complejo QRS, especialmente en el BRI, por lo que la interpretación del ECG asistida por ordenador puede ser útil, pues reduce los errores en la medición19. Además, el ordenador facilita la utilización de algoritmos diagnósticos. ELECTROPRES es una plataforma de internet desarrollada en España para proporcionar online ayuda asistida por ordenador para la detección de HVI en el ECG, utilizando el software Hannover ECG System® (HES®)20, 21.
Nuestro objetivo es investigar la precisión diagnóstica de los criterios ECG estándar de HVI y de varios algoritmos diagnósticos, aplicados mediante la plataforma ELECTROPRES, en pacientes con o sin BRI.
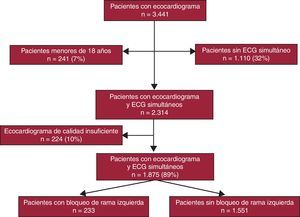
MétodosPoblación de estudioDesde enero de 2003 a agosto de 2009, se estudió a un grupo de 2.090 pacientes (el 60,7% de un total de 3.441 pacientes consecutivos con ecocardiograma) a los que se había realizado simultáneamente un ECG y un ecocardiograma bidimensional (2D) en una consulta externa de cardiología de un centro hospitalario. En el análisis retrospectivo se excluyó a los menores de 18 años y los que tenían un ecocardiograma de calidad insuficiente (215 pacientes; 10,3%), lo que dejó una muestra final de 1.875 pacientes. Se detectó BRI en 233 (12%) de ellos; el diagnóstico de BRI se obtuvo siguiendo los criterios ECG clásicos (anchura del QRS > 120 ms con morfología predominantemente negativa en V1 y predominantemente positiva en V6) sin distinciones por la anchura del QRS o el eje de este. Se comparó a estos pacientes con los que no tenían BRI ni infarto de miocardio en el ECG (n = 1.561). La Figura 1 muestra la inclusión de pacientes en el estudio22.
Figura 1. Gráfico de flujo de inclusión de pacientes en el estudio. ECG: electrocardiograma.
El protocolo de estudio fue aprobado por el Comité de Ética Clínica del Hospital Virgen de la Salud de Toledo en 2009.
ElectrocardiogramaSe realizó a todos los pacientes un ECG de 12 derivaciones con técnica estándar mediante un electrocardiógrafo MAC 1200 ST (GE Medical Systems). Los registros se almacenaron digitalmente en una base de datos GE Cardiosoft database v. 6.5 (GE Healthcare) y se exportaron en formato XML a ELECTROPRES.
ELECTROPRES es un sistema online desarrollado para la detección de HVI en el ECG que usa el programa HES®, aprobado por la Food and Drug Administration, y ha mostrado una elevada precisión20, 21, 23. Además de los criterios de ECG estándar de HVI, utiliza tres algoritmos diagnósticos formados por la combinación de diversos criterios estándar, de forma que se consideraron diagnósticos si se cumplía alguno de los criterios incluidos en ellos; estos algoritmos son: el algoritmo A, formado por los criterios recomendados por las guías de hipertensión arterial de la Sociedad Europea de Cardiología (HVI por el criterio de Sokolow-Lyon voltaje o por el producto duración-voltaje [PDV] de Cornell), el algoritmo B (HVI por el criterio de Sokolow-Lyon voltaje, el criterio de voltaje de Cornell, el criterio de duración-voltaje de Sokolow o el criterio duración-voltaje de Cornell) y el algoritmo C (HVI por criterio de Sokolow-Lyon voltaje, el criterio de voltaje de Cornell, el criterio de Gubner-Ungerleider, el índice de Lewis, R-V6/R-V5, onda R en aVL [RaVL], QRS 12 derivaciones, PDV de Sokolow, PDV de Cornell, PDV del QRS de 12 derivaciones, el PDV Gubner-Ungerleider o el PDV de la onda RaVL) (Tabla 1)24, 25. Algunos criterios ECG como Sokolow, Cornell, Gubner-Ungerleider, onda RaVL y la suma del QRS de 12 derivaciones se estudiaron no sólo en voltaje, sino también en PDV.
Tabla 1. Criterios electrocardiográficos de hipertrofia ventricular izquierda
| Criterios | Fórmula | Criterios de HVI |
| Sokolow-Lyon voltage (mV) | S (V1) + máx (RV5 o RV6) | ≥ 3,5 mV |
| Cornell voltage (mV) | RaVL + SV3 | ≥ 2,8mV (varones), ≥ 2mV (mujeres) |
| R6:R5 | RV6 / RV5 | > 1 |
| RaVL (mV) | RaVL | > 1,1 mV |
| Gubner-Ungerleider (mV) | RI + SIII | > 2,5 mV |
| Lewis (mV) | (RI + SIII) – (RIII + SI) | > 1,7 mV |
| QRS 12 (mV) | Onda R + onda S (u onda Q, la mayor) en las 12 derivaciones | > 19.530mV (varones), > 18.499mV (mujeres) |
| HES® | Ecuación regresión logística | |
| PDV Sokolow (ms×mV) | SV1 + máx (RV5×RV6)×duración QRS | > 367,4mVms (varones), > 322,4mVms (mujeres) |
| PDV Cornell | Varones: RaVL + SV3×duración QRS | > 244mVms |
| Mujeres: (R-aVL + S-V3 + 0,6 mV)×duración QRS | ||
| PDV Gubner | Gubner×duración QRS | > 207mVms |
| PDV RaVL | RaVL×duración QRS | > 103mVms |
| PDV QRS 12 | Área QRS de las 12 derivaciones | > 2.348,8mVms (varones), > 1.960,7mVms (mujeres) |
| Dalfó | RaVL + SV3 | > 1,6mV (varones), > 1,4mV (mujeres) |
| Perugia | a) SV3 + RaVL > 2,4mV (varones) o > 2 mV (mujeres), o | Cualquiera de ellos |
| b) Patrón de sobrecarga del ventrículo izquierdo, o | ||
| c) Sistema de puntuación de Romhilt-Estes ≥ 5 | ||
| Romhilt-Estes (puntos) | > 4 o > 5 puntos |
HES®: Hannover ECG system®; HVI: hipertrofia ventricular izquierda; PDV: producto duración-voltaje; RaVL: onda R en aVL.
Simultáneamente con el ECG, se realizó a los pacientes un ecocardiograma 2D-Doppler color en un ecocardiógrafo Vivid 4 de General Electric con un transductor de 2,5 MHz según técnica habitual. Todos los estudios fueron realizados por el mismo cardiólogo (LRP). Se seleccionaron para lectura las imágenes con visualización óptima. Las medidas se tomaron en el plano paraesternal de eje largo en la pantalla sobre la imagen 2D en telediástole, según técnica estándar, poniendo cuidado en tomar la distancia más perpendicular de las diferentes estructuras. Se calculó la masa del ventrículo izquierdo (VI)26, 27:
En la que DdVI es el diámetro telediastólico del VI; GdTIV, el grosor telediastólico del tabique interventricular, y GdPP, el grosor telediastólico de la pared posterior del VI. Se consideró que hay HVI cuando el índice de la masa del VI es > 134g/m 2 (varones) o > 110g/m 2 (mujeres) 28. Análisis estadísticoSe construyó una tabla 2 × 2 con los puntos de corte de la HVI y el punto de corte de cada criterio de ECG, calculando sensibilidad, especificidad, valores predictivos, razones de verosimilitud, odds ratio pretest y probabilidad de un test positivo y negativo, así como las odds ratio postest y la probabilidad de una prueba positiva o negativa utilizando las definiciones estándar. Se utilizó una prueba de la χ2 para analizar las diferencias entre los criterios de ECG y curvas ROC (característica operativa del receptor) para completar el análisis de la precisión diagnóstica de los distintos criterios ECG utilizando métodos estándar. Asimismo, se calcularon coeficientes de correlación de Pearson entre el índice de masa del VI y el voltaje de los distintos criterios ECG, salvo RaVL, PDV RaVL, Romhilt-Estes y Perugia, para los que se han calculado coeficientes de correlación de Spearman, al no presentar normalidad.
En las pruebas de dos colas se consideró estadísticamente significativo un valor de p<0,05. Para los cálculos se utilizó el programa estadístico SPSS v.17.0.
Se realizó una estimación de la variabilidad intraobservador midiendo dos veces, de manera enmascarada, tres dimensiones en 15 ecocardiogramas de pacientes seleccionados aleatoriamente (total, 45 mediciones) por el mismo observador con un intervalo de 2 semanas. Se calculó la desviación estándar de las diferencias existentes entre las primeras y las segundas mediciones, y se expresó como porcentaje de la media.
ResultadosCaracterísticas basalesLa Tabla 2 muestra las características basales de los pacientes. El grupo de pacientes con BRI está constituido por 124 varones (53,2%) y 109 mujeres (46,8%), con una media de edad de 67,1±12,6 años. Los diagnósticos más frecuentes fueron la sospecha o presencia de cardiopatía (160; 79,3%), hipertensión arterial (145; 62,2%) y arritmias (extrasistolia supraventricular o ventricular y fibrilación auricular) (160; 68,7%). La mayoría de ellos (n = 201; 86,3%) tenían o habían tenido fibrilación auricular paroxística o permanente según la historia clínica o el ECG.
Tabla 2. Características basales (demográficas, ecocardiográficas y electrocardiográficas) de la población con bloqueo de rama izquierda y sin bloqueo de rama izquierda ni infarto de miocardio
| Variable | BRI (n=233) | Sin BRI ni IM (n=1.561) | p |
| Edad (años) | 67,1±12,6 | 53,6±15,5 | < 0,0010 |
| Varones (%) | 53,2 | 55,2 | 0,8872 |
| Hipertensión (%) | 62,3 | 51,8 | 0,0030 |
| Peso (kg) | 86,7±83,4 | 85,5±67,8 | 0,8072 |
| Estatura (cm) | 165,7±9,3 | 168,8±9,2 | 0,0010 |
| Índice de masa corporal | 31,3±27,6 | 30,3±27,2 | 0,6014 |
| Índice de masa del VI (g/m 2 ) | 100,2±31,7 | 82,7±41,4 | < 0,0010 |
| Grosor telediastólico del TIV (mm) | 11,9±3,3 | 10,8±2,7 | < 0,0010 |
| Diámetro telediastólico del VI (mm) | 45,2±7,1 | 43±5,7 | < 0,0010 |
| Grosor telediastólico de la pared posterior (mm) | 10,5±1,9 | 9,9±2,8 | < 0,0010 |
| Sokolow-Lyon voltaje (mV) | 2,01±0,88 | 1,99±0,73 | 1 |
| Cornell voltaje (mV) | 1,48±0,79 | 1,13±0,59 | < 0,0010 |
| R6:R5 | 0,93±0,48 | 0,85±0,19 | < 0,0010 |
| RaVL (mV) | 0,56±0,36 | 0,51±0,34 | 0,0410 |
| Gubner-Ungerleider (mV) | 1,11±0,65 | 1,10±0,58 | 0,8092 |
| Lewis (mV) | 0,79±0,84 | 0,71±0,80 | < 0,0010 |
| QRS 12 derivaciones (mV) | 13,4±3,7 | 13,1±3,3 | 0,2030 |
| PDV Sokolow (ms·mV) | 212,8±116,1 | 193,3±80,7 | 0,0140 |
| PDV Cornell | 194,3±127,8 | 137,2±70 | < 0,0010 |
| PDV Gubner | 120,5±86,2 | 107,3±63,3 | 0,0049 |
| PDV RaVL | 61,5±47,5 | 50,1±36,6 | 0,0030 |
| PDV QRS 12 | 1.443,9±584,1 | 1.293,9±438,9 | 0,0020 |
| Dalfó | 1,48±0,79 | 1,13±0,59 | < 0,0010 |
| Perugia | 0,30±0,46 | 0,08±0,28 | < 0,0010 |
| Romhilt-Estes (puntos) | 2,03±2,14 | 1,19±1,32 | < 0,0010 |
BRI: bloqueo de rama izquierda; IM: infarto de miocardio; PDV: producto duración-voltaje; RaVL: onda R en aVL; TIV: tabique interventricular; VI: ventrículo izquierdo.
Salvo otra indicación, los datos expresan media±desviación estándar.
En el grupo de pacientes sin BRI ni infarto de miocardio, había 861 varones (55,2%) y 700 mujeres (44,8%), con una media de edad de 53,6±15,5 años. Los diagnósticos más frecuentes fueron la sospecha o presencia de cardiopatía (41; 2,6%), hipertensión arterial (810; 51,9%) y arritmias (extrasistolia supraventricular o ventricular y fibrilación auricular) (138; 8,8%). Se observó fibrilación auricular paroxística o permanente en 138 (8,8%) de estos pacientes.
Los pacientes con BRI eran mayores, tenían un mayor índice de masa corporal y más frecuencia de hipertensión y de fibrilación auricular.
La variabilidad intraobservador en la medida del ecocardiograma fue del 3%.
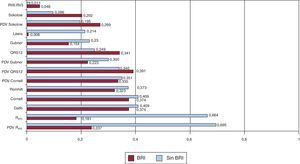
Correlación entre los voltajes del electrocardiograma y la masa del ventrículo izquierdoLa Figura 2 muestra los coeficientes de correlación entre el índice de la masa del VI y los criterios ECG. El PDV del QRS de las 12 derivaciones muestra la mayor correlación (r=0,391) con el índice de la masa del VI, seguido del criterio de Cornell (r=0,374) y el criterio de Dalfó (r=0,374). En los pacientes que no tenían BRI ni infarto de miocardio, la correlación con el índice de la masa del VI fue mayor para el PDV de la RaVL (r=0,695) y la onda RaVL (r=0,664) y menor para la relación RV6:RV5 (r=0,011). Las mayores diferencias en la correlación con la masa del VI entre los pacientes con y sin BRI se observaron en RaVL, el PDV de RaVL y el índice de Lewis.
Figura 2. Coeficientes de correlación entre el índice de masa del ventrículo izquierdo en ecocardiografía y los criterios electrocardiográficos considerados en este estudio en pacientes con bloqueo de rama izquierda y en los que no tienen bloqueo de rama izquierda ni infarto de miocardio. Los coeficientes de correlación se muestran en cada columna. BRI: bloqueo de rama izquierda; PDV: producto duración-voltaje; RaVL: onda R en aVL.
Sensibilidad, especificidad y razones de verosimilitudLa frecuencia de HVI fue del 60,5%. La Tabla 3 muestra la utilidad diagnóstica de todos los criterios ECG en los pacientes con BRI.
Tabla 3. Sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razón de verosimilitud positiva, razón de verosimilitud negativa, frecuencia, probabilidad postest negativa y probabilidad postest positiva de todos los criterios electrocardiográficos considerados en pacientes con bloqueo de rama izquierda (n=233)
| Criterios | S (%)±IC95% | E (%)±IC95% | VPP (%)±IC95% | VPN (%)±IC95% | RV+ | RV− | Frecuencia (%) | PPT− | PPT+ |
| Algoritmo A | 37,6±8 | 92,4±5,4 | 88,3±8,1 | 49,1±7,5 | 4,94 | 0,68 | 60,5 | 50,9 | 88,3 |
| Algoritmo B | 38,3±8 | 90,2±6,1 | 85,7±8,6 | 48,2±7,5 | 3,91 | 0,68 | 51,2 | 85,7 | |
| Algoritmo C | 70,9±7,5 | 57,6±10,1 | 71,9±7,5 | 56,4±10 | 1,67 | 0,50 | 43,6 | 71,9 | |
| Sokolow-Lyon voltaje | 10,6±5,1 | 97,8±3 | 88,2±15,3 | 41,7±6,6 | 4,89 | 0,91 | 58,3 | 88,2 | |
| Cornell voltaje | 19,1±6,5 | 95,7±4,2 | 87,1±11,8 | 43,6±6,8 | 4,40 | 0,85 | 56,4 | 87,1 | |
| R6:R5 | 21,3±6,8 | 87±6,9 | 71,4±13,7 | 41,9±7 | 1,63 | 0,91 | 58,1 | 71,4 | |
| RaVL | 8,5±4,6 | 97,8±3 | 85,7±18,3 | 41,1±6,5 | 3,91 | 0,94 | 58,9 | 85,7 | |
| Gubner-Ungerleider | 6,4±4 | 100±0 | 100±0 | 41,1±6,4 | Infinito | 0,94 | 58,9 | Infinito | |
| Lewis | 15,6±6 | 95,7±4,2 | 84,6±13,9 | 42,5±6,7 | 3,59 | 0,88 | 57,5 | 84,6 | |
| QRS 12 derivaciones | 10,6±5,1 | 96,7±3,6 | 83,3±17,2 | 41,4±6,6 | 3,26 | 0,92 | 58,6 | 83,3 | |
| HES® | 25,5±7,2 | 89,1±6,4 | 78,3±11,9 | 43,9±7,1 | 2,35 | 0,84 | 56,2 | 78,3 | |
| PDV Sokolow | 16,3±6,1 | 93,5±5,1 | 79,3±14,7 | 42,2±6,9 | 2,50 | 0,90 | 59,8 | 79,3 | |
| PDV Cornell | 34±7,8 | 92,4±5,4 | 87,3±8,8 | 47,8±7,3 | 4,47 | 0,71 | 52,3 | 87,3 | |
| PDV Gubner | 17,7±6,3 | 94,6±4,6 | 83,3±13,3 | 42,9±6,8 | 3,26 | 0,87 | 57,1 | 83,3 | |
| PDV RaVL | 24,1±7,1 | 93,5±5,1 | 85±11,1 | 44,6±7 | 3,70 | 0,81 | 55,4 | 85 | |
| PDV QRS 12 derivaciones | 29,8±7,6 | 91,3±5,8 | 84±10,2 | 45,9±7,2 | 3,34 | 0,77 | 54,1 | 84 | |
| Dalfó | 55,3±8,2 | 79,4±8,3 | 80,4±7,9 | 53,7±8,4 | 2,68 | 0,56 | 46,3 | 80,4 | |
| Perugia | 39,7±8,1 | 83,7±7,6 | 78,9±9,5 | 47,7±7,7 | 2,44 | 0,72 | 52,5 | 78,9 | |
| Romhilt-Estes > 4 | 8,5±4,6 | 93,5±5,1 | 66,7±21,8 | 40±6,6 | 1,33 | 0,98 | 60 | 66,7 | |
| Romhilt-Estes > 5 | 17,7±6,3 | 92,4±5,4 | 78,1±14,3 | 42,3±6,8 | 2,33 | 0,89 | 57,7 | 78,1 |
E: especificidad; HES®: Hannover ECG System®; IC95%: intervalo de confianza del 95%; PDV: producto duración-voltaje; PPT–: probabilidad postest negativa; PPT+: probabilidad postest positiva; RaVL: onda R en aVL; RV–: razón de verosimilitud negativa; RV+: razón de verosimilitud positiva; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En general, en los pacientes con BRI las sensibilidades fueron bajas o intermedias y oscilaron del 6,4% para el criterio de voltaje de Gubner-Ungerleider al 70,9% para el algoritmo C. Las especificidades fueron altas y oscilaron del 57,6% para el algoritmo C al 100% para el criterio de voltaje de Gubner-Ungerleider. Las razones de verosimilitud positivas oscilan de 1,33 para el Romhilt-Estes > 4 a 4,89 para el criterio de voltaje de Sokolow-Lyon, y las razones de verosimilitud negativas van de 0,50 para el algoritmo C a 0,98 para el criterio de Romhilt-Estes > 4. En nuestra población, estas razones de verosimilitud producen una probabilidad postest negativa de HVI que va del 43,6% para el algoritmo C al 60,0% para el criterio de Romhilt-Estes > 4, y una probabilidad postest positiva de HVI que va del 71,9% para el algoritmo C al 88,3% para el algoritmo A.
La frecuencia de HVI en los pacientes que no tenían BRI ni infarto de miocardio fue del 37,8%. La Tabla 4 muestra la utilidad diagnóstica de todos los criterios ECG analizados en los pacientes sin BRI. En general, las sensibilidades fueron bajas y oscilaron del 3,5% para el criterio de voltaje de Sokolow-Lyon al 53,1% para el algoritmo C. Las especificidades fueron altas, entre el 70,7% para el algoritmo C y el 99,3% para el voltaje de Cornell. Las razones de verosimilitud positivas van de 1,28 para el criterio de voltaje de Sokolov-Lyon a 8,73 para el criterio de voltaje de Cornell, y las razones de verosimilitud negativas oscilaron entre 0,66 para el algoritmo C y 0,99 para el criterio de voltaje de Sokolow-Lyon. En nuestra población, estas razones de verosimilitud dan una probabilidad postest negativa que oscila entre el 22,8% para el algoritmo C al 30,6% para el criterio de voltaje de Sokolow-Lyon, y una probabilidad postest positiva de HVI que va del 36,2% para el criterio de voltaje de Sokolov-Lyon al 79,5% para el criterio de voltaje de Cornell.
Tabla 4. Sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razón de verosimilitud positiva, razón de verosimilitud negativa, frecuencia, probabilidad postest negativa y probabilidad postest positiva de todos los criterios electrocardiográficos considerados en pacientes sin bloqueo de rama izquierda ni infarto de miocardio (n=1.561)
| Criterios | S (%)±IC95% | E (%)±IC95% | VPP (%)±IC95% | VPN (%)±IC95% | RV+ | RV− | Frecuencia (%) | PPT− | PPT+ |
| Algoritmo A | 13,9±3,1 | 95,7±1,2 | 59,3±9,1 | 71,5±2,3 | 3,28 | 0,90 | 30,7 | 59,3 | 28,5 |
| Algoritmo B | 14,8±3,2 | 93,8±1,4 | 51,5±8,3 | 71,3±2,4 | 2,39 | 0,91 | 51,5 | 28,7 | |
| Algoritmo C | 53,1±4,5 | 70,7±2,7 | 44,6±4,1 | 77,3±2,6 | 1,81 | 0,66 | 44,6 | 22,8 | |
| Sokolow-Lyon voltaje | 3,5±1,6 | 96,2±1 | 36,2±13,7 | 69,4±2,3 | 1,28 | 0,99 | 36,2 | 30,6 | |
| Cornell voltaje | 6,5±2,2 | 99,3±0,5 | 79,5±12,7 | 70,5±2,3 | 8,73 | 0,94 | 79,5 | 29,5 | |
| R6:R5 | 6,5±2,2 | 95,5±1,2 | 38,8±10,7 | 69,7±2,3 | 1,42 | 0,98 | 38,7 | 30,3 | |
| RaVL | 10±2,7 | 96,6±1,1 | 56,5±10,5 | 70,7±2,3 | 2,92 | 0,93 | 56,5 | 29,3 | |
| Gubner-Ungerleider | 5,2±2 | 98,6±0,7 | 62,5±15 | 70,1±2,3 | 3,75 | 0,96 | 62,5 | 29,9 | |
| Lewis | 19±3,5 | 93,4±1,5 | 56,2±7,7 | 72,3±2,4 | 2,89 | 0,87 | 56,2 | 27,8 | |
| QRS 12 derivaciones | 6,5±2,2 | 96±1,2 | 41,9±11,2 | 69,8±2,3 | 1,62 | 0,97 | 41,9 | 30,2 | |
| HES® | 9,2±2,9 | 97,2±1 | 59,5±11,2 | 70,7±2,3 | 3,30 | 0,93 | 59,5 | 29,3 | |
| PDV Sokolow | 5,2±2,1 | 96,9±1 | 42,4±12,6 | 69,7±2,3 | 1,66 | 0,98 | 42,4 | 30,3 | |
| PDV Cornell | 12,3±2,9 | 97,4±1 | 67,8±9,8 | 71,4±2,3 | 4,75 | 0,90 | 67,2 | 28,6 | |
| PDV Gubner | 13,3±3 | 95,6±0,2 | 57,1±9,2 | 71,3±2,3 | 3 | 0,91 | 57,1 | 28,7 | |
| PDV RaVL | 15,2±3,2 | 95,1±1,3 | 57,9±8,6 | 71,6±2,3 | 3,10 | 0,89 | 57,9 | 28,4 | |
| PDV QRS 12 derivaciones | 12,7±3 | 92,2±1,6 | 42,1±8 | 70,4±2,4 | 1,64 | 0,95 | 42,1 | 29,6 | |
| Dalfó | 37,1±4,3 | 85,4±2,1 | 53±5,3 | 75,4±2,4 | 2,54 | 0,74 | 54 | 24,7 | |
| Perugia | 16±3,3 | 95,1±1,3 | 59,2±8,5 | 71,8±2,3 | 3,27 | 0,88 | 59,2 | 28,2 | |
| Romhilt-Estes > 4 | 6±2,1 | 97,6±0,9 | 52,7±13,2 | 70,1±2,3 | 2,51 | 0,96 | 52,7 | 30 | |
| Rohmhilt-Estes > 5 | 6,3±2,2 | 98,7±0,7 | 68,2±13,8 | 70,3±2,3 | 4,83 | 0,95 | 68,2 | 29,7 |
E: especificidad; HES®: Hannover ECG System®; IC95%: intervalo de confianza del 95%; PDV: producto duración-voltaje; PPT–: probabilidad postest negativa; PPT+: probabilidad postest positiva; RaVL: onda R en aVL; RV–: razón de verosimilitud negativa; RV+: razón de verosimilitud positiva; S: sensibilidad; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Todos los criterios ECG, excepto RaVL, fueron significativamente más sensibles en pacientes con BRI (Tabla 5). Por otra parte, solo tres criterios ECG (RV6:RV5, Perugia, Rohmhilt-Estes > 5) fueron significativamente menos específicos en los pacientes con BRI.
Tabla 5. Comparaciones entre las sensibilidades y especificidades de los dos grupos de pacientes (con y sin bloqueo de rama izquierda)
| Sensibilidad (%) | Especificidad (%) | |||||
| Criterios | Sin BRI (n=1.561) | BRI (n=233) | p | Sin BRI (n=1.561) | BRI (n=233) | p |
| Algoritmo A | 13,9±3,1 | 37,6±8 | 0,0002 | 95,7±1,2 | 92,4±5,4 | 0,3717 |
| Algoritmo B | 14,8±3,2 | 38,3±8 | 0,0004 | 93,8±1,4 | 90,2±6,1 | 0,4343 |
| Algoritmo C | 53,1±4,5 | 70,9±7,5 | 0,0133 | 70,7±2,7 | 57,6±10,1 | 0,0762 |
| Sokolow-Lyon voltaje | 3,5±1,6 | 10,6±5,1 | 0,0172 | 96,2±1 | 97,8±3 | 0,6785 |
| Cornell voltaje | 6,5±2,2 | 19,1±6,5 | 0,0207 | 99,3±0,5 | 95,7±4,2 | 0,3650 |
| R6:R5 | 6,5±2,2 | 21,3±6,8 | 0,0081 | 95,5±1,2 | 87±6,9 | 0,0425 |
| RaVL | 10±2,7 | 8,5±0,6 | 0,8094 | 96,6±1,1 | 97,8±3 | 0,6506 |
| Gubner-Ungerleider | 5,2±2 | 6,4±4 | 0,7564 | 98,6±0,7 | 100±0 | 0,3161 |
| Lewis | 19±3,5 | 15,6±6 | 0,5723 | 93,4±1,5 | 95,7±4,2 | 0,5356 |
| QRS 12 derivaciones | 6,5±2,2 | 10,6±5,1 | 0,4585 | 96±1,2 | 96,7±3,6 | 0,7004 |
| HES® | 9,2±2,9 | 25,5±7,2 | 0,0029 | 97,2±1 | 89,1±6,4 | 0,0524 |
| PDV Sokolow | 5,2±2,1 | 16,3±6,1 | 0,0211 | 96,9±1 | 93,5±0,1 | 0,4951 |
| PDV Cornell | 12,3±2,9 | 34±7,8 | 0,0004 | 97,4±1 | 92,4±5,4 | 0,2147 |
| PDV Gubner | 13,3±3 | 17,7±6,3 | 0,4345 | 95,6±1,2 | 94,6±0,6 | 0,7330 |
| PDV RaVL | 15,2±3,2 | 24,1±7,1 | 0,1534 | 95,1±1,3 | 93,5±5,1 | 0,7564 |
| PDV QRS 12 derivaciones | 12,7±3 | 29,8±0,6 | 0,0059 | 92,2±0,6 | 91,3±5,8 | 0,7998 |
| Dalfó | 37,1±4,3 | 55,3±8,2 | 0,0159 | 85,4±0,1 | 79,4±8,3 | 0,3574 |
| Perugia | 16±3,3 | 39,7±8,1 | 0,0003 | 95,1±1,3 | 83,7±7,6 | 0,0211 |
| Romhilt-Estes > 4 | 6±2,1 | 8,5±4,6 | 0,5913 | 97,6±0,9 | 93,5±5,1 | 0,2790 |
| Rohmhilt-Estes > 5 | 6,3±0,2 | 17,7±6,3 | 0,0157 | 98,7±0,7 | 92,4±5,4 | 0,0407 |
BRI: bloqueo de rama izquierda; HES®: Hannover ECG system®; PDV: producto duración-voltaje; RaVL: onda R en aVL.
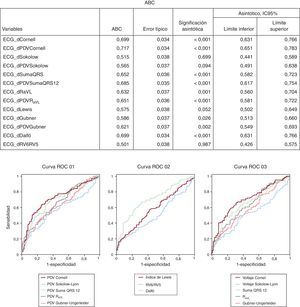
Los criterios ECG del PDV tienen una sensibilidad ligeramente mayor y una especificidad algo menor que los criterios de voltaje, aunque la precisión diagnóstica no mejoró significativamente (Figura 3).
Figura 3. Curvas de las características operativas del receptor de todos los criterios electrocardiográficos, excluidos los criterios de Perugia y Romhilt Estes por ser scores y no variables continuas. ABC: área bajo la curva; ECG: electrocardiograma; IC95%: IC95%: intervalo de confianza del 95%; PDV: producto duración-voltaje; RaVL: onda R en aVL; ROC: característica operativa del receptor.
DiscusiónEste estudio demuestra que la presencia de BRI no limita la precisión del ECG en el diagnóstico de HVI, al menos cuando la interpretación del ECG se realiza asistida por ordenador. El ordenador puede mejorar el uso del ECG en el diagnóstico de HVI, pues permite una medida precisa y la evaluación simultánea de diversos criterios.
La frecuencia de HVI es mayor en los pacientes con BRI (el 60,5 frente al 35,1%), lo que indica que el incremento de la masa del VI contribuye a la aparición del BRI por fibrosis intraventricular y/o daño del tejido de conducción. Esto puede explicar la elevada incidencia de fibrilación auricular observada. La prevalencia de HVI hallada en diversos estudios ha dependido del escenario clínico considerado y el criterio utilizado, y se ha comunicado del 15 al 73% cuando se ha usado el mismo criterio de HVI que el nuestro29. La presencia de BRI se ha considerado como un indicador de la presencia de HVI30, lo que podría explicar su elevada frecuencia en nuestros pacientes con BRI, similar a lo comunicado por otros10, 14, 31.
El ECG se utiliza para el diagnóstico de HVI a pesar de su baja sensibilidad32, 33, 34. Aunque su elevada especificidad podría indicar que es una técnica «SpPIn» (specific, positive, in) en el diagnóstico de HVI, lo que significaría que su positividad establecería el diagnóstico definitivo, su baja sensibilidad limita su utilidad35. Además, la presencia de BRI parece restringir aún más la precisión diagnóstica de HVI mediante el ECG10, 11, 12, 13. Como consecuencia de todo ello, algunos autores han concluido que los criterios electrocardiográficos son insatisfactorios para el diagnóstico de HVI y han señalado la necesidad de desarrollar algoritmos más eficientes20.
A pesar de estas limitaciones, a muchos pacientes se les realiza un ECG por diversos motivos, por lo cual parece razonable utilizar esta técnica para evaluar la presencia de HVI. Además, su bajo coste y su disponibilidad, así como la significativa información pronóstica que aporta3, 36, 37, son también importantes razones para proponer el ECG como una técnica diagnóstica de primera línea en la hipertensión arterial4, 5. El ECG da información sobre la masa del VI y el remodelado de la cavidad, adicional al mero incremento del voltaje38. Se considera que la ecocardiografía es la herramienta más útil para el diagnóstico de HVI en la hipertensión, aunque su mayor coste y su menor disponibilidad restringen su uso39.
Nuestros datos indican que los criterios ECG de HVI tienen una elevada especificidad pero baja sensibilidad para detectar a la mayoría de los pacientes con HVI cuando tienen BRI. Sin embargo, algunos criterios y algoritmos pueden alcanzar una sensibilidad de un 40-70%, lo que permite la detección de un número significativo de pacientes con HVI. Es de destacar que algunos criterios ECG, como el de Gubner-Ungerleider, tienen una elevada razón de verosimilitud positiva, lo que permite establecer el diagnóstico de HVI cuando son positivos. Por el contrario, las razones de verosimilitud más bajas encontradas no permiten descartar la presencia de HVI, aunque reducen la probabilidad postest al 41% en esta población, que presenta una frecuencia de HVI del 61%.
Aunque existen diferencias en la correlación de los criterios ECG con el índice de masa del VI, la precisión diagnóstica del ECG no cambia significativamente en el BRI. Por otra parte, los criterios compuestos muestran un aumento significativo de la sensibilidad en los pacientes con BRI sin que se observe cambio en especificidad, lo que puede deberse a que estos criterios tienen en cuenta de forma más completa los cambios vectoriales que se observan en el BRI.
Se han propuesto diversos criterios para superar las limitaciones del ECG en el diagnóstico de HVI. Entre ellos, los PDV han sido validados clínicamente. Algunos autores han hallado que estos criterios tienen mayor sensibilidad40, lo que no ha sido confirmado por otros41; además, no existe información sobre su utilidad en el BRI. Nosotros hallamos que los PDV presentan un ligero aumento de sensibilidad con una pequeña disminución en la especificidad. Se necesita más investigación para mejorar la precisión del ECG para el diagnóstico de HVI, y se debe tomar en cuenta, probablemente, algunas características epidemiológicas además de la señal eléctrica del corazón42.
El uso del ordenador en la interpretación del ECG permite obtener mayor precisión en la medición de los complejos QRS en el BRI, lo cual es difícil manualmente debido a los empastamientos del QRS. En la clínica, la variabilidad en la medida del voltaje del ECG es alta, con baja concordancia en el diagnóstico de HVI14. El diagnóstico asistido por ordenador a través de internet es factible y especialmente útil en atención primaria43. Se ha demostrado que los métodos asistidos por ordenador tienen una capacidad diagnóstica similar a la de los cardiólogos más competentes15, 16, 21, 43, 44. Nuestros datos muestran que el uso del ordenador puede ayudar a superar las limitaciones clásicas del ECG.
Las medidas de los ecocardiogramas se realizaron en la imagen 2D, lo cual puede ser menos preciso que las realizadas sobre el registro en modo M. No obstante, la técnica utilizada fue optimizada para minimizar los errores y, de hecho, se obtuvo una frecuencia de HVI parecida a la observada en otras muestras similares29, 30, 31. Además, esta técnica se usa habitualmente en la clínica, lo que incrementa la posibilidad de extrapolar los resultados.
ConclusionesLa presencia de BRI no limita la precisión diagnóstica del ECG para el diagnóstico de HVI, al menos cuando se utiliza un sistema de diagnóstico asistido por ordenador. Esto permite la implementación de algoritmos diagnósticos más eficaces. De los criterios considerados, el de Gubner-Ungerleider es el que ha mostrado mayor razón de verosimilitud positiva para el diagnóstico de HVI en presencia de BRI.
FinanciaciónEste trabajo se ha realizado con una beca no condicionada de Sanofi-Aventis, que también apoyó el desarrollo y puesta en marcha de la plataforma ELECTROPRES.
Conflicto de interesesNinguno.
Recibido 22 Marzo 2011
Aceptado 16 Julio 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Virgen de la Salud, Avda. Barber 30, 45005 Toledo, España. lrodriguez@sescam.org