Palabras clave
INTRODUCCIÓN
El tratamiento intravascular con stents de las estenosis ha sido una técnica que ha evolucionado en los últimos años, aunque ha tenido una aplicación muy restringida en las cardiopatías congénitas del recién nacido.
Tras el nacimiento, tanto en la atresia pulmonar con septo interventricular intacto (AP/SVI) como en la estenosis pulmonar crítica (EPC), la circulación pulmonar depende del conducto arterioso, por lo que es necesario el uso de la prostaglandina E1 (PGE1) por vía intravenosa para mantener su permeabilidad. En ambas enfermedades se realiza la valvuloplastia pulmonar con balón, pero en la AP/SVI es necesario perforar la válvula durante el cateterismo cardíaco, ya sea mecánicamente1,2 o con técnicas que implican el uso de radiofrecuencia3,4 o láser5. Una vez liberada la obstrucción del ventrículo derecho, no siempre se logra una fisiología biventricular de forma inmediata, por lo que se requiere continuar tratamiento con PGE1 y, en algunos casos, es necesario crear una fístula Blalock-Taussig (FBT). Esta última opción se ha asociado con complicaciones, como parálisis del nervio frénico y/o vago, quilotórax, distorsión del crecimiento de arterias pulmonares, estenosis de rama pulmonar y adherencias quirúrgicas. Por estas razones, es necesario disponer de una opción no quirúrgica para la FBT6. La implantación de un stent para mantener la permeabilidad del conducto arterioso7,8 es una técnica que se ha empleado tanto en enfermedades con circulación sistémica ductal dependiente como en enfermedades con circulación pulmonar ductal dependiente, y los resultados son mucho mejores en esta última indicación. Aún más, en las enfermedades donde el conducto arterioso es corto y menos tortuoso, como en la AP/SVI y la EPC, se obtienen los mejores resultados6,9. En este artículo comunicamos nuestra experiencia con la implantación de un stent para mantener la patencia del conducto arterioso y, así, evitar la cirugía paliativa.
PACIENTES Y MÉTODOS
Pacientes
En la tabla 1 se muestran las características generales de los 3 pacientes. Todos fueron estudiados con ecocardiografía antes del cateterismo y se consideró que tenían un ventrículo derecho tripartito. En los pacientes 1 y 2 se hizo durante el cateterismo una ventriculografía derecha y se consideró que las fístulas coronarioventriculares no eran significativas.
Técnica
Todos los casos se hicieron después de obtener el consentimiento informado. La implantación del stent se hizo por vía anterógrada, para lo cual fue necesario ubicar inicialmente una guía 0,014 inch desde la vena femoral hasta la arteria femoral que atravesaba la aurícula derecha, la arteria pulmonar, el conducto arterioso y la aorta descendente, y se exteriorizaba la guía por la arteria femoral con el fin de establecer una guía venoarterial. Todos los stents estaban premontados sobre un balón (Stent BX Sonic® de 4 x 18 mm, Cordis/Johnson & Johnson) y se avanzaron coaxialmente sobre la guía de 0,014 inch. La implantación del stent se hizo bajo visión radioscópica. Se hizo un aortograma en proyección lateral para comprobar la posición del stent. La perfusión de PGE1 se suspendió, en todos los casos, antes de iniciar la implantación del stent, con el fin de conseguir visualizar por angiografía la zona de máxima constricción ductal, la cual se tomó como referencia para ajustar la óptima posición del stent en su expansión. Durante el mismo cateterismo se realizó una ecocardiografía de control para asegurarse de correcta posición del stent en el conducto. Todos los niños recibieron cefazolina intravenosa durante el procedimiento. Todos recibieron aspirina 5 mg/kg/día y dipiridamol 3 mg/kg/día durante 3 meses.
RESULTADOS
Caso 1
Neonato con AP/SVI que tras el procedimiento de apertura de la válvula pulmonar dependía de la PGE1 para mantener una SatO2 del 85-90%; ante la imposibilidad de suspenderla se decidió implantar un stent ductal 17 días después. Durante la implantación del stent ductal se suspendió la perfusión de PGE1; la SatO2 al finalizar el procedimiento fue del 92%
Caso 2
Neonato con AP/SVI que tras la apertura valvular con radiofrecuencia y valvuloplastia con balón muestra, en la ecocardiografía practicada en la sala de hemodinámica, escaso flujo anterógrado a través de la válvula pulmonar y constricción ductal a pesar de la infusión de PGE1, por lo que se decide implantar inmediatamente un stent ductal y suspender la perfusión de PGE1. La SatO2 en el momento del alta fue del 88%.
Caso 3
Niño con EPC que requería perfusión de PGE1 tras la valvuloplastia, con lo que mantenía una SatO2 > 9O%; 2 días después presenta una clínica de cierre ductal (fig. 1A) y, a pesar de dosis altas de PGE1, la SatO2 se mantiene alrededor del 68-70%, por lo que se decide implantar el stent ductal de forma urgente. La SatO2 en el momento del alta fue del 90-93%.
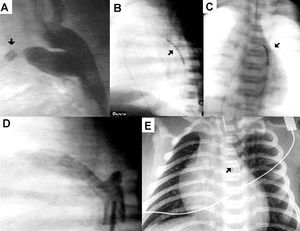
Fig. 1. Paciente con estenosis pulmonar crítica. A) Aortografía, véase otro catéter (flecha) en la arteria pulmonar que muestra la constricción ductal. B y C) Stent montado en balón (flecha) antes del inflado, visión lateral y anteroposterior. D) Aortografía una vez implantado el stent. E) Radiografía de tórax en la que se observa el stent (flecha).
Seguimiento
En ningún niño hubo necesidad de reiniciar la perfusión de PGE1 o de realizar una FBT de urgencia en el período agudo. En la tabla 2 se muestra el período de seguimiento; en todos ellos, el conducto arterioso permanecía abierto, sin que se observara un cuadro clínico de hiperaflujo pulmonar o necesidad de diuréticos. La presión pulmonar era normal en todos ellos. Ocurrió lo mismo con la presión del ventrículo derecho, a excepción del paciente con EPC, que había quedado con una estenosis pulmonar residual por ecocardiografía.
DISCUSIÓN
En 2 series representativas10,11 de pacientes con AP/SVI con perforación valvular con radiofrecuencia se ha comunicado que el 52% (14/27 y 17/33) necesitó una FBT entre los días 2 y 24 después del cateterismo terapéutico. En la EPC se ha observado que tras la valvuloplastia pulmonar, en el 7% de los pacientes fue necesaria una FBT12.
En el momento actual no se conocen con exactitud los factores que puedan predecir qué pacientes vayan a necesitar una FBT tras la liberación de la obstrucción del tracto de salida del ventrículo derecho13. Identificar estos factores nos permitiría estratificar a los pacientes y crear en ellos una FBT sin esperar demasiado tiempo o hacerlo electivamente. La efectividad del stent en determinadas lesiones con circulación pulmonar dependiente ha sido puesta en duda por Gibbs et al8, pero todos los pacientes de esa serie tenían un diagnóstico de atresia pulmonar con comunicación interventricular (CIV) y en esta enfermedad el conducto arterioso es generalmente largo y tortuoso6. Por el contrario, Schneider et al9 comunican que en 8 pacientes con AP/SVI o EPC, la implantación de un stent se realizó con éxito en todos ellos, sin mortalidad ni necesidad de reiniciar la administración de prostaglandinas. Esto se explicaría porque el conducto arterioso en la EPC y AP/SVI es corto y recto.
Se ha observado que el stent ductal está completamente endotelizado a los 30 días8. La permeabilidad del stent disminuye con el tiempo9; en 4 de 6 pacientes se ocluyó completamente entre los 4,5 y 17 meses (media, 10 meses), pero esta evolución es deseable en estos pacientes, puesto que ya el ventrículo derecho se ha adaptado a la fisiología biventricular.
Nuestra breve experiencia refleja 3 situaciones diferentes. En el caso 1 fue necesario implantar el stent electivamente 17 días después porque no se podía suspender la perfusión de PGE1. El caso 2 requirió la implantación inmediata del stent porque la ecocardiografía en la sala de cateterismo mostró que, a pesar de haberse abierto completamente la válvula pulmonar, casi no había flujo anterógrado pulmonar y había restricción ductal a pesar de la infusión de PGE1. En el tercer caso, el cierre súbito del conducto nos obligó a la implantación urgente del stent 2 días después.
COMENTARIOS
Aunque nuestra experiencia inicial es pequeña, podemos plantear las ventajas que ofrece implantar un stent en este grupo de pacientes: a) evitar la creación quirúrgica de la FBT; b) implantación relativamente sencilla, mejor aún cuando, tras finalizar la apertura del tracto de salida, tenemos aún canalizados los vasos femorales; c) implantación temporal: tanto el stent en el conducto arterioso como la FBT son soluciones temporales, puesto que esperamos la viabilidad biventricular en estos pacientes. En los que no sea posible esta evolución, el siguiente paso tras algunos meses sería la fístula de Glenn como paso inicial a la reparación univentricular o la cirugía de 1 y 1/2 ventricular; d) posibilidad de redilatación del stent implantado en el conducto arterioso en los casos en los que éste se haga restrictivo; e) facilidad del cierre del conducto arterioso cuando ya no es necesario utilizando las técnicas de cierre percutáneo ductal; e) evitar la conocida distorsión de las arterias pulmonares tras la creación de la FBT, y f) evitar la terapia prolongada con PGE1.
Un problema que nos planteamos en este artículo y que será necesario estudiar en el futuro es la forma de identificar al grupo de pacientes (aproximadamente el 50 y el 7% en la AP/SVI y EPC, respectivamente) que tras la apertura del ventrículo derecho necesitarán soporte prolongado con PGE1, FBT o un stent ductal.
Correspondencia: Dr. C. Mortera Pérez.
Servei de Cardiologia. Hospital Sant Joan de Déu.
Passeig de Sant Joan de Déu, 2. 08950 Barcelona. España.
Correo electrónico: cmortera@hsjdbcn.org