Full English text available from: www.revespcardiol.org/en
Existe suficiente evidencia de que la diabetes mellitus tipo 2 (DM2) aumenta tanto la morbilidad como la mortalidad cardiovascular. En un estudio reciente se ha estimado que, por cada punto de aumento de la glucohemoglobina (HbA1c), el riesgo relativo de enfermedad cardiovascular (ECV) aumenta un 18%1. Sin embargo, los estudios de intervención dirigidos a demostrar que la optimización del control glucémico se traduce en una reducción de ECV no han resultado concluyentes. Ello plantea la importancia de la elección del tratamiento antidiabético en cuanto a su acción cardiovascular, independientemente de su efectividad en reducir las cifras de glucemia. En la última década se han comunicado varios resultados en este sentido que, en general, han mostrado que la mayoría de los agentes antidiabéticos tienen, como mucho, un efecto neutro en cuanto a protección cardiovascular. Sin embargo, en la gran mayoría de los casos, estos resultados se obtuvieron de subanálisis de ensayos clínicos cuyo objetivo principal no era la seguridad cardiovascular.
En 2008, tras la retirada del mercado de la rosiglitazona por su potencial efecto favorecedor de eventos cardiovasculares, se produjo un punto de inflexión, ya que, dentro del proceso regulatorio, la Food and Drug Administration (FDA) instó a efectuar ensayos clínicos específicamente dirigidos a evaluar la seguridad cardiovascular de todos los nuevos antidiabéticos que salieran al mercado2. De hecho, la FDA no considera aceptable un límite superior del intervalo de confianza de la razón de riesgo cardiovascular superior a 1,82.
A partir de entonces se han publicado 6 ensayos clínicos multicéntricos, prospectivos, aleatorizados y controlados para evaluar la seguridad cardiovascular de los fármacos empleados en el tratamiento de la DM2, que han incluido en total a más de 58.000 personas. En 3 de ellos se han evaluado los inhibidores de la dipeptidil-peptidasa (DPP-4): saxagliptina (estudio SAVOR-TIMI 533), alogliptina (estudio EXAMINE4) y sitagliptina (estudio TECOS5); en 2, los agonistas del receptor del péptido similar al glucagón-1 (GLP1-RA) lixisenatida (estudio ELIXA6) y liraglutida (estudio LEADER7) y en 1, un inhibidor del cotransportador de sodio-glucosa (SGLT2), la empagliflozina (estudio EMPA-REG OUTCOME8). De todos los inhibidores de la DPP-4 estudiados y lixisenatida, se ha demostrado la no inferioridad en comparación con placebo en cuanto a mortalidad y morbilidad cardiovasculares, que era el objetivo principal. Sin embargo, tanto la empagliflozina (estudio EMPA-REG OUTCOME8) como muy recientemente la liraglutida (estudio LEADER7) han mostrado superioridad respecto al placebo en reducción de mortalidad y morbilidad cardiovasculares. Estos resultados son un hito relevante y pueden condicionar el tratamiento clínico del paciente diabético, dada la importancia de la ECV en el pronóstico de estos pacientes.
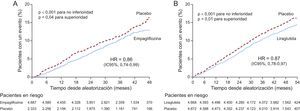
El estudio EMPA-REG OUTCOME es el primer ensayo clínico en que se demostró que un agente antidiabético es capaz de reducir los eventos cardiovasculares8. Se incluyó a un total de 7.020 pacientes con DM2 y ECV establecida, que se siguieron durante un periodo medio de 3,1 años. El evento primario (variable principal) era la combinación de mortalidad cardiovascular, infarto de miocardio no fatal e ictus no fatal (MACE). La empagliflozina redujo de manera significativa el riesgo de eventos adversos cardiovasculares mayores (MACE) (hazard ratio [HR] = 0,86; intervalo de confianza del 95% [IC95%], 0,74-0,99; p = 0,04). Sin embargo, se produjeron varios hechos que merecen un comentario. En primer lugar, la significación estadística obtenida en el MACE fue a expensas de la mortalidad cardiovascular, la cual se redujo en un 38% (HR = 0,62; p = 0,001) en el grupo tratado con empagliflozina, mientras que no se encontraron diferencias significativas en las incidencia de infarto de miocardio no fatal (discreta reducción) e ictus no fatal (ligero aumento). En segundo lugar, no hubo diferencias entre las 2 dosis empleadas (10 y 25 mg) y, por lo tanto, no se evidenció un efecto dosis-respuesta en lo que se refiere a seguridad cardiovascular. En tercer lugar, la empagliflozina redujo en un 35% la tasa de hospitalizaciones por insuficiencia cardiaca y tuvo un efecto beneficioso en la mortalidad de ese origen. En cuarto lugar, y quizá el punto más sorprendente, se observó una separación muy precoz de los 2 brazos de tratamiento (empagliflozina frente a placebo) y las diferencias ya eran significativas respecto al objetivo primario (MACE) a los 3 meses de empezar el tratamiento. Estos resultados tan rápidos no indican que el efecto observado se deba a una acción antiarterioesclerótica de la empagliflozina y apuntan hacia un efecto hemodinámico y/o metabólico9,10.
El descenso de la presión arterial sistólica/diastólica fue aproximadamente de 5/2 mmHg y se mantuvo a lo largo del estudio. Si bien ello puede contribuir a la reducción de eventos cardiovasculares, sería esperable observar este efecto como mínimo al año de iniciar el tratamiento, y no ya a los 3 meses. Además, probablemente esta discreta reducción de la presión arterial probablemente debería tener más impacto en el ictus que en los eventos coronarios pero, tal como se ha comentado, este no fue el caso. Por lo tanto, es poco probable que la reducción de la presión arterial desempeñe un papel importante en la seguridad cardiovascular asociada al tratamiento con empagliflozina. El efecto diurético de la empagliflozina, a través de la reducción del volumen intravascular (precarga) y la mejoría de la presión arterial y la rigidez aórtica (poscarga) pueden mejorar la función ventricular y la demanda miocárdica de oxígeno. Ello se puede considerar especialmente atractivo para los pacientes con fracción de eyección reducida e insuficiencia cardiaca. La determinación de péptido natriurético tipo B podría ser útil para confirmar esta hipótesis e identificar el subgrupo de pacientes que más se beneficiarían del tratamiento9. Aparte de estos factores hemodinámicos, cabe mencionar que probablemente exista un factor metabólico inherente a la moderada hipercetonemia que ocurre en los pacientes tratados con inhibidores de SGLT2, con aumento del β-hidroxibutirato. La hipótesis se basa en que la concentración discretamente elevada de β-hidroxibutirato, que es el combustible más utilizado por el miocardio y proporciona más energía en forma de trifosfato de adenosina, tendría un efecto cardioprotector11. Además, se ha demostrado que la administración de inhibidores SGLT2 aumenta el hematocrito, probablemente debido a la hemoconcentración que tiene lugar por su efecto diurético. Este aumento del hematocrito podría facilitar la liberación tisular de oxígeno en el miocardio y con ello contribuir a la cardioprotección11. Los mecanismos involucrados en la acción hipoglucemiante de los inhibidores de SGLT2 y en sus acciones pleotrópicas se han revisado recientemente10.
No se ha publicado ningún estudio de seguridad cardiovascular que utilice otro inhibidor de SGLT2, por lo que no se puede aventurar que el efecto observado con la empagliflozina sea específico de la molécula o inherente a un efecto de clase. Otro punto de interés al que se deberá responder con ensayos clínicos ad-hoc es como gestionar la admistración de diuréticos a los pacientes en tratamiento con SGLT2.
En el estudio LEADER7 se incluyó a 9.340 pacientes, de los que el 81% tenía ECV establecida y/o insuficiencia renal. El seguimiento medio fue de 3,8 años y el evento primario, al igual que en el estudio EMPA-REG OUTCOME, fue la combinación de mortalidad cardiovascular, infarto de miocardio no fatal e ictus no fatal. El tratamiento con liraglutida redujo en un 13% el evento primario (HR = 0,87; IC95%, 0,78-0,97; p = 0,01 para superioridad). Se redujeron tanto la mortalidad cardiovascular como los infartos e ictus no fatales y las hospitalizaciones por insuficiencia cardiaca, pero solo la reducción de la mortalidad cardiovascular fue estadísticamente significativa (reducción del 22%). A diferencia del estudio EMPA-REG OUTCOME, el efecto del fármaco se evidenció más tarde (figura). En el LEADER, las diferencias entre el grupo placebo y el tratado con liraglutida empezaron a ser evidentes a partir del año de seguimiento, lo que indica un efecto en la progresión de la ateromatosis más que un efecto hemodinámico-metabólico.
Diferencias en la cronología del efecto beneficioso observado con empagliflozina y liraglutida en los eventos cardiovasculares (combinación de mortalidad cardiovascular, infarto de miocardio no fatal e ictus no fatal) entre los estudios EMPA-REG OUTCOME8 (A) y LEADER7 (B). HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Se ha demostrado la presencia de GLP-1R en miocardio y vasos (células endoteliales y musculares). Los mecanismos por los que los agonistas de GLP-1R ejercerían efectos beneficiosos directos en el sistema cardiovascular se han revisado recientemente12,13. En resumen, los GLP1-RA modulan la presión arterial, la frecuencia cardiaca, la contractilidad miocárdica y la perfusión tisular. Asimismo, reducen la inflamación vascular y protegen del estrés oxidativo. Además, en un estudio experimental reciente se ha demostrado que la exenatida reduce la activación plaquetaria y la formación de trombos14. Por último, el tratamiento con GLP1-RA se asocia a una discreta reducción del colesterol total, el colesterol unido a lipoproteínas de baja densidad y los triglicéridos15, pero no hay suficiente información para concluir que esta ligera mejora del perfil lipídico tenga un impacto significativo en los eventos cardiovasculares.
Una pregunta que aún no tiene respuesta es si el efecto observado con liraglutida es exclusivo de este GLP1-RA o bien se trata de un efecto de clase. Como ya se ha mencionado, el estudio ELIXA demostró no inferioridad (efecto neutro) respecto al placebo en cuanto a seguridad cardiovascular. Sin embargo, los estudios no son comparables en cuanto a diseño y metodología. En este sentido, cabe mencionar que en el estudio ELIXA6 se aleatorizó a un total de 6.068 pacientes (placebo frente a lixisenatida) que habían sufrido un infarto de miocardio o habían estado hospitalizados por angina inestable en los 6 meses previos a su inclusión en el estudio y se los siguió una media de 25 meses. Este es un perfil de paciente distinto del que se incluyó en el estudio LEADER. Además, la variable primaria que se analizó fue la combinación de mortalidad cardiovascular, infarto de miocardio no fatal e ictus no fatal y la hospitalización por angina inestable (este último criterio no se incluyó en el estudio LEADER). Por lo tanto, aunque no hay duda de que existen diferencias de estructura molecular y farmacocinética entre liraglutida y lixisenatida, no se puede concluir con los datos disponibles actualmente que la liraglutida sea el único GLP1-RA con efecto beneficioso cardiovascular en pacientes de elevado riesgo.
Actualmente están en marcha 11 ensayos clínicos (6 con GLP1-RA, 3 con inhibidores de la DPP-4 y 2 con inhibidores SGLT-2) que en conjunto incluirán a más de 80.000 pacientes y pueden aportar respuestas tales como aclarar si la reducción de eventos cardiovasculares observada con la empagliflozina y la liraglutida es un efecto de clase o se trata de un efecto específico de estas moléculas concretas. También sería muy útil que estos estudios incorporaran análisis multivariables a fin de discernir qué variables son las que influyen de modo independiente en los resultados obtenidos. Tanto el estudio EMPA-REG OUTCOME como el LEADER adolecen de este tipo de análisis estadístico.
Seguir las recomendaciones de la FDA respecto a la seguridad cardiovascular de los fármacos antidiabéticos centradas en los eventos isquémicos puede ser cuestionable, ya que supone un gran coste y puede no ser eficiente en identificar y evaluar otros problemas cardiovasculares, como la insuficiencia cardiaca. En este sentido quizá sería más efectivo desde el punto de vista coste-beneficio adoptar una estrategia más individualizada y realizar estudios de seguridad cardiovascular solo cuando exista algún indicio que los justifique y, además, centrados en el problema que se quiere abordar. Así, por ejemplo, si en la fase previa o tras la autorización el problema que parece adecuado abordar es la posibilidad de que el fármaco precipite una insuficiencia cardiaca, habría que diseñar un ensayo clínico específicamente dirigido a responder a esta cuestión.
No hay duda de que es importante que el cardiólogo conozca esta información para la toma de decisiones terapéuticas. Sin embargo, debe evitarse tener situado el foco únicamente en la seguridad cardiovascular y dejar al margen las complicaciones microvasculares o, como ha ocurrido en algunos estudios, analizándolas solo marginalmente y con diseños metodológicos que dejan mucho que desear. Tanto el cardiólogo como el endocrinólogo no deben perder la visión holística de la enfermedad. Así, por ejemplo, sería muy poco serio tener un fármaco muy seguro desde el punto de vista cardiovascular, pero que favoreciera el edema macular diabético y causara ceguera a un alto porcentaje de la población. Otro ejemplo emergente es el deterioro cognitivo, en particular el aumento de prevalencia de enfermedad de Alzheimer entre los pacientes con DM2. Dada la acción neuroprotectora del GLP-1 y su abundancia de receptores en el cerebro, están en marcha ensayos clínicos para demostrar si los GLP1-RA son capaces de evitar la enfermedad de Alzheimer. Tampoco sería oportuno, en caso de que estos ensayos demostraran que reducen el deterioro cognitivo en la población diabética, no tener en cuenta esta propiedad a la hora de seleccionar un antidiabético, especialmente para población diabética de edad avanzada y, por lo tanto, más proclive a la demencia. Todo ello abre una nueva perspectiva en la prescripción del tratamiento antidiabético, que aumenta su complejidad pero lo posiciona hacia una medicina más personalizada o de precisión.
En definitiva, los estudios EMPA-REG OUTCOME y LEADER han iniciado una revolución en la selección de prescripción para todos los profesionales que atienden a pacientes con DM2. En otras palabras, parece adecuado prescribir este tipo de fármacos a los pacientes que ya han sufrido un evento cardiovascular, aun a la espera de estudios que avalen su coste-efectividad. Evidentemente, habrá que estar atentos al impacto que los resultados de estos estudios tengan en las guías. Sin embargo, debe quedar claro que no hay evidencia de efecto de protección cardiovascular en pacientes que no han sufrido un evento cardiovascular o tengan riesgo bajo. Un punto de especial interés será ver si la combinación de empagliflozina y liraglutida tiene efectos aditivos o sinérgicos en la prevención de eventos cardiovasculares. Dado que los mecanismos de acción parecen completamente distintos, es razonable aventurar esta posibilidad. No obstante, habrá que esperar a los resultados de los ensayos clínicos al respecto. Quedan aún muchas preguntas por responder, pero lo cierto es que nos espera un futuro apasionante que va a exigir una colaboración aún más estrecha entre cardiólogos y endocrinólogos para optimizar el tratamiento de la DM, una de las pricipales pandemias del siglo xxi.
CONFLICTO DE INTERESESNinguno.