Con el objetivo de mejorar las limitaciones de la primera generación de stents farmacoactivos, las nuevas generaciones se han desarrollado para mejorar su seguridad y su biocompatibilidad optimizando sus tres principales componentes: la plataforma, el polímero y el fármaco. Además de estas, otras líneas de investigación se centran en desarrollar nuevos dispositivos con polímeros biodegradables, sin polímero, entre los que se incluyen los llamados stents bioactivos, que introducen mejoras en la superficie del stent para optimizar la reendotelización arterial, y finalmente prototipos completamente biodegradables. Es impresionante el esfuerzo en investigación básica, estudios de anatomía patológica e ingeniería de diseño que se ha realizado en los últimos años en este campo. Por lo tanto, la información que ha surgido en poco tiempo también es increíble. En esta revisión se hace un análisis de las novedades y los estudios aparecidos en los últimos 3 años en relación con los stents farmacoactivos. Se analizan las mejoras en la segunda generación y se describe la llamada tercera o siguiente generación de stents farmacoactivos.
Palabras clave:
Key words
Conformité Européene
infarto de miocardio
eventos adversoscardiacos mayores
sistema de transporte del stent
stent farmacoactivo
stent metálico
transcatheter cardiovascular therapeutics course
necesidad de revascularización de la lesión diana.
necesidad de revascularización del vaso diana
Desde la introducción de los stents farmacoactivos (SFA) de primera generación, el progreso en el diseño de las nuevas generaciones ha sido tremendo. Se han introducido mejoras en sus componentes básicos: la plataforma, el polímero y el fármaco. La plataforma ha sufrido cambios significativos tanto en el material como en su diseño. Sedieron cuenta de que los stents de filamentostrut más fino producían una reendotelización más rápida y causaban menor daño vascular inherente al implante, con una menor respuesta neointimal. Se pasó de una plataforma de acero inoxidable a una aleación de cromo-cobalto y la última novedad, la de cromo-platino, que proporcionan mayor fuerza radial, radiopacidad y struts más finos.
Respecto al diseño, las nuevas generaciones se han centrado en cambios para reducir el perfil de cruce, mejorar la flexibilidad y dispensabilidad de los stents. Se pasó de los stents tipo espiral a los diseños tubulares ranurados de celda cerrada y a los modulares de celda abierta, que son los más utilizados. Recientemente se ha presentado un diseño novedoso, llamado tecnología continua sinusoidal, con el objetivo de obtener mayor flexibilidad y mejor navegabilidad del stent. Sobre el fármaco y el polímero, se ha introducido el concepto de que la eficacia y la seguridad de los SFA no deben basarse solamente en el grado de inhibición neointimal del fármaco, sino que se debe tener en cuenta otros factores, como conseguir una óptima reendotelización arterial y evitar una excesiva respuesta inflamatoria1.
Con relación al polímero, el desarrollo de los polímeros biodegradables es actualmente un reto, ya que, para evitar los fenómenos de inflamación tardía asociados a este, es importante encontrar un equilibrio entre el tiempo de degradación del polímero y el tiempo de liberación del fármaco2. Finalmente, han aparecido innovadoras líneas de investigación que se centran en reemplazar el stent metálico (SM) por stents completamente biodegradables. Como concepto es realmente atractivo; los estudios iniciales, sobre todo en animales, parecen prometedores, pero debemos esperar a ver los resultados clínicos en los próximos años3.
Otra línea de investigación prometedora es la llamada tecnología de superficie, que introduce mejoras en la superficie del stent para crear stents sin polímero que optimizarían la reendotelización arterial, con lo que se minimizaría el daño arterial y se favorecería una mejor cicactrización-endotelización arterial tras el implante del stent4.
En los próximos años, ¿veremos si la llamada nueva generación de SFA supera a la segunda generación mejorada?
NOVEDADES EN STENTS. PLATAFORMASEl diseño de un stent y su sistema de transporte ideales requieren tener presente toda una serie de exigencias5: buen empuje y navegabilidad, bajo perfil con capacidad para negociar estenosis severas, adherencia firme al balón, amplia gama de tamaños, alta capacidad de expansión sin cambios en su longitud, andamiaje uniforme del vaso sin obstrucción de las ramas laterales y buena conformabilidad a las angulaciones del vaso. Además, debe ser recruzable hacia las ramas laterales, con buena capacidad de apertura de la celda. El material debe ser biocompatible y resistente a la trombosis, la migración y la compresión extrínseca (fuerza radial); no debe presentar una deformabilidad permanente ni degradación con el tiempo y ha de tener una radiopacidad moderada; todo ello con un coste razonable. Aunque los diseños actuales han logrado avances significativos, no existe un stent ideal, y los ingenieros no cesan de buscar evoluciones (a veces, casi revoluciones) en los stents para mejorar continuamente sus prestaciones. Revisaremos a continuación las novedades aparecidas en los últimos 3 años (o próximas a aparecer) en lo que a plataformas se refiere.
Multilink 8 (Abbott Vascular Corporation, Estados Unidos)El Multilink 8 representa la nueva evolución del diseño Multilink y constituye la plataforma del SFA Xience Prime. Según datos de Abbott Vascular Corp., mejora en un 32% la navegabilidad del stent respecto a su antecesor, el Multilink Vision. Mantiene el grosor de strut de 0,0032", la aleación de cobalto-cromo L-605 y el diseño de tubo ranurado con anillos ondulados y tres links en fase; las modificaciones consisten en el link no lineal de mayor altura y mayor longitud de la celda, el rediseño del anillo final proximal y en el sistema de transporte del stent (SDS), con cambios del sistema de catéter y del balón. El SDS incorpora seis mejoras: un hipotubo reforzado, con un lumen de catéter mayor gracias al rediseño del lumen de inflado en forma semicircular; nueva junta del soporte de unión con el segmento monorraíl de acero inoxidable; vaina distal más flexible; mayor presión de rotura (RBP) del balón (ahora de 18 atm); conificaciones del balón más cortas (reducción de su longitud de entre un 50 y un 67%, según la longitud del balón) y abruptas. La longitud del balón por fuera del stent es de sólo 2,1 mm, con una punta suave y redondeada del SDS.
Estas mejoras se traducen en una mejora de soporte y empuje, mayor flexibilidad y resistencia al acodamiento, un desinflado más rápido y una minimización del daño del vaso. Otras características del stent son un retroceso del 4,4% y los siguientes diámetros máximos de expansión: 3,25 mm para los stents de 2,5 mm, 3,75 mm para los de 2,75 y 3 mm y 4,5 mm para los de 3,5 y 4 mm.
Integrity (Medtronic Corporation, Estados Unidos)El nuevo sistema de stent coronario de Medtronic ha obtenido recientemente la marca CE (enero de 2010) y está disponible como stent no farmacoactivo, si bien está prevista su incorporación como futura plataforma del SFA. Este stent supone un cambio en el proceso de fabricación respecto al Driver, se construye a partir de una única guía que se moldea, frente a los anillos modulares del Driver. En el Driver, a partir de anillos rectos se obtenían anillos sinusoidales que luego se soldaban de manera rotacional, corona a corona; el Integrity se construye a partir de una sola guía a la que se da forma sinusoidal, que luego se enrolla sobre un tubo para soldarla (fig. 1). Dicha tecnología proporciona una mayor flexibilidad: los elementos helicoidales continuos se pueden flexionar en toda su extensión, a diferencia de los stents con segmentos alternos rígidos y flexibles. Según datos del fabricante, mejora en un 116% el perfil de navegabilidad del Multilink Vision, mantiene idéntica la aleación de cobalto-cromo del Driver (MP35N), así como el mismo grosor del strut (0,0036") e idéntica relación metal:arteria. Se incrementa el número de tamaños del stent.
También se ha mejorado el nuevo SDS, el catéter MicroTrac RX, respecto al del stent Driver dotándolo de una mayor capacidad de empuje del cuerpo del catéter. Aumenta el grosor del hipotubo (2,1 frente a 1,9 Fr del Driver) y se integra la punta en el hipotubo, lo que mejora la capacidad de avance del balón. Los diámetros máximos de expansión son 3,5 mm para los stents de 2,25 a 2,75 mm y 4,75 mm para los de 3 a 4 mm.
Taxus y Promus Element (Boston Scientific Corporation; Natick, Massachusetts, Estados unidos)La novedad más destacada de estos stents es que se confeccionan con una aleación de cromo-platino. El platino añadido al acero inoxidable (en proporción del 33% sobre el total de elementos) aporta más radiopacidad (la densidad del platino es superior a la del hierro y el cobalto; la radiopacidad resultante es superior a la del acero 316L y las aleaciones de cobalto-cromo) y fuerza (la fuerza radial de un stent Taxus Element es superior a la de un Liberté o Cypher —stents de acero inoxidable— y de aproximadamente el doble que un Endeavor o Xience V —stents de cromo-cobalto—) y permite un strut más fino, a la vez que muestra biocompatibilidad, estabilidad química y resistencia a la corrosión6.
En cuanto al diseño del stent Element, viene montado en un SDS basado en el catéter de dilatación APEX; un patrón dimensionalmente uniforme de segmentos sinusoidales, cada uno con dos interconectores que muestran dirección inversa a filas alternas, mantiene el equilibrio de fuerzas dentro del stent y permite que, prácticamente, cada segmento opere de manera independiente, lo que mejora la navegabilidad y la conformabilidad. Los picos son más anchos en la corona para redirigir la tensión de la expansión a la porción longitudinal, lo que reduce el retroceso elástico y ayuda a mantener la fuerza radial. Los struts son de 0,0032" (0,0034" en los stents de 4 y 4,5 mm), más finos que los del stent Liberté. Los segmentos son más cortos para mejorar la conformabilidad y minimizar los huecos en la parte externa de las curvas. Se incrementa el número de tamaños del stent. Estos son los diámetros máximos de expansión: 2,75 mm para el stent de 2,25; 3,5 mm para los de 2,5 y 2,75 mm; 4,25 mm para los de 3 y 3,5 mm; 4,75 mm para el Promus Element de 4 mm y 5,75 mm para los Taxus Element de 4 y 4,5 mm.
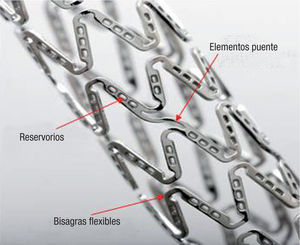
Stent Nevo (Cordis Corp., Johnson and Johnson, Estados Unidos)El Nevo es el nuevo SFA de Cordis, basado en un sistema de reservorios, todavía sin marca CE. Muy diferente del Cypher, este stent se basa en una plataforma de cobalto-cromo más flexible y conformable, con struts más finos (0,0039"), estructura de celda abierta y, sobre todo, con la tecnología de reservorios (que suponen un tercio del volumen del stent) que minimizan el contacto entre la pared arterial y el polímero reduciéndolo en más de un 75% respecto a un stent recubierto en superficie (fig. 2). Esto permite, además, reducir de manera importante la carga de polímero. Lo que los ingenieros denominan «bisagras dúctiles» (los picos en la corona) son las zonas que soportan la máxima deformación en la expansión del stent manteniendo intactos los reservorios con el fármaco incluso en la sobreexpansión, con lo que se evita la fragmentación del polímero.
Stent Biomatrix (Biosensors International Ltd., Singapur)Se trata de un stent que utiliza como plataforma el S-stent, de acero inoxidable, con un grosor de strut de 0,0044" (112 |m), con un diseño de anillo ondulado que recibió la marca CE en enero de 2008. El nuevo stent Biomatrix Flex recibió la marca CE en enero de 2010, pero hasta la última semana de abril de 2010 no se realizó la presentación oficial. El nuevo stent sin fármaco de Biosensors se denomina Gazelle; combina el S-stent con un nuevo SDS. El conjunto destaca por un muy buen perfil de cruce (0,038" para el stent de 2,5 mm) y mínimo retroceso (3,67%)7.
STENTS REABSORBIBLESPreviamente5 se han mencionado ya las ventajas que supondría disponer de un stent plenamente reabsorbible. Este es un campo de intensa investigación, si bien los esfuerzos por desarrollar stents bioabsorbibles han conseguido hasta la fecha un éxito limitado, sobre todo porque el stent no logra proporcionar al vaso un soporte adecuado durante el tiempo suficiente. Como ejemplo, la primera versión del Absorbable Metal Stent (AMS) de Biotronik (Berlín, Alemania). Biotronik está desarrollando una nueva versión que ofrecerá una estabilidad mecánica más prolongada gracias a mejoras en el diseño del stent (diseño moderno de seis coronas), una modificación de la aleación de magnesio que muestra una degradación más lenta y la pasivación de la superficie (stent AMS-2).
El nuevo AMS-2 presenta un grosor de strut de 0,0047" (120 |m) frente a las 0,065" (165 |m) del AMS-1. Los efectos de estas modificaciones han de consistir en un andamiaje del vaso y una integridad del stent más duraderos, una menor inducción de hiperplasia neointimal y un aumento de la fuerza radial (presión de colapso de 120 kPa). Por otro lado, se trabaja en el stent reabsorbible liberador de fármaco para reducir la hiperplasia neointimal. Este stent, el Dreams AMS-3, tendría como plataforma el stent biorreabsorbible de aleación de magnesio con modificaciones en la matriz biorreabsorbible para controlar la liberación del fármaco antiproliferativo3.
Una segunda compañía que está desarrollando un stent coronario bioabsorbible es REVA Medical (San Diego, California, Estados Unidos). El stent REVA está compuesto de un material de policarbonato derivado de la tirosina que tiene fuerza, flexibilidad, retroceso y radiopacidad equivalentes a los del metal, diseñado para reabsorberse por completo a los 2 años. También está en desarrollo una versión liberadora de paclitaxel (stent ReZolve).
El stent bioabsorbible en desarrollo por Abbott Vascular, el BVS, está construido de ácido poli-Lláctico que libera everolimus.
NOVEDADES EN EL POLÍMEROHemos entrado en la era de los stents con polímero biodegradable, stents sin polímero o nanopolímeros y stents completamente biodegradables.
NOVEDADES EN LOS FÁRMACOSLa novedad sería que los SFA del futuro buscan evitar el retraso de la endotelización que producen estos potentes fármacos, ser lo más biocompatibles posible y favorecer una rápida reendotelización tras el implante del dispositivo.
ACTUALIZACIÓN EN RESULTADOS DE LOS ESTUDIOS CON STENTS FARMACOACTIVOSPrimera generación de stents farmacoactivosAun conociendo las limitaciones de los SFA de primera generación, en los últimos 3 años se han
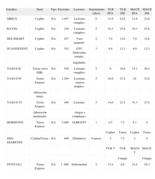
publicado los resultados a largo plazo de los estudios principales de estos stents en «lesiones sencillas» y los resultados de estudios aleatorizados que incluyen «lesiones y pacientes de mayor complejidad». En la tabla 1 se muestran los principales estudios de SFA de primera generación aparecidos en los últimos 3 años, dando preferencia a los estudios aleatorizados publicados.
Estudios aleatorizados de los SFA de primera generación aparecidos en los últimos 3 años
| Estudios | Stent | Tipo | Pacientes | Lesiones | Seguimiento (años) | TLR SFA | TLR SM | MACE SFA | MACE SM |
| SIRIUS | Cypher | EA | 1.057 | Lesiones «simples» | 6 | 11,9 | 22,6 | 11,9 | 22,6 |
| RAVEL | Cypher | EA | 238 | Lesiones «simples» | 5 | 10,3 | 25,8 | 10,3 | 25,8 |
| SES-SMART | Cypher | EA | 257 | Vaso pequeño | 2 | 7,9 | 12,6 | 7,9 | 12,6 |
| SCANDSTENT | Cypher | EA | 332 | OTC, bifurcadas, ostiales, | 3 | 4,9 | 12,3 | 4,9 | 12,3 |
| anguladas | |||||||||
| TAXUS II | Taxus (stent NIR) | EA | 536 | Lesiones «simples» | 5 | 9 | 16,6 | 15,1 | 20,4 |
| TAXUS IV | Taxus Express | EA | 1.294 | Lesiones «menos simples» | 5 | 16,9 | 27,4 | 24 | 32,8 |
| (liberación lenta) | |||||||||
| TAXUS VI | Taxus Express | EA | 446 | Lesiones | 5 | 14,6 | 21,4 | 31,3 | 27,8 |
| (liberación moderada) | «largas y complejas» | ||||||||
| HORIZONS | Taxus Express | EA | 3.006 | IAMCEST | 1 | 4,5 | 7,5 | 8,1 | 8 |
| Cypher | Taxus | Cypher | Taxus | ||||||
| DES-DIABETES | Cypher/Taxus | EA | 400 | Diabéticos | 9 meses | 2 | 7,5 | 2 | 8 |
| TVR T | TVR | MACE T | MACE | ||||||
| Cirugía | Cirugía | ||||||||
| SYNTAX* | Taxus Express | EA | 1 .800 | Enfermedad | 2 | 17,4 | 8,6 | 23,4 | 16,3 |
de tres vasos y/o de TCI
EA: estudio aleatorizado; IAMCEST: infarto agudo de miocardio con elevación del ST; MACE: eventos adversos cardiacos mayores; OTC: oclusión de tronco común; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco común izquierdo; TLR: nueva revascularización de la lesión diana; TVR: nueva revascularización del vaso diana.
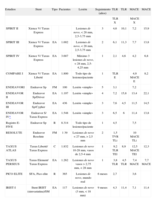
Los dos stents clásicos y más estudiados son el Xience y el Endeavor. En la tabla 2 se muestran los principales estudios de SFA de segunda generación aparecidos en los últimos 3 años, dando preferencia a los estudios aleatorizados publicados.
Estudios aleatorizados o registros con impacto de los SFA de segunda generación aparecidos en los últimos 3 años
| Estudios | Stent | Tipo | Pacientes | Lesión | Seguimiento (años) | TLR | TLR | MACE | MACE |
| TLR X | MACE X | ||||||||
| SPIRIT II | Xience V/ Taxus Express | Lesiones de novo, < 28 mm, 2,5-3,75 mm | 3 | 4,6 | 10,1 | 7,2 | 15,9 | ||
| SPIRIT III | Xience V/ Taxus Express | EA | 1.002 | Lesiones de novo, < 28 mm, 2,5-3,75 mm | 2 | 6,1 | 11,3 | 7,7 | 13,8 |
| SPIRIT IV | Xience V/ Taxus Express | EA | 3.687 | Máximo 3 lesiones de novo, < 28 mm, 2,5-4,25 mm | 1 | 2,1 | 4,6 | 4,2 | 6,8 |
| COMPARE I | Xience V/ Taxus Liberté | EA | 1.800 | Todo tipo de lesiones/paciente | 1 | TLR E | 4,9 MACE E | 8,2 | |
| ENDEAVORI | Endeavor Sp | FM | 100 | Lesión «simple» | 5 | 3,1 | 7,2 | ||
| ENDEAVOR II | Endeavor Sp/Driver | EA | 1.197 | Lesión «simple» | 4 | 7,2 | 15,8 | 13,4 | 22,1 |
| ENDEAVOR III | Endeavor Sp/Cypher | EA | 436 | Lesión «simple» | 3 | 7,6 | 4,5 | 11,5 | 14,5 |
| ENDEAVOR IV* | Endeavor S/ Taxus Express | EA | 1.548 | Lesión «simple» | 3 | 6,5 | 6 | 11,4 | 13,8 |
| Registro E-FIVE | Endeavor Sp | R | 8.314 | Todo tipo de lesiones/paciente | 1 | 4,5 | 7,5 | ||
| RESOLUTE | Endeavor Resolute | FM | 1 39 | Lesiones de novo < 27 mm, > 2,5 mm | 2 | 1,5 TVR TLi | 10 MACE TLi | ||
| TAXUS ATLAS | Taxus Liberté/ Taxus Express | C | 1.832 | Lesiones de novo 10-28 mm, vasos de 2,5-4 mm | 1 | 9,2 TLR TEl | 8,9 | 12,5 MACE TEl | 12,3 |
| TAXUS PERSEUS | Taxus Element/ Taxus Express | EA | 1.262 | Lesiones de novo vasos > 2,75 mm, < 28 mm | 1 | 3,8 TLR | 4,5 TLR | 7,4 MACE | 7,7 MACE |
| PICO ELITE | SFA, Pico elite | R | 365 | Lesiones de novo, mundo real | 6 meses | 2,7 | 3,6 | ||
| IRIST-I | Stent IRIST (simvastatina)/SM | EA | 117 | Lesiones de novo (3 mm, < 18 mm) | 9 meses | 4,3 | 11,4 | 7,1 | 11,4 |
C: estudio que compara el stent en estudio frente a grupo control de pacientes seleccionados de estudios previos; EA: estudio aleatorizado; FM: first in man; MACE: eventos adversos cardiacos mayores; R: registro; SFA: stent farmacoactivo; SM: stent metálico; TLR: nueva revascularización de la lesión diana.
En los últimos años se han publicado los resultados a 3 años del estudio SPIRIT II y los resultados a 1 y 2 años del estudio SPIRIT III, se han presentado en el congreso Transcatheter Cardiovascular Therapeutics Course (TCT) 2009 los resultados iniciales del estudio SPIRIT IV8 y se han publicado los resultados iniciales del estudio COMPARE I.
El estudio COMPARE I, dirigido fuera del programa SPIRIT, aleatorizó a 1.800 pacientes a stent Xience V frente a stent Taxus Liberté en una población en mayor riesgo y con lesiones coronarias más complejas que las del estudio SPIRIT IV. Se han publicado recientemente los resultados a 1 año9, que informan de una menor tasa total de eventos adversos cardiacos mayores (MACE) (muerte total, infarto de miocardio [IM] no mortal y necesidad de revascularización del vaso diana [TVR]) (el 6,2 frente al 9,1%; p = 0,023), así como menor necesidad de revascularización de la lesión diana (TLR) (el 4,9 frente al 8,2%; p = 0,005) y trombosis definitiva/probable (el 0,7 frente al 2,6%; p = 0,002).
A la siguiente generación pertenece el stent Xience Prime; ya se han descrito previamente las características de esta nueva plataforma y sus potenciales ventajas. Este nuevo stent será evaluado en el estudio Xience Prime, que incluirá a 500 pacientes de 75 centros y tendrá dos ramas: una, la llamada rama de lesiones largas, incluirá a 100 pacientes que serán tratados con stents de longitud de 33 o de 38 mm.
Stent Endeavor (Medtronic, Minneapolis, Estados Unidos)En los últimos años se han publicado los resultados a 4 y 5 años del estudio ENDEAVOR I, first in man y II (Endeavor frente Driver). Se han presentado los resultados a 3 años del estudio ENDEAVOR III (Endeavor frente a Cypher) y IV (Endeavor frente a Taxus Express) y se han publicado los resultados a 1 año del registro E-Five. Con el Endeavor Resolute, que incorpora el copolímero BioLinx con zotarolimus, se ha publicado el seguimiento angiográfico y clínico a 1 año.
Stent Endeavor Resolute (Medtronic, Minneapolis, Estados Unidos)El primer estudio en humanos con el nuevo SFA de Medtronic, que incorpora el copolímero BioLinx con zotarolimus, es el denominado Resolute, que incluye a 139 pacientes con lesiones de novo. La pérdida tardía fue de 0,22 ± 0,27 mm. Los MACE a 1, 6, 9 y 12 meses fueron el 4,3, el 4,3, el 7,2 y el 8,7%, respectivamente. El procedimiento tuvo éxito en todos los casos. A 9 meses, las tasas de TLR, fracaso de la lesión tratada (TFL) y trombosis del stent fueron del 9%, el 6,5% y 0, respectivamente10. Finalmente, a 2 años, las tasas de TLR, TVR, TFL y MACE fueron del 1,4, el 1,4, el 7,9 y el 10%, respectivamente. No hubo ninguna trombosis tardía ni muy tardía11.
El estudio Resolute III es un estudio de no inferioridad que aleatorizó a 2.300 pacientes y lesiones del mundo real para comparar el stent Endeavor Resolute con el Xience V en cuanto a muerte cardiaca, IM y TLR a 1 año. Este estudio se inició en abril de 2008. Se esperan los primeros resultados para mayo de 2010 (clinicaltrials.gov).
Stents Taxus y Promus Element (Boston Scientific Corporation; Natick, Massachusetts, Estados Unidos)Ya se ha comentado que la novedad más destacada de estos stents es la nueva plataforma de cromo-platino y se han descrito sus características y potenciales ventajas.
En cuanto al stent Taxus Element, se está llevando a cabo dentro del programa PERSEUS, que evalúa la eficacia y la seguridad de este stent, un estudio de no inferioridad que incluye a 1.262 pacientes aleatorizados 3:1 a Taxus Element frente a Taxus Express. Los resultados a 1 año, que incluyen un 25% de pacientes diabéticos y un 65% de lesiones tipo B/C, muestran la no inferioridad del stent Taxus Element frente al Express, con tasas de FLT (el 5,6 frente al 6,1%; p = 0,78), MACE (el 7,4 frente al 7,7%; p = 0,86), TLR (el 3,8 frente al 4,5%; p = 0,6) y trombosis del stent (el 0,4 frente al 0,3%; p > 0,9) (información facilitada por Boston Scientific y disponible en su página web).
Con relación al stent Promus Element, el PLATINIUM es un estudio aleatorizado que compara Promus Element con el Promus (Xience V) en aproximadamente 1.729 pacientes con un máximo de dos lesiones de novo. Este estudio se inició en enero de 2009, se realizará un seguimiento a 5 años y se esperan los primeros resultados en octubre de 2010 (clinicaltrial.gov).
TERCERA O «SIGUIENTE» GENERACIÓN DE STENTS FARMACOACTIVOSEn la tabla 3 se dispone de un resumen de los principales stents de última generación distribuidos en tres grupos: stents con polímero biodegradable, stents metálicos (SM) sin polímero —que a su vez se dividen en dos grupos: SFA sin polímero y stents bioactivos— y stents biodegradables.
Tercera o «siguiente» generación de stents farmacoactivos
| Tipo de stent/nombre | Empresa (país) | Fármaco | Plataforma | Estudios | Marca CE |
| Stents con polimero biodegradable | |||||
| NOBORI | Terumo (Japon) | Biolimus A9 | Acero inoxidable | NOBORI I: fase 1 y 2.NOBORI II (registro) | Si |
| Biomatrix/Bioam. Flex* | Biosensors (Suiza) | Biolimus A9 | Acero inoxidable | Stealth, Leaders* | Si |
| JacTAX Liberte | Boston Scientific (Estados Unidos) | Paclitaxel | Acero inoxidable | JACTAX, JACTAX LD (np) | No |
| Labcoat Element | Boston Scientific (Estados Unidos) | Paclitaxel | Cromo-platino | No | |
| JacPro/Evolution | Boston Scientific (Estados Unidos) | Everolimus | Cromo-platino | No | |
| NEVO | Cordis (Estados Unidos) | Biolimus A9 | Cromo-cobalto | NEVO RES- I, II (np) | No |
| AXXESS | DebaX (Estados Unidos) | Biolimus A9 | Nitinol | AXXESS PLUS, DIVERGE | Si |
| Xtent | Menlo (Estados Unidos) | Biolimus A9 | Cromo-cobalto | CUSTOM I, II | Si |
| INFINNIUM/INFIN CORETM | Sahajanad (India) | Paclitaxel | Acero inoxidable/cromo-cobalto | SIMPLE I, II (registro) | Si |
| SUPRALIMUS | Sahajanad (India) | Sirolimus | Sirolimus Acero inoxidable | SERIES I, PAINT (np) | No |
| Stents metalicos sin polimero | |||||
| SFA sin polimero | |||||
| VESTASsync | MIV Therap (Estados Unidos) | Sirolimus | Acero inoxidable | ≪FIM≫. VESTASYNC I | No |
| Yukon | Translumina (Alemania) | Rapamicina | Acero inoxidable | ISAR-TEST. In real world | Si |
| BioFreedom | Biosensors (Suiza) | Biolimus A9 | Acero inoxidable | No | |
| Coroflex Please | B. Braun (Alemania) | Paclitaxel | Acero inoxidable | PECOPS-I, II | Si |
| Optima | Sorin (Italia) | Tacrolimus | Tacrolimus Acero inoxidable | Registro OPTIMA (np) | Si |
| Bioactivos | |||||
| Genous | OrbusNeich (Estados Unidos) | Anti CD34 | Cromo-cobalto | HEALING-FIM, HEALING II,GENIUS-STEMI, GENAMI,e-HEALING, HEALING IIb, TRIAS | |
| Titan-2 | Hexacath (Francia) | Titanium NO | Acero inoxidable | TiNOX, TITAX-AMI 1, 2a | Si |
| Catania | CeloNova BioScience (Estados Unidos) | Cromo-cobalto | CATANIA-FIM ATLANTA | Si | |
| Stents biodegradables | |||||
| Polimericos | |||||
| BVS stent | Abbot Vascular (Estados Unidos) | Everolimus | Poly-L-Lactide | ABSORB | No |
| Igaki-Tamai | Kyoto Medical (Japon) | Poly-L-Lactic acid | No | ||
| IDEAL | Bioabsorbable Th. (Estados Unidos) | Polymer salicylate | No | ||
| REVA stent | REVA Medical. BostonScientific Corp. (Estados Unidos | Polymer tyrosinederived polycarbonate | RESORB | No | |
| Metalicos | |||||
| AMS-1 | Biotronik (Alemania) | Magnesium alloy | PROGRESS-AMS | No | |
CE: certificado de conformidad europea; NO: óxido nítrico.
Los dos más estudiados son el Nobori y el Biomatrix Flex. Ambos tienen en común el fármaco biolimus A9 y el polímero bioadegradable PLA en la cara abluminal del stent, que deja un stent metálico libre de fármaco y polímero a los 6-9 meses del implante.
Biomatrix (Biosensors, Morges, Suiza)En el estudio multicéntrico y aleatorizado LEADERS12, se evalúa la no inferioridad del stent Biomatrix Flex frente al Cypher Select™ en 1.707 pacientes del mundo real. El stent Biomatrix Flex fue comparable al Cypher Select en cuanto al objetivo primario combinado MACE a 9 meses (el 9 frente al 11%; p = 0,003 para no inferioridad y p = 0,39 para superioridad) y TVR (el 4,4 frente al 5,5%; p = 0,29). Asimismo el Biomatrix fue no inferior al Cypher con relación al porcentaje de estenosis en el stent a los 9 meses (el 20,9 frente al 23,3%; diferencia, -2,2% (intervalo de confianza [IC] del 95%, -6 a 1,6); p = 0,001 para no inferioridad y p = 0,26 para superioridad). Recientemente se han publicado los resultados de los subgrupos de este estudio en relación con lesiones largas (< 20 mm) y en vasos de pequeño calibre (< 2,75 mm). En total y en cada grupo, como era de esperar, los resultados fueron peores pero comparables.
Stent Nobori (Terumo Corporation, Tokio, Japón)El estudio3 Nobori 1 fase 2 de no inferioridad frente a Taxus Liberté incluyó a 243 pacientes de 29 centros. A los 9 meses, el stent Nobori se mostró superior en cuanto al objetivo primario, con una pérdida luminal tardía del stent de 0,11 ± 0,3 mm frente a 0,32 ± 0,5 mm; p < 0,01 para no inferioridad y superioridad, así como para los objetivos secundarios: reestenosis (el 0,7 frente al 6,2%; p = 0,02), volumen de hiperplasia neointimal medida por ultrasonidos del 2,2 frente al 8,9% (p < 0,02), MACE (el 4,6 frente al 5,6%), tasa de trombosis del stent (0 frente al 4,4%) y TLR guiada por isquemia (0 frente al 2,2%). Otros estudios pendientes de finalizar la inclusión o el seguimiento son el Nobori II (registro del mundo real), el ISARTEST6 (Nobori frente Xience V) y el COMPARE II (Nobori frente a stent de everolimus).
Stents con polímero biodegradable pendientes de la marca CENevo (Cordis Corp., Johnson and Johnson, Estados Unidos)Se han iniciado dos estudios, el NEVO-RES-II (estudio de eficacia y seguridad) y el NEVO-RES-I (estudio aleatorizado, comparado con Taxus Liberté) (clincialtrial.gov).
JacTAX LD (Boston Scientific, Estados Unidos)Con el stent JacTAX se han iniciado dos estudios. El primero es el Jactax (Drug Eluting stent trial), no aleatorizado, que incluye a 100 pacientes de diez centros europeos y compara sus resultados con los del estudio del stent Taxus Atlas (clinicaltrial.gov). El segundo es el estudio JacTAX LD (Drug Eluting stent trial), estudio aleatorizado que compara este nuevo stent con el Taxus Liberté (clinicaltrial.gov).
Stents metálicos sin polímero (SFA sin polímero/stents bioactivos)Ya hemos comentado que este grupo se puede clasificar a su vez en SFA sin polímero, pero con el fármaco «clásico» (p. ej., los stents VESTAsync, Yukon y Optima), y stents metálicos bioactivos, con novedosos recubrimientos con propiedades antitrombóticas, prorreendotelizantes, antiinflamatorias, etc., pero que no liberan los «clásicos» fármacos inhibidores de la proliferación neointimal tipo sirolimus o análogos y taxanos (p. ej., los stents Genous, Titan-2 y Catania). En la tabla 3 se resumen las características principales y los resultados de estos stents.
Stents farmacoactivos sin polímeroEl stent Yukon DES® (Translumina GmbH, Hechingen, Alemania) ya se ha descrito previamente5. Recientemente se presentaron los resultados a 1 año de este stent comparado con el Taxus, pero en pacientes y lesiones no seleccionados del mundo real. Se observaron peores tasas de MACE (el 35,1 frente al 16,6%; p = 0,001), debido a peores tasas de TLR (el 13,7 frente al 4,4%; p = 0,005). No se informó de trombosis del stent Yukon y fue del 0,5% con el stent Taxus, pero esta diferencia no fue estadísticamente significativa14.
Stents metálicos sin polímero (bioactivos)Englobamos en este grupo los stents metálicos con novedosos recubrimientos, no poliméricos, con propiedades antitrombóticas, prorreendotelizantes, antiinflamatorias, etc., pero que no liberan fármacos antiproliferativos.
El mejor ejemplo sería el stent Genous (Orbus Neich, Fort Lauderdale, Forida, Estados Unidos); su plataforma es el R stent, de acero inoxidable cubierto por una matriz biocompatible. Mediante enlaces covalentes, se une a la superficie de esta matriz una capa de anticuerpos monoclonales CD34 que tienen como diana las células CD34+ en circulación. Las células progenitoras del endotelio (CPE) tienen este antígeno de superficie y son atraídas y capturadas por los anticuerpos del stent, lo que favorece y acelera su endotelización.
El estudio HEALING II confirmó y extendió los resultados iniciales del HEALING FIM, en 63 pacientes con lesiones de novo. Los MACE (muerte cardiaca, IM, TLR) a 18 meses fueron el 7,9%, con tasa de TLR del 6,3%. No hubo eventos trombóticos, a pesar de sólo 1 mes de doble antiagregación. La pérdida luminal tardía en el stent a 6 meses fue de 0,78 ± 0,39 mm, y se produjo una regresión a 18 meses de 0,59 ± 0,31 mm4.
El estudio GENIUS-STEMI15 aleatorizó a 100 pacientes a stent Genous o stent metálico de cromo-cobalto. A 6 meses, las tasas (Genous/SM) de TLR fueron del 14 frente al 4% (p = 0,04); las de IM, el 6 frente al 2% (diferencia no significativa); la de muerte cardiaca, el 4% en ambos, y la de MACE, el 24 frente al 10% (p = 0,03). La pérdida luminal fue de 0,89 ± 0,59 frente a 0,79 ± 0,47 mm. Resultados parecidos se observaron en el estudio GENAMI.
Del registro e-HEALING se dispone de los resultados de 3.196 pacientes a 1 año, con tasas de TLR del 5% y MACE (muerte cardiaca, IM, TLR) del 8,5%.
Stents biodegradables o reabsorbiblesEn el apartado «Novedades en plataformas» se describen las características y las limitaciones actuales de este grupo de stents. Existen dos grupos de materiales utilizados en este tipo de stent: los construidos a partir de biopolímeros orgánicos (stents poliméricos biodegradables) y los hechos de metales corrosibles (stents metálicos biodegradables)3. Sin embargo, hasta la fecha ninguno de estos materiales/stents ha sido capaz de conseguir un buen equilibrio entre la biocompatibilidad, la cinética de degradación necesaria para proporcionar un soporte adecuado que limite el retroceso elástico o recoil durante el tiempo suficiente y la inflamación. En la tabla 3 se resumen los principales stents de este grupo, así como sus estudios.
CONCLUSIONESComo se ha podido comprobar en este artículo, el campo de los SFA, al igual que el campo tecnológico en el mundo moderno, está en continua evolución y avanza a una velocidad vertiginosa.
Respecto a la primera generación de SFA, la segunda generación clásica se ha mostrado, sin entrar en detalles, al menos comparable o más eficaz, sobre todo gracias a una reducción de la tasa de TLR a medio plazo y por tener un mejor perfil de seguridad (trombosis del stent) en pacientes y lesiones del mundo real. Sin embargo, las empresas responsables de la primera generación ya están presentando sus versiones mejoradas, como Taxus y Promus Element y Nevo. Pero las de la segunda generación no se quedan atrás y también presentan sus mejoras, sobre todo en lo referente a la plataforma (Xience Prime), pero también en el polímero (copolímero Biolink), Endeavor Resolute, así como en la plataforma, Stent Integrity. Todas estas mejoras se tendrían que traducir en mejoras en los resultados clínicos en próximos estudios.
Otra línea de investigación se centra en el grupo de los stents con polímero biodegradable. En este grupo, los dos más estudiados (Nobori y BioMatrix Flex) se han demostrado comparables a 9 meses; en el caso del stent BioMatrix, comparado con el Cypher y el Nobori, ha mostrado ser superior al stent Taxus Liberté. Al mismo tiempo, Cordis y Boston Scientific presentan sus nuevos prototipos con polímero biodegradable y plataformas de cromo-cobalto y cromo-platino, potencialmente mejores que las de acero inoxidable. Sin embargo, los próximos estudios deberán demostrar si lo que parece en teoría una ventaja es en la práctica un hecho y si esta nueva combinación es mejor que la previa.
Finalmente, hay otras dos líneas de investigación con más futuro que presente pero que, como concepto, son tremendamente atractivas. La primera se centra en lo que se llama la tecnología de superficie. En el primer subgrupo de SFA libres de polímero hemos observado ya algunas sombras iniciales, como los resultados del stent Yucon (rapamicina) que, si bien se mostró comparable al stent Taxus a los 6 meses, a 1 año se ha mostrado inferior, con mayores tasas de MACE y TLR. En cambio, en el grupo de los llamados stents bioactivos, los resultados iniciales son prometedores con los stents Genous, Titan216 y Catania, sobre todo en cuanto a la tasa de trombosis del stent, aunque con margen de mejora en lo que respecta a la eficacia-TLR (en general, superior a la de un stent metálico, pero inferior la de un SFA) y la plataforma, ya que, excepto el Catania, la plataforma común a todos ellos es la de acero inoxidable.
El futuro está en los stents biodegradables, pero debemos esperar y ver si en los próximos años superan las limitaciones iniciales respecto a proporcionar al vaso un soporte adecuado el tiempo necesario, así como a inhibir de forma eficaz la hiperplasia neointimal inherente al implante del stent.
conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.