Palabras clave
INTRODUCCIÓN
En esta revisión se tratarán algunos de los aspectos de más interés referidos a la estimulación cardiaca, siguiendo los objetivos de estos suplementos. Los avances más significativos en el último año han sido, por una parte, los derivados del desarrollo tecnológico en relación con el control ambulatorio y las herramientas de control clínico, y por otro, el proyecto de acreditación de las unidades de estimulación cardiaca en nuestro país.
La gran cantidad de información médica generada en el campo de la estimulación cardiaca durante este año ha sido valorada, filtrada y expuesta en un apartado especial en este artículo con el objetivo de mantener al día al médico dedicado a este campo de la cardiología.
CONTROL AMBULATORIO
Durante estas últimas décadas, varios hechos han contribuido de forma significativa a la modificación de las políticas sanitarias en cardiología en los países industrializados. Por un lado, el tratamiento agresivo y precoz de la enfermedad coronaria ha frenado la mortalidad inicial de esta enfermedad. Por otro lado, se han consolidado tratamientos muy eficaces de prevención secundaria, tanto en esta área como en otros tipos de miocardiopatía. Con ello, la supervivencia de la población ha aumentado claramente, lo que ha favorecido con el tiempo la presencia de cuadros de insuficiencia cardiaca.
En este ámbito, la estimulación cardiaca permanente está desempeñando un papel primordial, ya que es preciso implantar un mayor número de marcapasos (MP) en enfermedad preponderante de la tercera edad, mayor número de desfibriladores, especialmente como prevención primaria en los pacientes tratados tras síndromes coronarios agudos, y resincronizadores en una población cada vez más numerosa de pacientes con insuficiencia cardiaca avanzada refractaria a fármacos. Por consiguiente, el número de implantes de dispositivos de estimulación cardiaca ha aumentado de forma muy significativa en todo el mundo. En España, a pesar de registrarse un incremento porcentualmente más discreto que en la mayoría de los países de nuestro entorno, se ha triplicado en los últimos 6 años. Este hecho se acompaña de otra característica trascendente: los estimuladores ofrecen más prestaciones terapéuticas y diagnósticas, y cada vez son más complejos, por lo que es preciso programar un mayor número de parámetros. Ambos aspectos contribuyen a generar una significativa sobrecarga asistencial ya que, no solamente el número de pacientes se ha incrementado, sino que, de manera simultánea, el tiempo empleado en el control y el seguimiento de los dispositivos ha aumentado de forma considerable. Entre las medidas implantadas para paliar esta situación cabría destacar la creación en la mayoría de los centros de consultas específicas de seguimiento, así como la participación de personal de enfermería cualificado1 que realiza en muchos hospitales una gran parte de las revisiones de pacientes portadores de marcapasos, mientras que la consulta médica se reserva únicamente a los que no cumplen unas normas estrictas de normofunción.
Desde las últimas décadas, las empresas de estimulación cardiaca permanente han trabajado en la creación de sistemas de control a distancia de los dispositivos2. El primero de ellos fue presentado en nuestro país en el año 2002. Biotronik® puso a nuestra disposición un transmisor que permitía hacer un chequeo del estado del marcapasos o del desfibrilador desde el domicilio del paciente a través de un receptor-emisor similar a un teléfono móvil (Home Monitoring [HM])3. A continuación, con la utilización de la línea telefónica convencional, hacía llegar la información a un centro de servicio contratado que, tras procesarla, emitía un informe por fax al equipo médico responsable del paciente. Posteriormente la información fue accesible por parte del equipo médico mediante conexión a través de página web al centro de procesado, y de una selección de datos en las primeras versiones se pasó a disponer de la información completa, similar a la de una revisión presencial que, a su vez, puede ser seleccionada con anterioridad para simplificar el análisis de los datos. El sistema solamente quedaba limitado a la hora de realizar cualquier test activo (medición de umbrales, detecciones o programación de parámetros).
Después de 5 años, llama la atención la escasa implantación de este método en nuestro país. Mientras que se cuentan por varios millones las transmisiones recogidas en los artículos de revisión, en España a penas se utiliza el control domiciliario (CD) en unas pocas decenas de pacientes.
Recientemente, una nueva empresa de estimulación cardiaca ha desarrollado un sistema similar que, con el mismo objetivo4, presenta solamente algunas diferencias técnicas colaterales con el HM de la empresa Biotronik. Inicialmente el sistema Carelink (C) de Medtronic® precisaba que el paciente se colocara físicamente un pequeño telemando sobre el implante para que se realizara la transmisión. En la actualidad cuenta también con sistema de emisión a distancia similar al HM para los nuevos modelos de estimulación. La mayor diferencia entre ambas empresas se centra en que, mientras el HM es utilizable en exclusiva con los modelos disponibles de los últimos años, el C es aplicable a pacientes con dispositivos implantados en un período retrospectivo de más de 10 años, lo que permite incluir un gran volumen de pacientes de nuestras consultas de forma retrospectiva. Ambas compañías proporcionan un informe resumen con los datos más relevantes. Una tercera empresa, St Jude®, con su sistema Housecall (HC), se suma en la actualidad a este grupo. Se está realizando un estudio multicéntrico europeo planificado para incluir a 160 pacientes con un seguimiento de un año. En nuestro país, solamente un centro dispone de este tercer método, ya que participa en dicho estudio.
Repasaremos a continuación cuáles pueden ser los aspectos que condicionan en nuestro medio la escasa utilización de esta prometedora herramienta de seguimiento eléctrico y clínico ya implantada en otros países de nuestro entorno.
Desarrollo tecnológico
En las últimas décadas del siglo pasado, la inestabilidad de la red telefónica constituyó un freno para la utilización de estos sistemas. El volcado de la información al telemando ubicado en el domicilio del paciente y el posterior envío de la información con la utilización, si era preciso, de varios intentos hasta lograr la recepción correcta en el servidor seguro ha terminado en los dos sistemas comercializados en España en este momento con esta limitación5. Además, el paciente cuenta con una señal de confirmación de un correcto envío de los datos. Tanto con el HM como con C se utilizan sendos centros de recepción comunes para toda Europa, en el primer caso ubicado en Alemania y en el segundo, en Inglaterra. La centralización de este servidor aumenta su seguridad técnica y su confidencialidad. La utilización de Internet como una alternativa al fax agiliza la lectura de los datos y permite, previa traslación a formatos pdf, incluir por parte del personal sanitario autorizado los comentarios correspondientes antes de su inclusión obligada en la historia clínica del paciente. Este sistema, evidentemente, puede asimismo ser archivado en cualquier modelo de historia informatizada.
Ámbito legal
Uno de los frenos más relevantes detectados en nuestro país ha sido un limitado marco legal. En la actualidad parece aceptado que se requiere un consentimiento específico del paciente para la empresa propietaria del servidor ya que, aunque se utilizan específicamente datos personales encriptados, ante determinados supuestos de avería el paciente debe autorizar a priori una asistencia técnica que, en teoría, podría acceder a la información. Desde el punto de vista del personal sanitario, ambos sistemas permiten estructurar el acceso a los datos de un paciente a determinados profesionales, conformando grados diferentes de autorización y responsabilidad.
Plantea una mayor dificultad delimitar la responsabilidad profesional ante una información emitida por el paciente y no revisada por el personal sanitario con la agilidad necesaria. En determinados foros de opinión se ha planteado el extremo de la alerta de 24 h. Evidentemente, este grado de cobertura está fuera del alcance de la práctica totalidad de las unidades de seguimiento. Quizás el único recurso que delimita el servicio del seguimiento domiciliario de dispositivos de estimulación cardiaca en su justa medida sea la especificación de las prestaciones a las que se puede acceder en cada uno de los hospitales que lo implementen. Parece necesario contar con un documento firmado por el paciente y redactado por el hospital responsable en el que queden recogidos y aceptados por ambas partes los grados de cobertura. Puede ser imprescindible concretar que solamente se revisará la base de datos dentro de un horario concreto y en unos determinados días de la semana. De cualquier modo, este aspecto hay que encuadrarlo en la legislación vigente en cada país y, muy probablemente, en la construcción de marcos éticos en la actualidad poco desarrollados6.
Estructura de las consultas
La estructura de una consulta de seguimiento no presencial puede romper, en mayor o menor grado, los moldes de una consulta convencional. En cualquier caso, sería aconsejable precisar de entrada algunos aspectos. Partiendo de la base de que esta herramienta de trabajo persigue simultáneamente optimizar el grado de vigilancia y disminuir la carga asistencial del personal sanitario, nunca puede ser considerada como una prestación «además» de las consultas habituales, sino «en vez» de parte de ellas7,8.
Otra consideración aceptada por una gran parte de los profesionales que se inician en este sistema de seguimiento es que una primera evaluación por parte de un equipo de enfermería entrenado disminuye de forma muy significativa el número de pacientes que deben ser revisados por el médico especialista1. La responsabilidad del equipo de enfermería puede quedar cubierta contando sistemáticamente con la opción de consulta con el facultativo responsable y ciñéndose a un esquema de normalidad estructurado para cada tipo de dispositivos. Podría ser aconsejable el envío de información al paciente para que tenga constancia de que su información ha sido evaluada, precisando o no, en cada caso, una revisión presencial.
Es aconsejable proporcionar a los pacientes un calendario de transmisiones pactadas en el que se precise en qué situaciones deberá realizarlas fuera de ese horario, y se deberá efectuar, o no, una llamada a la consulta de seguimiento del hospital. La utilización de la información remitida por los sistemas disponibles catalogada como alertas deberá quedar reflejada en el contrato establecido entre el paciente y el centro. Es preciso también contar con un horario dentro de la actividad del profesional estructurado para la revisión de las transmisiones. Solamente esto, junto con un código específico para nuestra consulta de CD, permitirá que sea evaluada nuestra actividad dentro de cada centro.
Evaluación de la aceptación del paciente
La aceptación por parte de los pacientes de este sistema de seguimiento, que muy probablemente disminuye el número de entrevistas presenciales con el especialista, puede ser diversa. Parece oportuno que, en una primera fase de implantación de este tipo de actividad asistencial, se realice alguna medición del grado de satisfacción de los pacientes y se establezca en su caso el perfil de los que aceptan de buen grado el sistema y los que pueden ser más reacios a su uso.
Evaluación económica
De los dos sistemas accesibles hoy día, uno de ellos (HM) incluye el precio del servicio de la empresa que procesa la información en el valor del dispositivo implantado. La otra plantea, por el mismo concepto, un pequeño canon por paciente y año. Evidentemente, el resultado del análisis económico de este tipo de seguimiento dependerá de la disminución de dedicación en tiempo que se logre en concepto de supresión de revisiones convencionales. Aunque la utilidad del CD está basada especialmente en el incremento de la seguridad y la agilidad del seguimiento de los pacientes con estimulación cardiaca, el conocimiento de este dato económico es básico para la consolidación del sistema. La información recogida en la literatura científica avala que el CD tiene una buena relación coste-eficacia9,10, pero también concreta que los resultados son difícilmente extrapolables de una realidad asistencial a otra11.
Selección de grupos
Los estudios realizados en los que se ha evaluado la utilidad de esta tecnología de seguimiento, si bien escasos, permiten mantener unas fundadas expectativas en su utilización clínica en diversos supuestos. Dado que se puede programar sistemas de aviso muy precoces, bien automáticos, bien mediados por alertas sonoras de determinados dispositivos, el CD se plantea como un sistema de altas prestaciones en la detección precoz de disfunciones de dispositivos de estimulación cardiaca12. Detección precoz de fibrilación auricular y, por tanto, anticoagulación sin demoras en pacientes sintomáticos13. Corrección mediante cambios de tratamiento o reprogramaciones de terapias improcedentes, en ocasiones previas a tratamientos de alta energía que, por sí solos, suponen consultas presenciales adelantadas14. Además, no podemos olvidar su utilidad como control clínico, especialmente en pacientes poco estables15.
Con estos datos, parece tentadora la aplicación de esta tecnología en la totalidad de los pacientes de nuestras consultas de seguimiento. De cualquier modo, su utilización está condicionada por la estructura asistencial previa. Cada centro deberá realizar una revisión y adaptación personalizada en su sistema de trabajo16. Inicialmente podemos plantear varios escenarios de uso para la consulta de CD:
1. En los centros que cuentan con una consulta de cardiología clínica responsable de los pacientes estimulados que limita la actividad de la consulta específica a la evaluación de los dispositivos, podría suplirse la mayor parte de su actividad presencial por un sistema de CD. Bien es cierto que debe mantenerse una consulta presencial ágil que permita revisar, reprogramar o planificar un intervencionismo en los pacientes en los que se detecten datos que así lo aconsejen.
2. La aplicación del CD en los centros en los que la consulta de seguimiento del paciente estimulado sea simultáneamente la de revisión clínica se podría circunscribir a pacientes estables en lo referente a su enfermedad de base:
-- Intercalarse en un alto porcentaje del total de revisiones en pacientes asintomáticos o poco sintomáticos estables (la mayoría de los pacientes portadores de marcapasos o de desfibriladores indicados en prevención primaria).
-- Sustituir la revisión presencial en pacientes con implantes por prevención primaria sin enfermedad estructural cardiaca (pacientes con desfibrilador por síndrome de Brugada, síndrome de QT largo, etc.).
3. Otro ámbito especialmente propicio para la implantación de este tipo de consulta se ciñe a los pacientes que, disponiendo de un hospital próximo con unidad de cardiología clínica, deben desplazarse al hospital terciario donde se desarrolla de manera simultánea la revisión clínica y de estimulación cardiaca. Dado que con mucha frecuencia se producen repeticiones de las evaluaciones clínicas en ambos centros, es evidente el beneficio económico para el sistema sanitario y el incremento de la comodidad que supone para el paciente y sus acompañantes la sustitución de la consulta presencial por la de CD con la información al paciente y a su cardiólogo clínico de los datos más relevantes.
4. En los supuestos anteriores se propone seleccionar a los pacientes en revisión mediante CD basándose en una escasa necesidad de seguimiento clínico o por contar con una unidad asistencial más accesible que el hospital terciario. No podemos olvidar que este sistema a distancia puede reforzar de forma muy eficaz el seguimiento intensivo de pacientes en situaciones críticas, y disminuir la frecuencia de las consultas presenciales e, incluso, demorar la necesidad de ingreso hospitalario7-15.
5. Por último, el CD se plantea como una herramienta de excepcional utilidad en dos situaciones clínicas que obligan a incrementar las revisiones de seguimiento, específicamente por criterios eléctricos derivados del funcionamiento de los dispositivos:
Pacientes con alta frecuencia de revisiones por encontrarse próximos a alcanzar los criterios de recambio electivo de la unidad de estimulación cardiaca.
Pacientes incluidos en grupos con alertas de posible funcionamiento defectuoso en los que se recomienden seguimientos frecuentes12.
De cualquier forma, este somero repaso al presente del CD solamente pretende introducirnos a una tecnología que progresa en prestaciones a gran ritmo. Proyectos en alto grado de desarrollo, como la comunicación bidireccional con el paciente, opciones para comunicar el dispositivo con el hospital responsable desde cualquier parte del mundo o a través de telefonía móvil, o la posibilidad de programación a distancia de las unidades sin precisar para ello una revisión presencial, podrían ser accesibles en los próximos años17.
ACREDITACIÓN EN ESTIMULACIÓN CARDIACA
La calidad es considerada hoy día una variable estratégica por la mayoría de empresas, instituciones públicas y organizaciones en general. Hasta tal punto es así que se acepta que la supervivencia en el mercado de muchas empresas está directamente relacionada con su capacidad para competir en calidad. Los servicios públicos de salud y sus profesionales tienen, además, una responsabilidad que va más allá de las cuestiones económicas: por la naturaleza del tipo de servicio que prestan y por el carácter público de éstos, la calidad es una exigencia ética.
Desde que, en 1917, en Estados Unidos, el American College of Surgeons compiló el primer conjunto de estándares mínimos de calidad para los hospitales estadounidenses, ha habido diferentes intentos por parte de organismos gubernamentales, tanto americanos como europeos, para garantizar la mejora continua de la calidad de la asistencia sanitaria. Agencias no gubernamentales, como la Joint Commission on Accreditation of Healthcare Organizations (la más importante en Estados Unidos), han tenido como función evaluar la calidad y la seguridad de la atención al paciente en hospitales y clínicas, así como vigilar el cumplimiento de los estándares nacionales establecidos, a través de encuestas sorpresivas y análisis de datos.
En España, la subcomisión parlamentaria para la consolidación y modernización del Sistema Nacional de Salud incluyó en sus recomendaciones, aprobadas por el Pleno del Congreso de los Diputados el 18 de diciembre de 1997, la necesidad de impulsar la mejora continua de la calidad de la asistencia a través de un sistema general de acreditación de centros y servicios sanitarios consensuado en el seno del Consejo Interterritorial. Su objetivo era incrementar progresivamente la equidad en la provisión de servicios de salud, la eficacia en el uso de los recursos, la productividad y una mejora sustancial en la calidad de atención.
Asimismo, las sociedades científicas Española y Europea de Cardiología se han implicado no sólo en la elaboración de un código ético, sino también en el desarrollo de la idea de «responsabilidad convencida y compartida» para toda la organización, sobre todo a la hora de desarrollar y aplicar sistemas de acreditación o evaluación de la calidad18,19. La Declaración de Madrid (un documento de la Conferencia Europea sobre el Futuro de la Cardiología elaborado en junio 2006)20 hace referencia también a la necesidad de la supervisión en la formación y recomienda una mayor demanda de certificación, auditoria y acreditación.
Objetivo de la acreditación
La acreditación en salud es un proceso voluntario y periódico de autoevaluación interna y revisión externa de los procesos y resultados, realizada generalmente por una organización no gubernamental diseñada de manera específica para el sector salud. Garantiza y mejora la calidad de la atención del cliente-paciente en una organización de salud y es realizada por personal idóneo (profesionales de salud) y entrenado para tal fin. Esta evaluación reconoce públicamente a una institución prestadora de servicios de salud el cumplimiento de estándares superiores de calidad. Puede implicar a una institución sanitaria (más frecuente), a una unidad-servicio o a un profesional de la salud.
En este contexto, la Asamblea de la Sección de la Estimulación Cardiaca de la Sociedad Española de Cardiología plantea en el año 2004 la necesidad de idear un sistema de acreditación en estimulación cardiaca permanente. Durante los 2 años siguientes se desarrolló el trabajo que ha llevado a la elaboración del documento guía en acreditación21, que queda resumido en este artículo. Este proceso se orienta específicamente a promover la calidad en la atención a los enfermos con indicación de estimulación cardiaca y, por decisión aprobada en asamblea, se aplica a los centros hospitalarios (la acreditación individual queda enmarcada en lo anterior). Se contempla como una certificación de excelencia dada por una sección de una sociedad científica (sin implicaciones legales) y no se considera una certificación restrictiva para el desarrollo de la actividad profesional en esta área de trabajo para las personas que no accedan a ella. Será de acceso voluntario y no se realizará examen de los candidatos, sino se utilizará la confirmación de su experiencia profesional como sistema de evaluación.
El objetivo de la acreditación en estimulación es establecer un sistema de certificación de idoneidad para centros sanitarios y servicios en el ámbito de la estimulación cardiaca permanente, siguiendo el criterio de la norma internacional ISO 9001-2000.
Definición global del proceso
El documento guía de acreditación se inicia con la definición global del proceso, entendido como el conjunto de actuaciones, decisiones, actividades y tareas que se encuadran de forma secuencial y ordenada, dirigidos a obtener un resultado que satisfaga plenamente las necesidades del paciente al que va dirigido. En el caso que nos ocupa, definiría todos los grupos de profesionales sanitarios implicados en el proceso (industria de electromedicina, asistencia sanitaria extrahospitalaria y diversos colectivos del ámbito hospitalario) y a las distintas actividades del proceso asistencial, que abarcan desde el diagnóstico hasta el estudio clínico cardiológico, la implantación del dispositivo, el seguimiento postimplante, la optimización de la terapia, la vigilancia de las disfunciones y el recambio al final de la vida de la batería. En cada una de estas actividades intervienen varias unidades asistenciales, que también serán especificadas en el proceso. Asimismo, es necesario definir el alcance de la estimulación cardiaca, es decir, su destinatario (los pacientes con trastorno del ritmo cardiaco que reúnan criterios de indicación de estimulación recogidos en las guías internacionales de actuación clínica). El proceso tendrá un responsable (la persona que se responsabiliza de la gestión y mejora del proceso, independientemente de su posición jerárquica dentro de la organización), un equipo gestor (heterogéneo en nuestro país, por la diversidad de grupos responsables del implante y seguimiento) y unos proveedores del proceso (empresas de electromedicina dedicadas a la fabricación y el suministro de los dispositivos de estimulación).
El proceso que nos ocupa precisa esencialmente de la interacción con otros procesos y unidades asistenciales, tales como servicios de radiología, laboratorio, área quirúrgica y anestesiología. Se valorará de éstas que el producto recibido por ellas cumple los requisitos obligatorios para desarrollar su labor asistencial y que el control de calidad asegure los resultados percibidos por nuestros pacientes. Se debe contar, asimismo, con un sistema de gestión de personal que proporcione el grupo humano y la dotación material necesaria para aplicar el tratamiento en suficientes condiciones de seguridad y eficiencia. Por último, se comunicará a la dirección del centro el proceso completo para su aprobación.
Respecto a los recursos necesarios para el correcto funcionamiento de la unidad central se incluirían: recursos humanos en las diversas áreas del proceso (consulta de seguimiento, área de registros, electrofisiología, hospitalización, área quirúrgica), material protésico específico (marcapasos en todas sus variedades, resincronizador, desfibrilador, cables, Holter implantable, introductores específicos) y recursos de equipamientos e infraestructuras (áreas de hospitalización con control continuo, sala específica para implantes, almacén de material, equipo de fluoroscopia, material quirúrgico y de emergencias).
Indicadores de calidad
Todas las actividades desarrolladas para lograr el objetivo final de calidad de vida optimizada del paciente se recogen en el mapa del proceso (fig. 1). Para evaluar la optimización del proceso, hay unos indicadores de calidad (tabla 1) que incluyen: la agilidad de acceso (lista de espera asistencial para acceso de enfermedades urgentes y demorables y realización de pruebas, demoras quirúrgicas y en consultas de seguimiento), la eficacia (evaluación de la adaptación de los diagnósticos a las recomendaciones planteadas en las guías y evaluación de complicaciones), la actualización permanente (preparación técnica del personal y su formación continuada, y la actualización del equipamiento), la satisfacción del paciente (recogida de datos como la percepción del paciente en cuanto a eficacia, trato, agilidad, reclamaciones y demandas), y la optimización de costes (comprobación de duración de los estimuladores por tipos y enfermedades, y establecimiento de concursos públicos para la selección de proveedores del material protésico).
Fig. 1. Diagrama de flujos y mapa global del proceso de acreditación en estimulación cardiaca.
La documentación empleada (tabla 2) como soporte para la evaluación del proceso incluirá documentos tales como: libro del paciente portador, consentimiento informado, protocolo de detección de complicaciones, base de datos o petición normalizada de implante y seguimiento, controles de calidad del laboratorio y registros (historia clínica, tarjeta europea, hoja quirúrgica, solicitud de implante de dispositivo). Finalmente, la planificación general de mejora del proceso se basará en la opinión del personal sanitario (a través del libro de recogida de incidencias, reuniones periódicas y encuesta de satisfacción), opinión de pacientes y usuarios, sistema de autoevaluación y corrección de disfunciones, control de gestión (evaluación anual del proceso por la unidad asistencial y la dirección de gestión), revisión del sistema y auditoría externa con revisión inicial de la documentación aportada por la junta habilitada en la Sección de estimulación cardiaca y posteriormente por una empresa auditora independiente. La sección acreditará, por último, la calidad del proceso en el centro por un período de 3-5 años (tabla 3). La acreditación individual puede realizarse a posteriori si así se solicita, y precisa requisitos específicos.
HERRAMIENTAS DE CONTROL CLÍNICO EN LOS DISPOSITIVOS DE ESTIMULACIÓN CARDIACA
Desde su comercialización, hace casi 50 años, los marcapasos cardiacos han mejorado la vida de millones de pacientes. Durante todo ese tiempo se han producido avances tecnológicos continuos que han llevado a mejorías significativas en la seguridad, la longevidad, la función y la técnica de implante que han permitido que la estimulación cardiaca sea considerada como una de las terapias más efectivas de la medicina moderna22. Además, las indicaciones de la estimulación cardiaca se han extendido más allá del tratamiento de la bradicardia sintomática y en estos momentos se indica en pacientes con miocardiopatía hipertrófica, síncope neuromediado y disfunción ventricular severa23.
El concepto de control (transtelefónica) se introduce en la estimulación cardiaca al comienzo de la década de 1970, para vigilar las funciones básicas del sistema de estimulación y la longevidad de los marcapasos24. La aparición de baterías de larga duración y el desarrollo de circuitos eficientes han permitido fabricar dispositivos complejos y sofisticados, con multitud de funciones y con capacidad para almacenar información, que permiten conocer el comportamiento de las unidades y ofrecen, además, la oportunidad de vigilar y controlar algunos aspectos del estado clínico de los pacientes.
Fibrilación auricular
En pacientes portadores de MP, sean unidades del ventrículo izquierdo (VI) o de estimulación bicameral sin respuesta en frecuencia (DDD), las taquiarritmias auriculares, principalmente la fibrilación auricular (FA), son muy frecuentes. Cuando su incidencia es evaluada basándose en la presencia de síntomas o registros intermitentes (electrocardiograma [ECG] y Holter), son seguramente subestimadas; en cambio, pueden ser sobreestimadas (por sobresensado auricular, sobre todo del campo lejano ventricular) cuando se usan únicamente los contadores incluidos en la memoria de los dispositivos25. Sin embargo, cuando se utiliza para su reconocimiento el análisis de los electrogramas intracavitarios (EGM) almacenados, llega a estar presente en más del 50% de los pacientes con MP doble cámara, son asintomáticas en casi el 80% de ellos y, aunque son más frecuentes en los pacientes con antecedentes de taquiarritmias auriculares (TA) antes del implante, no hay diferencias significativas entre pacientes con enfermedad de nódulo sinusal (ENS) y bloqueo auriculoventricular (BAV)26.
Por las implicaciones clínicas que puede tener (interrupción del tratamiento anticoagulante o necesidad de introducir fármacos antiarrítmicos), es muy importante su detección correcta, sobre todo, las que son mínimamente sintomáticas o asintomáticas. De manera reciente se ha destacado la importancia clínica que tiene el grado de control de la frecuencia cardiaca (FC) en los pacientes con ENS, portadores de MP y con episodios recurrentes de FA, y se ha documentado que los pacientes con recurrencias de TA y frecuencia ventricular alta (FC >100 lat/min durante los episodios de TA), detectada por las herramientas diagnósticas de los dispositivos, tienen mayor sintomatología durante los episodios de TA y mayor número de hospitalizaciones27.
La mayor parte de los marcapasos tiene limitaciones, más o menos significativas, para informar, con exactitud, acerca del número de eventos arrítmicos (carga arrítmica). Esas limitaciones son debidas, principalmente, a la imposibilidad de almacenar EGM o a la reducida capacidad para almacenarlos (entre 1 y 6 min). Sin embargo, algunos marcapasos (AT500TM Medtronic Inc.), y más recientemente el modelo EnRhythmTM Medtronic Inc., tienen una mayor capacidad de memoria y permiten almacenar más de 16 min de 2 canales de EGM.
El dispositivo AT500TM es un marcapasos DDDR con funciones diagnósticas avanzadas para la detección TA, y algoritmos de prevención y tratamiento de éstas. El algoritmo para la detección de las TA está diseñado para clasificarlas basándose en la frecuencia y la regularidad de las señales auricular y ventricular. Para ello, las reconoce dentro de un rango de longitud de ciclos basado en dos zonas programables, una para la detección de TA lentas y otro para detectar FA, y puede, además, programarse una zona de solapamiento entre el intervalo más corto de las TA lentas y el intervalo máximo de la zona de FA. Cualquier TA detectada en la zona de solapamiento será clasificada como TA o FA por un criterio de regularidad. Si la longitud de ciclo más corto y más largo difieren en menos del 25% de la longitud de ciclo media, será almacenada como TA, y si es mayor del 25%, será considerada como irregular y almacenada, por tanto, como FA. De esta manera, son capaces de detectar TA con una especificidad del 97% y una sensibilidad del 100%28, y rechazar la detección inadecuada de la R de campo lejano gracias al ajuste automático de la sensibilidad y con el algoritmo detección lógica que reconoce el patrón corto-largo asociado con la detección auricular de campo lejano29. Esto permite, por tanto, un continuo y detallado control de las taquiarritmias auriculares, lo que proporciona un diagnóstico precoz y seguro, y facilita la aplicación del tratamiento óptimo, además de ofrecer información acerca del tipo de arritmia, su frecuencia y su evolución30 (fig. 2).
Fig. 2. Detalle cardiac compass. Tendencias de las arritmias auriculares. Informa acerca de la carga arrítmica, útil para la respuesta a fármacos antiarrítmicos y el control del riesgo de eventos embólicos.
Uno de los problemas encontrados con más frecuencia en el seguimiento de los pacientes con ablación de venas pulmonares por FA es la identificación de las recurrencias asintomáticas, que no son despreciables y que pueden afectar hasta al 37% de los episodios en algunas series31. Lógicamente, esto supone una dificultad añadida a la vigilancia y el tratamiento de estos pacientes, en relación sobre todo con la administración de tratamiento anticoagulante y fármacos antiarrítmicos, y con el reconocimiento de posibles fracasos del procedimiento de ablación. Recientemente se ha puesto de manifiesto el papel del control de la TA en pacientes portadores de MP con ablación de FA. En un grupo de pacientes portadores de MP AT500, principalmente indicado por síndrome bradicardia-taquicardia y frecuentes episodios de FA paroxística o recurrente, en los que se realizó un aislamiento de las venas pulmonares, el control con EGM ha demostrado que es capaz de identificar a más pacientes con episodios de recurrencia de FA que el control intermitente con Holter32.
Apnea del sueño
El síndrome de apnea/hipopnea del sueño (SAHS) es un trastorno respiratorio muy frecuente en la población general y que puede llegar a rango de epidemia en la población obesa33. La Sociedad Española del Aparato Respiratorio (SEPAR) ha definido el SAHS como un síndrome caracterizado por excesiva somnolencia durante el día y manifestaciones neuropsiquiátricas, causadas por una alteración anatómica y/o funcional de la vía aérea superior que conduce a la aparición de episodios repetidos de obstrucción durante el sueño, alteraciones en la saturación de oxígeno, despertares transitorios y sueño no reparador34. La polisomnografía nocturna es considerada el patrón de referencia para su diagnóstico, de acuerdo con todas las guías internacionales.
El SAHS se clasifica en forma obstructiva y central. En la forma obstructiva, el tono muscular en la vía aérea no es suficiente para mantenerla abierta. En la forma central, el trastorno respiratorio se debe a la interrupción de la actividad del diafragma por alteración de los mecanismos de regulación central del control respiratorio y se encuentra con frecuencia en los pacientes con insuficiencia cardiaca.
El tratamiento con presión positiva continua en la vía aérea (CPAP) es una terapia efectiva del SAHS y se considera, desde hace años, de primera elección. La CPAP ha demostrado ser altamente efectiva para aliviar los síntomas, reducir la morbimortalidad y mejorar la calidad de vida35. Sin embargo, una tasa alta de pacientes se siente incómodo durante su uso y entre un 20 y un 35% deja de usarla por la incomodidad que les produce36. Por ello, el hallazgo de que la sobreestimulación auricular (SEA) puede reducir significativamente el número de episodios de apnea centrales y obstructivas37 crea una gran expectativa, ya que puede aventurarse una nueva opción terapéutica. No obstante, y aunque se han señalado algunos mecanismos que pueden explicar los efectos de la SEA, ningún estudio ha sido capaz de confirmar que la SEA pueda afectar significativamente al SAHS38-40.
Hasta un 59% de los pacientes portadores de MP tiene un SAHS no diagnosticado, y no se sabe con certeza si el tratamiento del SAHS puede modificar la necesidad de estimulación41. En cualquier caso, el SAHS debe ser sistemáticamente buscado en pacientes estimulados, debido sobre todo al efecto deletéreo que puede producir sobre la evolución cardiovascular.
Ciertos MP comercialmente disponibles tienen un sensor basado en la medición de la impedancia transtorácica (ITT), que es usado de forma primaria para incrementar la frecuencia de ejercicio en respuesta a los cambios en la ventilación minuto. La ITT es capaz de seguir las fluctuaciones que experimenta el volumen corriente durante el SAHS y los cambios en el volumen minuto (VM) respiratorio en fases de apnea/hipopnea o en situación basal normal, y pueden ser controlados y registrados por el sensor ventilación minuto de los marcapasos Talent 3 (ELA Medical). Para detectar el período de sueño y los movimientos respiratorios, el sensor proporciona tres clases de información:
1. Estimación del VM. El sensor deriva un índice de VM de las medidas de impedancia transtorácica. Para medir la impedancia transtorácica se libera un pulso de baja energía (320 µA, 5 µs, 8 Hz) entre la carcasa del MP y el anillo de un electrodo bipolar implantado en la cámara cardiaca, y se mide el valor de la señal de impedancia entre la punta del electrodo y la carcasa del MP. La ITT aumenta con la inspiración, disminuye con la espiración y su amplitud varía con el volumen corriente. La amplitud y el período de cada ciclo respiratorio se miden desde la señal de impedancia, correlacionándose la amplitud con el volumen corriente y el período con la frecuencia respiratoria.
2. Reconocimiento de los períodos de sueño o reposo. El algoritmo del dispositivo ha sido diseñado para determinar si el paciente está activo o en reposo; para ello se compara el valor del VM con un valor umbral previamente determinado. Por otro lado, el sensor es incapaz de detectar cambios instantáneos en el perfil respiratorio (despertar transitorio), pero los períodos sostenidos de vigilia/sueño si son correctamente estimados.
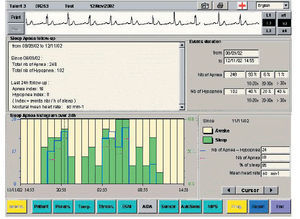
3. Identificación de las pausas de apneas y otras alteraciones respiratorias. Mediante el análisis automático de la impedancia en tiempo real, el MP con sensor VM puede detectar el cese sostenido o la reducción sostenida de la respiración durante el sueño (apnea e hipopnea) y el MP ha sido diseñado para detectar la frecuencia global de la apnea e hipopnea y, por lo tanto, permite detectar y controlar la evolución del SAHS en pacientes portadores de ese tipo de MP (fig. 3).
Fig. 3. Identificación de las pausas de apnea e hipopnea por un marcapasos que ha sido diseñado para detectar y controlar la evolución del síndrome de apnea/hipopnea del sueño (SAHS).
En un estudio42 realizado en 46 pacientes se concluye que el algoritmo es una herramienta útil para detectar y vigilar el SAHS grave, con una sensibilidad del 75% y una especificidad del 94%, y se destaca que es completamente automático y que puede ayudar al seguimiento a largo plazo de estos pacientes en relación con la evolución y el control del tratamiento. Al mismo tiempo, y mediante la utilización de otras herramientas diagnósticas del MP (p. ej., función Holter), se puede avanzar en el conocimiento de la asociación de arritmias y trastornos del sueño y seguir su evolución.
Control del rechazo cardiaco en pacientes trasplantados
El seguimiento ambulatorio de los pacientes que ha superado la fase precoz de un trasplante cardiaco tiene como objetivo evaluar la situación general del paciente, descartar posibles complicaciones relacionadas con el trasplante y detectar de manera precoz el rechazo del trasplante (RT). Debido, fundamentalmente, a la mejora en el mantenimiento de la inmunodepresión, la contribución del RT a la mortalidad del trasplante ha ido disminuyendo con el tiempo pero, a pesar de ello, la aparición de uno o más episodios de RT sigue considerándose un problema clínico grave y un importante factor de riesgo para la supervivencia a largo plazo43. Para controlar su diagnóstico, la mayor parte de los grupos considera y recomienda, a pesar de sus limitaciones, la realización de una biopsia endocárdica repetida como el método de elección44. Las complicaciones asociadas con la biopsias endomiocárdicas están relacionadas con la inserción del catéter (lesión de la arteria carótida) o con el procedimiento de la toma de muestras (arritmias y trastornos de conducción y perforación), que por fortuna son raras y sin consecuencias a largo plazo. Una complicación usualmente relacionada con el traumatismo inducido por las biopsias repetidas en el corazón trasplantado es la insuficiencia tricuspídea, en general bien tolerada y que rara vez requiere sustitución o reparación quirúrgica45. La toma de muestras mediante biopsia endomiocárdica es, por tanto, un procedimiento invasivo, costoso y no exento de complicaciones, por lo que es lógico que se hayan buscado métodos no invasivos que permitan controlar el RT y que puedan reducir de manera significativa su realización. Los cambios estructurales que aparecen durante el proceso del rechazo, como por ejemplo el edema, producen alteraciones en la conducción. Este fenómeno ha permitido el desarrollo de dispositivos que, implantados en el momento del trasplante, permiten controlar mediante telemetría los cambios que se producen en el EGM inducido por el marcapasos (respuesta evocada [REV]), ya que los cambios de la REV se han correlacionado con el rechazo46. Para obtener la REV, en el procedimiento del trasplante se implantan dos electrodos unipolares epicárdicos con superficie fractal (ELC 54-UP, Biotronik, Berlin, Alemania), conectados a un MP doble cámara (Physios CTM 01, Biotronik, Berlin, Alemania). Uno de los electrodos, implantado en el tracto de salida de ventrículo derecho, se conecta al canal ventricular del MP y el otro, implantado en la pared lateral del VI, se conecta al canal auricular. La valoración de la señal plantea no pocas limitaciones. Por un lado, la diferencia interindividual dificulta la comparación de los valores absolutos derivados de la REV de un paciente en particular, por lo que los pacientes son utilizados como su propia referencia y los resultados nuevos se comparan con el promedio de todos los resultados previos. En segundo lugar, la señal de la REV se ecuentra influida por la hora del día a la que se hace, la postura del paciente e, incluso, por la frecuencia de estimulación del test; por ello, y para que la REV sea reproducible, es necesario realizarlo a una frecuencia de 100-120 lat/min, en decúbito tras 5 minu de reposo y a la misma hora de la mañana, lo cual dificulta su realización (fig. 4).
Fig. 4. Respuesta evocada ventricular. VER-T-slew rate es la parte de la REV analizada para la evaluación del rechazo. Es la máxima pendiente negativa en la parte descendente de la fase de repolarización de la REV. Cortesía de Biotronik.
Aunque se apunta la posibilidad de que la REV puede tener valor pronóstico global en el trasplante47, la mayor parte de los estudios realizados destacan su alto valor predictivo negativo (entre el 95 y el 98%)48-50. De este modo, debe considerarse como un buen predictor del rechazo, lo que permite reducir significativamente el número de biopsias endomiocárdicas. Las investigaciones futuras deben centrarse en mejorar la sensibilidad y la especificidad de la técnica y progresar en la automatización del registro y en la transmisión de los datos. Cuanto más fácil, rápida y cómoda sea la obtención y el procesamiento de los datos, mayor será la aceptación por parte de los centros implantadores.
Control del fallo cardiaco
La insuficiencia cardiaca (IC) es un grave problema de salud pública en virtud de su alta prevalencia, mortalidad y morbilidad, así como por el alto coste de su tratamiento. La prevalencia en la población general española mayor de 40 años es del 1%, y llega al 10% a los 70 años51. A pesar de una cuidadosa valoración clínica y bioquímica, los pacientes con IC presentan un elevado número de hospitalizaciones. En España se producen unos 80.000 ingresos hospitalarios por IC cada año y es la primera causa de hospitalización en mayores de 65 años (causante de un 5% de todas las hospitalizaciones)52. La mortalidad de los pacientes con IC es del 50% a los 5 años del diagnóstico y es la tercera causa de muerte cardiovascular en España, por detrás de la cardiopatía isquémica y la enfermedad cerebrovascular53.
Los dispositivos de estimulación cardiaca pueden disponer de diversos métodos de control de la situación hemodinámica del paciente que pueden ayudar a tomar determinadas actitudes terapéuticas antes de que aparezcan los síntomas y evitar hospitalizaciones.
Control de la impedancia intratorácica
La capacidad de controlar la congestión pulmonar mediante la medición de la impedancia transtorácica es posible en los nuevos dispositivos antiarrítmicos. Según la ley de Ohm, la impedancia puede ser medida mediante pequeñas descargas eléctricas entre el electrodo y la carcasa del dispositivo (fig. 5).
Fig. 5. Medición de impedancia intratorácica. (Cortesía de Medtronic Inc.)
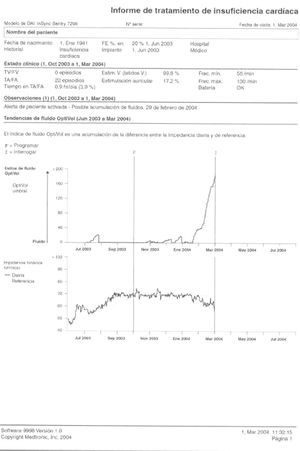
El sistema Optivol (Medtronic, Inc., Minneapolis, MN) incorporado en algunos desfibriladores automáticos implantables (DAI) (Virtuoso) o DAI + TRC (InSync Sentri y Virtuoso), representa la aplicación de los conceptos de impedancia transtorácica como una medida de la acumulación de fluido pulmonar dentro de los dispositivos implantables. La evaluación puede realizarse midiendo la impedancia entre la carcasa del dispositivo, que normalmente está implantado en la región pectoral izquierda, y el electrodo alojado en el ventrículo derecho (VD). Cuando se produce congestión pulmonar, la resistencia tisular disminuye debido a la acumulación de líquido, lo que da lugar a una disminución de la impedancia. La congestión pulmonar comienza con congestión vascular, seguida de acumulación de líquido intersticial y, posteriormente, alveolar e intersticial, con la aparición de los síntomas clínicos. El sistema de control de fluido Optivol detecta cambios en cualquiera de los estadios54.
En relación con la aplicación del control de la impedancia, hay que tener en cuenta varias consideraciones. Tras el implante del dispositivo se produce edema en la bolsa, que puede dar lugar a medidas de impedancia más bajas, por lo que se recomienda que no se inicie el control hasta pasados 3 o 4 días. La localización del electrodo en el ápex o septo no parece afectar la medida de la impedancia; sin embargo, la posición del cuerpo sí puede afectarla. Hay varias situaciones que puede afectar a la especificidad de la impedancia intratorácica, como son: neumonía, derrame pleural y enfermedad pulmonar obstructiva crónica (EPOC). Las medidas se realizan cada 20 min durante 5 h para eliminar los posibles errores debido a la posición del cuerpo o la respiración. La media de las 64 medidas es representada en una gráfica, tomando como referencia la media de varios días. Cuando la media desciende por debajo del valor de referencia, se puede representar en una gráfica como índice de acumulación de fluido, la cual posee un valor umbral programable.
Cuando se alcanza el valor umbral, el dispositivo alerta al paciente para que solicite una revisión que permita el tratamiento ambulatorio de una posible descompensación de la IC, y es muy importante programar la alarma de acumulación de fluidos a una hora distinta de otras alertas programables en el dispositivo. De esta forma, el paciente puede reconocer si la alarma se debe a la acumulación de fluidos55.
Variabilidad de la frecuencia cardiaca
La variabilidad de la frecuencia cardiaca (VFC) informa sobre la modulación autonómica cardiaca. La frecuencia de descarga del nódulo sinusal está regulada por el sistema nervioso autónomo. La inervación simpática tiende a aumentarla y la parasimpática o vagal tiende a enlentecerla. En condiciones de reposo, predomina la actividad vagal y en situaciones de estrés y ejercicio, la simpática aumenta, lo que da lugar a un aumento de la frecuencia. Los pacientes con IC presentan un incremento del tono simpático que amortigua las fluctuaciones normales de la FC56. La VFC es más baja en pacientes con muerte u hospitalización por IC y muestra un valor predictivo sobre la muerte cardiaca súbita en este tipo de pacientes. La TRC mejora la VFC, quizá por normalización del control simpático, y el análisis de la VFC podría identificar a los pacientes respondedores de los no respondedores a la TRC57.
Cuando se interrogan los DAI (Virtuoso) o DAI + TRC (InSync Sentri y Virtuoso) (Medtronic, Inc., Minneapolis, MN), del dispositivo podemos obtener datos relacionados con el Optivol y la VFC junto con otros relacionados con el ritmo cardiaco, la tasa de estimulación auricular y ventricular, o la actividad del paciente (fig. 6). Esta información es muy útil para el clínico que debe evaluar al paciente directamente tras la revisión del dispositivo o mediante el control remoto antes de la visita del paciente58,59.
Fig. 6. Información de la insuficiencia cardiaca. Tendencia a la acumulación de fluido. Descenso de la impedancia intratorácica. Hay una buena correlación entre la disminución de la impedancia intratorácica y el incremento del índice de fluidos y el empeoramiento clínico del paciente.
Aceleración intracardiaca
La amplitud de las vibraciones generadas por la contracción del miocardio puede ser medida con un sensor, un microacelerómeto (Biomechanical Endocardial Soria Trasducer o BEST) (Sorin Group, Milan) localizado en la punta de un electrodo unipolar. La señal EA (endocardial acceleration) es la señal vibratoria continua recogida endocavitariamente por el sensor. La PEA (peak endocardial acceleration) representa la vibración endocárdica (amplificada y filtrada) medida por el sensor en el ventrículo derecho durante la fase de contracción isovolumétrica.
La PEA se correlaciona con la actividad simpática y ha demostrado que es capaz de proporcionar una rápida y específica adaptación de la frecuencia cardiaca en respuesta al estrés físico y psíquico60. Además, estudios realizados en animales y humanos han mostrado que la amplitud de la PEA se correlaciona estrechamente con la dP/dt del VD y VI61, y con los cambios en el intervalo auriculoventricular (AV)62. Todo esto puede proporcionar las bases para la optimización automática del intervalo AV durante la estimulación cardiaca convencional y la TRC, y puede llegar a ser una excelente herramienta para controlar la contractilidad miocárdica durante la TRC, permitiendo, de igual manera, detectar y controlar el efecto deletéreo de la estimulación ventricular derecha sobre la función ventricular.
ARTÍCULOS DE INTERÉS PUBLICADOS EN EL ÚLTIMO AÑO
Durante el pasado año se han publicado 1.173 artículos que incluyen la palabra pacing como palabra clave, de los cuales vamos a comentar algunos de los más interesantes. Los hemos agrupado en distintos aspectos de la estimulación cardiaca, como son: el tema de la extracción de electrodos, la estimulación autorregulable en frecuencia, la FA, la estimulación en lugares distintos del ápex del VD (AVD), la TRC y estudios futuros de los que se han publicado sus diferentes diseños, aunque no sus resultados. Por último, comentaremos el registro nacional de marcapasos63 y las guías europeas de actuación clínica en EC y TRC, recientemente publicadas64.
Extracción de electrodos
Dos grupos diferentes publican su experiencia en la extracción percutánea de un gran número de electrocatéteres de marcapasos y desfibriladores. La experiencia europea65 incluye la extracción de 383 electrocatéteres (170 auriculares, 213 ventriculares) en 292 pacientes con láser-excimer, en 14 hospitales diferentes. El tiempo medio de implantación era de 74 meses (intervalo, 3-358 meses). Las indicaciones más frecuentes de extracción fueron la infección de bolsa, la disfunción del electrodo y la morbilidad del paciente. El tiempo medio de extracción fue de 15 min (intervalo, 1-300 min) y fue completa en el 90,9% de las sondas y parcial en el 3,4%. La tasa de complicaciones mayores (perforación) y menores fue del 5,1%, sin ninguna mortalidad intrahospitalaria. Concluyen que la extracción con esta técnica es segura, eficaz y predecible, no debiendo dejarse los electrocatéteres abandonados, y sólo en casos muy aislados se requiere cirugía.
Centella et al66, del hospital Ramón y Cajal de Madrid, publican su experiencia en la extracción percutánea de 314 sondas (115 auriculares, 196 ventriculares y 3 de seno coronario) en 187 pacientes, con un tiempo medio de implantación de 69,16 meses (intervalo, 0,11-234 meses) desde 1989 hasta 2006. Las indicaciones de extracción fueron la infección, la disfunción, el decúbito, la endocarditis y la bacteriemia. La extracción fue total en el 96,8% de los electrodos, bien con tracción simple (el 23,4% de los pacientes), bien con técnicas de contratracción en el 64,6% (con y sin radiofrecuencia). La tasa de complicaciones fue del 4,6% (el 2,5%, mayores) y se relacionaron con la edad superior a 60 años, la endocarditis y la implantación por el lado derecho. Concluyen también que la retirada de cables con los sistemas actuales soluciona el problema, y que debe ser realizada en centros con disponibilidad de cirugía por la posibilidad, aunque baja, de complicaciones.
Estimulación autorregulable en frecuencia
Aunque la estimulación autorregulable en frecuencia (DDDR) es ampliamente utilizada, no hay un acuerdo en cuanto a su beneficio sobre la calidad de vida. En este sentido, se publican dos estudios multicéntricos. El primero de ellos, de Van Hemel et al67, es un estudio prospectivo aleatorizado, simple ciego, de diseño cruzado, que compara en 64 pacientes con indicación tipo I de EC (el 72% con ENS) el efecto de la estimulación DDDR con doble sensor (VM y actividad) y sensor único (VM) frente a la DDD, sobre la calidad de vida, con un seguimiento de 8 meses. Aunque tras la implantación del marcapasos la calidad de vida mejora de manera significativa (el 83,5 frente al 71,3%; p < 0,001), no se observa ninguna mejoría significativa adicional tras la activación de uno o los dos sensores.
En el mismo sentido, Lamas et al68 publican los resultados de un subestudio del estudio ADEPT (Advanced Elements of Pacing Randomized Controlled Trial). Se trata de un estudio simple ciego, aleatorizado y de diseño factorial en el que se compara el efecto de la estimulación DDDR frente a la DDD en cuanto a la mejoría de la calidad de vida y la capacidad de ejercicio en 872 pacientes con indicación estándar de EC (64% ENS) con seguimiento a un año. Aunque la FC alcanzada durante el test de ejercicio realizado a los 6 meses fue significativamente mayor (113,3 frente a 101,1 lat/min; p < 0,001), en los pacientes con estimulación DDDR no se encontraron diferencias significativas en los índices de escala de actividad específica ni en los de calidad de vida a un año de seguimiento. Concluyen igualmente que la autorregulación en frecuencia es inefectiva en la mejoría de la capacidad funcional de los pacientes con indicación de EC por bradicardia.
Fibrilación auricular
La prevención de la FA en pacientes con EC sigue constituyendo un tema de gran interés, dada su alta prevalencia e incidencia. En este campo, hay diversas áreas de investigación, como son la eficacia de los diferentes algoritmos preventivos, la estimulación auricular en lugares diferentes de la orejuela derecha (OD) o la estimulación multisitio en la aurícula, y la disminución de la estimulación ventricular.
Respecto a la eficacia de los diferentes algoritmos preventivos, los resultados siguen siendo contradictorios entre los diferentes estudios, debido a los distintos diseños, objetivos y poblaciones, y en ocasiones los resultados neutrales se deben al alto porcentaje de estimulación auricular que se obtiene con la estimulación DDDR, a la estimulación en lugares no óptimos de la OD, y al efecto deletéreo de la estimulación en el AVD (EAD). No obstante, la clave del éxito en la prevención de FA está en la aplicación individualizada de los diferentes algoritmos. Al menos, la sobreestimulación auricular que provoca la aplicación de éstos no ha mostrado favorecer el desarrollo de disfunción ventricular izquierda o insuficiencia cardiaca, tal como demuestran Schuchert et al69 en un análisis post hoc de los resultados del ADOPT70, en el que no hallan diferencias significativas en el número de eventos adversos relacionados con IC o muertes relacionadas con ésta, entre los grupos con el algoritmo de prevención de FA activado o no.
En cuanto a la resincronización auricular para prevención de FA, Lewicka-Nowak et al71 comunican los resultados de un estudio observacional realizado en 97 pacientes con FA sintomática refractaria a fármacos, enfermedad del seno y onda p de duración superior a 120 ms, con conducción auriculoventricular (CAV) normal, a los que les realizan estimulación auricular en el haz de Bachmann y en el ostium del seno coronario, con un seguimiento medio de 2,3 años. La eficacia en el control de ritmo se consigue en el 90% de los casos y en 14 pacientes no hubo episodios de FA durante el seguimiento. Con la estimulación biauricular disminuyeron de forma significativa la necesidad de fármacos antiarrítmicos, cardioversiones y la incidencia y la duración de las hospitalizaciones por FA. Asimismo, la duración de la onda p fue significativamente menor durante la estimulación biauricular que en ritmo sinusal o durante la estimulación aislada del haz de Bachmann o el ostium del seno coronario. Concluyen que este método de estimulación biauricular es seguro y eficaz para el control de ritmo en pacientes con FA refractaria y trastorno de la conducción auricular. Otro estudio multicéntrico italiano72 demuestra que la estimulación auricular septal es superior a la estimulación en la OD para prevenir las recurrencias de FA en 47 pacientes con ENS y FA aleatorizados a recibir una u otra, pero sólo en los pacientes con severo trastorno de la conducción auricular derecha, que afecta a la tercera parte de éstos.
El estudio SAVE-PACe, de Sweeney et al73, realizado en 1.065 pacientes con ENS, CAV y complejo QRS normal, compara la estimulación DDD convencional frente a la DDD con algoritmo de estimulación ventricular mínima, de forma aleatorizada, con el objetivo principal del tiempo transcurrido hasta el desarrollo de FA persistente. El tiempo medio de seguimiento fue de 1,7 ± 1 años, tiempo en que el estudio se interrumpió por haber alcanzado el objetivo primario. El porcentaje de estimulación ventricular fue significativamente inferior en el grupo de estimulación ventricular mínima (el 9,1 frente al 99%), mientras que el de estimulación auricular no mostró diferencias significativas (el 71,4 frente al 70,4%). En total, 110 pacientes desarrollaron FA persistente (62 en el grupo DDD convencional y 42 en el grupo DDD con estimulación ventricular mínima), con una reducción significativa del riesgo relativo de desarrollar FA persistente del 40% en el grupo de estimulación ventricular mínima y del 4,8% de reducción del riesgo absoluto.
Estimulación ventricular alternativa
Tras conocer los efectos deletéreos de la EAD, cada vez son más numerosos los trabajos sobre estimulación ventricular en puntos diferentes del AVD. A finales de 2006, Vlay74 publica sus resultados del intento de implantación de 460 electrocatéteres en el tracto de salida del VD (TSVD) en pacientes con indicación de EC por bradicardia (n = 420) o con indicación de TRC. La tasa de éxito fue del 84% a lo largo de 9 años y del 92% en la última mitad. En un subgrupo seguido durante 20 meses no hubo diferencias en los parámetros eléctricos (umbral de estimulación, onda R o impedancia de estimulación) entre los electrodos implantados en AVD y TSVD. Sólo hubo una dislocación y ninguna perforación. Concluye que la estabilidad y el funcionamiento de los electrodos en el TSVD son excelentes y sin algunas de las complicaciones agudas y crónicas de los implantados en AVD.
Lewicka-Nowak et al75 comunican los resultados de un estudio aleatorizado, aunque en un escaso número de pacientes (n = 27), con indicación estándar de EC, de estimulación en AVD frente a TSVD con un seguimiento a largo plazo (7 años). La fracción de eyección del VI (FEVI) disminuyó de forma significativa en el grupo de AVD (del 56 al 47%; p < 0,05), mientras que la regurgitación tricúspide progresó y el NT-proBNP aumentó de forma significativa sólo en ellos. Hillock et al76 describen la técnica con una nueva forma de estilete para dirigir la sonda-electrodo de fijación activa a la porción septal de TSVD y, así, estandarizar la posición y poder realizar estudios amplios comparativos. Muto et al77 realizan un estudio retrospectivo en 273 pacientes con FA, FEVI < 30%, no candidatos a TRC y con indicación de EC, y comparan los efectos a largo plazo (18 meses) de la estimulación en la AVD frente a la estimulación en la porción medioseptal de VD. La FEVI y el estadio funcional se deterioraron de forma significativa en el grupo de AVD, mientras que la FEVI mejoró y no hubo cambios en el estadio funcional en el grupo de estimulación medioseptal. En relación con la estimulación hisiana, Barba et al78 publican excelentes resultados en 7 pacientes con síncope, complejo QRS ancho, BAV infra-His y disfunción VI no candidatos a TRC (imposibilidad de acceso a seno coronario) con un seguimiento entre 2 y 12 meses.
Terapia de resincronización cardiaca
En este campo, el número de publicaciones es extremadamente alto. Las áreas de mayor interés son las que aún no están resueltas: asincronía eléctrica o mecánica como predictor de respuesta y sus instrumentos de medida, papel en la FA, la IC grado I o II de la New York Heart Association o en disfunción VI asintomática, pacientes pediátricos, elección de dispositivo con o sin DAI (TRCP o TRCD), estimulación biventricular o sólo VI, o bifocal en VD y TRC en pacientes con estimulación en AVD y disfunción VI.
En cuanto al papel de la ecocardiografía en el diagnóstico de la asincronía mecánica y su importancia para predecir la respuesta a la TRC, se ha publicado recientemente una actualizada revisión79 que recoge la literatura científica más relevante al respecto. Delnoy et al80 publican un estudio prospectivo observacional en 263 pacientes con TRC, de los que 96 se encontraban en FA permanente con evaluación clínica y ecocardiográfica a los 3 y a los 12 meses, cuyos resultados demuestran una mejoría clínica y ecocardiográfica similar en los 2 grupos. En ambos, la tasa de estimulación fue mayor del 90% y sólo 2 pacientes del grupo de FA requirieron ablación de nódulo AV. En este sentido, un registro multicéntrico español (SPARE) de TRC en pacientes con FA permanente, aún no publicado, también apunta a que no es imprescindible la ablación del nódulo AV, siempre que se consiga un adecuado control farmacológico de frecuencia y un porcentaje de estimulación superior al 90%. El estudio BRIGHT81, multicéntrico, de diseño cruzado y aleatorizado, demuestra los efectos beneficiosos de la estimulación bifocal en el VD (AVD y TSVD) en 42 pacientes con indicación de TRC sobre parámetros clínicos y ecocardiográficos. El estudio HOBIPACE82 es el primero aleatorizado, de diseño cruzado a 3 meses, que compara los resultados de la estimulación biventricular frente a la del VD en 30 pacientes con disfunción VI e indicación estándar de EC en cuanto a parámetros clínicos, ecocardiográficos y neurohormonales, con una clara superioridad de la estimulación biventricular, tanto en pacientes con FA permanente (n = 9) como en RS.
Auricchio et al83 publican un estudio multicéntrico, observacional y de supervivencia a largo plazo en 1.303 pacientes con TRCP (44%) o TRCD. La supervivencia libre de eventos (muerte, trasplante urgente o dispositivo de asistencia ventricular) fue del 92% al primer año y del 56% al quinto. La incidencia acumulada de muerte por IC fue del 25,1%, y por muerte súbita del 9,5%, con una reducción no significativa de la mortalidad del 20% en los pacientes con TRCD. Rivero-Ayerza et al84 realizan un metaanálisis de 5 estudios (MUSTIC85, MIRACLE86, MUSTIC-AF87, COMPANION88 y CARE-HF89), con un total de 2.371 pacientes, y demuestran una reducción significativa de la mortalidad total con TRCP del 29 y el 38% de la mortalidad por IC. Yao et al90, en un estudio de coste-efectividad a largo plazo de la TRCP o TRCD frente a tratamiento médico, asumiendo los resultados del CARE-HF89 y del COMPANION88, concluyen que la TRCP es coste-efectiva comparada con el tratamiento médico, y cuando la esperanza de vida es razonable, la TRCD también es coste-efectiva frente a TRCP + tratamiento médico. El registro andaluz de IC (RAIC)91 establece que de un total de 647 pacientes ingresados por IC, sólo un 5,6% es candidato a TRC.
Registro Español de Marcapasos
Como cada año, esta Revista ha publicado el informe de los datos del Registro Nacional de Marcapasos de 2005, elaborado por el Coma-Sanmartín et al63. Se analizan los datos de 9.150 tarjetas europeas remitidas desde 82 centros, que corresponden a un 31,9% del total de marcapasos implantados, según la estimación de la industria. La causa más frecuente de implantación fue el BAV, seguida de la ENS. La TRC supone el 1,34% del total de implantaciones. La edad media de las primoimplantaciones fue de 75 años. El 79% de los marcapasos implantados se asocian con autorregulación en la frecuencia. Se observa una tendencia hacia una mayor adecuación a las guías de práctica clínica en la selección del modo de estimulación.
Estudios futuros
El BLOCK HF92 es un estudio multicéntrico mundial, doble ciego, controlado, que pretende comparar en 1.636 pacientes con BAV, la disfunción ligera de VI (FEVI ≤ 50%) e IC ligera-moderada (NYHA I-III), con indicación de EC, los efectos sobre la mortalidad, la descompensación de IC y el remodelado VI de la estimulación VD frente a la biventricular. El PACE Trial93 es un estudio multicéntrico, prospectivo, doble ciego, aleatorizado, paralelo y controlado que pretende comparar los efectos de la estimulación biventricular frente a la del VD en la función y el remodelado del VI, en 200 pacientes con indicación de EC y disfunción ligera del VI (FEVI ≤ 45%). El PREVENT HF94, también multicéntrico, aleatorizado y controlado, compara los efectos de la estimulación biventricular frente a la del VD sobre el volumen telediastólico del VI (objetivo primario) y sobre la FEVI, la mortalidad, la morbilidad y la regurgitación mitral en pacientes con una recomendación de grado I o IIa de EC que requieran más de un 80% de estimulación ventricular. El PEGASUS-CRT95 es un estudio multicéntrico, aleatorizado, con 3 grupos, que pretende demostrar el efecto de la estimulación auricular sobre los eventos de IC, la calidad de vida, la clase funcional, la capacidad de ejercicio y las arritmias auriculares y ventriculares en más de 375 pacientes con CRTD.
Guías europeas de actuación clínica en estimulación y resincronización cardiaca
Por primera vez, la Sociedad Europea de Cardiología y la European Heart Rythm Association han elaborado unas guías de actuación clínica en la EC y la TRC62. Las previas, de 200296, de las sociedades americanas de Cardiología y de Estimulación, no incluían la TRC. Tras revisar la evidencia científica disponible se establecen las indicaciones de EC y TRC, así como la selección del modo de estimulación con los grados clásicos de recomendación I, II (IIa y IIb) y III. También incluyen la descripción de los requerimientos, tanto humanos como de espacio y aparataje, para la implantación y el seguimiento de los pacientes con dispositivos. Destacaremos sólo algunos aspectos por ser más novedosos o controvertidos, como son la selección de modo en la ENS y las indicaciones de TRC, así como algunos aspectos de los requerimientos.
En la ENS sin BAV asociado y sin arritmias auriculares, la recomendación de grado I es la estimulación AAI(R), con nivel de evidencia C, y la estimulación DDD(R) con algoritmo de disminución de la estimulación ventricular es una recomendación de grado IIa, también con un nivel de evidencia C. Si hay arritmias auriculares, la indicación de estimulación DDD(R) con algoritmo de disminución de la estimulación ventricular es una recomendación de grado IIa, con un nivel de evidencia C, mientras que la asociación de algoritmos antitaquicardia supone una recomendación de grado IIb, también con evidencia C. Si hay BAV asociado, la recomendación de grado I es la estimulación DDD(R) con algoritmo de disminución de estimulación ventricular, con un nivel evidencia C. La TRCP constituye una recomendación de grado I en pacientes con IC de grados III-IV, a pesar del tratamiento médico óptimo, la FEVI ≤ 35%, la dilatación de VI, el RS y el complejo QRS ≥ 120 ms, para mejorar morbilidad y mortalidad, con un nivel de evidencia A, y la TRCD es una buena opción en los pacientes de las mismas características con esperanza de vida superior a un año (recomendación de grado I pero nivel de evidencia B). En pacientes con las características anteriores y con indicación de EC, la TRC constituye una recomendación de grado IIa con un nivel de evidencia C. En pacientes con indicación de DAI y las características anteriores, la TRCD constituye una recomendación de grado I, con un nivel de evidencia B. En pacientes con las características anteriores, FA permanente e indicación de ablación del nódulo AV, la TRC constituye una recomendación de grado IIa, con un nivel de evidencia C.
En cuanto al número necesario de 20 implantes anuales para poder mantener la calidad de la TRC, puede parecer un poco excesivo en nuestro país, ya que excluiría a un gran número de centros. Por otra parte, el objetivo de una tasa de éxito sólo del 90% parece un poco escaso en la actualidad, debiendo aspirar a tasas mayores, por encima del 95%, una vez superada la curva de aprendizaje.
ABREVIATURAS
AVD: ápex ventrículo derecho.
BAV: bloqueo auriculoventricular.
C: Carelink.
CAV: conducción auriculoventricular.
CPAP: presión positiva continua en la vía aérea.
DAI: desfibrilador automático implantable.
DDD: estimulación bicameral sin respuesta en frecuencia.
DDDR: estimulación bicameral con respuesta en frecuencia.
EA: endocardial acceleration. Señal vibratoria continua recogida por un sensor.
EC: estimulación cardiaca.
EGM: electrogramas intracavitarios.
ENS: enfermedad del nódulo sinusal.
FA: fibrilación auricular.
FC: frecuencia cardiaca.
FEVI: fracción de eyección de ventrículo izquierdo.
HC: Housecall.
HM: Home Monitoring.
IC: insuficiencia cardiaca.
ISO 9001-2000: Organización Internacional para la Estandarización.
ITT: impedancia transtorácica.
MD: seguimiento domiciliario.
MP: marcapasos.
OD: orejuela derecha.
PEA: peak endocardial acceleration, representa la vibración endocárdica.
REV: respuesta evocada.
RT: rechazo agudo de trasplante.
SAHS: síndrome de apnea/hipopnea del sueño.
SEA: sobreestimulación auricular.
TA: taquiarritmias auriculares.
TRC: terapia de reincronización cardiaca.
TRCD: terapia de resincronización cardiaca con capacidad de estimulación y desfibrilación.
TRCP: terapia de resincronización cardiaca sólo con capacidad de estimulación.
TSVD: tracto de salida de ventrículo derecho.
VD: ventrículo derecho.
VFC: variabilidad de la frecuencia cardiaca.
VI: ventrículo izquierdo.
VM: volumen minuto.
Correspondencia: Dr. F. Ruiz Mateas.
Unidad de Cardiología. Hospital Costa del Sol.
Ctra. Nacional 340, Km 187. 29603 Marbella. Málaga. España.