Palabras clave
INTRODUCCIÓN
La insuficiencia cardiaca es un síndrome complejo que causa un daño orgánico generalizado y progresivo1. Aunque los mecanismos fisiopatológicos implicados no son bien conocidos2, la afección muscular periférica es frecuente en la insuficiencia cardiaca crónica avanzada y su presencia está asociada a un peor pronóstico de forma independiente3.
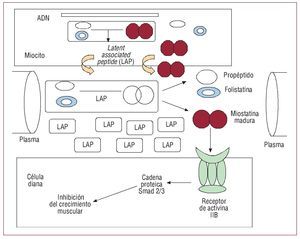
La miostatina (MIOS) es una proteína inhibidora del crecimiento muscular de la familia de los factores de crecimiento y diferenciación beta, que se expresa en el tejido muscular y tiene un papel fundamental en la regulación de la masa muscular (fig. 1). Se ha observado que está aumentada en ciertas situaciones de sarcopenia4-6, aunque no hay datos sobre el papel de esta proteína en pacientes con insuficiencia cardiaca crónica.
Fig. 1. Síntesis, liberación y mecanismo de acción de la miostatina y su propéptido precursor.
El objetivo del estudio fue determinar la concentración sérica de MIOS y su propéptido precursor (pro-MIOS) en pacientes con insuficiencia cardiaca crónica, y analizar su relación con la situación funcional, diversos parámetros clínicos y analíticos y con la mortalidad.
MÉTODOS
Se incluyó de forma prospectiva a 70 pacientes ambulatorios con insuficiencia cardiaca crónica y disfunción sistólica de acuerdo con su clase funcional, 30 pacientes en clase funcional I-II y 40 en clase III-IV. Se les realizó una visita rutinaria y una extracción venosa. Las muestras fueron centrifugadas durante 20 min a 3.000 rpm, y el suero extraído se congeló a -80 °C. Los pacientes fueron seguidos mediante visitas presenciales según el protocolo de la unidad. La concentración sérica de pro-MIOS se determinó mediante ELISA (myostatin LAP/propeptide de BioVendor®, Chequia). El límite analítico de detección es 0,023 ng/ml y la linearidad, 0,1-10 ng/ml. La precisión intraanalítica es CV del 2,9 al 5,4% y la interanalítica, coeficiente de variación (CV) del 8,6 al 10,6%. La concentración sérica de MIOS se determinó mediante el Human Myostatin ELISA kit (Immundiagnostik AG®, Bensheim, Alemania). El límite de detección del método es 0,273 ng/ml y la linearidad, 0-250 ng/ml (interanalítica, CV del 3%). A falta de una concentración de normalidad, se obtuvo un grupo control de 11 individuos sanos (7 varones y 4 mujeres; media de edad, 66,9 ± 9,8 años), sin antecedentes de cardiopatías, miopatías o alteraciones hormonales. Respecto a los pacientes no hubo diferencias en edad y sexo. Se determinaron las concentraciones séricas de r2-TNFα mediante el sTNF-R (60 kDa) Instant ELISA (Bender Med Systems GmBH, Austria), y las de NT-proBNP mediante el analizador Dimension® RxL (Dade Behring).
Para el análisis estadístico se utilizó el SPSS® 11.0 para Windows. Los valores de MIOS tenían distribución normal, a diferencia de los de pro-MIOS, r2-TNFα y NT-proBNP. Las variables continuas se expresan como media ± desviación estándar o mediana [intervalo intercuartílico], según tuvieran o no una distribución normal. La relación entre estos valores como variables continuas y parámetros clínicos, de laboratorio, clase funcional y mortalidad, se analizó con los tests adecuados (t de Student, U de Mann-Whitney, correlación de Pearson o Spearman). En el análisis multivariable de regresión de Cox para la supervivencia (método «introducir»), se incluyeron como covariables edad, sexo, clase funcional, fracción de eyección, MIOS, pro-MIOS, r2-TNFα y NT-proBNP. Se consideró significativo un valor de p < 0,05. No hubo pérdidas en el seguimiento y al final de éste se determinó el estado vital de todos los pacientes.
El estudio cumple las recomendaciones internacionales para la investigación clínica de la Declaración de Helsinki de la Asociación Médica Mundial. Todos los pacientes firmaron un consentimiento informado para participar en el estudio, que fue aprobado previamente por el comité ético del hospital.
RESULTADOS
Las características de los pacientes se describen en la tabla 1. El valor medio de MIOS fue 12,3 ± 7 ng/ml y la mediana de pro-MIOS, 0,1 [0,1-0,38] ng/ml. La mediana de r2-TNFα era 2,42 [1,61-4,13] ng/ml y la de NT-proBNP, 899 [290-2.743] pg/ml. Cuando se compararon los valores de los pacientes con los de los sujetos sanos, se observó que los primeros tenían tendencia a tener valores más bajos tanto de MIOS (12,3 ± 7 frente a 18,6 ± 9,3 ng/ml; p = 0,01) como de pro-MIOS (0,1 [0,1-38] frente a 1,25 [0,1-2,9] ng/ml; p = 0,02).
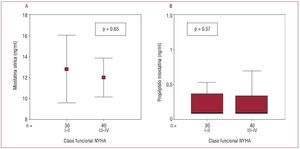
No hallamos relación entre los valores de MIOS (A) y pro-MIOS (B) con la clase funcional de la New York Heart Association (NYHA) (fig. 2). En cambio, tanto los de r2-TNFα (p = 0,001) como los de NT-proBNP (p < 0,001) sí se relacionaron con la clase funcional. No hallamos correlación entre MIOS y pro-MIOS (r = -0,049; p = 0,68). Tampoco entre estos dos péptidos y r2-TNFα (MIOS, p = 0,86; pro-MIOS, p = 0,65), NT-proBNP (MIOS, p = 0,75; pro-MIOS, p = 0,89), edad, sexo, fracción de eyección, etiología de la insuficiencia cardiaca, duración de la insuficiencia cardiaca, glucosa, proteínas totales, albúmina, creatinina, tropo-nina I, uratos, colesterol e índice de masa corporal, y con ninguno de los tratamientos recibidos. Los valores de pro-MIOS (r = 0,24; p = 0,04), pero no los de MIOS, se correlacionaron débilmente con los valores séricos de creatincinasa.
Fig. 2. Relación entre concentraciones séricas de miostatina (A) y propéptido precursor (B) con la clase funcional de la New York Heart Association (NYHA).
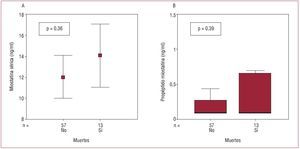
Fallecieron 13 pacientes durante el seguimiento (17,9 ± 1,3 meses): 9 de insuficiencia cardiaca, 2 de muerte súbita, 1 de otra causa cardiovascular y 1 de causa no cardiovascular. Ni la concentración de MIOS ni la de pro-MIOS se relacionaron con la mortalidad (fig. 3). Sin embargo, los pacientes fallecidos sí presentaban cifras más elevadas de NT-proBNP —2.998 [2.610-9.983] frente a 573 [238-1.582] (p < 0,001)— y de r2-TNFα —4,32 [1,94-7,51] frente a 2,30 [1,43-3,27] (p = 0,005)—. En la regresión de Cox, la clase funcional (hazard ratio [HR] 5,28 [1,47-19,0]; p = 0,01) y los valores de r2-TNFα (HR = 1,24 [1,03-1,49]; p = 0,02) permanecieron estadísticamente relacionados con la mortalidad.
Fig. 3. Relación entre concentraciones séricas de miostatina (A) y propéptido precursor (B) con la mortalidad total.
DISCUSIÓN
La implicación de la MIOS ha sido demostrada en diferentes situaciones de afección muscular4-6. Se ha señalado que esta proteína podría estar implicada en el daño orgánico asociado a la insuficiencia cardiaca7. Sin embargo, nosotros hemos observado que las cifras de MIOS en pacientes con insuficiencia cardiaca eran inferiores a las de personas sin insuficiencia cardiaca. Este hecho, totalmente inesperado, podría indicar que quizá la MIOS esté inhibida en un intento de preservar la masa muscular, aunque esta posibilidad es sólo una especulación.
Además, en nuestro estudio encontramos ausencia de relación de los valores de MIOS y pro-MIOS con la clase funcional y otros parámetros utilizados habitualmente para medir la gravedad de la insuficiencia cardiaca y también con la mortalidad. En cambio, tanto los valores de r2-TNFα como los de NT-proBNP mostraron clara relación con la clase funcional y la supervivencia. La ausencia de relación de MIOS y pro-MIOS con estos parámetros podría indicar que, aunque estas proteínas estuvieran implicadas en el daño muscular asociado a la insuficiencia cardiaca, serían independientes de la gravedad de ésta o incluso podrían no formar parte de ese daño orgánico. Hay un gran desconocimiento de la fisiopatología de esta proteína y hay pocos datos sobre sus concentraciones séricas. Los diferentes anti-cuerpos diseñados contra distintas partes de la proteína y el hecho de que el 70% de la proteína circulante está unida a su propéptido8 dificultan el análisis de los resultados. También es controvertida la relación existente entre los valores séricos y los del músculo esquelético, aunque algunos estudios4,5 han observado cifras similares de proteína en suero y tejido muscular. Se ha señalado que las concentraciones de propéptido en suero son muy bajas9, hecho que se confirma en nuestro estudio. Por otro lado, se ha descrito cierto efecto anabólico de los bloqueadores beta10. Quizá el elevado porcentaje de pacientes que recibían este tratamiento haya podido influir en la ausencia de relación entre cifras de MIOS y gravedad de la insuficiencia cardiaca.
Limitaciones
El número de pacientes analizados es bajo y el número de eventos fue escaso. Se dispone de una población pequeña y no controlada por variables poblacionales de individuos sanos para la comparación. No se dispone de datos objetivos para clasificar la situación funcional de los pacientes como prueba de esfuerzo con consumo de gases o test de 6 minutos.
En conclusión, tanto las concentraciones de MIOS como las de pro-MIOS determinadas mediante ELISA no se relacionaron con parámetros de gravedad ni con el pronóstico en pacientes con insuficiencia cardiaca crónica.
AGRADECIMIENTOS
Los autores quieren agradecer a Josep Maria Manresa su ayuda en el análisis estadístico.
Full English text available from: www.revespcardiol.org
Este estudio se ha realizado con la ayuda de una beca no condicionada de Laboratorios Menarini S.A. (España).
Correspondencia: Dra. E. Zamora.
Unidad de Insuficiencia Cardiaca. Servicio de Cardiología. Hospital Universitario Germans Trias i Pujol.
Ctra. del Canyet, s/n. 08016 Badalona. España.
Correo electrónico: e.zamora@telefonica.net
Recibido el 28 de marzo de 2009.
Aceptado para su publicación el 2 de septiembre de 2009.