La muerte súbita cardiaca continúa siendo un problema de salud pública no resuelto, que supone un 13–18,5% del total de muertes por causas naturales. A la vista de las tasas de supervivencia bajas y desalentadoras que se dan en los eventos de parada cardiaca, recientemente se han dedicado muchos esfuerzos a la prevención de la muerte súbita cardiaca. Aproximadamente un 90–95% de las víctimas de muerte súbita cardiaca sufren una cardiopatía estructural. Esta revisión se centra en la prevención de la muerte súbita cardiaca en esta población de pacientes. Se examina la prevención primaria y secundaria de la muerte súbita en la enfermedad coronaria, la miocardiopatía dilatada no isquémica, la miocardiopatía hipertrófica, la displasia/miocardiopatía arritmogénica de ventrículo derecho y la miocardiopatía no compactada. Se comentan también las indicaciones actuales para el tratamiento profiláctico primario o secundario con un desfibrilador automático implantable en estos trastornos.
Palabras clave
La muerte súbita cardiaca (MSC) supone un 13–18,5% del total de muertes por causas naturales1. Continúa siendo un problema de salud pública no resuelto, y ello se debe a diversas razones. En primer lugar, aunque la mortalidad cardiaca total se ha reducido en la última década, la proporción y el número absoluto de casos de MSC han aumentado2. En segundo lugar, a pesar de los amplios esfuerzos realizados, la supervivencia tras una parada cardiaca súbita continúa siendo baja y no ha mejorado significativamente en las últimas décadas3. Por estas razones, recientemente los esfuerzos se han centrado en la prevención de la MSC1. Se entiende por prevención primaria la prevención de la muerte súbita (MS) en pacientes que no han sufrido previamente ninguna parada cardiaca ni arritmia ventricular sostenida o su equivalente sintomático1. Se entiende por prevención secundaria la prevención de la MS en pacientes que ya han sufrido una parada cardiaca súbita, taquicardia ventricular (TV) sostenida o síncope inexplicado, con un estudio diagnóstico que indique alta probabilidad de que la causa del síncope sea una taquiarritmia ventricular1.
Aproximadamente un 90–95% de las víctimas de MSC sufren una cardiopatía estructural1. Esta revisión se centra en la prevención primaria y secundaria de la MSC en esta población de pacientes.
Enfermedad coronariaLa incidencia geográfica de MSC varía en función de la prevalencia de la enfermedad coronaria en distintas regiones1. Los estudios observacionales indican que alrededor de 3/4 pacientes que sufren una MSC tienen enfermedad coronaria (EC)1. Los estudios de autopsias revelan cambios agudos en la morfología de las placas coronarias, como la formación de un trombo o la rotura de la placa, en el 50% de esos pacientes1. Lamentablemente, en al menos un 50% del total de casos de MSC debidos a EC, esta es el primer evento clínico o se da en subgrupos de pacientes que se considera que tienen un riesgo de MSC relativamente bajo3. Aunque el empleo de medidas de prevención efectivas en esta población de pacientes sería lo que tendría mayor efecto en el número absoluto de MS, la identificación de los pacientes que tienen riesgo de MSC en estos grupos de bajo riesgo es algo que por el momento no se ha podido resolver3. En estudios aleatorizados recientes, se ha incluido a subgrupos de pacientes con riesgo alto de MSC a causa de los antecedentes de infarto de miocardio (IM) previo con o sin insuficiencia cardiaca. Sin embargo, debe señalarse que sólo una minoría de los episodios de MSC se da en estas poblaciones de pacientes de alto riesgo. En consecuencia, las intervenciones preventivas efectivas utilizadas en estos subgrupos, como el uso del desfibrilador automático implantable (DAI), tendrán sólo un efecto menor en la frecuencia de la MSC en el conjunto de la población3.
Prevención primariaLa hipertensión, el consumo de cigarrillos, la obesidad y la diabetes mellitus son factores de riesgo modificables importantes no sólo para la enfermedad coronaria, sino también para la MSC1. Dado el número absoluto de pacientes en los que se dan, el tratamiento efectivo de estos factores de riesgo es lo que tiene mayor influencia en la prevención de la MSC. Los factores de riesgo no modificables, como el sexo, la edad y la herencia, desempeñan también un importante papel en la etiología de la MSC1. Recientemente, se han descrito también otros factores asociados a la MSC, como el estado de forma física cardiorrespiratoria4, la prolongación anormal idiopática del QTc5 y la depresión del segmento ST asintomática durante una prueba de esfuerzo (en varones de mediana edad)6. Además, dos estudios poblacionales han descrito la agrupación de los casos de MSC como primer síntoma de EC en algunas familias7,8. Esta observación indica que los factores genéticos modulan el riesgo de MSC en el contexto de la EC. Muy recientemente, nuevos avances de la medicina genómica nos han proporcionado otros enfoques novedosos para identificar genes candidatos y polimorfismos relativamente frecuentes que pueden predisponer a los pacientes a un aumento del riesgo de MSC. Como resultado de ello, en un análisis combinado de dos estudios de cohorte prospectivos de base poblacional, se identificó que las variaciones en la secuencia del gen de la NOS1AP (proteína adaptadora de la óxido nítrico sintasa 1) se asociaban al intervalo QT basal y al riesgo de MSC en adultos blancos de Estados Unidos9. En otro reciente estudio poblacional europeo similar, que se centró principalmente en los genes causales de síndromes de susceptibilidad arrítmica hereditaria muy poco comunes, se identificaron dos variantes intrónicas frecuentes en los genes KCNQ1 y SCN5A que estaban asociadas a la MSC10. Los nuevos avances en el conocimiento de la genética de la MSC permitirán mejorar la estratificación del riesgo de manera que el uso de DAI y otras medidas preventivas pueda centrarse en los pacientes que más probablemente obtendrán beneficio con estas intervenciones. Es posible que los estudios actuales y futuros permitan identificar unas pocas variantes génicas frecuentes asociadas a un aumento del riesgo de MSC en la EC. El análisis del genoma completo de un individuo podría hacer posible en el futuro la detección sistemática de estas variantes frecuentes y, por lo tanto, una predicción del riesgo individual de MSC. Como primer paso en esa dirección, muy recientemente, se ha descrito que la secuenciación del genoma completo de un paciente con antecedentes familiares de MSC es útil para predecir un mayor riesgo de EC y de que la MSC sea la primera manifestación de la EC11. Sin embargo, en la actualidad, la estratificación del riesgo y la prevención de la MSC en los subgrupos de población de menor riesgo continúan siendo una cuestión no resuelta, debido a que ninguno de los factores de riesgo de MSC antes mencionados tiene la potencia predictiva necesaria para generar estrategias de prevención para el elevado número de eventos arrítmicos mortales que se producen.
En las últimas décadas, la identificación de factores de riesgo de MS tras un primer evento miocárdico ha sido un campo de activa investigación. A pesar de la amplia búsqueda realizada, la función del ventrículo izquierdo y los síntomas de insuficiencia cardiaca han continuado siendo los factores predictivos más importantes. Un factor de riesgo de posible utilidad que actualmente se recomienda (con una indicación de clase IIa) para la estratificación del riesgo es la alternancia de la onda T (TWA)1. La TWA es la fluctuación entre un latido y otro de la morfología y la amplitud de la onda T evaluadas durante el ejercicio o la estimulación auricular. Otro campo de investigación recientemente descrito y que parece prometedor es el de las exploraciones por imagen de las cicatrices. En un reciente estudio de pacientes portadores de DAI, se observó que la heterogeneidad del tejido del infarto en la resonancia magnética (RM) con contraste era el predictor más potente de arritmia ventricular espontánea12.
Tratamiento farmacológicoEn ensayos clínicos aleatorizados, no se ha demostrado que ningún fármaco antiarrítmico de clase I o III consiga prevenir la MSC en pacientes con EC1. Los antiarrítmicos de clase I incluso podrían aumentar el riesgo de MSC y debe evitarse su empleo en pacientes con antecedentes de IM previo (indicación de clase III)1. En cambio, se ha demostrado que los bloqueadores beta, los inhibidores de la enzima de conversión de la angiotensina, los antagonistas de los receptores de la angiotensina II, los hipolipemiantes, la espironolactona y los fármacos fibrinolíticos y antitrombóticos son eficaces para prevenir la MS1. Dichos fármacos deben utilizarse en todos los pacientes con EC para la prevención primaria y secundaria, según lo recomendado por las guías actuales. De igual modo, la insuficiencia cardiaca debe ser tratada de forma enérgica. En la actualidad hay controversia respecto al efecto protector de los ácidos grasos n-31.
Intervenciones de revascularizaciónLa revascularización coronaria quirúrgica o percutánea, con la consiguiente mejora del flujo sanguíneo coronario y la reducción de la isquemia miocárdica, tiene unos efectos antiarrítmicos favorables1. Estas intervenciones deben realizarse según lo indicado en las guías actuales y siempre antes de la implantación del DAI.
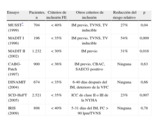
Desfibrilador automático implantableEn varios ensayos clínicos prospectivos multicéntricos, se ha documentado una mejora de la supervivencia con el tratamiento con DAI en pacientes de alto riesgo con disfunción del ventrículo izquierdo debida a un IM previo (tabla 1)7,13–19. El tratamiento con DAI, en comparación con el empleo de un tratamiento farmacológico convencional o antiarrítmico, se ha asociado a una reducción del riesgo relativo de mortalidad de un 21 a un 54%. La mejora de la supervivencia se debió casi exclusivamente a una reducción de la MSC. Dos metaanálisis recientes de estos ensayos han respaldado la conclusión general de que el tratamiento con DAI en pacientes de alto riesgo con EC proporciona una reducción del riesgo relativo de mortalidad total de entre un 20 y un 30%20,21. Sin embargo, los factores de riesgo utilizados para identificar a una población de alto riesgo en estos estudios han sido diversos (tabla 1). Es de destacar que los valores de corte utilizados para la fracción de eyección (FE) oscilaron entre el 30 y el 40%. Además, debe señalarse que dos de los ensayos no han mostrado una mejora de la supervivencia con el tratamiento con DAI en el momento de la revascularización quirúrgica (CABG-Patch) ni en un plazo de 40 días tras un IM agudo (DINAMIT) (tabla 1). El ensayo IRIS, recientemente presentado, ha confirmado estos resultados; el tratamiento profiláctico con DAI no redujo la mortalidad total en los pacientes con IM agudo (en un plazo de 5 a 31 días) ni las manifestaciones clínicas que comportaban un aumento del riesgo (frecuencia cardiaca ≥ 90lpm y/o taquicardia ventricular no sostenida (TVNS) durante la monitorización Holter19.
Principales ensayos del desfibrilador automático implantable para la prevención primaria de la muerte súbita cardiaca en la enfermedad coronaria.
| Ensayo | Pacientes, n | Criterios de inclusión FE | Otros criterios de inclusión | Reducción del riesgo relativo | p |
| MUSST* (1999) | 704 | < 40% | IM previo, TVNS, TV inducible | 27% | 0,04 |
| MADIT I (1996) | 196 | < 35% | IM previo, TVNS, TV inducible | 54% | 0,009 |
| MADIT II (2002) | 1.232 | < 30% | IM previo | 31% | 0,016 |
| CABG-Patch (1997) | 900 | < 36% | IM previo, CBAC, SAECG positivo | Ninguna | 0,63 |
| DINAMIT (2004) | 674 | < 35% | 6-40 días después del IM, deterioro de la VFC | Ninguna | 0,66 |
| SCD-HeFT (2005) | 2.521 | < 35% | ICC de clase II o III de la NYHA | 23% | 0,007 |
| IRIS (2009) | 898 | < 40% | 5-31 días del IM, FC > 90lpm/TVNS | Ninguna | 0,78 |
CBAC: cirugía de bypass arterial coronario; DINAMIT: Defibrillator in Acute Myocardial Infarction Trial; FC: frecuencia cardiaca; FE: fracción de eyección; IM: infarto de miocardio; MADITI y II: Multicenter Automatic Defibrillator Implantation Trial I y II; MUSST: Multicenter Unsustained Tachycardia Trial; SAECG: ECG de promediación de señal; SCD-HeFT: Sudden Cardiac Death in Heart Failure Trial; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida; VFC: variabilidad de la frecuencia cardiaca.
Los resultados de los ensayos aleatorizados han sido incorporados a la recomendación que hacen varias guías respecto a la implantación de DAI profilácticos primarios en la enfermedad coronaria. Sin embargo, hay discrepancias entre estas guías, sobre todo por lo que se refiere a los valores de corte de la FE1,22. Las guías más recientes de ACC/AHA/HRS, de 2008, respecto a los tratamientos mediante dispositivos recomiendan la implantación de un DAI profiláctico primario en los pacientes con una FE < 35% a causa de un IM previo al menos 40 días después del infarto si se encuentran en clase funcional II o III de la New York Heart Association (NYHA). Si un paciente se encuentra en la clase funcional I 40 días después de un IM, la FE debe ser < 30%22. El tratamiento con DAI es una indicación de clase I en los pacientes con FE < 40% a causa de un IM previo, con TVNS espontánea y con FV o TV sostenida inducibles en un estudio electrofisiológico1,22.
Las guías abordan el hecho clínicamente importante de que no existe un patrón de referencia estándar para la determinación de la FE del ventrículo izquierdo (FEVI). Se recomienda que los clínicos utilicen la determinación de la FEVI que crean tiene mayor exactitud clínica y es más apropiada en su centro22. Otra cuestión de importancia clínica es la implantación de un DAI profiláctico primario en los pacientes ancianos. Según lo indicado por un análisis de subgrupos y por ensayos no aleatorizados, la edad es un factor importante que influye en el resultado clínico obtenido tras el empleo de un DAI. Sin embargo, incluso en pacientes octogenarios, cabe esperar una supervivencia media de más de 4 años tras la implantación de un DAI23. En consecuencia, las guías recomiendan que no se utilice sólo la edad como único criterio para descartar un tratamiento con DAI1,22. La decisión debe tomarse de manera individualizada para cada paciente, en función de la presencia de comorbilidades y de las preferencias del paciente.
Desfibrilador externo automáticoEl desfibrilador externo automático (DEA) salva vidas cuando la desfibrilación externa puede aplicarse en un plazo de minutos tras el inicio de la fibrilación ventricular (FV). En el ámbito extrahospitalario, se ha demostrado que los programas de desfibrilación de acceso público aumentan la supervivencia tras una parada cardiaca súbita. Sin embargo, aproximadamente el 80% de las paradas se producen en el hogar. El estudio HAT, recientemente publicado, ha abordado el uso de DEA en este contexto24. En dicho estudio, se asignó aleatoriamente a un total de 7.001 pacientes con antecedentes de IM de cara anterior, no candidatos a tratamiento con DAI, el uso domiciliario de un DEA o una respuesta de control (llamar a los servicios de emergencias médicas para maniobras de reanimación cardiopulmonar [RCP]). Lamentablemente, la disponibilidad de un DEA en el domicilio no mejoró significativamente la supervivencia total en comparación con los métodos de reanimación convencionales. Las tasas de MS muy bajas, el elevado porcentaje de eventos de MS que se produjeron sin que nadie los presenciara y la infrautilización del DEA en las emergencias pueden haber desempeñado un papel en estos resultados desalentadores.
Prevención secundariaSe entiende por prevención secundaria el tratamiento de los pacientes tras una MS resucitada, una taquicardia ventricular sostenida o un síncope inexplicado. En los pacientes con síncope de origen indeterminado, si durante el estudio electrofisiológico puede inducirse una taquiarritmia ventricular sostenida, se presume que la arritmia inducida es la causa del síncope inexplicado22.
Desfibrilador automático implantableLa evidencia obtenida en múltiples ensayos controlados y aleatorizados respalda el empleo de DAI para la prevención secundaria, con independencia de que haya o no cardiopatía estructural y de su tipo25–27. En estos ensayos, el DAI se ha asociado a una reducción del 50% en el riesgo relativo de muertes arrítmicas y una reducción del 25% en el riesgo relativo de muerte por todas las causas. La mayoría de los pacientes incluidos en estos ensayos tenían una EC subyacente (73–83%), con una disfunción ventricular izquierda debida a un IM previo (media de FE, 32–45%). Múltiples análisis han puesto de manifiesto que los pacientes con una reducción de la función del ventrículo izquierdo pueden obtener más beneficio con el empleo de un DAI que con el tratamiento farmacológico22. Así pues, los ensayos de prevención secundaria eran estadísticamente robustos y han mostrado un efecto uniforme de mejora de la supervivencia con el empleo de DAI, en comparación con el tratamiento con fármacos antiarrítmicos en los diversos estudios.
En consecuencia, el empleo de DAI es una indicación de clase I en los pacientes que han sobrevivido a una parada cardiaca debido a FV/ TV o que han sufrido un episodio de TV sostenida, tras haberse descartado toda causa completamente reversible1,22. De igual modo, la implantación de un DAI está indicada (con una indicación de clase I) en los pacientes con síncope de origen indeterminado que presentan una TV o FV sostenida, clínicamente relevante y hemodinámicamente significativa, inducida en el estudio electrofisiológico. Los pacientes deben recibir paralelamente un tratamiento médico óptimo para la insuficiencia cardiaca y la EC.
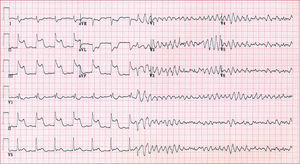
Algunos individuos son reanimados de una parada cardiaca debida a causas reversibles que pueden ser transitorias. Sin embargo, debe recordarse que el riesgo de recurrencia de la parada cardiaca es elevado, a pesar de que la causa de la parada inicial pareciera ser una anomalía transitoria o corregible1. Las dos presuntas causas de parada cardiaca reversible más frecuentes en la práctica clínica son la isquemia aguda y el desequilibrio electrolítico, la mayoría de las veces por hipopotasemia1. Las guías existentes abordan ambas cuestiones1,22. Sólo si hay evidencia directa y clara de isquemia inmediatamente precedente al inicio de la FV o la TV polimórfica (fig. 1), con una función ventricular izquierda normal y sin evidencia de un IM previo, la revascularización completa es tratamiento suficiente1,22. En los pacientes con TV/FV sostenida y un IM previo y/o disfunción ventricular izquierda, la revascularización por sí sola no es suficiente para prevenir un nuevo episodio de MSC1,22. De igual modo, es improbable que la TV monomórfica sostenida con IM previo se vea afectada por la revascularización1,22. Además, en pacientes con una EC conocida que presentan una TV o FV monomórfica sostenida y elevaciones de bajo nivel de troponina cardiaca y creatincinasa, no debe suponerse que un nuevo IM ha sido la causa de la TV/FV sostenida. En estos pacientes debe realizarse una evaluación de la isquemia. Sin embargo, dichos pacientes deben ser tratados de la arritmia ventricular de la misma forma que los pacientes en quienes no se documenta aumento alguno de los biomarcadores1,22.
La segunda situación identificada con más frecuencia en los pacientes que sobreviven a una parada cardiaca es la hipopotasemia y/o hipomagnesemia. Aunque las anomalías electrolíticas facilitan la aparición de una TV/FV, la hipopotasemia puede deberse también a la propia parada cardiaca. Además, la corrección de la hipopotasemia no afecta a la inducibilidad de una TV monomórfica aparecida después del IM1. Las guías recomiendan que no se dé por supuesto que las anomalías electrolíticas son la causa de la parada, excepto en presencia de un síndrome de QT largo inducido por fármacos1,22. Los pacientes que han sobrevivido a una parada cardiaca o una TV sostenida en presencia de EC en los que se detectan anomalías electrolíticas, en general deben ser evaluados y tratados de una forma similar que los pacientes sin anomalías electrolíticas1,22.
Recientemente, varios estudios han descrito que, tras el primer tratamiento con DAI, la mortalidad aumenta entre 2 y 5 veces. Se planteó la cuestión de si el tratamiento con DAI era una causa o un signo del aumento de riesgo de mortalidad, sobre todo en pacientes con insuficiencia cardiaca. En un reciente análisis de subgrupos del estudio SCD-HeFT, se puso de manifiesto que el tratamiento con DAI reducía la mortalidad cardiaca y la MS de presunto origen taquiarrítmico ventricular y no tenía efecto alguno en la mortalidad por insuficiencia cardiaca28. Teniendo en cuenta estas consideraciones, los pacientes que reciben un primer o ulterior tratamiento con DAI deben ser reevaluados y tratados intensivamente, según sea necesario, en cuanto a la insuficiencia cardiaca, la arritmia y/o las exacerbaciones isquémicas.
Ablación con catéter de radiofrecuenciaAunque los DAI son muy eficaces en la prevención secundaria de la MSC, las descargas del desfibrilador son dolorosas, pueden causar ansiedad y depresión y no brindan una protección completa1,22. En consecuencia, son deseables otras estrategias de prevención secundaria. El ensayo SMASH VT, recientemente publicado, ha investigado el uso de la ablación mediante catéter de radiofrecuencia, utilizando un enfoque basado en el sustrato que aplica los métodos modernos de mapas y técnicas percutáneas como terapia adyuvante a la implantación del DAI en los pacientes con un IM previo29. Se estudió a 128 pacientes con un episodio espontáneo de TV o FV sostenida a los que se asignó aleatoriamente la ablación percutánea y el empleo de DAI o solamente el tratamiento con DAI. La tasa de mortalidad a los 30 días de la ablación fue nula. Durante un periodo medio de seguimiento de 23 ± 6 meses, el 33% de los pacientes del grupo de DAI solo, en comparación con el 12% de los pacientes del grupo de DAI y ablación, recibieron tratamientos de DAI apropiados (p=0,007; reducción del riesgo relativo del 67%). Hubo menos muertes en los grupos de tratamiento de ablación, pero la mortalidad no presentó diferencias significativas (el 9 frente al 17%; p=0,29). Se espera que estos resultados prometedores sean confirmados en futuros estudios más amplios29.
Miocardiopatía dilatada no isquémicaLa mortalidad a 5 años de la miocardiopatía dilatada (MCD) no isquémica se estima actualmente en un 20%, y la MSC supone aproximadamente un 30% del total de muertes1. En la MCD, el tratamiento médico óptimo de la insuficiencia cardiaca es eficaz para reducir tanto la MS como la muerte no súbita, y su empleo es imprescindible.
Prevención primariaEn múltiples ensayos prospectivos aleatorizados, se ha evaluado el papel de la implantación profiláctica primaria de DAI en la prevención de la MS en pacientes con MCD (tabla 2). Después de tres estudios iniciales pequeños y no concluyentes30–32, el ensayo SCD-HeFT incluyó a 2.521 pacientes con insuficiencia cardiaca congestiva (ICC) en clase II o III de la NHYA que presentaban miocardiopatía isquémica o no isquémica, con una FE < 35%. Ese estudio ha demostrado que la reducción del riesgo relativo es comparable en los pacientes con disfunción del ventrículo izquierdo debida a un IM previo o a una MCD no isquémica18. Sin embargo, la mortalidad total fue inferior en el grupo no isquémico, de tal manera que el número de pacientes que es necesario tratar por vida salvada era superior18. Debe señalarse que estos ensayos no incluyeron a pacientes con insuficiencia cardiaca de clase I de la NHYA. Dado que la mortalidad en este grupo de pacientes es baja, el efecto beneficioso esperado con el tratamiento de DAI es moderado22. La insuficiencia cardiaca de clase IV es de por sí un estado heterogéneo y dinámico. Sin embargo, cuando un paciente presenta síntomas de clase IV persistentes o que reaparecen con frecuencia a pesar de un tratamiento médico óptimo, la esperanza de vida es inferior a 12 meses1,22. En estos pacientes, las muertes por insuficiencia cardiaca explican un elevado porcentaje del total de muertes, y la implantación de un DAI no está indicada, sean cuales sean las preferencias del paciente y la familia1,22. Sin embargo, los pacientes hospitalizados que presentan síntomas de clase IV muestran a menudo una mejora sustancial y pueden ser dados de alta, y se mantienen de manera persistente en un estado de clase III con un tratamiento farmacológico oral. En este subgrupo de pacientes, la supervivencia es similar a la de otros pacientes de clase III que no han sido hospitalizados recientemente por insuficiencia cardiaca22. En estos pacientes, puede comentarse la implantación de un DAI y cabe esperar que con ella mejore la supervivencia22. Otro subgrupo específico de pacientes es el de los que tienen insuficiencia cardiaca grave y están a la espera de un trasplante cardiaco. La probabilidad de una supervivencia prolongada después del trasplante es alta, pues actualmente un 50% de los pacientes sobreviven a los 10 años del trasplante. La elevada tasa de MS en los pacientes que se encuentran en listas de espera para trasplante justifica la implantación de un DAI en la mayor parte de los candidatos que están a la espera de un trasplante y no están ingresados en el hospital, con independencia de que el origen de la insuficiencia cardiaca sea isquémico o no1,22. En consecuencia, en las guías más recientes, el tratamiento con DAI es una indicación de clase I para la prevención primaria de la MS en los pacientes con MCD y una ICC de clase II o III de la NYHA con una FE < 35%22. La implantación de un DAI es razonable (indicación de clase IIa) en los pacientes que están a la espera de un trasplante cardiaco y no están hospitalizados22.
Principales ensayos del desfibrilador automático implantable para la prevención primaria de la muerte súbita cardiaca en la miocardiopatía dilatada no isquémica.
| Ensayo | Pacientes, n | Criterios de inclusión (FE) | Otros criterios de inclusión | Reducción del riesgo relativo | p |
| CAT (2000) | 104 | 30% | Inicio reciente (< 9 meses) | Ninguna | NS |
| AMIOVIRT (2000) | 103 | 35% | TVNS | Ninguna | NS |
| DEFINITE (2004) | 458 | 35% | ESV o TVNS, NYHA I-III | 35% | 0,08 |
| SCD-HeFT (2005) | 2.521 | 35% | ICC en NYHA II-III | 23% | 0,007 |
AMIOVIRT: Amiodarone Versus Implantable Defibrillator in patients with nonischemic Cardiomyopathy and Asymptomatic Nonsustained Ventricular Tachycardia; CAT: Cardiomyopathy Trial; DEFINITE: Defibrillators in Nonischemic Cardiomyopathy Treatment evaluation; ESV: extrasístole ventricular; FE: fracción de eyección; ICC: insuficiencia cardiaca congestiva; NYHA: clase funcional de la New York Heart Association; SCD-HeFT: Sudden Cardiac Death in Heart Failure Trial; TVNS: taquicardia ventricular no sostenida.
Según las recomendaciones actuales para la implantación profiláctica primaria de un DAI, en un número significativo de pacientes el dispositivo nunca llega a producir una descarga. Por este motivo, continúa la búsqueda de mejores predictores del riesgo. Los datos recientes indican que la fibrosis miocárdica regional demostrada mediante el contraste tardío de gadolinio en la resonancia magnética podría predecir una probabilidad elevada de arritmias ventriculares33.
Prevención secundariaLos pacientes con MCD no isquémica y episodios previos de FV o TV sostenida presentan un riesgo elevado de recurrencia de parada cardiaca. No se ha demostrado que el tratamiento antiarrítmico mejore la supervivencia. Sí se ha observado que el tratamiento con DAI es superior al de amiodarona para la prevención secundaria de la TV/FV en ensayos en que la mayoría de los pacientes tenían una EC25–27. Sin embargo, en estos estudios el subgrupo de pacientes con MCD no isquémica obtuvo un efecto beneficioso similar o incluso superior al del subgrupo de pacientes con isquemia22. El síncope en la MCD se ha asociado a un mayor riesgo de MSC, con independencia de la etiología demostrada34. Además, tras la implantación de un DAI, estos pacientes reciben descargas adecuadas de una forma comparable a la de una cohorte de prevención secundaria1,22. Teniendo en cuenta estas consideraciones, las guías actuales recomiendan la implantación de un DAI como indicación de clase I en la MCD tras una parada cardiaca, una TV sostenida o tras un episodio de síncope inexplicado con inducción de una TV o FV sostenida clínicamente relevante y hemodinámicamente significativa en un estudio electofisiológico1,22. Sin embargo, incluso en los pacientes sin arritmia inducible en el estudio electrofisiológico, el tratamiento con DAI es razonable (indicación de clase IIa) en los individuos con MCD y un síncope inexplicado y disfunción del ventrículo izquierdo significativa1,22. Los pacientes deben recibir paralelamente un tratamiento médico óptimo para la insuficiencia cardiaca. Por lo que respecta a la edad, las causas reversibles y el primer tratamiento con DAI, deben tenerse en cuenta las mismas consideraciones que respecto a los pacientes con cardiopatía isquémica.
Miocardiopatía hipertróficaLa miocardiopatía hipertrófica (MCH) es una enfermedad muscular hereditaria que afecta a 1 de cada 500 individuos de la población general y la causa más frecuente de MS de personas de menos de 40 años de edad1,22.
Prevención primaria y secundariaLa mayor parte de los individuos con MCH están asintomáticos y la primera manifestación de la enfermedad puede ser la MS. En una población de alto riesgo seleccionada, la mortalidad anual por MCH se ha estimado en hasta un 6% en estudios de centros terciarios1,22. Sin embargo, los estudios de base extrahospitalaria indican una enfermedad más benigna en la mayoría de los pacientes, con una tasa de mortalidad anual del 1% o inferior1,22. Esta baja tasa de eventos hace que la estratificación del riesgo y la prevención primaria resulten difíciles. Se han identificado factores de riesgo de MS en múltiples estudios observacionales y registros1,22. En un documento de consenso de 2003, se clasificaron los factores de riesgo de MSC conocidos como «mayores» o «posibles»35. Los factores de riesgo mayores son la parada cardiaca previa, la TV sostenida espontánea, la TVNS, los antecedentes familiares de MS prematura, el síncope inexplicado, el grosor del ventrículo izquierdo ≥ 30mm y la respuesta anormal de la presión arterial al ejercicio. Recientemente, múltiples estudios han confirmado que la captación miocárdica tardía de contraste de gadolinio en la RM corresponde a la fibrosis intramiocárdica y, como tal, es un importante factor de riesgo para el pronóstico adverso36. Los posibles factores de riesgo en pacientes individuales son la fibrilación auricular, la isquemia miocárdica, la obstrucción del infundíbulo del ventrículo izquierdo, la mutación de alto riesgo y el ejercicio físico intenso (de competición)35. No disponemos de estudios aleatorizados del tratamiento con DAI para la prevención primaria o secundaria de la MS en los pacientes con MCH. En estudios observacionales, el tratamiento con DAI se ha utilizado en pacientes con parada cardiaca, TV o FV sostenida, y un elevado porcentaje de pacientes han recibido descargas de DAI apropiadas durante el seguimiento, con una frecuencia de un 11% al año1,22. En un ensayo no aleatorizado de la implantación de DAI para la prevención primaria en función de un riesgo elevado de MSC real o percibido, se observó una tasa de descargas apropiadas inferior, de un 5% anual37.
Según lo indicado por los estudios observacionales, en los pacientes con MCH que han sufrido TV y/o FV sostenida, la implantación de un DAI es una indicación de clase I1,22. Aunque la estratificación precisa del riesgo no se ha validado, según las recomendaciones actuales, la implantación de un DAI es razonable (indicación de clase IIa) en los pacientes con MCH que tienen 1 o varios factores de riesgo de MSC mayores1,22.
Displasia/miocardiopatía arritmogénica de ventrículo derechoLa displasia/miocardiopatía arritmogénica de ventrículo derecho (D/MAVD) es un trastorno genético caracterizado por una infiltración fibroadiposa del ventrículo derecho y con menor frecuencia del ventrículo izquierdo. Generalmente se manifiesta clínicamente por una TV monomórfica sostenida, con morfología de bloqueo de rama izquierda del haz, en individuos jóvenes durante el ejercicio.
Prevención primaria y secundariaNo hay estudios prospectivos y aleatorizados del tratamiento farmacológico en comparación con el tratamiento de DAI en pacientes con D/MAVD para la prevención secundaria de la MS. Sin embargo, los estudios observaciones de múltiples centros ponen de manifiesto de manera uniforme una frecuencia elevada de descargas de DAI apropiadas por taquiarritmias ventriculares con peligro para la vida1,22. Sin embargo, cuando se considera el posible uso de un DAI para la prevención primaria, debe tenerse en cuenta que hay factores de riesgo de MSC en la D/MAVD que no se han definido aún en estudios prospectivos amplios centrados en la supervivencia1,22. Los factores de riesgo que tienen utilidad clínica para identificar a los pacientes con riesgo de taquiarritmias ventriculares son la inducibilidad de una TV sostenida durante el estudio electrofisiológico, la TVNS en la monitorización Holter, el sexo masculino, la dilatación severa del ventrículo derecho y la afección extensa de este1,22. La edad de presentación temprana (< 5 años), la afección del ventrículo izquierdo, determinadas mutaciones, la parada cardiaca previa y el síncope inexplicado son marcadores del riesgo22. Es evidente que todavía no hay consenso claro respecto a los factores de riesgo específicos que identifican a los pacientes en quienes la probabilidad de MSC es lo suficientemente alta para justificar el uso de un DAI para la prevención primaria. Mientras no se disponga de nuevos datos, las decisiones deben tomarse de manera individualizada para cada paciente22.
Se recomienda la implantación de un DAI (con una indicación de clase I) en los pacientes con D/MAVD y una TV o FV sostenida documentada1,22. La implantación de un DAI es razonable (indicación de clase IIa) en los pacientes con MAVD y una enfermedad extensa, incluidos los que tienen una afección del ventrículo izquierdo, uno o varios familiares afectados de MSC o un síncope no diagnosticado1. El tratamiento con amiodarona o sotalol puede ser eficaz (indicación de clase IIa) para la TV o FV sostenida como terapia adyuvante o cuando no es factible el empleo de un DAI1. La ablación puede ser una terapia adyuvante útil (indicación de clase IIa) en caso de TV recurrente1.
Miocardiopatía no compactadaLa falta de compactación del ventrículo izquierdo es una miocardiopatía congénita infrecuente que se caracteriza anatómicamente por la presencia de trabéculas prominentes excesivas y recesos intertrabeculares profundos en el ventrículo izquierdo. El diagnóstico es difícil y con frecuencia pasa inadvertido o se realiza tardíamente22.
Prevención primaria y secundariaLa MS y las arritmias ventriculares se encuentran entre las principales complicaciones de este trastorno. Los datos clínicos indican que la MS es la más frecuente causa de muerte22. Aunque no hay datos de ensayos ni registros prospectivos, hay datos observacionales suficientes que indican que la colocación de un DAI puede reducir el riesgo de MS en pacientes seleccionados22. Las guías recientes establecen que puede considerarse el uso de un tratamiento de DAI (indicación de clase IIb) en pacientes con ventrículo izquierdo no compactado22. En un estudio reciente de pequeño tamaño, el tratamiento con DAI resultó eficaz para la prevención secundaria o primaria de la MSC. Sin embargo, no se observaron predictores clínicos de la terapia de DAI apropiada. El tratamiento de resincronización cardiaca mejoró la clase funcional de la NYHA y, por lo tanto, puede considerarse su uso en pacientes con FEVI < 35% y signos de disincronía ventricular38.
Conflicto de intereses