Full English text available from: www.revespcardiol.org/en
Actualmente el implante percutáneo de válvula aórtica (TAVI) es el método de tratamiento estándar para los pacientes con estenosis aórtica grave inoperables y de alto riesgo adecuadamente seleccionados. Recientemente se ha demostrado que esta intervención es también una alternativa a la sustitución quirúrgica de la válvula aórtica (SAVR) en poblaciones de riesgo intermedio, y pronto se realizarán estudios aleatorizados sobre su uso en pacientes de bajo riesgo1–6. Al ampliarse el uso de esta técnica para incluir a poblaciones de pacientes de menos edad y riesgo, tiene un interés creciente la reducción de las complicaciones de la intervención, como los eventos neurológicos, que son especialmente devastadores. En un artículo recientemente publicado en Revista Española de Cardiología, Abdul-Jawad Altisent et al.7 resumen con elegancia las cuestiones relativas a la identificación, la cuantificación y la prevención del ictus durante el TAVI, y comentan la evidencia existente respecto a los dispositivos de protección embólica y las incertidumbres actuales sobre su uso clínico en el futuro.
Es importante señalar que los datos contemporáneos indican claramente que el riesgo de ictus como complicación del TAVI probablemente sea equivalente y podría ser menor que el de los pacientes similares tratados con SAVR. La idea, actualmente desprestigiada, de que el TAVI conlleva un riesgo de ictus superior al de la SAVR predominó después del primer ensayo aleatorizado PARTNER IA, en el que se comparó el TAVI utilizando la válvula SAPIEN de primera generación (Edwards Lifesciences) con la SAVR en pacientes con un riesgo quirúrgico elevado. Dicho estudio puso de manifiesto un aumento al doble del riesgo de la variable combinada de ictus y accidente isquémico transitorio (AIT) en un plazo de 30 días en el grupo de TAVI (el 5,5 frente al 2,4%; p = 0,04), aunque la tasa de ictus mayores no mostró una diferencia significativa (el 3,8 frente al 2,1%; p = 0,20)2. Afortunadamente, esta preocupación inicial no se ha confirmado en estudios posteriores. Un estudio del sistema CoreValve autoexpandible (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos) mostró ausencia de diferencias en la tasa de ictus a 30 días en los pacientes de alto riesgo asignados aleatoriamente a TAVI en comparación con la SAVR (el 4,9 frente al 6,2%; p = 0,46)4. De igual modo, el estudio recientemente publicado PARTNER II mostró ausencia de diferencias en cuanto a las tasas de ictus entre los pacientes de riesgo intermedio aleatorizados a TAVI con la válvula SAPIEN XT (Edwards Lifesciences) y los asignados a SAVR (el 5,5 frente al 6,1%; p = 0,57), sin diferencias también en las tasas de ictus invalidantes (el 3,2 frente al 4,3%; p = 0,20)6. Además, los datos de la válvula SAPIEN 3 (Edwards Lifesciences) demostraron nuevas mejoras en la incidencia de ictus a los 30 días, que se dio en un 1,5% de los pacientes de esta cohorte inoperable/de alto riesgo, y en un 2,6% de los pacientes de la cohorte de riesgo intermedio5. En comparación con una cohorte de pacientes igualados por puntuación de propensión, «según tratamiento», sin aleatorización, que fueron asignados a SAVR en el ensayo PARTNER IIA, el TAVI fue superior a la cirugía por lo que respecta al riesgo de ictus (–3,5% [–5,9 a –1,1]; p = 0,0038)5. Las diferencias de resultados entre el estudio PARTNER IA y los estudios posteriores pueden explicarse por el hecho de que en el estudio PARTNER IA no se exigió una evaluación neurológica sistemática, mientras que sí fue obligatoria en los estudios posteriores.
A pesar de los resultados de estos ensayos aleatorizados o igualados por puntuación de propensión, sigue siendo motivo de preocupación el ictus en los pacientes tratados con TAVI. Además, muchos autores han señalado que las tasas de eventos con la SAVR son muy inferiores a las descritas en los ensayos contemporáneos y apuntan que el informe de 2008 de la base de datos de la Society of Thoracic Surgeons indica un riesgo estimado de ictus para la cirugía valvular aórtica aislada de un 1,5%8. Sin embargo, es importante señalar que esto incluye a pacientes de todas las edades y puntuaciones de riesgo, y que el registro de estos episodios realizado en los centros puede no ser exacto. Este hecho se refleja en un estudio prospectivo que clasificó los ictus en función de la evaluación prequirúrgica y posquirúrgica realizada por un neurólogo a pacientes de edad ≥ 65 años sometidos a SAVR, e identificó 34 ictus clínicos en 196 pacientes, de los que solo 13 habían sido registrados correctamente en la base de datos de la Society of Thoracic Surgeons9. Además, los infartos cerebrales silentes, detectados mediante resonancia magnética con ponderación de difusión (DW-RM), no son específicos de los pacientes tratados con TAVI, y en un estudio se han demostrado eventos subclínicos en hasta un 47% de los pacientes tratados con SAVR10. Esto subraya la necesidad de métodos exactos y estandarizados para la medición de eventos neurológicos en los pacientes tratados con TAVI o SAVR.
La elaboración de las directrices del VARC (Valve Academic Research Consortium) es un avance extraordinariamente importante hacia la uniformidad en las variables de resultado que se debe considerar en estudios de valvulopatías, pero tienen ciertas limitaciones por lo que respecta a la evaluación de los eventos neurológicos11. Tal como comentan Abdul-Jawad Altisent et al., algunos estudios han presentado objetivos combinados que incluían cualquier AIT o ictus, y algunos han diferenciado más específicamente los ictus invalidantes de los no invalidantes. Además, la incidencia y la importancia de los eventos neurológicos subclínicos, incluidos los fenómenos embólicos silentes detectados en la DW-RM, y los cambios en mediciones neurocognitivas más sutiles no se han integrado hasta el momento en las guías actuales. Tal vez la forma más apropiada de atenuar estos problemas sea adaptar las guías futuras para que reflejen mejor el amplio espectro de objetivos neurológicos que se evalúan en la actualidad. En vez de buscar una única definición que incluya todos los ictus tras el TAVI, una forma más efectiva de clasificar los eventos observados puede ser clasificarlos por separado como ictus clínicos, AIT, infartos silentes y deterioros neurocognitivos (tabla). Esto está adquiriendo una importancia creciente, dadas las tasas extremadamente bajas de ictus clínicos que se están describiendo en los ensayos más recientes, y permite utilizar un método estandarizado para evaluar las estrategias de reducción de los ictus, como los dispositivos de protección cerebral, que requerirían ensayos extraordinariamente grandes para disponer de la potencia estadística necesaria para mostrar reducciones estadísticamente significativas con el empleo de las definiciones del ictus clínico solamente.
Método propuesto para la definición de los eventos neurológicos tras la sustitución quirúrgica o el implante percutáneo de la válvula aórtica, diferenciando los eventos silentes y el deterioro neurocognitivo en categorías distintas
| Definición | Características clínicas | Neuroimagen |
|---|---|---|
| Ictus: Isquémico Hemorrágico Indeterminado | Síndrome clínico de déficit neurológico focal o general sin ninguna otra causa claramente identificable | Requiere confirmación por un neurólogo o una técnica de neuroimagen |
| Accidente isquémico transitorio | Síndrome clínico de déficit neurológico focal o general sin ninguna otra causa claramente identificable | Se resuelve en menos de 24 h y los estudios de neuroimagen no muestran un signo que se corresponda con ello |
| Evento neurológico silente | Ausencia de síndrome clínico de déficit neurológico | Las exploraciones de neuroimagen o la anatomía patológica muestran una lesión isquémica aguda en el sistema nervioso central |
| Deterioro neurocognitivo | Diagnóstico basado en pruebas neurocognitivas específicas realizadas antes y después de la intervención | No requiere exploraciones de neuroimagen. Puede solaparse con algunos pacientes clasificados como «silentes» |
Tal vez el avance más positivo al que han dado origen las preocupaciones iniciales sobre los eventos embólicos durante el TAVI sea el compromiso para estudiar estrategias de reducción de ictus como el uso de antiagregantes plaquetarios, anticoagulantes y dispositivos de protección embólica. La protección embólica es un enfoque especialmente atractivo por diversas razones. La primera es el conocimiento de que al parecer estos dispositivos dan lugar a una reducción útil del número o el volumen de las lesiones de nueva aparición en la DW-RM después del TAVI, en especial las que pueden estar situadas en los territorios vasculares protegidos12,13. Segundo, la identificación de restos importantes en 19 de los 35 filtros de protección embólica SENTINAL (Claret Medical) utilizados en el ensayo clínico inicial y en el 86% de los 81 pacientes estudiados en un ensayo posterior, que demuestran que llegan restos a las arterias carótidas, incluso en los pacientes que no sufren un ictus clínico14. El ensayo fundamental de registro SENTINAL, actualmente en marcha, y los resultados de más de 350 pacientes se presentarán en breve, pero mientras tanto los operadores de TAVI y los pacientes continúan preguntándose qué papel tendrán estos dispositivos en el futuro.
Abdul-Jawad Altisent et al. señalan que la protección embólica de la arteria carótida ha sido durante mucho tiempo el método estándar empleado en el implante de stents arteriales carotídeos (SAC) a pesar de la ausencia de ensayos aleatorizados que muestren reducciones de los objetivos clínicos «duros» y que, aunque es cierto que la protección con filtro puede ser de por sí similar en sus resultados a los de otras estrategias de protección embólica, como la oclusión con balón proximal para el SAC, el empleo de algún tipo de protección embólica es actualmente universal para el SAC y es incluso obligatorio para el reembolso por parte de los Centers for Medicare and Medicaid Services en Estados Unidos. En el caso del TAVI, la cuestión es qué nivel de evidencia será necesario antes de que la protección embólica pase a incorporarse de manera similar en la práctica clínica estándar. Puede argumentarse que estos dispositivos deben reservarse para pacientes con un riesgo elevado de eventos neurológicos, pero un análisis de los datos del ensayo PARTNER solo pudo identificar un área de la válvula aórtica menor como factor independiente predictivo de ictus temprano tras el TAVI15. De igual modo, un estudio de la incidencia y los factores predictivos de la presencia de residuos en el filtro del SENTINAL durante el TAVI identificó solamente el uso de válvulas expandibles con balón y un índice de cobertura elevado como factores predictivos independientes en un análisis de regresión logística multivariable14. Así pues, resulta casi imposible predecir qué pacientes sufrirán un ictus embólico significativo.
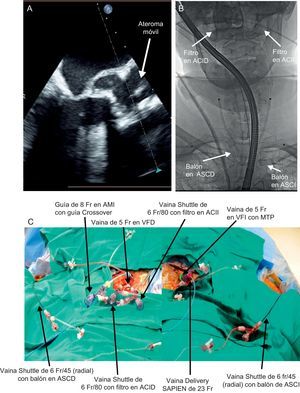
Falta por determinar si el uso de dispositivos de protección embólica pasa a ser una técnica estándar aplicada durante el TAVI o no, como ha sucedido en el caso del SAC. Ciertamente, los resultados de esos ensayos clínicos en curso orientarán la adopción de esta medida y serán clave para el proceso de aprobación por la Food and Drug Administration de Estados Unidos. En el supuesto de que los ensayos actuales sigan demostrando la seguridad del dispositivo y al menos una reducción de los eventos según las evaluaciones realizadas con la DW-RM, es difícil imaginar que una estrategia de protección embólica no llegue a formar parte del proceso de el TAVI. A pesar de las dificultades existentes en la predicción de eventos, parece que algunos pacientes tienen un riesgo especialmente elevado, por ejemplo los pacientes con un ateroma móvil conocido. En la figura se muestra un caso de este tipo en el que había un ateroma móvil en una válvula aórtica calcificada, pero lamentablemente no se comercializa ningún sistema de protección embólica específico para este fin. Así pues, la protección embólica se realizó colocando guías de filtro de arteria carótida bilaterales y ocluyendo con balón de la arteria subclavia bilateral. Aunque este caso resalta claramente la necesidad de sistemas específicos para los pacientes de riesgo extremadamente alto, será igual de difícil no aplicar la protección embólica a pacientes que al parecer muestran un riesgo normal de sufrir estos eventos.
Estrategia de protección embólica para un paciente de riesgo especialmente alto sin ningún sistema comercial disponible. A: ateroma móvil en las valvas de la válvula aórtica calcificada. B: para proteger las arterias carótidas internas, se colocaron 2 vainas Shuttle de 6 Fr y 80 mm en la arteria femoral común para permitir la colocación de guías de filtro de arteria carótida interna bilaterales; el acceso bilateral a la arteria radial se realizó con vainas Shuttle de 6 Fr y 45 mm y se colocaron balones en las arterias subclavia derecha e izquierda para proteger los sistemas vertebrales en el momento de desplegar la válvula con guía fluoroscópica. C: fotografía exterior que muestra las múltiples vainas radiales y femorales. ACID: arteria carótida interna derecha; ACII: arteria carótida interna izquierda; AMI: arteria mamaria interna; ASCD: arteria subclavia derecha; ASCI: arteria subclavia izquierda; MTP: marcapasos transitorio; VFD: vena femoral derecha; VFI: vena femoral izquierda.
Coincidimos con los autores en que, con más tiempo y estudio, se podrá conocer mejor los riesgos y los beneficios que aportan los dispositivos de protección embólica cerebral, así como las consecuencias clínicas de los infartos cerebrales silentes y el deterioro cognitivo después del TAVI. Es de esperar que estos esfuerzos, junto con el estudio de estrategias farmacológicas y el tratamiento de los factores asociados, como la fibrilación auricular tras la intervención, continúen reduciendo el riesgo de eventos neurológicos asociados al TAVI.
CONFLICTO DE INTERESESNinguno.