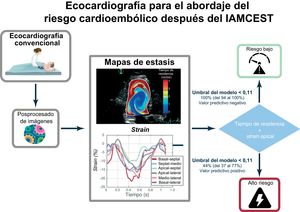
Tras el infarto agudo de miocardio con elevación del segmento ST (IAMCEST), los biomarcadores por imagen pueden ser útiles para guiar la anticoagulación oral en la prevención primaria de la cardioembolia. Nuestro objetivo es probar la eficacia de la imagen de estasis intraventricular como predictora del riesgo cardioembólico después de un IAMCEST.
MétodosSe diseñó un estudio clínico prospectivo, Imaging Silent Brain Infarct in Acute Myocardial Infarction (ISBITAMI), que incluyó a pacientes con un primer IAMCEST y fracción de eyección del ventrículo izquierdo ≤ 45%, sin fibrilación auricular, para evaluar el desempeño de las métricas de estasis en la predicción de la cardioembolia. En la inclusión, se obtuvieron imágenes de estasis por ultrasonido, seguidas de resonancia magnética cardiaca y cerebral en 2 visitas tras 1 semana y 6 meses. Usando los mapas de estasis, calculamos el tiempo de residencia promedio, RT, de la sangre dentro del VI y evaluamos su eficacia para predecir el objetivo primario. El strain apical longitudinal en los 4 segmentos apicales se cuantificó mediante speckle tracking.
ResultadosUn total de 66 pacientes completaron el periodo de seguimiento. De ellos, 17 pacientes sufrieron 1 o más eventos: 3 ictus, 5 infartos cerebrales silentes y 13 trombosis murales. No se observaron embolias sistémicas. El RT (OR=3,73; IC95%,1,75-7,97; p<0,001) y el strain apical (OR=1,47; IC95%, 1,13-1,92; p=0,004) mostraron un valor pronóstico complementario. El modelo bivariado mostró un índice c=0,86 (IC95%, 0,73-0,95), un valor predictivo negativo de 1,00 (IC95%, 0,94-1,0) y un valor predictivo positivo de 0,45 (IC95%, 0,37-0,77). Las métricas convencionales tuvieron un valor predictivo limitado.
ConclusionesEn pacientes con IAMCEST y disfunción sistólica del VI en ritmo sinusal, el riesgo de cardioembolia puede estimarse usando ecocardiografía y combinando imágenes de estasis y deformación. Registrado en ClinicalTrials.gov (NCT02917213).
Palabras clave
En el mes posterior a un infarto agudo de miocardio con elevación del segmento ST (IAMCEST), el riesgo ajustado de ictus isquémico es 30 veces mayor que en la población general1. Los anticoagulantes orales (ACO) son muy eficaces en la prevención de ictus, pero sus beneficios quedan neutralizados por el aumento del riesgo de hemorragias2–4. Por tanto, para prevenir cardioembolias y complicaciones cardioembólicas durante las primeras semanas después del IAMCEST, sería de gran ayuda en la selección de candidatos para recibir ACO una evaluación del riesgo personalizada.
Además de la fibrilación auricular (FA), los otros 2 factores principales implicados en las complicaciones tromboembólicas en el contexto del IAMCEST son la estasis sanguínea en el interior del ventrículo izquierdo (VI) y la lesión endocárdica5,6. Esta última está estrechamente relacionada con la función local anómala de los territorios isquémicos, de modo que puede abordarse adecuadamente mediante imágenes del strain o deformación. En cuanto a la primera, recientemente se ha implementado un método para visualizar y cuantificar la estasis sanguínea dentro del corazón a partir de datos de imagen ecocardiográfica convencional7,8. Este método ha servido para proponer un biomarcador capaz de cuantificar la estasis sanguínea: el tiempo de residencia (RT) de la sangre en el VI. Este parámetro se define por el número de ciclos que permanece la sangre en el interior del VI durante su tránsito por las cavidades cardiacas8,9. Los mapas espaciotemporales del RT son una técnica valiosa para evaluar las regiones de estasis sanguínea. Los estudios preliminares de su eficacia tanto en animales como en pacientes han demostrado el potencial del RT para explicar el riesgo de trombosis mural y microembolias cerebrales relacionadas con IAMCEST10,11.
Este estudio es el primer ensayo clínico diseñado para evaluar prospectivamente la eficacia de la imagen de estasis/cuantificación de estasis por imagen en la predicción de eventos tromboembólicos durante los 6 meses posteriores al IAMCEST. El objetivo principal integró eventos neurológicos y hallazgos subclínicos en los estudios de imagen cardiaca y cerebral.
MÉTODOSDiseño del estudioEl estudio clínico prospectivo Imaging Silent Brain Infarct in Acute Myocardial Infarction (ISBITAMI) se registró por primera vez en 2016 (número de registro NCT02917213). Se examinó a todos los pacientes con ingreso en nuestro centro con los siguientes criterios de inclusión: un primer IAMCEST con o sin revascularización y una fracción de eyección del VI (FEVI) ≤ 45% en el momento del ingreso, edad ≥ 18 años, presencia de ritmo sinusal y sin antecedentes de FA. Los criterios de exclusión consistieron en cualquier antecedente de ictus o accidente isquémico transitorio, tratamiento con ACO en curso o una indicación formal para este tratamiento, cualquier contraindicación para una resonancia magnética, antecedentes de shock cardiogénico, antecedentes de muerte súbita recuperada o cualquier otra causa potencial de lesión cerebral aguda por hipoperfusión, valvulopatía primaria de grado ≥ 3, un diagnóstico de arteriopatía carotídea con estenosis >50%, antecedentes de enfermedad protrombótica o renuncia a firmar el consentimiento informado por escrito. Cualquier antecedente de FA (ya sea detectado clínica o subclínicamente en pruebas Holter de 24 horas o cualquier dispositivo de monitorización cardiaca) también fue un criterio de exclusión. El estudio fue aprobado por el Comité de Ética del Hospital Gregorio Marañón y todos los pacientes dieron el consentimiento informado por escrito. El estudio se financió con fondos académicos y la Fundación para la Investigación Biomédica Hospital Gregorio Marañón fue el único patrocinador. El proyecto se ajusta a los principios de la Declaración de Helsinki.
Objetivo del estudioEl objetivo primario integró la incidencia de cualquiera de los siguientes eventos entre la inclusión y las visitas de seguimiento en los 6 meses posteriores al IAMCEST: a) ictus o accidente isquémico transitorio, b) embolia sistémica periférica sintomática en cualquier territorio arterial, c) infarto cerebral silente (ICS) agudo o subagudo fechado después del IAMCEST, diagnosticado mediante resonancia magnética cerebral, o d) diagnóstico de trombosis mural intraventricular (TVI) mediante ecocardiografía con contraste o resonancia magnética cardiaca (RMC) con realce tardío de gadolinio. A los pacientes con cualquier evento del objetivo primario se les realizó un estudio clínico convencional para garantizar el tratamiento y el seguimiento adecuados. El ictus se evaluó clínicamente y se llevaron a cabo pruebas de imagen adicionales (p. ej., tomografía computarizada cerebral) cuando estaba indicado por la clínica.
Imágenes cardiacas y cerebrales convencionalesA todos los pacientes se les realizaron 4 pruebas de imagen: en el cribado (evaluación de los criterios de inclusión mediante ecocardiografía), entre las 24 y las 72h posteriores al ingreso (ecocardiograma transtorácico con cuantificación de estasis), 1 semana tras el infarto (ecocardiograma y resonancia magnética cerebral y cardiaca) y 6 meses después de la inclusión (ecocardiograma y resonancia magnética cerebral y cardiaca). Para más detalles, véase el apartado «Métodos» del material adicional.
Variables complementariasLos datos clínicos se recopilaron en la inclusión y en la visita de seguimiento a los 6 meses. Estos incluyeron todos los eventos clínicos, tratamiento habitual, evaluaciones hematológicas y bioquímicas, el Beck Depression Inventory y las Mini-Mental State Examinations. Se realizaron ecografías Doppler transcraneales y dúplex carotídea en pacientes con el objetivo primario para descartar causas extracardiacas de infarto cerebral alternativas. Se implantaron Holters subcutáneos (iLINQ, Medtronic, Irlanda) en una muestra aleatoria de 31 pacientes para excluir la FA asintomática durante el seguimiento de 6 meses. Si los pacientes referían palpitaciones, síncope o cualquier otro síntoma potencialmente provocado por la FA, se les realizó monitorización cardiaca con Holter convencional de 24 horas.
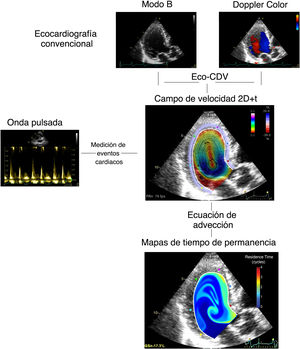
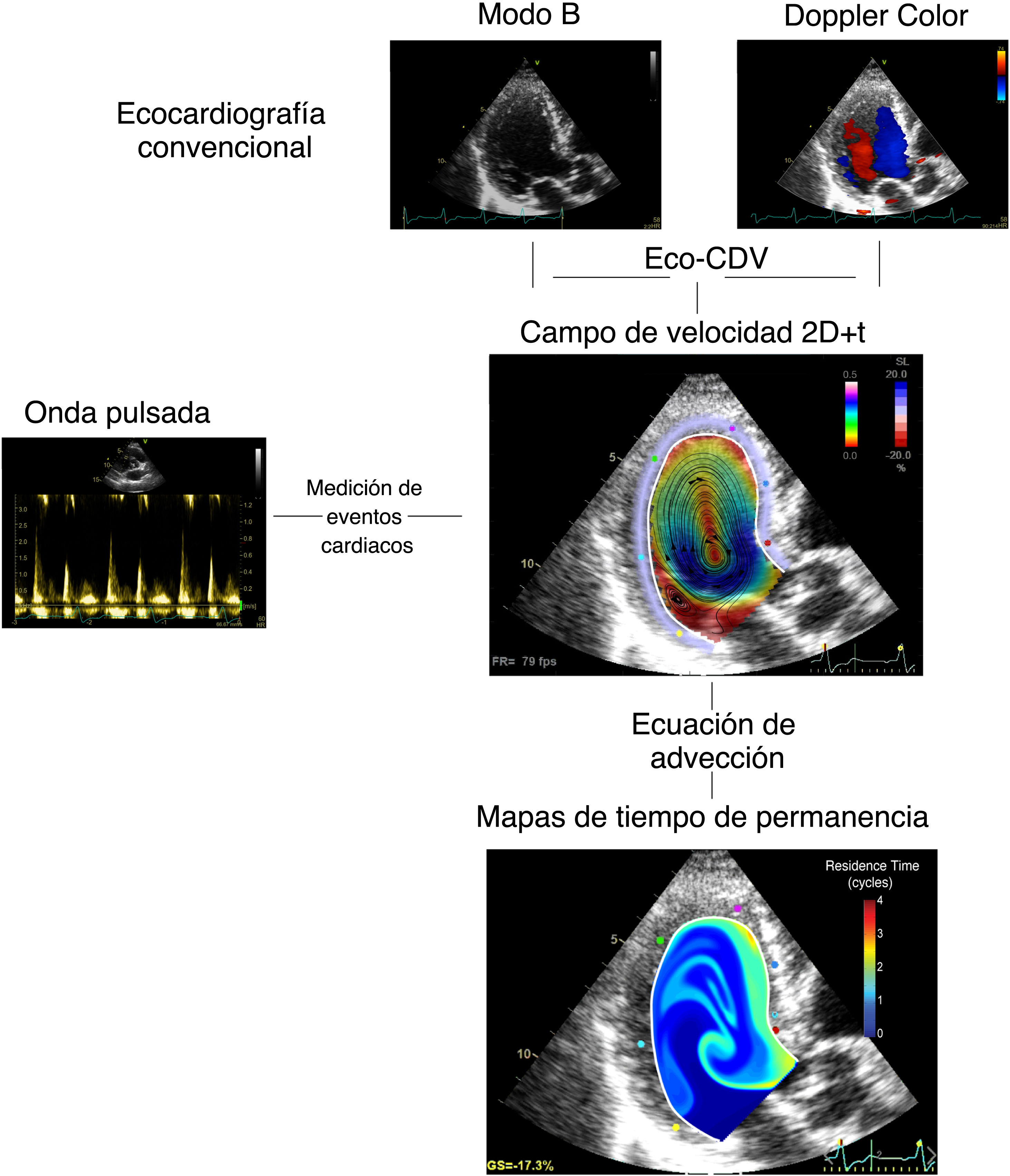
Imágenes de estasis intraventricularA partir de los ecocardiogramas realizados en el momento de la inclusión, se calcularon los mapas de flujo sanguíneo, bidimensionales y de alta resolución temporal (2D+t) dentro del VI mediante velocimetría Doppler color12. Los campos de velocidad de la sangre se utilizaron para integrar una ecuación de advección con el propósito de cuantificar el tiempo de residencia RT, un índice que cuantifica el número de ciclos cardiacos que un volumen de sangre permanece en el interior del VI7. Al final del octavo latido, que es el periodo estimado de paso de toda la sangre en un VI normal9, se cuantificó el RT medio dentro del VI como parámetro único de estasis. El proceso completo se resume en la figura 1. Todo el tratamiento de imágenes se realizó con enmascaramiento del objetivo primario. La reproducibilidad de los índices de estasis se ha publicado previamente. Los detalles completos de esta metodología se pueden encontrar en la sección «Métodos» del material adicional.
Análisis estadísticoEl tamaño de la muestra del estudio se estableció en n=92 pacientes para una potencia del 85% de alcanzar la significación (p<0,05) con un índice c >0,75, lo que supone una incidencia del 15% del objetivo principal y una tasa de exclusión del 15%. Los datos se presentan como mediana [intervalo intercuartílico] a menos que se indique otra cosa. Se utilizaron la prueba de Wilcoxon para datos emparejados y la prueba exacta de Fisher para comparar variables cuantitativas y proporciones. Se presentan las odds ratio (OR) junto con sus intervalos de confianza del 95% (IC95%) para estos modelos. La interacción entre los predictores clínicos, el RT y el objetivo principal se estudió en profundidad con análisis de correlación de Pearson. Se utilizaron análisis de la curva ROC o curva de eficacia diagnóstica para estimar el índice C, su IC95% y su significación estadística. Los puntos de corte se seleccionaron con el criterio de Youden, ponderado para penalizar los falsos negativos. Las medianas (y su IC95%) de los puntos de corte (sensibilidad, especificidad y valores predictivos positivos y negativos) se calcularon mediante remuestreo con reposición de 2.000 réplicas.
Los análisis se refieren a los pacientes que llegaron al final del protocolo de seguimiento o que pudieron ser asignados al objetivo principal porque sufrieron un evento antes del fin del seguimiento (figura 2). Para tratar las pérdidas en el seguimiento, se realizó un análisis de sensibilidad con el objetivo de evitar el sesgo de verificación (sección «Métodos» del material adicional). Los análisis estadísticos se realizaron en R (v. 4.1.3) y los valores de p <0,05 se consideraron significativos.
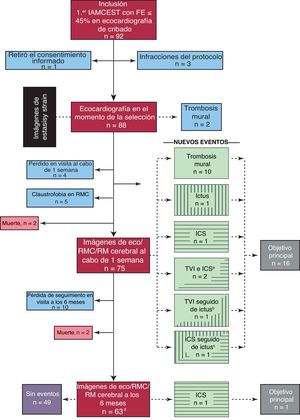
Diagrama del proceso del estudio ISBITAMI y los objetivos principales. Eco: ecocardiografía; FE: fracción de eyección; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; RM: resonancia magnética; RMC: resonancia magnética cardiaca; TVI: trombosis mural del ventrículo izquierdo.
aDos pacientes mostraron simultáneamente ICS y TVI.
bUn paciente tuvo un ictus 4 días después de que se tomaran imágenes de TVI pese a estar en tratamiento con ACO.
cUn paciente tuvo un ictus 1 semana después de que se tomara una imagen de un ICS.
dSe perdió para el seguimiento a 12 pacientes. De ellos, 3 ya habían alcanzado el objetivo primario, registrado en la visita al cabo de 1 semana.
La selección de pacientes comenzó en enero de 2017 y el seguimiento del último paciente finalizó en enero de 2022. De un grupo inicial de 92 pacientes seleccionados, a 66 se les asignó unívocamente el objetivo principal: 63 pacientes finalizaron el seguimiento de 6 meses y 3 pacientes sin seguimiento alcanzaron el objetivo primario en la visita de la semana 1 (figura 2). Cuatro pacientes murieron después de la inclusión, lo que impidió la confirmación del objetivo principal: 1 debido a una tormenta arrítmica, otro debido a trombosis aguda del stent y 2 por una causa desconocida tras el alta médica.
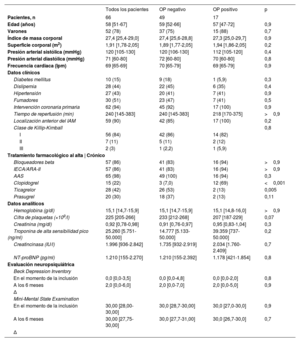
La mediana de edad fue 58 [51-67] años y el 22% de los pacientes eran mujeres (tabla 1). A 62 pacientes se les realizó una intervención coronaria percutánea primaria y 59 presentaron un IAMCEST de localización anterior. No se realizó ICP primaria a 4 pacientes, ya sea porque se sometieron a ICP tras fibrinolisis sistémica (n=2), porque se decidió una estrategia conservadora a causa de su avanzada edad (n=1) o porque la ICP estaba contraindicada por una anatomía coronaria inadecuada (n=1). La medianat de FEVI estimada por ecocardiografía en el momento de la inclusión fue del 41% [36-48%] y los valores obtenidos por RMC a la semana fueron similares (tabla 2 y tabla 3).
Datos clínicos
| Todos los pacientes | OP negativo | OP positivo | p | |
|---|---|---|---|---|
| Pacientes, n | 66 | 49 | 17 | |
| Edad (años) | 58 [51-67] | 59 [52-66] | 57 [47-72] | 0,9 |
| Varones | 52 (78) | 37 (75) | 15 (88) | 0,7 |
| Índice de masa corporal | 27,4 [25,4-29,0] | 27,4 [25,6-28,8] | 27,3 [25,0-29,7] | 0,9 |
| Superficie corporal (m2) | 1,91 [1,78-2,05] | 1,89 [1,77-2,05] | 1,94 [1,86-2,05] | 0,2 |
| Presión arterial sistólica (mmHg) | 120 [105-130] | 120 [106-130] | 112 [105-120] | 0,4 |
| Presión arterial diastólica (mmHg) | 71 [60-80] | 72 [60-80] | 70 [60-80] | 0,8 |
| Frecuencia cardiaca (lpm) | 69 [65-69] | 70 [65-79] | 69 [65-79] | 0,9 |
| Datos clínicos | ||||
| Diabetes mellitus | 10 (15) | 9 (18) | 1 (5,9) | 0,3 |
| Dislipemia | 28 (44) | 22 (45) | 6 (35) | 0,4 |
| Hipertensión | 27 (43) | 20 (41) | 7 (41) | 0,9 |
| Fumadores | 30 (51) | 23 (47) | 7 (41) | 0,5 |
| Intervención coronaria primaria | 62 (94) | 45 (92) | 17 (100) | 0,9 |
| Tiempo de reperfusión (min) | 240 [145-383] | 240 [145-383] | 218 [170-375] | >0,9 |
| Localización anterior del IAM | 59 (90) | 42 (85) | 17 (100) | 0,2 |
| Clase de Killip-Kimball | 0,8 | |||
| I | 56 (84) | 42 (86) | 14 (82) | |
| II | 7 (11) | 5 (11) | 2 (12) | |
| III | 2 (3) | 1 (2,2) | 1 (5,9) | |
| Tratamiento farmacológico al alta | Crónico | ||||
| Bloqueadores beta | 57 (86) | 41 (83) | 16 (94) | >0,9 |
| IECA/ARA-II | 57 (86) | 41 (83) | 16 (94) | >0,9 |
| AAS | 65 (98) | 49 (100) | 16 (94) | 0,3 |
| Clopidogrel | 15 (22) | 3 (7,0) | 12 (69) | <0,001 |
| Ticagrelor | 28 (42) | 26 (53) | 2 (13) | 0,005 |
| Prasugrel | 20 (30) | 18 (37) | 2 (13) | 0,11 |
| Datos analíticos | ||||
| Hemoglobina (g/dl) | 15,1 [14,7-15,9] | 15,1 [14,7-15,9] | 15,1 [14,8-16,0] | >0,9 |
| Cifra de plaquetas (×109/l) | 225 [205-266] | 233 [212-268] | 207 [187-229] | 0,07 |
| Creatinina (mg/dl) | 0,92 [0,78-0,98] | 0,91 [0,76-0,97] | 0,95 [0,83-1,04] | 0,3 |
| Troponina de alta sensibilidad pico (ng/ml) | 25.260 [5.751-50.000] | 14.777 [5.133-50.000] | 39.359 [737- 50.000] | 0,2 |
| Creatincinasa (IU/l) | 1.996 [936-2.842] | 1.735 [932-2.919] | 2.034 [1.760-2.409] | 0,7 |
| NT-proBNP (pg/ml) | 1.210 [155-2.270] | 1.210 [155-2.392] | 1.178 [421-1.854] | 0,8 |
| Evaluación neuropsiquiátrica | ||||
| Beck Depression Inventory | ||||
| En el momento de la inclusión | 0,0 [0,0-3,5] | 0,0 [0,0-4,8] | 0,0 [0,0-2,0] | 0,8 |
| A los 6 meses | 2,0 [0,0-6,0] | 2,0 [0,0-7,0] | 2,0 [0,0-5,0] | 0,9 |
| Δ | ||||
| Mini-Mental State Examination | ||||
| En el momento de la inclusión | 30,00 [28,00-30,00] | 30,0 [28,7-30,00] | 30,0 [27,0-30,0] | 0,9 |
| A los 6 meses | 30,00 [27,75-30,00] | 30,0 [27,7-31,00] | 30,0 [26,7-30,0] | 0,7 |
| Δ | ||||
AAS: ácido acetilsalicílico; ARA-II: antagonistas del receptor de la angiotensina II; IAM: infarto agudo de miocardio; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; OP: objetivo principal.
Salvo otra indicación, los valores expresan n (%) o mediana [intervalo intercuartílico].
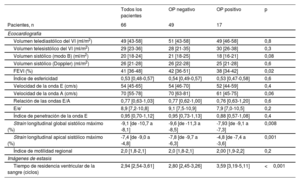
Imágenes de ecografía en el momento de la selección
| Todos los pacientes | OP negativo | OP positivo | p | |
|---|---|---|---|---|
| Pacientes, n | 66 | 49 | 17 | |
| Ecocardiografía | ||||
| Volumen telediastólico del VI (ml/m2) | 49 [43-58] | 51 [43-58] | 49 [46-58] | 0,8 |
| Volumen telesistólico del VI (ml/m2) | 29 [23-36] | 28 [21-35] | 30 [26-38] | 0,3 |
| Volumen sistólico (modo B) (ml/m2) | 20 [18-24] | 21 [18-25] | 18 [16-21] | 0,08 |
| Volumen sistólico (Doppler) (ml/m2) | 26 [21-28] | 26 [22-28] | 25 [21-28] | 0,6 |
| FEVI (%) | 41 [36-48] | 42 [36-51] | 38 [34-42] | 0,02 |
| Índice de esfericidad | 0,53 [0,48-0,57] | 0,54 [0,49-0,57] | 0,53 [0,47-0,58] | 0,6 |
| Velocidad de la onda E (cm/s) | 54 [45-65] | 54 [46-70] | 52 [44-59] | 0,4 |
| Velocidad de la onda A (cm/s) | 70 [55-78] | 70 [63-81] | 61 [45-75] | 0,06 |
| Relación de las ondas E/A | 0,77 [0,63-1,03] | 0,77 [0,62-1,00] | 0,76 [0,63-1,20] | 0,6 |
| E/e’ | 8,9 [7,2-10,8] | 9,1 [7,5-10,9] | 7,9 [7,0-10,5] | 0,2 |
| Índice de penetración de la onda E | 0,95 [0,70-1,12] | 0,95 [0,73-1,13] | 0,88 [0,57-1,08] | 0,4 |
| Strain longitudinal global sistólico máximo (%) | -9,1 [de -10,7 a -8,1] | -9,6 [de -11,3 a -8,5] | -7,93 [de -9,1 a -7,3] | 0,008 |
| Strain longitudinal apical sistólico máximo (%) | -7,4 [de -9,0 a -4,8] | -7,8 [de -9,7 a -6,3] | -4,8 [de -7,4 a -3,6] | 0,001 |
| Índice de motilidad regional | 2,0 [1,8-2,1] | 2,0 [1,8-2,1] | 2,00 [1,9-2,2] | 0,2 |
| Imágenes de estasis | ||||
| Tiempo de residencia ventricular de la sangre (ciclos) | 2,94 [2,54-3,61] | 2,80 [2,45-3,26] | 3,59 [3,19-5,11] | <0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; OP: objetivo principal; VI: ventrículo izquierdo.
Salvo otra indicación, los valores expresan mediana [intervalo intercuartílico].
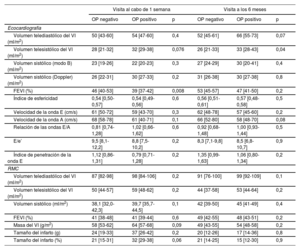
Imágenes cardiacas en las visitas a la semana y a los 6 meses
| Visita al cabo de 1 semana | Visita a los 6 meses | |||||
|---|---|---|---|---|---|---|
| OP negativo | OP positivo | p | OP negativo | OP positivo | p | |
| Ecocardiografía | ||||||
| Volumen telediastólico del VI (ml/m2) | 50 [43-60] | 54 [47-60] | 0,4 | 52 [45-61] | 66 [55-73] | 0,07 |
| Volumen telesistólico del VI (ml/m2) | 28 [21-32] | 32 [29-38] | 0,076 | 26 [21-33] | 33 [28-43] | 0,04 |
| Volumen sistólico (modo B) (ml/m2) | 23 [19-26] | 22 [20-23] | 0,3 | 27 [24-29] | 30 [20-41] | 0,4 |
| Volumen sistólico (Doppler) (ml/m2) | 26 [22-31] | 30 [27-33] | 0,2 | 31 [26-38] | 30 [27-38] | 0,8 |
| FEVI (%) | 46 [40-53] | 39 [37-42] | 0,008 | 53 [45-57] | 47 [41-50] | 0,2 |
| Índice de esfericidad | 0,54 [0,50-0,57] | 0,54 [0,49-0,56] | 0,6 | 0,56 [0,51-0,61] | 0,57 [0,48-0,58] | 0,5 |
| Velocidad de la onda E (cm/s) | 61 [50-72] | 59 [43-70] | 0,3 | 62 [48-78] | 57 [45-60] | 0,2 |
| Velocidad de la onda A (cm/s) | 68 [58-78] | 61 [40-71] | 0,1 | 66 [52-80] | 58 [48-70] | 0,08 |
| Relación de las ondas E/A | 0,81 [0,74-1,28] | 1,02 [0,66-1,62] | 0,6 | 0,92 [0,68-1,48] | 1,00 [0,93-1,44] | 0,5 |
| E/e’ | 9,5 [8,1-12,2] | 8,8 [7,5-10,2] | 0,2 | 8,3 [7,1-9,8] | 8,5 [6,8-10,7] | 0,9 |
| Índice de penetración de la onda E | 1,12 [0,86-1,31] | 0,79 [0,71-1,28] | 0,2 | 1,35 [0,99-1,63] | 1,06 [0,80-1,34] | 0,2 |
| RMC | ||||||
| Volumen telediastólico del VI (ml/m2) | 87 [82-98] | 98 [84-106] | 0,2 | 91 [76-100] | 99 [92-109] | 0,1 |
| Volumen telesistólico del VI (ml/m2) | 50 [44-57] | 59 [48-62] | 0,2 | 44 [37-58] | 53 [44-64] | 0,2 |
| Volumen sistólico (ml/m2) | 38,1 [32,0-42,3] | 39,7 [35,7-44,5] | 0,1 | 42 [39-50] | 45 [41-49] | 0,4 |
| FEVI (%) | 41 [38-48] | 41 [39-44] | 0,6 | 49 [42-55] | 48 [43-51] | 0,2 |
| Masa del VI (g/m2) | 58 [53-62] | 64 [57-68] | 0,09 | 49 [43-55] | 54 [48-58] | 0,2 |
| Tamaño del infarto (g) | 24 [19-33] | 37 [26-42] | 0,2 | 20 [12-26] | 17 [14-36] | 0,8 |
| Tamaño del infarto (%) | 21 [15-31] | 32 [29-38] | 0,06 | 21 [14-25] | 15 [12-30] | 0,9 |
FEVI: fracción de eyección del ventrículo izquierdo; OP: objetivo principal; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
Salvo otra indicación, los valores expresan mediana [intervalo intercuartílico].
Se registraron 21 eventos en 17 de los 66 pacientes estudiados (25%). Tres pacientes presentaron un ictus isquémico. Uno de ellos ocurrió después del diagnóstico de TVI pese a haber iniciado previamente anticoagulación oral. Otro ictus ocurrió 1 semana después de la detección de un ICS. Doce pacientes presentaron TVI, 2 de ellos acompañados de ICS en la vista de la semana 1. Finalmente, 2 pacientes fueron diagnosticados de ICS sin presentar eventos adicionales (1 en la visita de la semana 1 y el otro a los 6 meses). No se identificaron embolias sistémicas periféricas (tabla 4).
Objetivo compuesto
| n (%) | Comentarios | |
|---|---|---|
| Total de pacientes | 66 | |
| Pacientes que alcanzaron el objetivo compuesto | 17 (26) | |
| En la visita a la semana (n=66) | 16 (24) | 3 ictus (1 coexiste con un ICS y 1 coexiste con TVI); 12 TVI (2 coexisten con ICS); 1 ICS |
| En la visita a los 6 meses (n=63) | 1 (1) | 1 ICS |
| Trombosis mural del ventrículo izquierdo | ||
| RMC a la semana (n=66) | 13 (19) | 11 desaparecieron después de 6 meses de ACO y no estaban presentes en la RMC a los 6 meses. Uno fue seguido 4 días después de la visita por un ictus a pesar de ACO |
| RMC a los 6 meses (n=63) | 0 | 2 todavía presentes en la RMC al cabo de 1 semana |
| Infarto cerebral silente | ||
| RM cerebral la semana (n=66) | 4 (6) | 2 coexisten con TVI en la RMC al cabo de 1 semana |
| RM cerebral a los 6 meses (n=63) | 1 (2) | 1 no presente en la RM cerebral al cabo de 1 semana y sin TVI |
| Ictus | ||
| Total (n=66) | 3 (4) | Primero: 4 días después de TVI en la RMC al cabo de 1 semana y con ACO; segundo: 1 semana después de ICS encontrado en la RM cerebral al cabo de 1 semana; tercero: sin TVI o ICS en la RM al cabo de 1 semana |
| Embolia periférica (otros territorios) | ||
| En el momento de la selección (n=66) | 0 | |
| A los 6 meses de seguimiento (n=63) | 0 |
ACO: anticoagulantes orales; ICS: infarto cerebral silente; RM: resonancia magnética; RMC: resonancia magnética cardiaca; TVI: trombosis mural del ventrículo izquierdo; VI: ventrículo izquierdo.
Las ecografías Doppler dúplex carotídeas y transcraneales descartaron etiologías alternativas de eventos neurológicos en todos los pacientes con ICS o ictus. No se identificó FA durante el periodo de 6 meses en los 31 pacientes aleatorizados a un Holter implantable subcutáneo. No se observaron diferencias en las variables clínicas, hematológicas o bioquímicas entre los pacientes con y sin el objetivo principal. No hubo diferencias en el Beck Depression Inventory ni en las Mini-Mental State Examinations entre los pacientes con y sin el objetivo principal, ni en la visita de inclusión ni en la de seguimiento a los 6 meses. La localización del infarto fue anterior en todos los pacientes que alcanzaron el objetivo principal.
Predictores de imágenes del objetivo principalEn los pacientes con un objetivo primario presentaron infartos de miocardio de mayor tamaño en la RMC que aquellos sin eventos (el 37% [29-37%] frente al 21% [15-31%] de la masa miocárdica total; p=0,06). Las pruebas ecocardiográficas en el momento de la inclusión mostraron valores de FE más bajos en pacientes con objetivo principal (38% [34-42%]) que en aquellos sin eventos (42% [36-51%]; p=0,02). Además, el strain apical fue mayor en pacientes con un objetivo principal: −4,8% [−7,4% a −3,6%] frente a −7,8% [−9,7% a −6,3%] (p<0,001).
Los índices c de la FE, calculados por ecocardiografía y RMC, para la predicción del objetivo principal fueron 0,69 (IC95%, 0,55-0,82) y 0,55 (IC95%, 0,40-0,69). Sin embargo, la potencia predictiva de la FE en la ecografía se relacionó con el hecho de que fue ≤ 50% en todos los pacientes que alcanzaron el objetivo principal y no se identificó el objetivo principal ningún paciente cuya FE mejorara por encima del 50% desde el cribado hasta la inclusión. Entre los pacientes que mantuvieron la FE ≤ 50%, el índice c de la FE fue de 0,55 (IC95%, 0,38-0,72; p=0,6). De los índices de RMC, solo el tamaño del infarto de miocardio mostró un rendimiento moderado, pero sin significación, con un índice c de 0,67 (IC95%, 0,49-0,84; p=0,1).
El índice c del strain apical para predecir el objetivo principal fue 0,75 (0,62-0,88) con una OR = 1,48 (IC95%, 1,13-1,92; p=0,002) (tabla 1 del material adicional) por unidad. El índice c de RT fue 0,82 (IC95%, 0,71-0,92) con OR = 3,73 (IC95%, 1,75-7,96) por ciclo (p<0,001) (tabla 1 del material adicional; figura 3). En un modelo multivariante que englobaba FE, RT y strain apical para predecir el objetivo principal, solo los últimos 2 mostraron significación estadística (p=0,80; p<0,001 y p=0,03 respectivamente; R2=0,3).
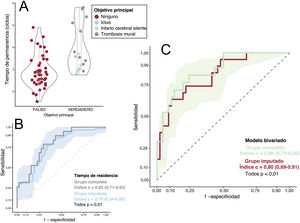
Relación entre el tiempo de residencia y el objetivo principal. A: gráficos de violín y de caja; el objetivo principal está coloreado según su etiología. B: curva ROC del rendimiento de RT para predecir el objetivo principal (grupos completos e imputados). Las cintas de los paneles B y C muestran la sensibilidad y el intervalo de confianza del 95% de la curva ROC calculada del conjunto imputado. ROC: característica operativa del receptor.
La precisión en la predicción fue mayor usando un modelo bivariante que incluyó RT y strain apical: índice c=0,86 (0,73-0,95), con strain apical (OR = 1,41; IC95%, 1,05-1,90) y RT (OR = 3,48; IC95%, 1,49-8,13) conservando valores predictivos significativos (p=0,02 y p =0,003) (figura 3). En el modelo bivariante, la sensibilidad, la especificidad y los valores predictivos positivos y negativos fueron 1,00 (IC95%, 0,88-1,00), 0,54 (IC95%, 0,37-0,91), 0,45 (IC95%, 0,37-0,77) y 1,00 (IC95%, 0,94-1,00). El índice c del modelo bivariante fue 0,81 (IC95%, 0,68-0,84) entre los pacientes con FE ≤ 50%. El modelo final para el riesgo del objetivo principal fue log (riesgo)=−2,9 + 0,34·strain (%) + 1,24·RT (ciclos). El análisis de sensibilidad confirmó un rendimiento similar del strain apical y el RT para predecir el objetivo principal en el conjunto imputado (tabla 1 del material adicional). La figura 4 y los vídeos 1 y 2 del material adicional muestran ejemplos ilustrativos de pacientes con y sin el objetivo principal. El vídeo 3 del material adicional muestra el mapa de RT de un voluntario sano para su comparación.
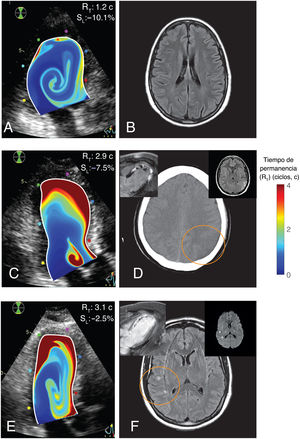
Ejemplos representativos de imágenes del tiempo de residencia y el objetivo principal. A y B: mapas de RT y RM cerebral potenciada en T2 y FLAIR (fluid-attenuated inversion recovery) de un paciente sin objetivo principal. C y D: mapas de RT y tomografía computarizada cerebral de un paciente con ictus isquémico y trombosis mural del VI (figuras insertadas: RMC y RM cerebral potenciada en T2 y FLAIR). E y F: mapas de RT e imágenes cerebrales potenciadas en T2 y FLAIR de un paciente con un ICS (figuras insertadas: RMC y RM cerebral ponderada por difusión, que muestra la naturaleza aguda de las lesiones). En todos los casos, los mapas de RT se superponen al modo B del ecocardiograma. En el extremo superior derecho de las figuras A, C y E se indican los valores individuales del strain apical, SL, y tiempo de residencia RT.
En este estudio preliminar de eficacia se sugiere un valor potencial de la combinación de imágenes de strain y biomarcadores de estasis para identificar el riesgo cardioembólico después del IAMCEST. Al explotar las asociaciones mecanicistas bien conocidas entre estasis, daño local y trombosis, se ha implantado un modelo de ecocardiografía con mejor capacidad predictora de eventos cardioembólicos que los índices tradicionales, como la FE. La eficacia de la predicción muestra el potencial de esta metodología para predecir el riesgo de eventos cardioembólicos mediante strain y cuantificación de estasis (figura 5).
Este es el primer estudio en la literatura que aborda prospectivamente los ICS en el contexto del IAMCEST. Los ICS son las lesiones en el parénquima cerebral que cumplen las características de imagen de un infarto cerebral pero no están asociadas con signos o síntomas clínicos de ictus o accidente isquémico transitorio. Los ICS se identifican con frecuencia en pacientes con disfunción sistólica13 y se han asociado con deterioro cognitivo y el doble de riesgo de ictus14. La RM cerebral es el método de referencia para el diagnóstico de ICS y las imágenes de difusión permiten identificar la cronología de las lesiones a las pocas horas de su aparición, discriminando de esta manera las lesiones agudas, subagudas y crónicas. Los ICS son un indicador sensible del riesgo cardioembólico en varias enfermedades e intervenciones cardiacas, además de haberse asociado con discapacidad y aumento de mortalidad por sí solos15. Los resultados de este estudio demuestran prospectivamente una asociación temporal entre los ICS y el IAMCEST, ya propuesta indirectamente en la literatura, dado el hallazgo frecuente de escaras miocárdicas en pacientes con ICS16. Sin embargo, si ambos índices son predictores de eventos embólicos en otros contextos clínicos, debe demostrarse en estudios futuros. Se observó una incidencia de ICS a los 6 meses del 6% en esta población con IAMCEST, y la mitad de los pacientes con ICS también mostraron TVI. Un paciente presentó un ictus a los pocos días de haberse diagnosticado un ICS en la RM cerebral. Además, otro paciente en el que se había identificado un TVI sufrió un ictus pese haberse iniciado anticoagulación. Esta complicación subraya las limitaciones de la actual estrategia de prevención del ictus guiada exclusivamente por la visualización de la trombosis mural5,17 e ilustra la ventaja potencial de anticipar la anticoagulación antes de que el trombo se desarrolle. Aunque los ICS pueden ser secundarios a la ICP18, el hecho de que coexistiera con trombosis mural en un paciente y un ictus posterior en otro indica que la manipulación del catéter es un origen altamente improbable de ICS en esta cohorte.
La estasis sanguínea es un factor clave en la tríada de Virchow de generación de trombosis6. Sin embargo, los métodos actuales para cuantificar la estasis en el corazón son cualitativos y limitados. Aunque el contraste espontáneo está relacionado con el riesgo de trombosis tanto en la aurícula izquierda19 como en el VI20, depende en gran medida del operador, el equipo ecocardiográfico y factores reológicos21. Los avances tecnológicos de la última década ofrecen la posibilidad de obtener campos de velocidad de la sangre bidimensionales o incluso tridimensionales, con alta resolución temporal, a partir de distintas modalidades de imagen7,22. La aplicación de las leyes físicas de la dinámica de fluidos a estos campos permite derivar índices cuantitativos que explican el transporte sanguíneo dentro de las cavidades, la interacción entre la sangre entrante y el resto de la sangre, y la estasis residual. Se ha demostrado que el RT medio de la sangre en el VI se correlaciona estrechamente con el número de señales de alta intensidad (HITS) detectadas por la ecografía Doppler carotídea en un modelo porcino de IAMCEST11. En otro estudio clínico piloto, el RT también fue mayor en pacientes que presentaron trombosis mural durante la fase subaguda del IAMCEST10. El transporte sanguíneo en el VI es un fenómeno complejo, guiado por las interacciones fluido-estructura y fluido-dinámica que, a su vez, son sensibles a las fracciones de llenado precoz y tardío, el grado de vaciado de la cavidad y el desarrollo de los vórtices0,9,23. Esto explica por qué el riesgo de trombosis mural después del IAMCEST está relacionado con un transporte del flujo apical anómalo24,25. Estos aspectos solo pueden analizarse y cuantificarse con mucha precisión mediante imágenes de estasis.
El segundo factor de la tríada de Virchow está relacionado con los cambios tisulares en la pared ventricular. La lesión endocárdica y la exposición al colágeno activan localmente el sistema de coagulación, y el daño local está estrechamente relacionado con el riesgo de trombosis. En el contexto del IAMCEST, el grado de deterioro del strain longitudinal miocárdico está directamente relacionado con la extensión transmural de la necrosis miocárdica26. En este estudio, el strain apical se relacionó con el riesgo cardioembólico27, pero no estuvo mediado por un aumento de la estasis intraventricular 28, ya que el strain apical no se correlacionó con el RT.
Implicaciones clínicasEste estudio abre la oportunidad para diseñar un ensayo clínico que evalúe la eficacia de los ACO en una selección de pacientes guiada por cuantificación de estasis por imagen. Anticipar una probabilidad del 45% de sufrir un evento cardioembólico (el valor predictivo positivo de este modelo) implica una relación riesgo-beneficio que justifica iniciar la anticoagulación en este subgrupo de pacientes con IAMCEST. Una vez iniciada, la monitorización de la estasis mediante ecocardiografía también podría ser útil para interrumpir la anticoagulación siempre que el strain y el RT alcancen cifras cercanas a la normaldiad. Los factores idiosincrásicos relacionados con la coagulación sanguínea podrían explicar el hallazgo de un valor predictivo positivo del modelo de solo el 45%. Curiosamente, estos factores de coagulación sanguínea se pueden incorporar de manera eficaz a los modelos de dinámica de fluidos para obtener parámetros integrados de trombosis29. Un valor predictivo negativo >95% indica que muy pocos pacientes en riesgo se quedarían sin tratamiento. Estos hallazgos deben confirmarse con una validación externa.
Tras un ictus embólico de origen desconocido, el beneficio de la anticoagulación debe balancease con el riesgo de complicaciones hemorrágicas4. Así la cuantificación de la estasis también puede ser útil en este contexto. Además, el RT también puede cuantificarse dentro de la aurícula izquierda y la orejuela izquierda30. Puesto que la disfunción sistólica del VI, la miopatía auricular y la alteración del flujo intraauricular son muy prevalentes en pacientes con un ictus embólico de origen desconocido31, los mapas de estasis también pueden ser útiles en este contexto clínico. Esta técnica también puede ofrecer información sobre la relación entre la disfunción sistólica subclínica del VI y la enfermedad cerebrovascular asintomática4.
LimitacionesEl número de pacientes y eventos fue relativamente pequeño, con pérdidas no despreciables durante el seguimiento. Por tanto, los resultados de este estudio deben tomarse con precaución e interpretarse como generadores de hipótesis. También deben validarse en estudios posteriores. A pesar de los criterios de inclusión que establecen una FE ≤ 45% en el estudio de selección, en 20 pacientes fue >50% en el momento del ecocardiograma de inclusión (realizado durante las 72h posteriores al IAMCEST) debido a la mejoría precoz de la función sistólica tras la revascularización. El objetivo principal integró eventos de diversa relevancia clínica. Aunque esto puede reducir las implicaciones pronósticas de nuestros hallazgos, el objetivo principal compuesto está respaldado por: a) la relación bien establecida entre los resultados neurológicos y de imagen resumidos anteriormente, y b) las implicaciones de mal pronóstico de la trombosis mural del VI después del IAMCEST17. Los ICS y los eventos neurológicos no pueden atribuirse inequívocamente a un origen cardioembólico y otras etiologías son posibles. Para minimizar esta limitación, se realizó un estudio integral en todos los pacientes con ICS y se implantaron Holter subcutáneos en una muestra de pacientes aleatoria. Sin embargo, es imposible excluir por completo que la enfermedad cerebrovascular de pequeño vaso o la FA subclínica sean la causa de alguna de las lesiones identificadas. El papel de las angioplastias coronarias como fuente de ICS por sí mismas se ha discutido anteriormente. Una incidencia del 25% del objetivo principal puede parecer mayor que en otras series. Esto podría deberse a los estrictos criterios de inclusión, que se centran en pacientes con disfunción sistólica del VI en el momento del ingreso y que se someten a una evaluación integral con pruebas de imagen cardiaca y cerebral. Otra limitación del estudio es que no se completó el seguimiento en todos los pacientes para la confirmación del objetivo principal según el protocolo. Sin embargo, el posible sesgo de verificación se excluyó mediante un análisis exhaustivo de sensibilidad de imputación.
Por diseño, la franja de tiempo del objetivo se encuadró entre la inclusión y la visita de seguimiento a los 6 meses. Sin embargo, dado que 2 pacientes mostraron TVI en el estudio de cribado, se evaluó el rendimiento de la estasis para predecir la embolia solo después de este punto temporal (eliminando a estos 2 pacientes de los análisis). El estudio se llevó a cabo durante la pandemia de SARS-CoV-2, lo que tuvo un gran impacto en las tasas de inclusión y seguimiento. Además, no pueden excluirse por completo los estados procoagulantes relacionados con la infección por COVID-19 o la vacunación de los pacientes del estudio a partir de marzo de 2020.
Existen algunas limitaciones respecto a la cuantificación de la estasis mediante ecocardiografía. Aunque nuestro método se basa en la ecocardiografía transtorácica bidimensional y asume una distribución de flujo planar, los estudios de validación adecuados muestran que el error relacionado con este supuesto es pequeño y el método muestra una buena reproducibilidad9,32. Sin embargo, conocer si el rendimiento de los índices de estasis mejoraría con datos de RMC tridimensional merece futuros estudios8.
CONCLUSIONESEn pacientes con IAMCEST, el riesgo de cardioembolias se puede predecir mediante ecocardiografía transtorácica a la cabecera del paciente, combinada con cuantificación de la estasis. Esta metodología puede ser adecuada para personalizar la anticoagulación en prevención primaria en pacientes con función sistólica deprimida y sin antecedentes de FA.
- –
Los pacientes con infarto de miocardio con elevación del segmento ST tienen riesgo de ictus cardioembólico cuando se reduce la fracción de eyección. Sin embargo, en los ensayos clínicos realizados en estas condiciones, la complicaciones hemorrágicas han neutralizado el beneficio de los ACO.
- –
El posprocesado de la ecocardiografía Doppler color convencional se puede utilizar para obtener mapas bidimensionales de estasis sanguínea en el ventrículo izquierdo. Los parámetros cuantitativos de estos mapas de estasis pueden servir para evaluar el riesgo cardioembólico, lo que permite identificar en la práctica clínica a los pacientes con riesgo alto o bajo y seleccionar o excluir candidatos para la prevención primaria.
Este estudio ha sido financiado por el Instituto de Salud Carlos III (PI15/02211-ISBITAMI y DTS/1900063 -ISBIFLOW), la Comunidad de Madrid (Synergy Grant: Y2018/BIO-4858 PREFI-CM) y por el Fondo Europeo de Desarrollo Regional. JCdA recibió apoyo parcial de las subvenciones NIH R01HL158667 y NIH R01HL160024.
CONSIDERACIONES ÉTICASEl estudio fue aprobado por el Comité de Ética del Hospital Gregorio Marañón y todos los pacientes dieron el consentimiento informado por escrito. El estudio fue financiado académicamente, y la Fundación para la Investigación Biomédica Hospital Gregorio Marañón fue el único patrocinador. El trabajo se ajusta a los principios recogidos en la Declaración de Helsinki. Este trabajo se adhiere a las directrices Sex and Gender Equity in Research (SAGER) al integrar las variables de sexo y género en todos los aspectos de nuestra investigación.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizaron métodos o herramientas de inteligencia artificial en la preparación o redacción del original ni en el análisis de los datos.
CONTRIBUCIONES DE LOS AUTORESE. Rodríguez-González, P. Martínez-Legazpi, T. Mombiela, A. González-Mansilla, A. Delgado-Montero, J.A. Guzmán-De-Villoria, F. Díaz-Otero, R. Prieto-Arévalo, M. Juárez, M.C. García del Rey, A. Postigo, R. Yotti, M. García-Villalba, J.C. del Álamo y J. Bermejo han contribuido sustancialmente a la concepción o el diseño del trabajo o a la adquisición, el análisis o la interpretación de datos para el trabajo. E. Rodríguez-González, P. Martínez-Legazpi, P. Fernández-García, Ó. Flores, F. Fernández-Avilés, J.C. del Álamo y J. Bermejo han contribuido sustancialmente a la redacción del trabajo o lo han revisado críticamente en busca de contenido intelectual importante. P. Martínez-Legazpi, F. Fernández-Avilés, J.C. del Álamo y J. Bermejo dieron la aprobación final de la versión que se publicará. P. Martínez-Legazpi, J.C. del Álamo y J. Bermejo aceptan ser responsables de todos los aspectos del trabajo.
CONFLICTO DE INTERESESP. Martínez-Legazpi, J.C. del Álamo, R. Yotti y J. Bermejo son inventores de un método para cuantificar la estasis intracardiaca y las tensiones de cizallamiento a partir de datos de imágenes en virtud de una solicitud del Tratado de Cooperación en materia de Patentes (WO2017091746A1). El resto de los autores no tienen nada que declarar.